稻瘟病菌MoZds1的功能分析
黃昌麗,朱學明,李 琳,鮑堅東,俞曉平,林福呈,
(1.中國計量大學 生命科學學院,浙江 杭州 310018; 2.農產品質量安全危害因子與風險防控國家重點實驗室,浙江省農業科學院 植物保護與微生物研究所,浙江 杭州 310021)
稻瘟病菌(Magnaportheoryzae)屬于半知菌類真菌,具有兩種生理狀態,即無性態和有性態[1],可以危害多種草本植物,包括水稻(Oryzasativa)、小麥(Triticumaestivum)、大麥(Hordeumvulgare)、玉米(Zeamays)、燕麥(oats)、黑麥(rye)、(Eleusinecorocana)、多年生黑麥草(Loliumperenne),以及雜草和觀賞草[2]。水稻(Oryzasativa)為禾本科多年生草本植物,稻瘟病菌主要寄主之一。稻瘟病菌分布遍布世界,對亞洲和非洲水稻危害最為嚴重[3],同時也對南北美洲小麥造成巨大損失[4]。在中國的各個水稻種植地區每年均有稻瘟病害發生,稻瘟病菌侵染水稻的不同部位,形成苗瘟、葉瘟、枝梗瘟、稈瘟、谷粒瘟、穗頸瘟和節瘟,其中葉瘟和穗頸瘟危害最大更為常見[5-7]。根據近十年《全國植保專業統計資料》統計,稻瘟病菌在我國水稻主產區造成的產量損失約達37.49萬t[8]。目前主要從生物防治(生防菌、次級代謝產物)[9-10]、化學防治(三環唑、稻瘟靈和嘧菌酯)[11-14]和抗性育種[15]等方面對稻瘟病菌進行預防與治理,其防治原理都離不開稻瘟病菌的生長發育及侵染機制。
在釀酒酵母中,Zds1p定位于胞質溶膠、隔膜和細胞皮層,Zds2p定位于細胞核[16],Zds調控細胞壁的強度和形態,維持細胞壁完整性。ZDS1的缺失除了對釀酒酵母細胞形狀有輕微影響外,沒有產生明顯表型。然而,zds1-zds2雙突變體生長緩慢,有明顯的有絲分裂延遲,并產生細長的細胞和芽。細胞進入有絲分裂由有絲分裂周期蛋白依賴性激酶(cyclindependent kinase)的激活和蛋白磷酸酶2A (PP2A)的抑制控制[17],Zds蛋白是Cdks和PP2A的調節因子。Cdc55是PP2A復合物的調節B亞基,在有絲分裂過程中發揮各種功能。Cdc55會拮抗Cdk1活性并使Cdk1底物脫磷,Zds1/Zds2卻能在細胞質中結合PP2A-Cdc55,從而促進有絲分裂進入并允許細胞核中有絲分裂的Cdk1的完全激活[18]。在有絲分裂后期,Zds1p抑制PP2A-Cdc55并誘導Cdc14p的釋放,Cdc14p磷酸酶在有絲分裂退出過程中對抗Cdks活性使Cdks失活,以促進有絲分裂的退出和胞質分裂的完成[19]。
MPS1-MAPK是調控稻瘟病菌生長發育及致病的一種信號途徑,絲裂原活化蛋白激酶Mps1與釀酒酵母Slt2同源[20]。真菌細胞被封閉在剛性細胞壁中,該壁賦予細胞形狀并介導細胞與環境之間的所有交換[21]。盡管真菌細胞壁足夠堅固,可以承受高壓,但其組織和結構應不斷重塑,以促進生長和發育。因此,在病原真菌中,保持細胞壁完整性的能力對于在其宿主上建立疾病至關重要[22]。一種確保細胞壁在不同環境中持續完整的信號轉導途徑已在釀酒酵母中得到表征[23],而這一信號轉導途徑的核心是由Bck1、Mkk1/2和Slt2組成的絲裂原激活蛋白(MAP)激酶級聯。Mps1-MAPK信號通路同源于酵母中的Bck1-Mkk1/Mkk2-Slt2信號通路,在稻瘟病菌中主要調控細胞壁的完整性。mps1突變體對真菌細胞壁消化酶過敏,是維持稻瘟病菌細胞壁完整性所必需的。mps1突變體產生氣生菌絲的能力有限導致分生孢子產量減少,但分生孢子的形態和萌發均正常。mps1突變體可以激發植物防御反應,無法使水稻幼苗發病,但可以侵染損傷葉片和葉鞘。此外,Mps1調節α-1,3-葡聚糖的積累,α-1,3-葡聚糖是細胞外壁層的一種成分,可在植物感染期間提供對幾丁質酶的保護[24]。
在稻瘟病菌中,菌絲的生長發育對稻瘟病菌致病具有重要作用,MoZDS1基因的缺失會顯著抑制稻瘟病菌落的生長。為了探究MoZds1的生物學功能,本研究對稻瘟病菌中MoZDS1基因進行了詳細的研究,旨在明確MoZds1在稻瘟病菌中的功能,為深入了解稻瘟病在生長發育及致病過程中的調控機制以及藥物靶點的解析和挖掘奠定基礎。
1 材料與方法
1.1 實驗材料
1.1.1 實驗植物與菌株
實驗所用到的植物為HordeumvulgareZJ-8大麥和OryzasativaCO39水稻。稻瘟病菌菌株為菌Guy11(英國皇家科學院院士Nick Talbot 實驗室惠贈)、大腸埃希菌感受態為EscherichiacoliDH5α(Trans T1, 北京全式金生物技術有限公司)、農桿菌為AgrobacteriumtumefaciensAGL1(上海唯地生物技術有限公司)。
1.1.2 培養基及試劑
培養基:LB培養基、CM培養基、AIM培養基、SD-N培養基、MM培養基。
試劑:DNA聚合酶、限制性內切酶EcoR I、BamH I、Hind Ⅲ、XbaI、cDNA逆轉錄酶、重組酶和連接酶、瓊脂糖凝膠DNA回收試劑盒、質粒DNA提取試劑盒、核酸染料、CFW(Calcofluor white,鈣熒光白)染料、DAPI(4′,6-diamidino-2-phenylindole,4′,6-二脒基-2-苯基吲哚)染料、DNA Marker、蛋白Marker、SDS-PAGE預制膠、GFP抗體標簽。
1.2 實驗方法
1.2.1 目的基因的獲取
在真菌基因數據庫(https://fungidb.org/fungidb/app/)中根據其基因號獲取MGG_03837的CDS序列及其上下游2 kb左右的堿基序列。
1.2.2 目的基因的敲除
利用軟件Primer Premier 6.0與BioXM 2.6設計引物,擴增MoZDS1基因上下游序列,與HPH抗性基因連接在PKO3A載體上,在大腸埃希菌中獲得重組質粒,利用農桿菌介導的ATMT法對稻瘟病菌MoZDS1基因進行敲除,獲得ΔMozds1敲除突變體并進行敲除驗證。
1.2.3 回補體的構建
設計引物,將目的基因片段同綠色熒光蛋白(GFP)基因序列連接在PKD5載體上,在大腸埃希菌體內表達,將質粒轉入農桿菌AGL1中,用ATMT法轉化法誘導ΔMozds1敲除突變體的分生孢子。待轉化子長出后挑取菌絲在熒光顯微鏡下觀察轉化子熒光,進行回補驗證。
1.2.4 敲除突變體致病性檢測
大麥葉片致病性檢測:取生長旺盛的稻瘟病菌野生型Guy11、敲除突變體、回補體,用打孔器取下相同大小的菌餅,接種在離體大麥葉片上,用涂布器刮洗下孢子。用無菌水將孢子沉淀稀釋至1×105mL-1,吸取孢子滴25 μL,滴在大麥葉片上,一片葉片滴加三滴菌液。將大麥葉片置于25 ℃恒溫培養箱光照16 h黑暗8 h交替培養4 d,觀察大麥葉片發病情況并拍照記錄。
水稻葉片致病性檢測:取3 mL濃度為1×105mL-1的孢子液,用孢子噴霧器均勻噴灑在水稻植株上,密封,25 ℃黑暗培養2 d后,16 h光照與8 h黑暗交替培養4 d,觀察水稻發病情況并拍照記錄。
以上實驗每組做3個重復,每個實驗重復3次。
1.2.5 表型分析
菌落生長分析:取生長旺盛的稻瘟病菌野生型Guy11,敲除突變體、回補體,接種在9 cm的CM固體培養基平板中央,每個菌株做3個重復,25 ℃恒溫培養7 d,觀察菌落形態并拍照記錄。采用十字交叉法測量菌落直徑,并記錄。重復3次。
菌絲形態分析:取菌落形態分析中生長7 d的菌落平板,用無菌解剖刀切取相同大小菌絲塊,整齊平放在無菌載玻片上。將放有菌絲塊的載玻片放在保濕盒中,在25 ℃恒溫培養箱中黑暗培養24 h,在顯微鏡下觀察菌絲及分生孢子梗生長形態,并拍照記錄。
孢子形態及產孢量分析:將孢子液滴在載玻片上,置于顯微鏡下觀察孢子形態并拍照記錄,測量孢子的長度與寬度并記錄。吸取少量混勻孢子液,滴在血球計數板上計算出總產孢量。用CFW和DAPI染液對孢子進行隔膜和細胞核染色,置于熒光顯微鏡下,UV照射觀察。
附著胞的形成率及糖原降解率測定:吸取25 μL孢子液滴在疏水膜中央,置于保濕盒中,在25 ℃恒溫培養箱中黑暗培養0、4、8、12、24 h,記錄4 h和8 h附著胞的形成率。用KI/I2染液進行糖原染色,觀察并記錄0、8、12、24 h時分生孢子和附著胞中糖原降解率。
1.2.6 敲除突變體細胞壁脅迫分析
以CM培養基為基礎,配制 0.005% SDS(sodium dodecyl sulfate,十二烷基硫酸鈉)和200 μg·mL-1CR(Congo Red,剛果紅)的細胞壁脅迫培養基,接種,觀察并記錄不同細胞壁脅迫環境下稻瘟病菌的生長情況。
1.2.7 蛋白免疫印跡實驗Western blot
將野生型Guy11和ΔMozds1突變體分別在CM液體培養基中培養2 d后轉入SD-N饑餓誘導培養基中誘導4 h和8 h,采用TCA丙酮法提取蛋白,利用GFP抗體并通過Western blot 來檢測GFP-MoAtg8和GFP的相對含量。
2 結果與分析
2.1 稻瘟病菌MoZDS1鑒定與分析
我們前期通過高通量基因敲除技術獲得一株嚴重影響稻瘟病菌營養生長的基因缺失突變體,基因序列號為MGG_03837,基因功能注釋為假定蛋白,為了探究其功能,我們將MGG_03837蛋白序列通過NCBI BLAST在酵母數據庫中進行比對,發現MGG_03837與釀酒酵母Zds1蛋白序列具有4%的覆蓋度和64%的置信度,因此我們將稻瘟病菌MGG_03837蛋白命名為MoZds1(圖1-A)。通過ArthoDB數據庫檢索發現,在真菌中普遍存在Zds1同源蛋白,他們主要存在于子囊菌綱(Sordariomycetes)、散囊菌綱(Eurotiomycetes)、酵母綱(Saccharomycetes)、座囊菌綱(Dothideomycetes)和絲菌綱中(Hyphomycetes)(圖1-B)。接下來,我們通過生物信息學方法構建了MoZds1的系統發育樹,發現稻瘟病菌Zds1與粗壯脈紋孢菌(Neurosporacrassa)、鐮刀菌(Fusariumgraminearum)和炭疽菌(Colletotrichumorbiculare)具有較近的親緣關系,而與曲霉(Aspergilluspseudonomius)、鏈格孢菌(Alternariaviburni)以及酵母(Saccharomycescerevisiae)具有較遠的親緣關系(圖1-C、D)。
2.2 稻瘟病菌MoZds1結構預測與敲除分析
為了探究稻瘟病菌中MoZds1的具體功能,我們利用蛋白結構預測工具AlphaFold2對稻瘟病菌和釀酒酵母的Zds結構域的結構進行了預測,結果顯示,稻瘟病菌MoZds_C結構域含有2個α螺旋結構,置信度pLDDT為80.8。在釀酒酵母中,ScZds_C也含有2個α-螺旋結構,置信度pLDDT為91.5(圖2-A),說明該結構已接近真實結構水平。通過三維結構聯配后發現MoZds_C和ScZds_C高度重合,RMSD為0.385(圖2-B、C),說明該結構域在酵母和稻瘟病菌中高度保守。我們推測MoZds1在稻瘟病菌中也有和釀酒酵母中相似的功能。因此,通過基因敲除手段獲得MoZDS1基因缺失突變體。通過驗證,發現在1 000 bp位置的內參基因Tubilin條帶在野生型Guy11與ΔMozds1敲除突變體中均可見,而ΔMozds1敲除突變體中只存在2 000 bp的重組條帶,野生型Guy11中僅存在500 bp的目的基因條帶,證明MoZDS1敲除成功。
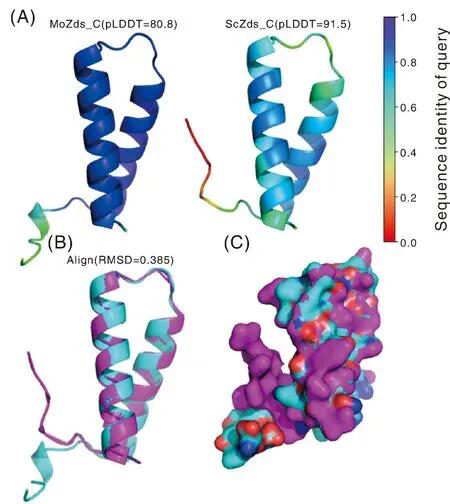
圖2 稻瘟病菌MoZds_C結構域結構分析Fig.2 Domain structure analysis of MoZds_C in M. oryzae
2.3 MoZds1調控稻瘟病菌營養生長、產孢和附著胞的形成
將野生型Guy11、ΔMozds1和互補菌株ΔMozds1-C接種于CM培養基中培養7 d,發現ΔMozds1敲除突變體的生長速度明顯減慢,菌落表面菌絲絨毛不明顯,呈粗糙凹凸狀(圖3-A、C)。為探究ΔMozds1對菌絲生長和產孢的影響,通過菌落橫截面切片觀察孢子梗和孢子情況,從圖3-B中可以看出,相比于野生型Guy11和互補菌株ΔMozds1-C,ΔMozds1敲除突變體分生孢子梗較密且長有大量分生孢子,缺少細長的氣生菌絲,統計分析發現ΔMozds1敲除突變體單位面積內產孢量顯著高于野生型和互補菌株(圖3-E),推測MoZds1參與稻瘟病菌氣生菌絲和分生孢子的形成。接下來,我們對分生孢子進行形態觀察,發現ΔMozds1敲除突變體孢子多以三隔孢子為主,呈梨形,通過對分生孢子的長寬進行了測量,發現ΔMozds1敲除突變體與野生型Guy11和互補菌株相比,孢子的長度顯著減小。然而,雖然孢子形態發生改變,但經隔膜染色和細胞核觀察統計發現ΔMozds1敲除突變體和野生型及互補菌株相比在隔膜和細胞核形成方面并無顯著差異(圖3-D)。通過附著胞統計觀察,結果如圖3-F所示,發現在4 h時ΔMozds1敲除突變體分生孢子附著胞的形成量遠高于野生型Guy11和回補體ΔMozds1-C,在8 h時,ΔMozds1敲除突變體、野生型Guy11和回補體ΔMozds1-C中附著胞的形成率無顯著差異。

圖中星號代表顯著性差異(*, P<0.05; **, P<0.01), 下同。標尺=10 μm。Asterisks represent significant differences (*, P<0.05; **, P<0.01), the same as below. Scale =10 μm.圖3 ΔMozds1突變體基本表型分析Fig.3 Phenotypic analysis of ΔMozds1 mutants
2.4 MoZds1參與稻瘟病菌的致病進程
為了解MoZds1是否影響稻瘟病菌的致病進程,我們分別將野生型Guy11、ΔMozds1和互補菌株ΔMozds1-C以菌餅的形式接種于大麥葉片。培養4 d后發現,無論是野生型Guy11、互補菌株ΔMozds1-C還是ΔMozds1突變體,都在大面葉片中形成了擴展性病斑(圖4-A-1)。接下來,我們將相同濃度的孢子接種到大麥葉片上,進一步觀察發現突變體在接種4 d后形成的病斑面積小于野生型Guy11和互補菌株ΔMozds1-C(圖4-A-2),說明MoZds1影響稻瘟病菌的侵染。為了進一步驗證Mozds1對水稻致病力的影響,我們采用孢子噴霧的形式將相同濃度的孢子接種于活體水稻葉片上,培養5 d后發現,ΔMozds1突變體在水稻葉片上也形成了菌斑,但菌斑面積顯著小于野生型Guy11和互補菌株ΔMozds1-C(圖4-B),說明MoZds1參與稻瘟病菌的致病進程。

圖4 ΔMozds1突變體致病性分析Fig.4 Pathogenicity analysis of ΔMozds1 mutants
2.5 Mozds1參與對細胞壁脅迫因子的響應
稻瘟病菌的生長、發育、產孢、侵染等各個過程均受環境因素的影響,在長期的進化過程中,稻瘟病菌形成了一套自身的完整應對機制,不同蛋白對不同的環境可以做出相應調節,以維持自身各項生命活動的正常運行。在釀酒酵母中,有報道Zds1參與細胞壁的合成。為探究ΔMozds1突變體對細胞壁脅迫因子的敏感性,我們對ΔMozds1突變體做了抗逆性測定。我們從生長旺盛的ΔMozds1敲除突變體、野生型Guy11和回補體ΔMozds1-C菌板上用打孔器打下4 mm大小的菌塊接種在含0.005%的SDS培養基、200 μg·mL-1的剛果紅CR培養基上(圖5-A),以CM為對照,測量不同脅迫環境下3種菌種的生長直徑,利用公式抑制率(%)=(野生型菌落直徑-敲除突變體菌落直徑)/野生型菌落直徑×100計算出不同細胞壁脅迫因子對稻瘟病菌的生長抑制率,結果如圖5-B所示。在SDS和CR細胞壁脅迫培養基上,脅迫因子對ΔMozds1突變體的抑制率均顯著高于野生型Guy11,由此可見,MoZds1參與稻瘟病菌細胞壁的完整性形成。
2.6 MoZds1熒光定位于細胞質
由于蛋白發揮的功能通常與其在細胞中的定位相關聯,為進一步探究MoZds1的功能,我們對它在細胞中的定位情況進行了分析。首先我們通過構建GFP-MoZds1表達載體,并連接H3強啟動子,利用大腸埃希菌并結合ATMT法誘導ΔMozds1敲除突變體,通過PCR驗證GFP-MoZds1的導入情況。將驗證正確的轉化子分生孢子及菌絲體置于熒光共聚焦顯微鏡下通過觀察綠色熒光位置判斷MoZds1的定位情況,結果如圖6所示。在分生孢子中,綠色熒光存在于孢子液泡中,而在生長旺盛的菌絲中,我們可以明顯看到MoZds1呈細胞質定位。

GFP-MoZds1在分生孢子與菌絲中的熒光定位,標尺=10 μm。Fluorescence localization of GFP-MoZds1 in conidia and mycelia, scale =10 μm.圖6 GFP-MoZds1熒光定位分析Fig.6 Fluorescence localization analysis of GFP-MoZds1
2.7 MoZds1影響糖原的降解
由于附著胞的形成與分生孢子中的糖原降解相關聯[25],因此我們進一步探究了分生孢子在形成附著胞過程中分生孢子與附著胞中的糖原降解率。通過KI/I2染液染色,結果如圖7-A所示,在8 h時分生孢子中的糖原均有一半轉移到附著胞中,3種菌株的分生孢子之間并無明顯差異。在12 h時,ΔMozds1敲除突變體分生孢子中有大半均已降解,降解率遠高于野生型Guy11和回補體ΔMozds1-C,同時突變體附著胞中糖原也有部分已經降解。到24 h時ΔMozds1敲除突變體與野生型Guy11突變體和分生孢子中的糖原幾乎均完全降解,但回補體的附著胞中還有部分糖原殘留(圖7-B、C),我們猜想這可能與回補體上的強啟動子過表達MoZDS1有關。綜合整個糖原降解的過程,可以看出ΔMozds1敲除突變體的分生孢子與附著胞中糖原降解速率均快于野生Guy11,由此可以說明MoZds1可以延緩糖原的降解速率。
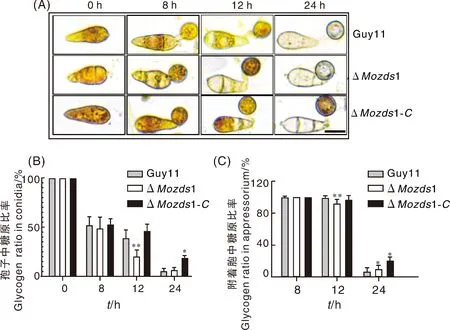
標尺=10 μm。Scale =10 μm.圖7 分生孢子及附著胞的糖原降解情況觀察Fig.7 Observation of glycogen degradation of conidia and appressorium
2.8 ΔMozds1敲除突變體細胞自噬分析
稻瘟病菌整個生命活動的正常進行離不開細胞自噬。在有利生長環境中,細胞自噬通常處于較低水平。但在營養缺乏、饑餓難耐的情況下,細胞自噬水平就會提高[26-27]。在稻瘟病菌分生孢子萌發侵染過程中,細胞自噬通過降解分生孢子中的糖原、甘油和脂滴等物質,促進分生孢子的萌發和侵染[28]。為研究MoZds1是否參與稻瘟病菌細胞自噬的過程,我們利用GFP-Atg8來檢測ΔMozds1敲除突變體細胞自噬水平,并通過Western blot 來檢測GFP-MoAtg8和GFP的相對含量。結果發現,未經饑餓誘導時,ΔMozds1敲除突變體與野生型G11中的游離的GFP相對含量大致相同(圖8),且經過SD-N饑餓處理4 h和8 h后兩者所含的游離GFP含量仍然相差不大。
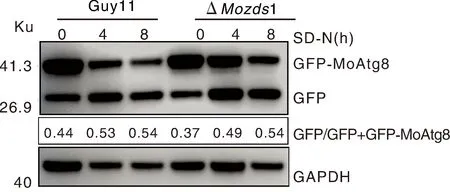
圖8 GFP-Atg8與GFP表達量分析Fig.8 GFP-Atg8 and GFP expression levels
3 討論
在惡劣的環境中,稻瘟病菌經常受到來自環境中各種因素的影響,因此維持細胞內部的相對穩定十分重要,在此過程中,細胞壁起著關鍵作用。細胞壁能抵抗外界機械壓力維持細胞形狀,并在細胞正常代謝、離子交換和滲透壓平衡中扮演重要角色。在細胞生長和形態發生過程中,細胞完整性通路(cell wall integrity pathway, CWI)主要負責協調細胞壁的變化并應對外界細胞壁壓力,維持細胞壁完整性的信號調節[29]。CWI信號通路由一系列細胞表面傳感器組成,這些傳感器與一種名為Rho1的小G蛋白相連。其中研究最為透徹的是Pkc1激活的絲裂原激活蛋白(MAP)激酶級聯Rho1效應通路。CWI信號傳導的MAP激酶級聯是由Pkc1、MEKK(Bck1)、Mkk1/2和MAP激酶(Mpk1/Slt2)組成的線性途徑,是酵母中調節交配、高滲透壓反應、菌絲侵入性生長、孢子形成和細胞壁應激反應的五種MAP激酶信號途徑之一。在稻瘟病菌中,Mps1-MAPK信號通路與酵母中的Bck1-Mkk1/Mkk2-Slt2信號通路功能相同,都主要負責細胞壁的完整性調控[30]。MoPkc1是酵母Pkc1的同源蛋白,在稻瘟病菌中能夠調控稻瘟病菌生長發育并直接參與對Mps1-MAPK信號通路的調控[31]。在裂殖酵母中,細胞需要Zds1來保持細胞壁的完整性。其C端序列與釀酒酵母Zds1p和Zds2p的C端具有高度同源性,Zds1p和Zds2p的C端是釀酒酵母的功能域[32]。相同地,Zds1的C端也是裂殖酵母的功能域,過表達Zds1的C端比過表達Zds1全長的產孢率高,Zds1的N端區域負調節C端功能區[16]。在本次研究中,MoZds1也參與分生孢子的形成,但ΔMozds1敲除突變體單位面積產孢量遠高于野生型Guy11,說明Zds1負調控分生孢子的形成,結合ΔMozds1敲除突變體的菌絲分析可知,Zds1也參與氣生菌絲的形成。ΔMozds1敲除突變體的分生孢子與附著胞中糖原降解速率在12 h時與野生型存在差異,在4 h時附著胞的形成率高于野生型,我們認為ΔMozds1敲除突變體通過加快糖原降解速率使分生孢子體內膨壓在短時間內升高,進而加快附著胞的形成速率。裂殖酵母Zds1參與細胞壁的強度和形態,細胞表現出圓形細胞形態。我們觀察到在稻瘟病菌中GFP-MoZds1也具有類似裂殖酵母Zds1-GFP的細胞質定位[16],同時分生孢子表現出偏圓形的形態。因此,我們推測MoZds1也參與稻瘟病菌細胞壁完整性途徑。經細胞壁脅迫因子SDS和CR脅迫測定,果然得出相同結論,我們認為ΔMozds1敲除突變體菌落形態粗糙生長較緩慢也與細胞壁遭到破壞相關。在裂殖酵母和釀酒酵母中,Zds1敲除體均表現出鈣敏感性[33]。另外Zds1/Zds2可控制Cdc55的皮層和細胞質定位,Cdc55在細胞質中可以促進有絲分裂的進入,當Zds1/Zds2缺失時Cdc55會在細胞核中積累,核Cdc55會阻止有絲分裂的退出[34]。多項研究均表明,Zds1蛋白調節PP2A-Cdc55的上游信號,在控制有絲分裂過程中發揮重要作用[18-19,35-37]。本研究對MoZds1的功能從營養生長、產孢、致病、脅迫、定位以及細胞自噬方面進行了觀察統計與分析,發現MoZds1正調控稻瘟病菌氣生菌絲的生長,抑制分生孢子的形成,協助致病侵染過程,參與維持稻瘟病菌細胞壁完整性途徑,呈細胞質定位但對細胞自噬無顯著影響。MoZds1的其他功能有待進一步挖掘,后續研究工作可參考酵母Zds1相關研究,從鈣敏感性和Cdc家族基因相互作用關系入手,探究MoZds1在細胞分裂方面是否發揮作用。

