HCA587/MAGE-C2蛋白聯合CFA和CpG佐劑的免疫應答及抗腫瘤效應
焦薇 譚媛芳△ 陳惠媛 范秋穎 尹艷慧 陳娟娟 (.南昌大學第二附屬醫院檢驗科,江西省檢驗醫學重點實驗室,南昌 330006;.北京大學醫學部免疫系,北京 009)
近年腫瘤免疫治療備受關注,尋找表達于腫瘤組織的特異性或相關性抗原,制備抗原特異性疫苗靶向攻擊腫瘤已成為腫瘤免疫治療的新動向。腫瘤疫苗接種的前景將集中于更有效的免疫策略[1]。
腫瘤-睪丸(cancer testis,CT)抗原在多種惡性腫瘤中表達,但在正常組織中除睪丸生殖細胞外不表達,是多肽或蛋白質疫苗誘導的特異性CTL的有效靶點。許多CT抗原疫苗在小鼠模型中表現出強烈和特異的免疫應答,并產生抗腫瘤效應[2-3]。HCA587(又稱MAGE-C2)是課題組前期用SEREX方法從HCC患者肝癌組織cDNA表達文庫中克隆出的一種新CT抗原[4]。正常組織中,HCA587蛋白僅在免疫豁免的睪丸高表達;多種腫瘤組織中,如肝癌、黑色素瘤等,HCA587蛋白高表達[5]。另外腫瘤患者血清中能檢測到自發的HCA587抗體產生,在體外用HCA587重組蛋白可從正常人外周血中誘導出特異的CD8+T細胞及CD4+T細胞應答[6]。表明HCA587抗原具有腫瘤組織表達特異性,且免疫原性強,具備作為腫瘤疫苗候選抗原的先決條件。
免疫佐劑通過激活共刺激因子和介導細胞因子產生提高多肽和蛋白質的免疫原性,不同程度激活早期固有免疫應答,并產生對疫苗抗原特異性更高的抗體和更強的細胞反應[7]。此外,多數佐劑誘導更廣泛的適應性反應,對異型病毒等提供保護[8]。免疫佐劑可在誘導同等強度應答條件下使蛋白抗原劑量減少,并提高蛋白抗原的免疫原性,增強特異性體液免疫應答和細胞免疫應答[9]。近年蛋白疫苗臨床試驗中,佐劑應用極為廣泛。因此,研究基于HCA587蛋白的不同免疫策略并檢測其誘導的免疫應答具有重要意義。本研究擬比較HCA587蛋白在不同免疫策略下的細胞和體液免疫應答及抗腫瘤作用。
1 材料與方法
1.1 材料
1.1.1 實驗動物與細胞系 6~8周齡SPF級C57BL/6J雌性小鼠購自浙江維通利華實驗動物技術有限公司,許可證號:SCXK(浙)2019-0001,飼養于南昌樂悠生物科技有限公司潔凈環境,20~25 ℃,相對濕度55%~65%,整個實驗過程和實驗操作符合國際實驗動物認可和評估委員會認證要求,本研究經南昌大學第二附屬醫院醫學研究倫理委員會批準(2015.056)。
1.1.2 主要試劑 pGEX-6P-1-HCA587重組質粒構建及HCA587重組蛋白表達和純化由北京中美冠科生物科技公司完成,HCA587蛋白純度為98%;OVA蛋白(>95%純度)、弗氏完全佐劑(CFA)、弗氏不完全佐劑(IFA)購自Sigma公司;CpG ODN 1826(5'-TCCATGACGTTCCTGACGTT-3')佐劑由上海生工生物工程技術服務有限公司合成;小鼠IFN-γ酶聯免疫斑點(ELISpot)檢測試劑盒購自MABTECH公司,包括預包被抗小鼠IFN-γ單抗的96孔板、生物素標記的抗小鼠IFN-γ單抗、堿性磷酸酶(ALP)標記的鏈霉親和素和BCIP-NBT底物;HRP標記的抗小鼠IgG抗體購自Promega公司;TMB顯色液購自北京天根;胞內細胞因子染色試劑購自Biolegend。
1.2 方法
1.2.1 細胞轉染、克隆及鑒定 將含有HCA587全長cDNA序列的質粒pEGFP-C1轉染B16黑素瘤細胞,通過G418壓力篩選和有限稀釋法獲得穩定表達HCA587的B16細胞克隆(B16-HCA587),Western blot檢測其HCA587表達。
1.2.2 小鼠免疫模型構建 將小鼠隨機分為7組,每組6只,分別給予HCA587蛋白結合CFA/IFA和不同劑量CpG佐劑(20 μg或50 μg),以及佐劑對照、PBS緩沖液對照。免疫分組:①HCA587+CFA+CpG 20 μg;②HCA587+CFA+CpG 50 μg;③HCA587+IFA;④HCA587+IFA+CpG 20 μg;⑤HCA587+IFA+CpG 50 μg;⑥CFA+CpG 50 μg;⑦PBS緩沖液對照組。HCA587蛋白10 μg/只,與CFA或IFA單獨1∶1混合,必要時與不同劑量CpG(20 μg或50 μg)混合,尾根部皮下注射,于第0、21天免疫,頸椎脫臼法處死小鼠。
1.2.3 IFN-γ ELISpot測定 第2次免疫后2周采集小鼠脾細胞,5×105個/孔加入預包被抗小鼠IFN-γ單抗的96孔板,加入2.5 μg/ml HCA587蛋白,對照組包括培養基和OVA無關蛋白,各3個復孔,37 ℃孵育20 h。加入生物素標記的抗小鼠IFN-γ單抗(1.5 μg/ml),溫育、洗板,加入ALP標記的鏈霉親和素(1 μg/ml)室溫避光孵育,洗板,加入BCIP-NBT顯色液避光顯色后沖洗,終止反應,統計各孔斑點數。
1.2.4 抗HCA587抗體ELISA測定 第2次免疫后2周采集小鼠血清,HCA587蛋白(1 μg/ml)包被,4 ℃過夜,37 ℃封閉2 h后洗滌。不同稀釋度血清加入反應板,37 ℃反應2 h后洗滌。加入HRP標記的抗小鼠IgG抗體(1∶2 500) 37 ℃作用90 min后洗滌。加入TMB顯色液100 μl室溫反應3~5 min,2 mol/L H2SO4終止反應,測定各孔450 nm波長處OD值。陰性血清對應孔平均OD值的2倍為陽性。
1.2.5 胞內細胞因子染色分析 5×106個/ml脾細胞在含10 μg/ml HCA587蛋白及10%胎牛血清的1640培基中37 ℃孵育24 h,培養終止前6 h加入Brefeldin A。收集細胞,洗滌后用抗小鼠CD4和CD8抗體染色30 min,洗滌,離心,棄上清,500 μl固定液室溫固定20 min,洗滌,離心,棄上清,用500 μl 1×通透液室溫通透10 min,洗滌,離心,PE-anti-IFN-γ和APC-anti-IL-4抗體染色30 min,1×通透液洗2次,重懸,進行流式分析。
1.2.6 小鼠腫瘤治療模型 取6~8周齡小鼠,每組6只。第0天,每只小鼠于右側脅腹部皮下接種B16-HCA587腫瘤細胞(1×104個/只,100 μl)。第7、第28天進行免疫治療,治療分組:①HCA587+CFA+CpG 50 μg;②CFA+CpG 50 μg;③PBS緩沖液對照組;100 μl/只,尾根部皮下注射。每隔2~3 d用游標卡尺測量腫瘤體積,腫瘤體積=長軸×短軸2×0.52。
1.3 統計學處理 采用GraphPad Prism 5.0軟件作圖及統計分析。非配對t檢驗分析分泌IFN-γ的脾細胞頻數、抗體滴度和小鼠組間腫瘤體積差異,Log-rank test評估生存曲線。P<0.05為差異有統計學意義。
2 結果
2.1 HCA587蛋白聯合CFA和50 μg CpG誘導最強的細胞免疫應答 HCA587蛋白與不同佐劑聯合免疫小鼠后,ELISpot分析各免疫策略誘導的分泌HCA587抗原特異性IFN-γ的脾細胞頻數。結果表明HCA587聯合CFA、CpG組均可檢測到高強度的IFN-γ分泌,50 μg CpG組更為明顯。HCA587與IFA、CpG聯用時僅檢測到微弱應答,HCA587與IFA聯用時未見陽性應答。可見HCA587蛋白需要CFA和CpG才能誘導較強的IFN-γ分泌,而50 μg CpG比20 μg誘導能力更強(圖1)。
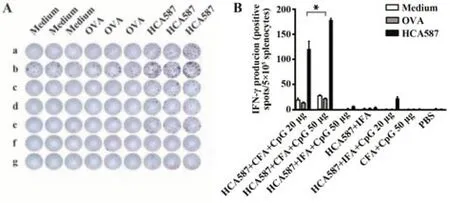
圖1 不同免疫策略誘導的HCA587特異性細胞免疫應答Fig.1 HCA587-specific cellular immune response induced by different strategies
2.2 HCA587蛋白與CFA和50 μg CpG聯合免疫產生高滴度抗體 ELISA檢測不同免疫策略誘導的抗HCA587 IgG抗體水平,HCA587蛋白與CFA或IFA聯用均能檢測到高水平的HCA587特異性抗體,這種能力不依賴于CpG存在與否或劑量高低(圖2)。盡管組間抗體滴度差異無統計學意義,但HCA587聯合CFA+50 μg CpG在多倍稀釋條件下產生的抗HCA587抗體滴度最高。
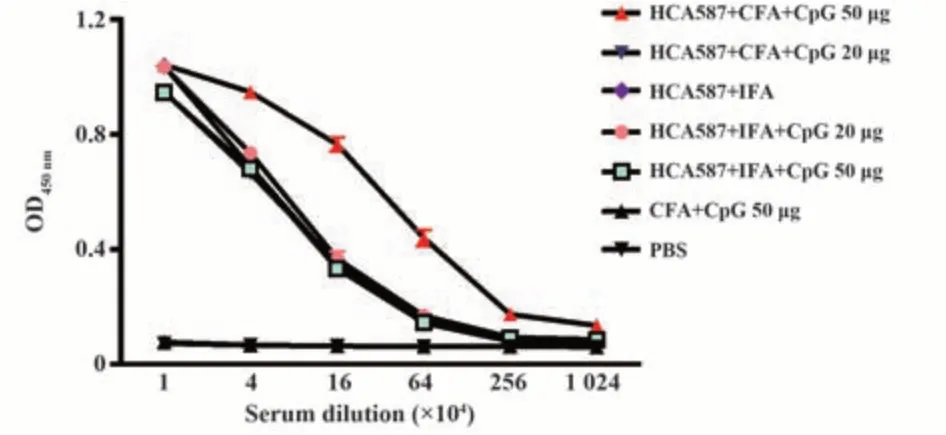
圖2 不同免疫策略誘導的抗HCA587特異性抗體滴度Fig.2 Anti-HCA587 IgG antibody titers induced by different strategies
2.3 HCA587蛋白聯合CFA和50 μg CpG誘導最高比例的IFN-γ+CD4+T細胞 對免疫后的脾細胞進行胞內細胞因子染色。結果表明,與IFA和CpG聯用相比,HCA587聯合CFA和CpG免疫的CD4+T細胞分泌IFN-γ的比例更高,且50 μg CpG下分泌IFN-γ的能力強于20 μg(圖3)。但CD8+T細胞中未檢測到顯著的IFN-γ分泌;同樣,CD4+T和CD8+T細胞亞群中均未檢測到顯著的IL-4分泌。說明HCA587蛋白聯合CFA和50 μg CpG能誘導強大的Th1型免疫應答,且效應細胞亞群主要為CD4+T細胞。
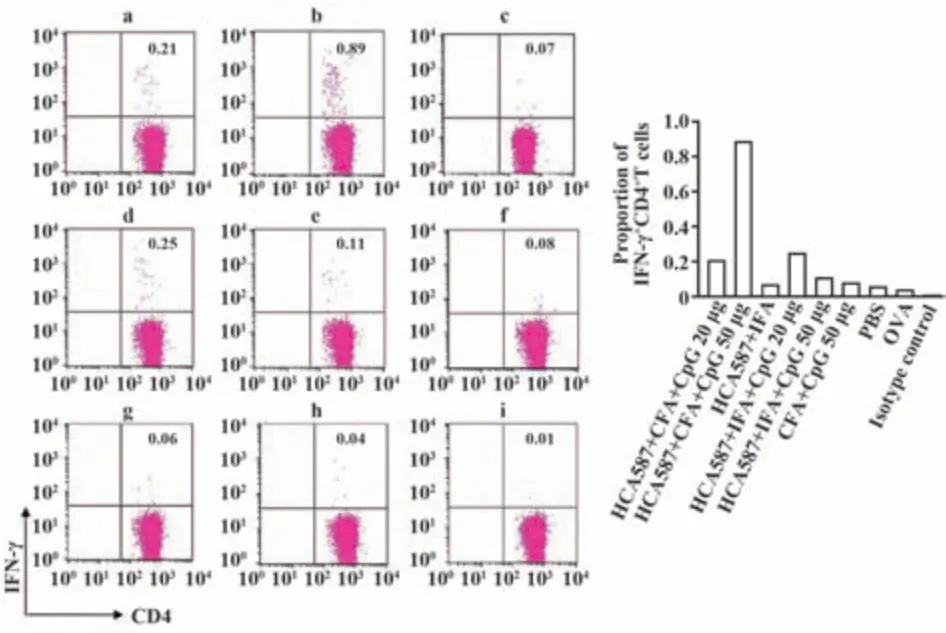
圖3 不同免疫策略誘導的IFN-γ+CD4+T細胞比例Fig.3 IFN-γ secreted by CD4+T cells from splenocytes following vaccination with different strategies
2.4 HCA587蛋白聯合CFA和50 μg CpG在小鼠模型中的抗腫瘤作用 基于以上研究結果,選擇HCA587蛋白聯合CFA和50 μg CpG作為最終疫苗策略觀察其在小鼠體內的抗腫瘤效果。結果顯示,該疫苗策略在體內能顯著延緩腫瘤生長(圖4A),但并不能顯著改善荷瘤小鼠存活率(圖4B)。
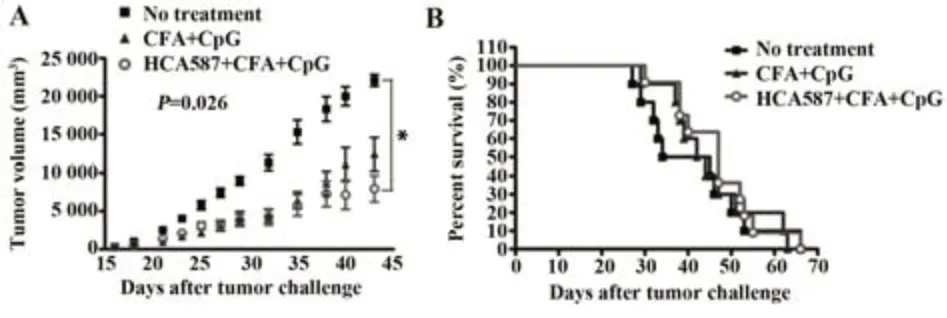
圖4 HCA587蛋白聯合CFA和50 μg CpG對B16-HCA587荷瘤小鼠的治療效果Fig.4 Anti-tumor effect of HCA587 protein formulated with CFA and 50 μg CpG against B16-HCA587 cells in tumor-bearing mice
3 討論
蛋白疫苗的優點包括不受MHC型別限制,在體內能被專業抗原提呈細胞攝取和呈遞,誘導高強度的包含CD4+T、CD8+T細胞和B細胞的綜合免疫應答[10]。本研究發現HCA587聯合CFA和50 μg CpG能誘導強大的細胞和體液免疫應答,并在小鼠體內呈現一定抗腫瘤作用。
佐劑對建立理想的免疫應答至關重要。免疫應答啟動時使用佐劑可增強天然免疫應答及適應性免疫應答[11-12]。佐劑是激活樹突狀細胞、誘導良好免疫環境的必要條件[13]。弗氏佐劑是一種經典佐劑,分為CFA和IFA,廣泛用于蛋白疫苗,并顯著增強人體宿主免疫應答[13-14]。可以解釋本研究中無論有無CpG存在,HCA587蛋白與CFA/IFA聯合免疫均可誘導較強的體液免疫應答。
一些臨床研究表明弗氏佐劑需要與其他佐劑結合才能增強其活性,如Toll樣受體3(TLR3)激動劑和TLR4激動劑CpG ODN[15-17]。MELSSEN等[15]研究表明,LPS和Polyiclc與IFA聯用是安全有效的疫苗佐劑,加入TLR激動劑時,IFA增強了T細胞對肽疫苗的反應。SPEISER等[17]研究表明,多肽、IFA和CpG ODN 7909疫苗可引起快速強烈的人類CD8+T細胞反應。此外,報道顯示,含有Montanide ISA 51佐劑的乳劑(油包水乳劑)中免疫多肽可能誘導以Th2為主的微環境,表明疫苗部位微環境并未誘導Th1/Tc1應答,而是誘導Foxp3+細胞和嗜酸性粒細胞,表明可能存在Th2主導的微環境[16]。以上結果支持了本研究結論,即弗氏佐劑需要其他佐劑幫助誘導足夠的細胞免疫應答。
CpG寡脫氧核苷酸是TLR9的配體,正廣泛作為刺激癌癥反應性CTL的多肽和蛋白質癌癥疫苗的有效佐劑[17]。CpG是一種含CpG基序的人工合成的寡核苷酸,是B細胞和Th1型免疫應答的有力驅動因素,并通過交叉遞呈促進分泌IFN-γ的細胞毒細胞產生[18-19]。疫苗有效性的基礎是宿主對抗原的免疫應答能否夠隨著時間推移而引起記憶T細胞反應[20]。疫苗接種試驗中,CpG佐劑可誘導較強的免疫應答。研究表明將合成的長NY-ESO-1多肽與強大的免疫佐劑CpG-B聯合接種,可在黑色素瘤患者中誘導完整和功能強大的CD8+T和CD4+T細胞反應,并顯著增強腫瘤抗原特異性抗體[21-22]。T細胞分泌的Ⅰ型細胞因子,如IFN-γ在T細胞介導的抗腫瘤機制中發揮重要作用[23]。本研究采用IFN-γ ELISpot實驗對幾種免疫策略進行比較,結果表明HCA587蛋白與CFA和CpG 50 μg聯合免疫可誘導大量分泌IFN-γ的脾細胞。同時,為了解免疫后的免疫應答類型和免疫細胞分泌細胞因子的能力進行了胞內細胞因子染色,HCA587和50 μg CpG誘導的脾細胞分泌IFN-γ的主要細胞群為CD4+T細胞,提示HCA587蛋白疫苗能誘導小鼠產生特異性Th1型細胞免疫應答,而CpG的存在是誘導Th1型細胞免疫應答的關鍵。
為評價HCA587蛋白疫苗在體內的抗腫瘤作用,本研究構建了穩定表達HCA587陽性的B16黑色素瘤細胞接種C57BL/6J小鼠。HCA587蛋白聯合CFA和50 μg CpG可特異性抑制HCA587抗原陽性小鼠腫瘤細胞,但不能延長荷瘤小鼠生存時間,可能與腫瘤微環境的復雜性有關。PD-1/PD-L1信號通路可抑制T細胞免疫應答,促進腫瘤免疫逃逸,適應性免疫維持的平衡狀態被破壞[24-25]。Tregs也可能在腫瘤微環境中通過各種直接和間接機制抑制T細胞反應和功能[26]。此外,IFA誘導的抗原特異性CD8+T細胞在細胞因子產生和增殖能力方面存在紊亂,可能是弗氏佐劑產生瞬時免疫應答和低臨床緩解率的重要機制[13]。佐劑可促進疫苗接種地點內T細胞招募、耗盡和最終死亡[27]。因此,基于以上結果,可以考慮改善免疫策略:使用更好的佐劑組合,如使用CpG和ISCOM佐劑組合誘導更強大的細胞和體液免疫應答[28-29];聯合檢查點抑制劑PD-1抗體治療;抑制PCSK9,有效減少MHCⅠ在溶酶體中的降解,顯著提高腫瘤細胞表面MHCⅠ表達和抗原遞呈,增強機體抗腫瘤免疫應答[30]。
綜上,HCA587蛋白聯合CFA和50 μg CpG佐劑能誘導小鼠產生強大的細胞和體液免疫應答,并具有一定抗腫瘤作用,為腫瘤抗原蛋白疫苗進入臨床試驗提供了新的依據。

