維生素D缺乏與2型糖尿病合并代謝性炎癥綜合征的相關性研究
鄭志榮(航空總醫院,北京 100012)
維生素D(VitD)是脂溶性維生素,其經典作用是調節鈣磷代謝,其在肝臟經肝臟25羥化酶轉化為25(OH)D,25(OH)D在血液中含量高且穩定,臨床上通過檢測25(OH)D水平來了解VitD的營養狀況。VitD受體(VDR)分布于全身各組織器官,VitD與其結合后參與免疫調節、炎癥等病理生理過程。代謝性炎癥綜合征(Metabolic inflammatory syndrome,MIS)是由我國學者胡仁明[1]等人首次提出的新概念,并發現2型糖尿病(type 2 diabetes mellitus,T2DM)患者高發MIS。VitD缺乏與T2DM密切相關,增加T2DM患者心血管死亡風險和全因死亡風險,補充VitD可延緩T2DM發生[2]。最近,有學者[3]發現血清25羥維生素D[25 hydroxy vitamin D,25 (OH)D]與2型糖尿病伴發MIS的超敏C反應蛋白(hs-CRP)、胰島素抵抗指數(HOMA-IR)關系密切,然而,維生素D缺乏與MIS的關系尚不明確,因此,筆者做了臨床研究,以明確維生素D與MIS的關系。
1 資料與方法
1.1研究對象
1.1.1一般資料 選取2019年1月-2019年12月時間段內的因糖尿病及其并發癥住院的患者,連續納入122例。其中男72例,女50例,年齡(62.1±6.9)歲,有高血壓病史71例(58.2%),吸煙39例(31.97%),飲酒33例(27.05%),糖尿病的病程(10.8±3.0)年。采集年齡、性別、BMI、吸煙史、非長期飲酒史、T2DM病程、高血壓病史、超聲診斷的NAFLD、超聲診斷的動脈粥樣硬化等資料,以及血清檢測指標如空腹血糖(fasting plasma glucose,FPG)、糖化血紅蛋白(HbA1c)、總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、C反應蛋白(CRP)、尿酸(UA)等。本研究經醫院倫理委員會審批通過。
1.1.2病例納入和排除標準 納入標準:①均符合1999年世界衛生組織(WHO)制定的T2DM診斷標準[4];②病歷資料完整。排除標準:有長期飲酒史、妊娠高血壓或繼發性高血壓病史、其他類型的糖尿病、住院期間處于感染及相關疾病、肝腎功能不全、惡性腫瘤、自身免疫性疾病史或其他嚴重疾病等。
1.2診斷標準
1.2.1MIS的診斷標準[1]MIS為符合以下4項中的2項或2項以上者:①T2DM;②體質指數(Body Mass Index,BMI)≥25kg/m2(超重或肥胖);③非酒精性脂肪肝病(Nonalcoholic fatty liver disease,NAFLD):超聲診斷為脂肪肝并且根據病史排除酒精性脂肪肝;④動脈粥樣硬化(Atherosclerosis,AS):超聲檢查頸動脈或下肢動脈存在斑塊。
1.2.2高血壓的診斷標準 高血壓:符合《中國高血壓防治指南(2018年修訂版)》[5]的診斷標準,或既往已經明確診斷的高血壓,現在用或不用藥物治療者。
1.2.3吸煙的判定標準 吸煙者被定義為入院前1年內吸煙的患者[6]。
1.2.4長期飲酒史的判定標準[7]飲酒時間一般超過5年,折合乙醇量≥40g/d,女性≥20g/d;或兩周內有大量飲酒史(≥80g/d)。乙醇量換算公式為:g=飲酒量(ml)×酒精含量(%)×乙醇比重。
1.3研究方法
1.3.1血清25羥維生素D檢測方法和正常值范圍 患者入院當天晚上開始禁食,禁食8h以上,于次日清晨抽取靜脈血5ml送檢。檢測儀器為羅氏601全自動化學發光免疫分析儀,采用電化學發光法檢測25(OH)D,≥30ng/ml為正常范圍。
1.3.2BMI的計算方法 測量身高、體重,BMI=體重(kg)/身高(m)2,其評估標準為:正常BMI在18.5-23.9kg/m2;偏輕BMI≤18.5kg/m2;超重BMI在24.0-27.9kg/m2;肥胖BMI≥28.0kg/m2。
1.3.3觀察指標 性別、年齡、高血壓史、吸煙、非長期飲酒史、糖尿病病程、BMI、FPG、HbA1c、TC、TG、HDL-C、LDL-C、UA、CRP、25(OH)D。
1.3.4數據庫的建立和統計學分析方法 將搜集的數據錄入數據庫。采用SPSS19.0統計軟件對數據庫進行統計分析。計量資料先進行方差齊性檢驗,如果方差齊,則以(±s)表示,組間比較采用t檢驗;如果方差不齊,以中位數與四分位數間距表示[M(QL,QU)],組間比較采用秩和檢驗;計數資料以率表示,組間比較采用χ2檢驗。多因素分析采用二分類Logistic回歸分析。以P<0.05表示差異有統計學意義。
2 結果
2.1兩組患者的臨床特征比較 在性別、年齡、高血壓病史、吸煙、非長期飲酒等方面的差異均無統計學意義(P>0.05),而在病程和BMI等方面的差異具有統計學意義(P<0.05),詳見表1。
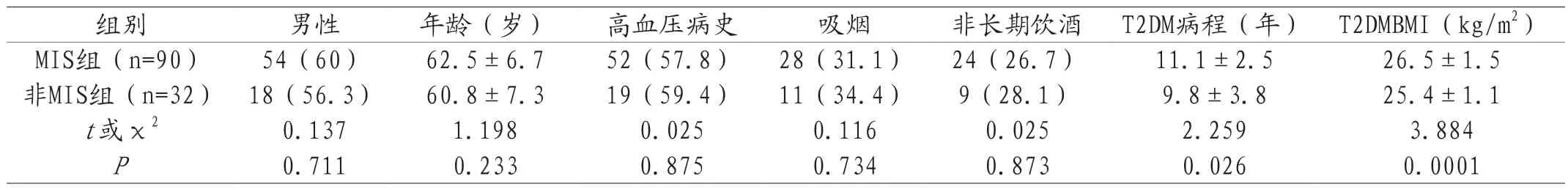
表1 兩組臨床特征比較
2.2兩組患者的血液生化指標比較 在FPG、HbA1c、TC、TG、LDL-C、UA等方面的差異無統計學意義(P>0.05);而在HDL-C、CRP和25(OH)D等方面的差異均具有統計學意義(P<0.05),詳見表2。

表2 兩組血液生化指標比較
2.3多因素Logistic回歸分析 以是否T2DM并發MIS作為因變量,以病程、BMI、HDL-C、CRP和25(OH)D等作為自變量作多因素Logistic回歸分析,結果BMI、CRP和25(OH)D進入回歸方程,BMI和CRP的回歸系數均為正數,說明BMI、CRP兩個變量增高可促進T2DM發生MIS,而25(OH)D的回歸系數為負數,表明25(OH)D顯著降低可促進T2DM發生MIS,詳見表3。

表3 二分類Logistic回歸分析結果
3 討論
本研究資料顯示CRP的回歸系數為正數,說明其增高可促進T2DM發生MIS,而25(OH)D的回歸系數為負數,表明25(OH)D顯著降低可促進T2DM發生MIS。研究[8-10]顯示,25(OH)D水平與胰島素敏感性呈正相關,維生素D缺乏的個體有更高的胰島素抵抗和2型糖尿病危險。糖尿病患者普遍存在維生素D不足或缺乏情況,低水平維生素D除與糖尿病發生密切相關外,還會增加糖尿病并發癥發生率[11],還有學者[12]發現高水平C反應蛋白(CRP)、高體質指數(Body Mass Index,BMI)是T2DM合并MIS的危險因素,而血清25(OH)D與2型糖尿病伴發MIS的超敏C反應蛋白、胰島素抵抗指數(HOMA-IR)關系密切[3]。這些研究的結果提示維生素D可能參與了T2DM的胰島素抵抗,同時也可能與慢性低度炎癥密切相關。代謝失調所致的產物,如游離脂肪酸、脂多糖等使巨噬細胞極化,常常誘發慢性低度炎癥[13-14],也稱代謝性炎癥(Metabolic inflammation或Metflammation),慢性低度炎癥與代謝性疾病關系密切,其參與并導致AS、T2DM、NAFLD及肥胖等代謝性疾病的發生。MIS由一組代謝性疾病組成,其中包括肥胖、NAFLD、T2DM和AS,將伴有上述4個代謝性疾病中2個或2個以上的患者診斷為MIS。因此,T2DM患者低水平血清25(OH)D、高水平CRP均與發生MIS獨立相關,同時也提示T2DM并發MIS的機制可能為慢性低度炎癥。
本研究結果還顯示BMI的回歸系數均為正數,說明其增高可促進T2DM發生MIS。因為肥胖是MIS的一個常見組成部分,故BMI與MIS是正相關關系。有研究[15]表明單核巨噬細胞侵襲脂肪細胞可導致肥胖。因此,BMI增高是慢性炎癥的結果,BMI增高是T2DM發生MIS的獨立危險因素。
本研究的不足之處在于樣本量小,有可能發生數據偏倚,其結果還有待于擴大樣本量進一步驗證。
總之,當T2DM患者出現血清維生素D水平顯著降低、CRP水平顯著升高或明顯肥胖時,發生MIS的風險顯著增大。

