氧化苦參堿對高糖誘導乳鼠原代心肌成纖維細胞轉分化的作用及機制*
張宇菲, 羅紅, 肖紅, 陶玲, 沈祥春*, 常楚瑞*
(1.貴州醫科大學 天然藥物資源優效利用重點實驗室, 貴州 貴陽 550025; 2.貴州醫科大學 貴州省特色天然藥物資源高效利用工程中心, 貴州 貴陽 550025)
心肌纖維化(myocardial fibrosis,MF)是糖尿病心肌病(diabetes cardiomyopathy,DCM)的一個重要特征,是糖尿病患者心臟的特異性病理性改變,導致患者心功能下降和心律失常等心血管意外事件[1]。也是指當受到病理條件的刺激時,心臟組織中的心肌成纖維細胞(cardiac fibroblasts,CFBs)異常增殖,從而促進CFBs向肌成纖維細胞轉分化(fibroblast-to-myofibroblast transformation,FMT)[2]。FMT是一種細胞分化和再生的復雜病理生理學過程,具體而言,糖尿病人體內的高糖(high glucose,HG)等環境,誘導CFBs的激活和分化,主要是表達肌成纖維細胞標志物、間質細胞產物Ⅰ型與Ⅲ型膠原[3],產生過量的細胞外基質(extracellular matrix,ECM)蛋白從而獲得肌成纖維細胞表型[4]。引起ECM的過度沉積、合成和代謝比例失調,膠原蛋白含量顯著增加[5],從而導致糖尿病患者的心室壁發生硬化,心肌的收縮功能下降,引起心臟供血不足,導致心室的順應性減退,嚴重時甚至造成心衰[6]。因此,尋找能夠有效抑制CFBs增殖、遷移、膠原沉積和促纖維化細胞因子表達的新型潛在藥物,對于預防MF的發生發展非常重要,對加強心血管疾病的治療,降低心血管疾病的病死率,提高心血管疾病患者的生活質量也具有重要的意義。氧化苦參堿(oxymatrine,OMT)又名苦參素,是從豆科屬植物苦參中分離出來的生物堿,具有抗腫瘤、抗炎、抗纖維化、心臟保護、改善心力衰竭的作用[7-11],此外,它還保護人體組織和器官,如肝臟、腸道及心臟等[12-13]。本課題組前期從動物、細胞、分子水平實驗分別探討了OMT的抗MF作用及相關機制,結果表明OMT可減少心肌細胞肥大和凋亡,抑制CFBs增殖與轉分化,并可減少MF的發生[14-15]。基于此,本研究在CFBs增殖模型基礎上,觀察OMT對HG誘導CFBs轉分化的影響及其是否可能通過缺氧誘導因子-1α(hypoxia inducible factor-1α,HIF-1α)信號對HG誘導的CFBs轉分化產生抑制作用。
1 材料與方法
1.1 實驗材料
1.1.1動物來源 日齡1~2 d的健康Sprague-Dawley(SD)乳鼠20只,7~10 g,雌雄不限,由學校實驗動物中心提供[SCXK(湘)2019-0014]。本研究已獲學校動物倫理委員會批準(No.2000132),且遵守了動物倫理學的相關規定。
1.1.2主要試劑 OMT(南京澤郎醫藥科技有限公司,20080210),D-葡萄糖(1102A0939)、D-甘露醇(1123F038)、噻唑藍(117X0516)、蘇木素伊紅(hematoxylin-eosin,HE)染色試劑盒(G1121)、天狼星紅苦味酸染色試劑盒(G1472)及蛋白定量(bicinchoninic acid,BCA)試劑盒(PC0020,北京Solarbio公司),Lificiguat(YC-1;170623-47-0,美國MCE公司),細胞培養基(dulbecco's modified eagle medium,DMEM;1717154,美國Gibco公司),羥脯氨酸(hydroxyproline,Hyp)試劑盒(A0310-1-1,中國南京建成生物工程研究所),HIF-1α(20960-1-AP)、VEGFA(19003-1-AP)、Vimentin(12789-1AP)、平滑肌肌動蛋白(alpha smooth muscle Actin,α-SMA;14395-1-AP)、Ⅰ型膠原(Collagen Ⅰ,14695-1-AP)、Ⅲ型膠原(Collagen Ⅲ,22734-1-AP)及纖粘蛋白(fibronectin,FN;15613-1-AP,中國武漢三鷹生物技術有限公司),結締組織生長因子(connective tissue growth factor,CTGF;MD5912-50,北京百奧思科生物醫學技術有限公司)和磷酸甘油醛脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體(美國Bioworld Technology公司,AB2243)。
1.1.3主要儀器 倒置顯微鏡XDS-2B型(日本尼康公司);酶標儀VARIOSKANLUX型(美國Thermo Fisher Scientific 公司);5810R型冷凍離心機(德國Eppendorf公司);SW-CJ-2F型單人操作凈化臺(中國蘇州凈化設備有限公司);細胞培養箱HF240型(中國上海力申科學儀器有限公司)。
1.2 研究方法
1.2.1原代CFBs的分離與培養 取SD乳鼠20只,參考文獻[16]方法取心尖部份,置于4 ℃預冷磷酸緩沖鹽溶液(phosphate buffer saline,PBS)培養皿中清洗;眼科剪剪成約1 mm3組織塊,PBS清洗,加胰酶于4 ℃過夜;次日棄上清液,加胰酶消化液,膠頭滴管吹散組織,加含血清的培養基,1 000 r/ min離心5 min,棄上清,加含血清的細胞培養基,混勻接種于培養瓶,培養箱中貼壁60~90 min,棄培養基,加含胎牛血清的培養基于培養箱中培養待后續實驗使用。
1.2.2噻唑藍比色法[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]法檢測細胞的增殖能力及OMT保護濃度的確定 取“1.2.1”項下對數生長期CFBs細胞,按50個/L密度接種培養,分為空白(Control)組、40 mmol/L甘露醇(Mannitol)組、不同濃度(30、35、40、45及50 mmol/L)HG組及不同濃度(25、50、100、200及400 mg/L)OMT組,每組6個復孔,各組按上述藥物處理24 h,加5 g/L MTT,20 μL/孔,37 ℃孵育4 h,吸取上清液,加二甲基亞砜(dimethyl sulfoxide,DMSO)150 μL,酶標儀于490 nm檢測吸光度;根據濃度效應的結果,選取最佳濃度HG分別作用于24和48 h,計算細胞存活率并確定后續實驗OMT的保護濃度。實驗均重復3次。
1.2.3細胞分組及HE染色觀察細胞形態 取“1.2.1”項下對數生長期CFBs細胞接種于6孔板,待細胞密度長到80%左右,結合“1.2.2”項下OMT的保護濃度結果,分為空白(Control)組、40 mmol/L甘露醇(Mannitol)組、40 mmol/L HG(HG)組、40 mmol/L HG+50 mg/L OMT(OMT低劑量)組、40 mmol/L HG+100 mg/L OMT(OMT中劑量)組及40 mmol/LHG+200 mg/L OMT(OMT高劑量)組,各組按上述處理結束后,棄培養基,PBS洗3次;加 4%多聚甲醛1 mL固定15 min,棄固定液,PBS洗3次;0.5%TritonX×100破膜20 min,PBS洗3次;蘇木素染色15 min,自來水洗掉多余染液;分化液分化5 s,自來水洗滌;返藍液返藍1 min,自來水洗洗滌;伊紅染液染色1 min,于顯微鏡下觀察各組細胞的形態變化。
1.2.4天狼星紅染色法觀察細胞的膠原纖維表達 取“1.2.3”項下蘇木素染色前的各組CFBs細胞,天狼星紅染液染1 h,自來水洗滌;蘇木素染液染5 min,于顯微鏡下觀察各組細胞的纖維表達情況。
1.2.5Hyp試劑盒法檢測細胞中Hyp的分泌情況 取“1.2.1”項下對數生長期CFBs細胞接種于6孔板,待細胞密度長到80%左右,按“1.2.3”分組給藥,24 h后吸取培養液上清500 μL,檢測各組細胞中Hyp的分泌。
1.2.6免疫熒光染色法檢測α-SMA的表達 取“1.2.1”項下對數生長期CFBs細胞接種于12孔板,待細胞生長到70%左右時,按照分組進行24 h的給藥處理。4%多聚甲醛固定,0.5%TritionX×100固定;5%牛血清白蛋白(bovine serum albumin,BSA)封閉60 min,加一抗(α-SMA∶一抗稀釋液=1∶500),4 ℃下孵育過夜;次日加熒光二抗[異硫氰酸熒光素(fluorescein isothiocyanate isomer,FITC)∶5% BSA=1∶500]孵育60 min;DAPI(DAPI∶PBS=1∶1 000)染核5 min;顯微鏡下觀察并拍照。
1.2.7流式細胞術測定CFBs的周期分布比例 取“1.2.1”項下對數生長期CFBs細胞,以1×105的密度接種培養,根據“1.2.3”項下實驗分組給藥,置于培養箱培養24 h后棄培養液,胰蛋白酶消化細胞,1 000 r/min離心5 min,沉淀細胞;棄上清,PBS 1 mL潤洗細胞,1 000 r/min離心5 min收集;將細胞沉淀與70%乙醇混勻,4 ℃過夜;次日,取沉淀細胞1 000 r/min離心5 min,PBS重新懸浮細胞;1000 r/min離心5 min,獲得細胞沉淀;每份細胞樣品中加混合液[染料緩沖液0.5 mL、碘化丙啶儲液10 μL及核糖核酸酶A(ribonuclease A from bovine pancreas,RNAse A)溶液10 μL混合均勻]0.5 mL,37 ℃避光孵育30 min;最后用流式細胞儀上機檢測。
1.2.8Western blot檢測α-SMA、CTGF、Collagen Ⅰ、Collagen Ⅲ、FN、VEGFA及HIF-1α蛋白的表達 取“1.2.1”項下對數生長期CFBs細胞,按“1.2.3”分組給藥,加radio immunoprecipitation assay(RIPA)裂解液和苯甲磺酰氟(benzylsulfonyl fluoride,PMSF)按比例(RIPA∶PMSF=99∶1)裂解細胞,按說明書步驟提取蛋白,定量分裝蛋白,電泳操作,濕轉法轉膜90 min,5%BSA封閉液封閉90 min,加一抗α-SMA(1∶400)、CTGF(1∶1 000)、Collagen Ⅰ(1∶2 000)、Collagen Ⅲ(1∶1 000)、FN(1∶1 000)、VEGFA(1∶2 000)、HIF-1α(1∶5 000)及GAPDH(1∶10 000),置搖床上30 min,4 ℃孵育過夜;次日加二抗(1∶10 000)孵育2 h;避光,采用Bio-Rad蛋白質印跡成像系統顯影,采集相應的蛋白圖像,ImageLab軟件對蛋白條帶進行分析。
1.3 統計學分析
2 結果
2.1 細胞增殖活性及OMT保護濃度的確定
MTT實驗結果顯示(圖1),不同濃度的HG作用24 h后對細胞的增殖作用較48 h明顯,并呈劑量依賴性,其中40 mmol/L的HG濃度下細胞增殖率達116.20%(P<0.05);給予不同濃度OMT能夠不同程度抑制HG誘導的細胞增殖,HG組CFBs存活率較Control組升高(P<0.05);與HG組相比,當OMT濃度<25 mg/L及>400 mg/L時,細胞存活率無明顯影響(P>0.05);當OMT濃度分別為50 mg/L、100 mg/L及200 mg/L時,細胞存活率不同程度的下降(P<0.05);與Control組相比,Mannitol組無明顯差異(P>0.05)。因此將50、100 及200 mg/L OMT分別作為OMT低、中及高劑量組作用于后續實驗。
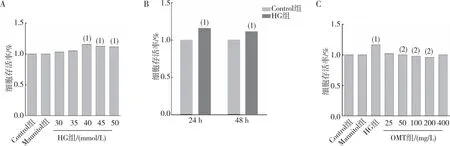
注:A、B為CFBs增殖的濃度-時間效應結果,C為OMT的保護濃度;(1)與Control組相比,P<0.05;(2)與HG組相比,P<0.05。
2.2 細胞形態學特征
與Control組比較,HG組的CFBs細胞數量增多,細胞核增大,細胞間隙變小;與HG組比較,OMT低、中及高劑量組細胞數量明顯減少,細胞形態不同程度的恢復。上述結果表明OMT可以改善HG誘導的CFBs數量及形態病理的改變。見圖2。
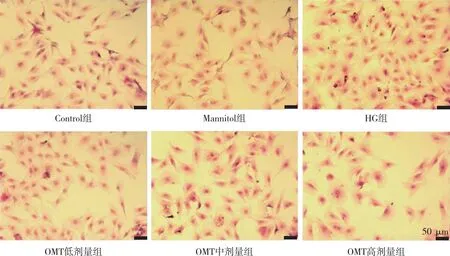
注:藍紫色為CFBs細胞核,粉紅色為CFBs細胞漿。
2.3 細胞膠原纖維的表達
天狼星紅苦味酸染色結果如圖3所示,與Control組比較,HG組CFBs細胞數量增多,且紅色的膠原面積增加;與HG組相比,OMT低、中及高劑量組細胞數量和紅色膠原面積都呈減少的趨勢,提示OMT可以改善HG誘導的CFBs膠原沉積。
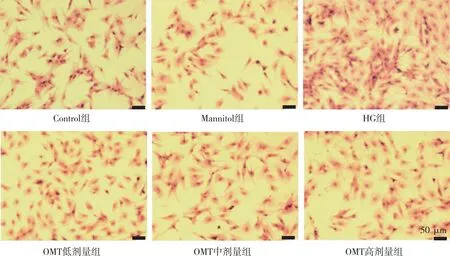
注:紅色為CFBs膠原纖維,紫紅色為CFBs細胞核。
2.4 Hyp含量的分泌
HG作用24 h后,Hyp檢測結果顯示(圖4),與Control組比較,HG組培養基上清中的Hyp含量升高(P<0.05);與HG組比較,OMT低、中及高劑量組培養基上清中的Hyp含量不同程度的降低(P<0.05);與Control組相比,Mannitol組無明顯差異(P>0.05)。
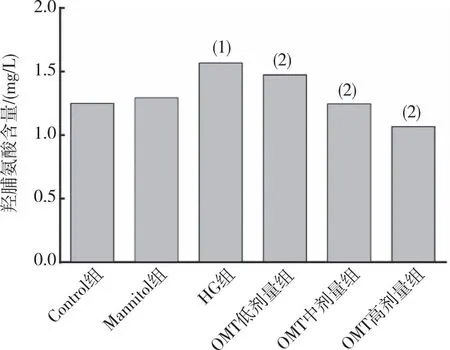
注:(1)與Control組相比,P<0.05;(2)與HG組相比,P<0.05。
2.5 細胞α-SMA的表達
熒光顯微鏡觀察結果顯示(圖5),與Control組相比,HG組CFBs細胞數量顯著增加,綠色熒光強度增強;與HG組比較,OMT低、中及高劑量組CFBs細胞數量減少,綠色熒光強度減弱。
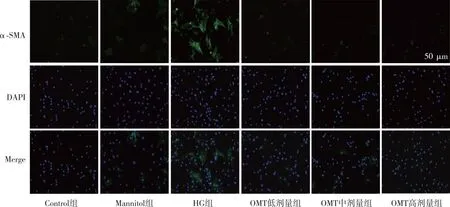
注:綠色熒光表示α-SMA,藍色熒光表示細胞核。
2.6 細胞周期
流式細胞儀檢測結果表明(圖6),與Control組相比,HG組CFBs細胞在S期的分布比例增加(P<0.05);與HG組相比,OMT低、中及高劑量組CFBs細胞在S期的分布比例有所減少(P<0.05);與Control組相比,Mannitol組無差異(P>0.05)。
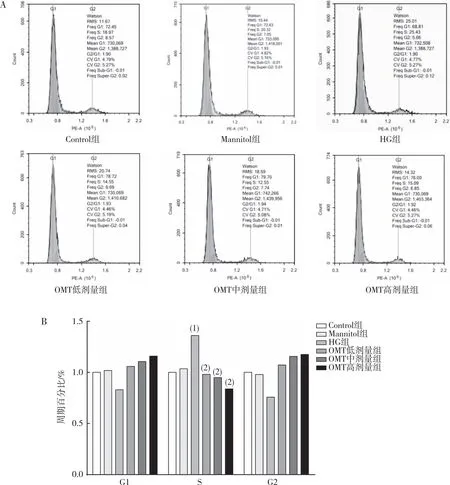
注:A為流式細胞儀檢測結果,B為定量結果;(1)與Control組相比,P<0.05;(2)與HG組相比,P<0.05。
2.7 細胞HIF-1α和VEGFA蛋白的表達
Western bolt實驗結果表明(圖7),與Control組相比,HG組CFBs中HIF-1α、VEGFA蛋白的表達升高(P<0.05);與HG組相比,OMT低、中及高劑量組CFBs中HIF-1α和VEGF蛋白表達減少(P<0.05);與Control組相比,Mannitol組HIF-1α和VEGF蛋白表達無差異(P>0.05)。
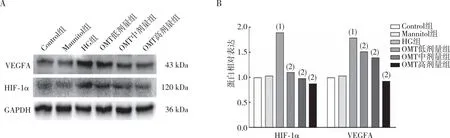
注:A為電泳結果,B為蛋白定量結果;(1)與Control組相比,P<0.05;(2)與HG組相比,P<0.05。
2.8 細胞α-SMA、CTGF、CollagenⅠ、CollagenⅢ及FN蛋白的表達
Western bolt實驗結果表明(圖8),與Control組相比,HG組CFBs中α-SMA、CTGF、Collagen Ⅰ、Collagen Ⅲ及FN蛋白表達升高(P<0.05);與HG組相比,OMT低劑量、中劑量及高劑量組CFBs中α-SMA、CTGF、CollagenⅠ、Collagen Ⅲ及FN蛋白表達減少(P<0.05);與Control組相比,Mannitol組上述蛋白表達無差異(P>0.05)。
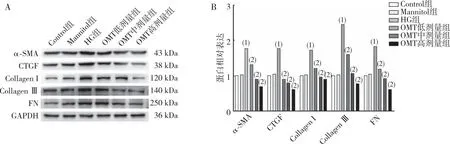
注:A為電泳結果,B為蛋白定量結果;(1)與Control組相比,P<0.05;(2)與HG組相比,P<0.05。
2.9 細胞VEGFA、HIF-1α、α-SMA、CTGF、Collagen Ⅰ及Collagen Ⅲ蛋白的表達
蛋白質免疫印跡法檢測HIF-1α信號相關蛋白以及MF相關蛋白的表達,結果提示(圖9),與Control組比較,HG組CFBs中HIF-1α、VEGF及MF相關蛋白表達升高(P<0.05);與HG組比較,OMT組(200 mg/L)和YC-1組(1 mg/L)CFBs中HIF-1α、VEGF及MF相關蛋白表達減少(P<0.05)。

注:A為電泳結果,B為蛋白定量結果;(1)與空白組(Control)組相比,P<0.05;(2)與HG組相比,P<0.05。
3 討論
糖尿病引起的心血管并發癥已成為全球發病率和死亡率的主要原因,這些疾病包括冠心病、風濕性心臟病、外周血管疾病、心力衰竭、先天性心臟病及心肌病,病理性MF幾乎參與了心血管病的所有病理生理過程,DCM在進展的早期階段沒有臨床癥狀,主要表現為各種形式的心臟代謝異常,這可能與MF和僵化的增加有關,這些有害的變化進一步導致心房充盈功能障礙和左心室舒張末期壓力升高,后期DCM演變為心力衰竭,隨后是心臟重塑、左心室肥厚、心肌間質纖維化及舒張功能障礙,進一步導致射血分數降低的心力衰竭[17-18]。由于DCM發病機制的復雜性和臨床特征,臨床管理面臨著巨大的挑戰。盡管過去10年進行了大量的研究,但DCM的治療仍然是一個醫學難題。2008年,美國食品和藥物管理局(Food and Drug Administration,FDA)也提出,僅僅控制血糖對糖尿病引起的心血管并發癥是不夠的,需要深入研究DCM的病理基礎和發病機制,以降低患者的死亡率[19]。DCM病變導致心肌供血不足,心臟的舒張功能也下降,加重纖維化的形成,最終導致MF[20]。間質心肌中含有大量的膠原蛋白,這可能導致心臟依從性受損,心臟功能的收縮和舒張能力也將下降[21],DCM的發生會引起心肌能量代謝紊亂,毛細血管基底膜增厚[22],膠原結構改變,心臟自主神經病變,導致微循環障礙,這會引起心肌廣泛的壞死、纖維化,心臟的收縮功能下降,從而導致心臟擴大、心律失常、甚至猝死等[23]。此外,胰島素抵抗和葡萄糖的高毒性會在一定程度上破壞心肌組織,加劇心肌無力及心肌組織的纖維化[24]。當DCM病癥持續嚴重時,患者的心室擴張,左心室壁厚度增大,心臟結構將發生改變,引發心功能不全[25]。DCM是由糖尿病引起的一種特異性心肌病,是高血壓的早期癥狀,但也伴隨著舒張心功能受損和收縮,隨著疾病的發展,會逐漸導致心力衰竭,死亡率和臨床致殘率均較高[26]。隨著時間的推移,越來越多研究發現,高血糖的存在已經被證實對心臟結構和心功能會產生不良的影響[27]。因此,為了明確介導FMT的新機制開展深入的研究,尋找可以改善CFBs轉分化的天然藥物非常重要。
MF的特征是CFBs的積累和ECM的過度沉積,CFBs轉分化出來的肌成纖維細胞是導致心臟纖維化的主要原因,這些病變是DCM的起始和進展[28]。因此,控制CFBs異常增殖和向肌成纖維細胞轉分化對于減輕心臟纖維化至關重要。而尋找抑制人類心臟纖維化的新分子靶點一直是一個重要的研究熱點。OMT是苦參中重要且有效的成分,其獨特的藥理作用可以改善心血管疾病[29];有研究表明,OMT可以調節多種參與糖尿病MF的關鍵基因[30],因此可以作為糖尿病MF研究的陽性藥物,確認發生MF的真實性和藥物藥效作用的有效性。本研究結果表明,HG可促進CFBs的轉分化,從而引起CFBs病理形態的改變,同時也會上調MF蛋白的表達,OMT則能夠有效地逆轉上述現象,因此表明OMT對HG誘導的CFBs轉分化具有一定的抑制作用。
DCM中CFBs大量增殖,不僅面臨更多的氧氣消耗,而且還會出現表皮肥厚的現象,最終導致氧供應的障礙[31-32];大量研究還顯示,轉錄因子HIF-1α在缺氧的組織或細胞可以被有效地儲存,從而調控及影響其下游多種因子的轉錄和表達[33-34];其中,包括TGF-β1、VEGFA等具有促纖維化功能的分子[35-36]。HIF-1α在纖維化發生機制中扮演者重要的角色,鑒于HIF-1α的特殊功能,其可能參與了MF過程,并有可能成為有效的治療靶點。YC-1作為一種特異的HIF-1α抑制劑,它在抑制纖維化方面發揮著重要作用,不僅能夠有效地抑制HIF-1α的轉錄活性,而且能抑制其下游分子的轉錄和表達[37-38]。YC-1能否通過抑制HIF-1α,從而減輕MF程度,目前還沒有相關的研究報道。有研究表明,HIF-1α是一種核轉錄因子,介導哺乳動物細胞對缺氧的反應。廣泛表達于哺乳動物的各種組織和細胞中,促進機體和細胞對缺氧的適應[39-40]。因此,HIF-1α作為使機體耐受缺氧、維持氧穩態的重要因素,并且為纖維化疾病的診斷和治療帶來了全新的視角。本研究中,采用體外實驗培養HG誘導的大鼠CFBs增殖模型,旨在深入探討HIF-1α在HG情況下如何加重MF程度的分子機制,以及其抑制劑YC-1對HG誘導的MF的抑制作用,最終提供一種有效的抗糖尿病MF的治療策略。
綜上,OMT通過調控HIF-1α信號可以有效地改善HG誘導的CFBs轉分化,減少膠原的沉積以及MF相關蛋白的表達,同時也減弱了相關信號分子的表達,進一步表明OMT通過影響HIF-1α信號發揮抑制CFBs轉分化的作用及機制,減少MF的發生和發展,為預防和治療MF奠定良好的基礎。

