載阿霉素納米粒溫敏凝膠復(fù)合體系的體內(nèi)緩釋性能和抗腫瘤作用及瘤內(nèi)滯留性能評(píng)價(jià)*
杜華康, 陸苑, 金陽, 陳玉穎, 王永林,3, 李勇軍,3, 劉文***
(1.貴州醫(yī)科大學(xué) 貴州省藥物制劑重點(diǎn)實(shí)驗(yàn)室 & 省部共建藥用植物功效與利用國(guó)家重點(diǎn)實(shí)驗(yàn)室, 貴州 貴陽 550004; 2.貴州醫(yī)科大學(xué) 藥學(xué)院, 貴州 貴陽 550004; 3.貴州醫(yī)科大學(xué) 民族藥與中藥開發(fā)應(yīng)用教育部工程研究中心, 貴州 貴陽 550004)
原發(fā)性肝癌是一種致命的消化道惡性腫瘤,其特點(diǎn)是起病隱匿、進(jìn)展快、生活質(zhì)量差及生存時(shí)間短[1],包括肝細(xì)胞癌(75%~85%)、肝內(nèi)膽管癌(10%~15%)及混合細(xì)胞癌(<15%)[2-4]。由于大多數(shù)肝癌患者在早期無明顯癥狀,確診時(shí)已處于中晚期[5-6]。對(duì)于這類中晚期患者,通常采用經(jīng)肝動(dòng)脈化療栓塞術(shù)(transarterial chemoembolization,TACE),即在數(shù)字減影血管造影機(jī)引導(dǎo)下,經(jīng)導(dǎo)管將混有化療藥物的碘油注射至腫瘤組織供血的二級(jí)或三級(jí)動(dòng)脈血管中,局部栓塞腫瘤組織的供血,“餓”死腫瘤的同時(shí)釋放化療藥物“毒”死腫瘤[7-8]。現(xiàn)已證實(shí),傳統(tǒng)TACE治療后(化療藥物與碘油簡(jiǎn)單的混合乳化后注射),與系統(tǒng)給藥方式相比,腫瘤局部藥物濃度雖能在短時(shí)間提高100倍以上,但化療藥物會(huì)在1~2 d內(nèi)迅速擴(kuò)散殆盡,腫瘤局部藥物有效治療濃度維持時(shí)間短,難以達(dá)到臨床期望效果[9]。為解決傳統(tǒng)TACE中化療藥物維持局部有效濃度時(shí)間短的問題,臨床上已廣泛推廣載藥微球(將化療藥物裝載在聚合物材料內(nèi),可達(dá)到緩慢釋放藥物的目的)[10]。但這類載藥微球價(jià)格昂貴,給肝癌患者帶來巨大經(jīng)濟(jì)壓力,且為不可降解材料不利于后續(xù)治療。本課題組前期研究制備的通過微導(dǎo)管注射的載阿霉素納米粒溫敏凝膠(doxorubicin-loaded nanoparticles thermosensitive gel,DOX-NPs-Gel)復(fù)合體系可較好地解決傳統(tǒng)TACE中阿霉素(doxorubicin,DOX)-碘油乳劑釋藥過快的問題且材料安全、可生物降解,但其在體內(nèi)的緩釋性能、抗腫瘤作用及瘤內(nèi)滯留性能尚不明了,因此本研究考察了DOX-NPs-Gel在大鼠體內(nèi)的緩釋性能和對(duì)H22荷瘤模型小鼠的抑瘤效果及瘤內(nèi)滯留性能。
1 材料與方法
1.1 實(shí)驗(yàn)材料
1.1.1動(dòng)物和細(xì)胞來源 雄性Sprague-Dawley(SD)大鼠18只,體質(zhì)量(250±20)g,購(gòu)于遼寧長(zhǎng)生生物技術(shù)股份有限公司[生產(chǎn)許可號(hào)SCXK(遼)2020-0001];美國(guó)癌癥研究所(Institute of Cancer Research,ICR)雄性小鼠90只,體質(zhì)量(20±2)g,購(gòu)于斯貝福(北京)生物技術(shù)有限公司[生產(chǎn)許可號(hào)SCXK(京)2019-0010];小鼠肝癌細(xì)胞株H22細(xì)胞購(gòu)自武漢普諾賽生命科技有限公司。本研究實(shí)驗(yàn)方案獲得學(xué)校實(shí)驗(yàn)動(dòng)物倫理委員會(huì)審查批準(zhǔn)(2201022)。
1.1.2主要試劑 DOX(含量>98.0%,大連美倫生物),殼聚糖(脫乙酰度≥95%,上海羅恩試劑),β-甘油磷酸鈉(含量≥98.0%,美國(guó)西格瑪奧德里奇),罌粟乙碘油注射液(碘濃度為480 g/L,江蘇恒瑞),PLGA(相對(duì)分子量10 kD,西安瑞禧生物),卵磷脂(供口服用藥用輔料,江蘇曼氏生物),吐溫-80(北京索萊寶),阿奇霉素(含量>98.0%,大連美倫生物),其余試劑為分析純。
1.1.3主要儀器 ACQUITY UPLC型超高效液相色譜-三重四級(jí)桿質(zhì)譜串聯(lián)儀(美國(guó)Waters),Forma 905-ULTS1490醫(yī)用低溫冰箱(美國(guó)Thermo Fisher),FDU-1100真空冷凍干燥機(jī)(日本東京理化器械),JY88-IIN細(xì)胞破碎機(jī)(寧波新芝生物),90Plus激光粒度儀(美國(guó)布魯克),R100旋蒸儀(瑞士步琦),Optima XPN-100超速離心機(jī)和Allegra X-30R低溫高速離心機(jī)(美國(guó)貝克曼庫(kù)爾特公司),MSC5R磁力攪拌器(群安實(shí)驗(yàn)),UV-2700紫外可見分光光度儀(島津儀器),IMS-20制冰機(jī)(常熟雪科),XYN-15LP氮?dú)獍l(fā)生器(上海析友),EL204電子天平(上海梅特勒-托利多)。
1.2 研究方法
1.2.1DOX-碘油的配制 用兩注射器分別吸取4 g/L DOX溶液1 mL 與碘油1 mL,通過三通管連通并混勻,臨用前現(xiàn)配。
1.2.2大鼠體內(nèi)緩釋性能考察 18只雄性SD大鼠隨機(jī)均分為DOX組、DOX-碘油組及DOX-NPs-Gel組,分別腹腔注射給予DOX、DOX-碘油及DOX-NPs-Gel(DOX為5 mg/kg,DOX濃度為2 g/L),分別在給藥后不同時(shí)間點(diǎn)(5、10、15、30、45、90、150 min及4、12、24、36、48、60、72、96、120、144、168 h)經(jīng)眼底靜脈叢穿刺取血100 μL,置于肝素化的1.5 mL離心管中,4 000 r/min離心10 min,分離血漿50 μL。參考根據(jù)課題組前期確定的樣品處理方法和超高效液相色譜-串聯(lián)質(zhì)譜(ultra performance liquid chromatograph mass spectrometer,UPLC-MS/MS)定量測(cè)定血漿中DOX濃度[11-12],經(jīng)WinNonLin 8.1軟件擬合得到主要藥動(dòng)學(xué)參數(shù),包括半衰期(half life,t1/2)、峰濃度(peak concentration,Cmax)、藥時(shí)曲線下面積(area under curve,AUC)、清除率(clearance,CL)及平均駐留時(shí)間(mean residence time,MRT)。
1.2.3H22細(xì)胞的培養(yǎng)、收集及H22荷瘤模型小鼠的建立 參考文獻(xiàn)方法[13-14]培養(yǎng)、收集H22細(xì)胞并建立H22荷瘤小鼠模型。H22細(xì)胞懸液經(jīng)2次小鼠腹水傳代后,PBS稀釋,制成2×1010個(gè)/L的腫瘤細(xì)胞懸液;取上述腫瘤細(xì)胞懸液0.2 mL分別于90只小鼠右腋皮下單次接種,以接種后小鼠右腋出現(xiàn)肉眼可見瘤體為造模成功。
1.2.4小鼠體內(nèi)抗腫瘤作用 取“1.2.3”項(xiàng)下H22荷瘤模型小鼠36只,隔天測(cè)量腫瘤體積,待腫瘤生長(zhǎng)至400 mm3時(shí)開始給藥。將荷瘤小鼠均分為生理鹽水組、空白NPs-Gel組、碘油組、DOX組、DOX-碘油組及DOX-NPs-Gel組,DOX、DOX-碘油及DOX-NPs-Gel的給藥量為10 mg/kg(以DOX計(jì)),DOX濃度為2 g/L。碘油組給藥為碘油與水的乳劑,其制備除將DOX溶液換為生理鹽水外,其它與DOX-碘油制備一致。生理鹽水組、碘油和空白凝膠組給藥體積為5 mL/kg。各組給藥方式均采用瘤內(nèi)注射,給藥1次,給藥當(dāng)天記為第0 天,治療周期10 d。
1.2.5小鼠體質(zhì)量變化及生長(zhǎng)情況 取“1.2.4”項(xiàng)下各組小鼠給藥期間每2天稱定體質(zhì)量1次,繪制體質(zhì)量變化曲線,計(jì)算各組小鼠的體質(zhì)量變化百分比[體質(zhì)量變化百分比(%)=當(dāng)日體質(zhì)量(mi)/最初體質(zhì)量(m0)×100%]。
1.2.6小鼠腫瘤生長(zhǎng)情況及抑瘤率的計(jì)算 取“1.2.5”項(xiàng)下各組小鼠稱重后同時(shí)測(cè)量瘤體寬度、長(zhǎng)度并計(jì)算腫瘤體積(volume,V),同時(shí)繪制腫瘤生長(zhǎng)曲線;給藥10 d后,脫頸處死各組小鼠,完整剝離腫瘤組織,稱取瘤體質(zhì)量并計(jì)算抑瘤率[抑瘤率(%)=(生理鹽水組小鼠平均瘤體質(zhì)量-各治療組小鼠平均瘤體質(zhì)量)/生理鹽水組小鼠平均瘤體質(zhì)量×100%]。
1.2.7小鼠腫瘤組織蘇木精-伊紅(hematoxylin-eosin,HE)染色 取“1.2.6”項(xiàng)下各組小鼠腫瘤組織稱重、拍照記錄后,放置于4%多聚甲醛固定液中保存,常規(guī)脫水,石蠟包埋、切片,HE染色,置于顯微鏡下觀察并拍照。
1.2.8瘤內(nèi)滯留性能評(píng)價(jià) 取“1.2.3”項(xiàng)下H22荷瘤小鼠54只,待H22荷瘤小鼠生長(zhǎng)至400 mm3左右時(shí)開始給藥。將荷瘤小鼠均分為DOX組、DOX-碘油組及DOX-NPs-Gel組,給藥劑量和途徑同“1.2.4”項(xiàng)下操作。各組分別于12、24、48、72、96及120 h時(shí)選擇3只小鼠脫頸處死,剝離腫瘤組織,參考課題組前期確定的樣品處理方法和UPLC-MS/MS分析方法測(cè)定腫瘤組織中DOX濃度[13-14],計(jì)算各時(shí)間點(diǎn)下DOX瘤內(nèi)滯留率(DOX瘤內(nèi)滯留率=DOX測(cè)得量/DOX給藥量×100%)。
1.3 統(tǒng)計(jì)學(xué)分析
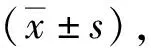
2 結(jié)果
2.1 大鼠體內(nèi)緩釋性能
藥動(dòng)學(xué)結(jié)果顯示(圖1和表1),48 h時(shí)DOX組和DOX-碘油組大鼠血漿中DOX含量低于檢測(cè)限,168 h時(shí)DOX-NPs-Gel組大鼠血漿中DOX濃度仍為90.5 μg/L,與DOX組和DOX-碘油組相比,DOX-NPs-Gel組的AUC0-t分別提高7.9倍和12.2倍,CL分別降低96.8%和97.4%,MRT0-∞分別延長(zhǎng)4.1倍和3.4倍,Cmax分別提高1.0倍和1.1倍,t1/2分別延長(zhǎng)52.1倍和19.7倍。
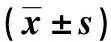
表1 各組大鼠的主要藥動(dòng)學(xué)參數(shù)Tab.1 The main pharmacokinetic parameters of each

圖1 各組大鼠血漿DOX平均血藥質(zhì)量濃度-時(shí)間曲線Fig.1 Average DOX concentration-time curve in plasma of rats in each group
2.2 小鼠生長(zhǎng)情況
給藥后荷瘤小鼠體質(zhì)量的變化趨勢(shì)結(jié)果顯示(圖2),DOX組、碘油組和DOX-碘油組小鼠體質(zhì)量于治療后第2天出現(xiàn)下降,下降幅度大小依次為DOX-碘油組>碘油組>DOX組;DOX組和碘油組小鼠體質(zhì)量第6天恢復(fù)到治療前,DOX-碘油組治療結(jié)束時(shí)體質(zhì)量仍未恢復(fù)至治療前;DOX-NPs-Gel組小鼠體質(zhì)量與生理鹽水組和空白NPs-Gel組變化趨勢(shì)一致,未出現(xiàn)下降,提示DOX-NPs-Gel對(duì)機(jī)體幾乎無毒副作用。
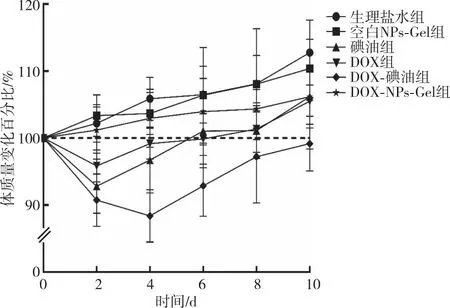
圖2 各組荷瘤小鼠給藥后的體質(zhì)量變化Fig.2 Weight change in load tumor mice after administration
2.3 小鼠體內(nèi)抗腫瘤作用
各組小鼠瘤體質(zhì)量比較結(jié)果見表2所示,生理鹽水組小鼠瘤重與空白NPs-Gel組比較、差異無統(tǒng)計(jì)學(xué)意義(P>0.05),各治療組小鼠瘤體質(zhì)量均較生理鹽水組和空白NPs-Gel組下降(P<0.05),DOX-碘油組小鼠瘤體質(zhì)量較DOX組下降(P<0.05),碘油組小鼠瘤體質(zhì)量與DOX-碘油組瘤體質(zhì)量比較、差異無統(tǒng)計(jì)學(xué)意義(P>0.05),DOX-NPs-Gel組瘤體質(zhì)量小于其余各治療組(P<0.05),提示其具有較好的抑瘤效果;各組小鼠抑瘤率比較結(jié)果見表2所示,碘油組、DOX組、DOX-碘油組和DOX-NPs-Gel組小鼠抑瘤率分別為54.8%、54.1%、68.3%和76.6%。各組小鼠腫瘤生長(zhǎng)情況顯示(圖3),治療期間生理鹽水組和空白NPs-Gel組小鼠瘤體生長(zhǎng)迅速,其余各治療組瘤體生長(zhǎng)速度均降低,其中DOX-NPs-Gel組生長(zhǎng)速度最慢;各組小鼠腫瘤組織HE染色結(jié)果如圖4所示,生理鹽水組和空白NPs-Gel組小鼠腫瘤組織切片中可見細(xì)胞排列緊密、細(xì)胞核大、無明顯壞死細(xì)胞,表明組織內(nèi)細(xì)胞處于快速增殖狀態(tài),但其它各治療組腫瘤組織切片出現(xiàn)細(xì)胞分布不規(guī)則、核固縮、破裂、溶解,提示腫瘤細(xì)胞壞死,其中DOX-NPs-Gel組腫瘤組織切片中出現(xiàn)大面積的細(xì)胞核固縮和溶解。

表2 各組小鼠的瘤體質(zhì)量和抑瘤率Tab.2 Tumor weight and tumor inhibition rate of rats in each group

注:A為各組腫瘤實(shí)體的剖截圖,B為各組腫瘤治療期間腫瘤體積變化情況。
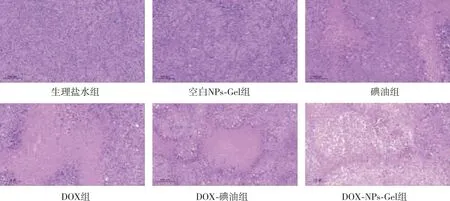
圖4 各組小鼠瘤體的組織學(xué)特征(HE,×10)Fig.4 Histological characteristics of the tumor in each group (HE,×10)
2.4 瘤內(nèi)滯留性能
各組小鼠DOX瘤內(nèi)滯留率如圖5所示。DOX組與DOX-碘油組小鼠DOX瘤內(nèi)滯留率變化趨勢(shì)基本一致,各時(shí)間點(diǎn)下DOX瘤內(nèi)滯留率比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05);第12 h時(shí),2組小鼠DOX瘤內(nèi)滯留率分別為(57.4±7.6)%和(49.6±4.1)%,96 h時(shí)已降至0%;前96 h內(nèi)所檢測(cè)的時(shí)間點(diǎn)下DOX-NPs-Gel組小鼠DOX瘤內(nèi)滯留率均高于其他組(P<0.05),而DOX-NPs-Gel組第120 h時(shí)DOX瘤內(nèi)滯留率仍為(44.1±3.9)%。

注:(1)與DOX組相比,P<0.05;(2)與DOX-碘油組相比,P<0.05。
3 討論
傳統(tǒng)TACE作為中晚期肝細(xì)胞癌的一線治療方法,在臨床中得到了廣泛應(yīng)用。通常化療藥物和碘油是臨用前乳化,但乳化后的乳液穩(wěn)定性較差[15]。本研究中模擬臨床制備方法制備DOX-碘油,結(jié)果顯示DOX-碘油混勻后靜置1 min會(huì)出現(xiàn)明顯分層現(xiàn)象,與相關(guān)報(bào)道一致。
溫敏凝膠的藥動(dòng)學(xué)考察,通常是采用皮下注射的方式給藥[16]。本課題前期預(yù)實(shí)驗(yàn)中曾采用皮下注射的給藥方式考察DOX、DOX-碘油和DOX-NPs-Gel在大鼠體內(nèi)藥代動(dòng)力學(xué)過程,結(jié)果顯示各組釋放均較為緩慢且無差異,可能是因?yàn)槠は卵茌^少,吸收過程為限速過程,無法準(zhǔn)確模擬肝臟中豐富血管的吸收過程;此外,皮下注射一段時(shí)間后,在注射部位會(huì)出現(xiàn)結(jié)痂,可能是因?yàn)榫植克幬餄舛冗^高導(dǎo)致的皮膚壞死。因此,本研究采用腹腔注射的方式給藥。為了模擬TACE術(shù)后藥物的體內(nèi)過程,腹膜表面積很大且具有豐富血管,吸收能力強(qiáng),可較好模擬肝動(dòng)脈血管環(huán)境[17]。本研究藥動(dòng)學(xué)結(jié)果表明,DOX-NPs-Gel組與DOX-碘油組相比達(dá)峰時(shí)間略晚,CL降低,Cmax、t1/2、AUC0-t和MRT0-t均增加;DOX-NPs-Gel組在48~168 h內(nèi)血藥濃度近乎無波動(dòng),這表明此時(shí)消除相與吸收相幾乎達(dá)到平衡;這種恒速釋放對(duì)維持腫瘤內(nèi)化療藥物高濃度,提高腫瘤的治療效果具有重要意義[18]。
體內(nèi)抗腫瘤研究結(jié)果顯示,DOX-NPs-Gel組小鼠瘤體質(zhì)量最小、抑瘤率最大,結(jié)合其給藥后體質(zhì)量變化和瘤內(nèi)滯留性能考察結(jié)果,分析原因可能是DOX-NPs粒徑小于<200 nm,根據(jù)腫瘤組織的高滲透性和滯留效應(yīng),DOX-NPs傾向于滯留在腫瘤組織中,加上凝膠和納米粒本身均具有緩釋作用,因而能有效減少DOX在腫瘤部位的逃逸,降低DOX的毒副作用,延長(zhǎng)治療時(shí)間,提高治療效果[19]。碘油在肝癌的TACE治療中通常充當(dāng)顯影劑和栓塞劑的角色[20]。本研究結(jié)果提示,碘油具有一定的抑瘤作用,分析其原因可能是碘油將腫瘤細(xì)胞完全包裹,阻礙了腫瘤細(xì)胞與組織液之間的物質(zhì)交換,促進(jìn)了細(xì)胞死亡[21]。此外,結(jié)合碘油給藥后,荷瘤小鼠體質(zhì)量變化的結(jié)果可推斷碘油存在毒性作用。DOX組與碘油組小鼠瘤重和抑瘤率結(jié)果相當(dāng),結(jié)合其在瘤內(nèi)滯留性能考察結(jié)果和給藥后荷瘤小鼠體質(zhì)量變化,考慮推測(cè)DOX注射到腫瘤后可發(fā)揮抑瘤作用,但無法長(zhǎng)時(shí)間維持治療濃度,DOX暴露在體環(huán)境中,引起荷瘤小鼠體質(zhì)量下降。DOX-碘油組小鼠抑瘤率高于DOX組和碘油組,瘤重小于DOX組和碘油組,表現(xiàn)出較強(qiáng)的抗腫瘤作用,但瘤內(nèi)滯留性能考察結(jié)果表明DOX與DOX-碘油滯留基本一致,推測(cè)其抗腫瘤作用是碘油和DOX共同作用的結(jié)果。同時(shí)受到碘油和DOX的雙重影響,DOX-碘油組荷瘤小鼠在治療期間體質(zhì)量下降最多。通過分析各組給藥后荷瘤小鼠體質(zhì)量的變化趨勢(shì)可用于評(píng)估藥物的毒副作用[22-23]。因此可推測(cè)DOX-NPs-Gel具有良好的安全性。
為更加貼合實(shí)際,后續(xù)研究可考慮采用兔肝癌VX2模型以TACE方式給藥進(jìn)行藥動(dòng)學(xué)與藥效學(xué)考察。腫瘤治療的困難之一是藥物瘤內(nèi)滯留量不足或維持時(shí)間不足,因此理想的藥物遞送系統(tǒng)應(yīng)可將藥物滯留在靶部位較長(zhǎng)時(shí)間。瘤內(nèi)滯留性能考察結(jié)果顯示, DOX-NPs-Gel組小鼠DOX瘤內(nèi)滯留率高于DOX組和DOX-碘油組,具有良好的瘤內(nèi)滯留性能。
綜上所述,DOX-NPs-Gel在體內(nèi)可緩慢釋藥,瘤內(nèi)注射后DOX可長(zhǎng)時(shí)間滯留于腫瘤組織,從而可有效地抑制腫瘤發(fā)展,具有一定的TACE應(yīng)用前景。
 貴州醫(yī)科大學(xué)學(xué)報(bào)2024年3期
貴州醫(yī)科大學(xué)學(xué)報(bào)2024年3期
- 貴州醫(yī)科大學(xué)學(xué)報(bào)的其它文章
- 扶正化濁湯聯(lián)合甲狀腺片治療對(duì)甲狀腺結(jié)節(jié)大小及療效的影響*
- 463例PICU意外傷害患兒的病因及臨床特點(diǎn)*
- 左室壓力-應(yīng)變環(huán)結(jié)合峰值應(yīng)變離散度評(píng)價(jià)HFpEF患者的左室收縮功能及同步性*
- 甲苯磺酸瑞馬唑侖在老年患者無痛胃鏡檢查中的安全性和有效性*
- 超微創(chuàng)針刀鏡下等離子成形術(shù)治療早期膝骨性關(guān)節(jié)炎的療效及作用機(jī)制*
- 房顫患者血清溴結(jié)構(gòu)域蛋白4的表達(dá)及臨床意義*
