典型鹵乙酰胺類消毒副產物對萼花臂尾輪蟲的毒性效應
李錦程,徐曉平,2*,陳 濤,秦 璇
1.安徽工程大學建筑工程學院,安徽 蕪湖 241000
2.皖江流域退化生態系統的恢復與重建省部協同創新中心,安徽 蕪湖 241000
鹵乙酰胺(Haloacetamides)是一類新興含氮消毒副產物,其分子具有很強的極性和親水性,且揮發性較差,難以去除[1].自2002 年在美國一項飲用水安全調查中被首次檢出后,鹵乙酰胺陸續在世界各國的飲用水、污水和再生水,甚至在地表水中被檢測到,濃度范圍一般在0.1~14.0 μg/L 之間[2-5],其中在美國兩個湖泊中鹵乙酰胺的濃度分別達6.9 和8.3 μg/L[6].我國也有相關報道,粵港澳大灣區的供水管網中檢測到的鹵乙酰胺濃度為0.41~3.34 μg/L[7],無錫市飲用水廠出水和末梢水中檢出鹵乙酰胺濃度為0.137~3.288 μg/L[8].資料顯示,氯代乙酰胺在檢出的鹵乙酰胺中占比最大,其次是溴代乙酰胺[9],在中性和酸性條件下,溴代乙酰胺的穩定性大于氯代乙酰胺,其毒性風險更需引起重視[10].
研究表明,鹵乙酰胺的毒性遠大于含碳消毒副產物且具有“三致”效應[11-12],其可誘導人腎胚細胞產生高含量的活性氧,損壞線粒體正常功能,導致細胞周期阻滯和凋亡[13];還可抑制小鼠胚胎細胞發育,導致流產和胎兒畸形,破壞機體正常能量代謝[14-15].經過暴露,斑馬魚腦組織中鹵乙酰胺積累量高于腸和鰓,體內氨基酸代謝出現紊亂,肝臟超氧化物歧化酶和過氧化氫酶水平增加,產生氧化應激[16].何夢婷等[17]還發現,溴乙酰胺可抑制斑馬魚胚胎神經發育相關基因的表達,提高其胚胎腦組織中活性氧水平.然而,關于鹵乙酰胺對浮游生物毒性效應的研究較少.
輪蟲是水體中常見的浮游生物,主要以水體中的藻類、細菌和有機碎屑等為食,同時又可被枝角類、魚蝦等捕食,在水生態系統物質循環和能量傳遞過程中發揮重要作用.輪蟲普遍具有世代時間短、繁殖快、易于實驗室培養、培養成本低和對污染物敏感等特點,常被用來評估污染物的環境毒性和生態風險[18-19].淡水萼花臂尾輪蟲(Brachionuscalyciflorus)是開展水生態毒理學研究的模式生物,具有孤雌生殖和有性生殖兩種方式,兩種生殖方式可交替進行.近年來,利用萼花臂尾輪蟲的有性生殖參數和氧化應激指標作為實驗終點,開展了多種新污染物毒性效應評價[20-21],但對新興含氮消毒副產物鹵乙酰胺的研究報道較少.鑒于地表水體中存在一定濃度的鹵乙酰胺,為探明此類物質對輪蟲類重要水生生物的毒性影響,綜合評價其潛在的生態風險,采用急性毒性、種群增長、有性生殖和氧化應激指標檢測等試驗方法,研究了氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲的急慢性毒性效應,以期為正確評價含氮消毒副產物鹵乙酰胺的生態風險提供參考.
1 材料與方法
1.1 試驗材料
試驗所用氯乙酰胺(Chloroacetamide,純度?99%)和溴乙酰胺(Bromoacetamide,純度?98%)均購于上海阿拉丁試劑有限公司,二氯乙酰胺(Dichloroacetamide,純度?98%)購于天津希恩思生化科技有限公司,3 種鹵乙酰胺理化性質如表1 所示.氧化應激指標檢測生化試劑盒購于北京索萊寶科技有限公司,其余藥品購自國藥集團,均為分析純.
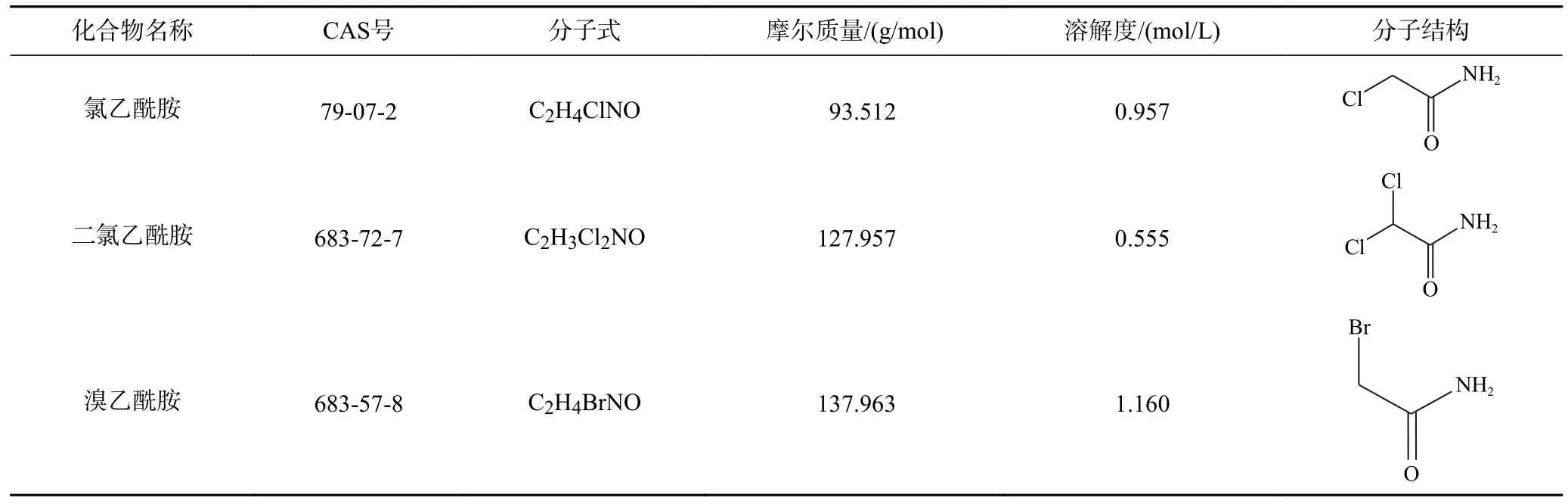
表1 氯乙酰胺、二氯乙酰胺和溴乙酰胺的理化性質Table 1 Physical and chemical properties of chloroacetamide,dichloroacetamide and bromoacetamide
受試萼花臂尾輪蟲由采自蕪湖市鏡湖水體沉積物中的休眠卵孵化所得,實驗室內經過多代單克隆培養后,種群建立并穩定培養[18].所用輪蟲培養基為美國環境保護局(US EPA)配方(EPA 培養基,96 mg NaHCO3、60 mg CaSO4·2H2O、60 mg MgSO4、4 mg KCl、1 L 去離子水)[22],食物為離心收集的斜生四鏈藻(Tetradesmusobliquus).該藻采用HB-4 培養基在(25±1)℃條件下恒溫培養,離心濃縮后置于4 ℃冰箱儲存[23].試驗正式開始前,將萼花臂尾輪蟲置于溫度為(25±1)℃培養箱中預培養超過14 d,光暗周期為14 h (光):10 h (暗),每24 h 更換新鮮輪蟲培養基,并投喂密度為2.0×106cells/mL 的斜生四鏈藻,同時去除一部分個體,保持種群處于穩定增長期.
1.2 急性毒性試驗
根據多次試驗結果,將氯乙酰胺、二氯乙酰胺和溴乙酰胺濃度設置為1、5、10、20、40、80 mg/L 和一組空白對照(僅含有EPA 培養基).試驗在(25±1)℃、無光照的恒溫培養箱中進行,首先挑選200~300 個輪蟲非混交雌體卵,置于50 mL 的玻璃杯中(含30 mL EPA 培養基和密度為2.0×106cells/mL 的斜生四鏈藻);4 h 后隨機挑選10 個大小相近的輪蟲幼體放入容量為6 mL 的玻璃杯中,并加入5 mL 測試液(不含食物),每個濃度設置4 個重復;24 h 后對每個玻璃杯中死亡輪蟲計數,試驗期間不投喂食物.
1.3 種群增長和有性生殖試驗
根據急性毒性試驗結果和環境檢出濃度,3 種鹵乙酰胺濃度均設置為10、20 和200 μg/L,另設一組空白對照組,每組設置8 個重復.隨機選取3 個齡長小于4 h 且大小相近的輪蟲幼體,放入6 mL 玻璃杯中,加入5 mL 的測試液(含密度為2.0×106cells/mL 的斜生四鏈藻).試驗在(25±1)℃、無光照的恒溫培養箱中進行,每12 h 懸浮沉積在玻璃杯底部的食物,每24 h更換新鮮的測試液;試驗至48 h 后,對每個玻璃杯中存活的輪蟲進行計數;96 h 后,對不同種類雌體輪蟲進行計數,雌體鑒別方法參考文獻[24];168 h 后,對混交雌體攜帶休眠卵和落入玻璃杯底部的休眠卵進行計數.
2 d 種群增長率(r)計算公式:
式中:Nt和N0分別為試驗結束和開始時的輪蟲總個數;t為時間,該試驗中t取2 d;
4 d 有性生殖參數包括OF/NOF(攜卵雌體數/不攜卵雌體數)、MF/AF(攜卵雌體數中混交雌體數/非混交雌體數)[25]、MR(混交率,種群中混交雌體數/雌體總數)、FR(受精率,輪蟲種群中受精的混交雌體數/混交雌體總數);7 d 休眠卵產量為7 d 內輪蟲種群所產休眠卵總數[26].
1.4 氧化應激指標檢測
3 種鹵乙酰胺濃度和空白對照的設置與有性生殖試驗中相同.從預培養的試管中隨機挑取約10 000 個輪蟲放入50 mL 燒杯中,加入25 mL 測試液(不含食物),每個濃度設置4 個重復.試驗在(25±1)℃、無光照恒溫培養箱中進行,試驗期間不投喂食物.暴露12 h 后,用25 μm 的濾網收集輪蟲并用EPA 培養基清洗,收集好的輪蟲樣品保存于-80 ℃冰箱中,待檢測用.
將輪蟲樣品轉移至玻璃勻漿器中加入預冷的磷酸緩沖液,0 ℃下冰浴勻漿5 min 后轉移至1.5 mL 離心管中,于10 000 g、4 ℃下離心10 min,離心結束后收集上清液用于測定相關酶活性和蛋白含量.選取超氧化物歧化酶(SOD)活性、過氧化氫酶(CAT)活性、過氧化物酶(POD)活性和還原型谷胱甘肽(GSH)含量作為氧化應激指標,選取丙二醛(MDA)含量來衡量細胞脂質過氧化化水平,同時檢測總抗氧化能力(T-AOC).具體檢測步驟按照索萊寶生物科技有限公司SOD 試劑盒(BC0170)、CAT 試劑盒(BC0205)、POD 試劑盒(BC0090),GSH 試劑盒(BC1175)、MDA(BC0025)、T-AOC 試劑盒(BC1315)等說明進行.
1.5 數據分析
數據處理、分析和擬合在Excel 2003 和SPSS 17.0軟件中完成,繪圖在Origin 2023 軟件中完成.急性試驗中,采用概率單位法(PROBIT,Probability unit)計算3 種鹵乙酰胺對輪蟲的24 h-LC50(24 h 半數致死濃度).慢性試驗中,經正態分布和方差齊性檢驗后,采用單因素方差分析(One-way ANOVA)和多重比較(LSD test)法,比較處理組與對照組數值之間的差異顯著性,設定P<0.05 為顯著性水平.
2 結果與分析
2.1 氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲的急性毒性
暴露于10 mg/L 氯乙酰胺、二氯乙酰胺和溴乙酰胺24 h 后,低倍(5 倍)鏡下多個輪蟲和高倍(20 倍)鏡下典型個體體型狀況如圖1 所示.因輪蟲個體較小,低倍鏡下無法觀察處理組輪蟲與對照之間的顯著差異;高倍鏡下觀察發現,3 種鹵乙酰胺導致輪蟲死亡后體內器官明顯萎縮、分解,身體呈透明狀,特別是在溴乙酰胺處理組中該特征更顯著.暴露于不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺中萼花臂尾輪蟲24 h 的死亡率和24 h-LC50如圖2 所示.由圖2 可見,氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲的24 h-LC50分別為12.49、23.12 和2.46 mg/L,測試濃度與死亡率之間呈現明顯的劑量-效應關系(R2≥0.87).與對照組相比,不同濃度鹵乙酰胺均提高了輪蟲的死亡率;而相同濃度下,溴乙酰胺對輪蟲致死作用比氯乙酰胺、二氯乙酰胺更明顯.暴露于20 mg/L溴乙酰胺的輪蟲死亡率為100%,而暴露于80 mg/L(最高濃度)氯乙酰胺、二氯乙酰胺中輪蟲死亡率分別為80%和70%.
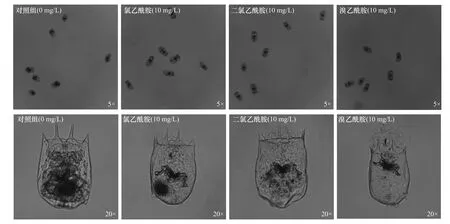
圖1 暴露于10 mg/L 氯乙酰胺、二氯乙酰胺和溴乙酰胺24 h 后的萼花臂尾輪蟲體態Fig.1 Morphological changes of Brachionus calyciflorus after exposure to 10 mg/L chloroacetamide,dichloroacetamide and bromoacetamide for 24 h
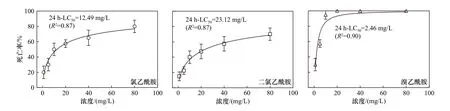
圖2 暴露于不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺24 h 后的萼花臂尾輪蟲死亡率Fig.2 Mortality of Brachionus calyciflorus after exposure to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide for 24 h
2.2 氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲2 d 種群增長和有性生殖的影響
不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲2 d 種群增長率的影響如圖3 所示.由圖3 可見,與對照相比,20、200 μg/L 氯乙酰胺和200 μg/L 溴乙酰胺均顯著降低了輪蟲2 d 種群增長率(P均小于0.05),其他處理組對輪蟲的2 d 種群增長率均無顯著影響(P均大于0.05).
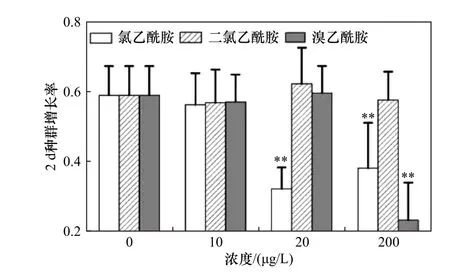
圖3 暴露于不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺中萼花臂尾輪蟲的2 d 種群增長率Fig.3 Two-day population growth rate of Brachionus calyciflorus exposed to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide
不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲4 d 有性生殖參數的影響如表2 所示.由表2 可見:與對照相比,200 μg/L 氯乙酰胺和20 μg/L 溴乙酰胺均顯著提高了輪蟲種群的OF/NOF(P均小于0.05),20 μg/L 二氯乙酰胺則顯著降低了輪蟲種群的OF/NOF (P<0.05);200 μg/L 氯乙酰胺和20 μg/L 溴乙酰胺均顯著提高了輪蟲種群的MR (P均小于0.05);200 μg/L 二氯乙酰胺和20 μg/L 溴乙酰胺均顯著提高了輪蟲種群的FR (P均小于0.05);所有處理組對輪蟲種群MF/AF 均無顯著影響(P均大于0.05).
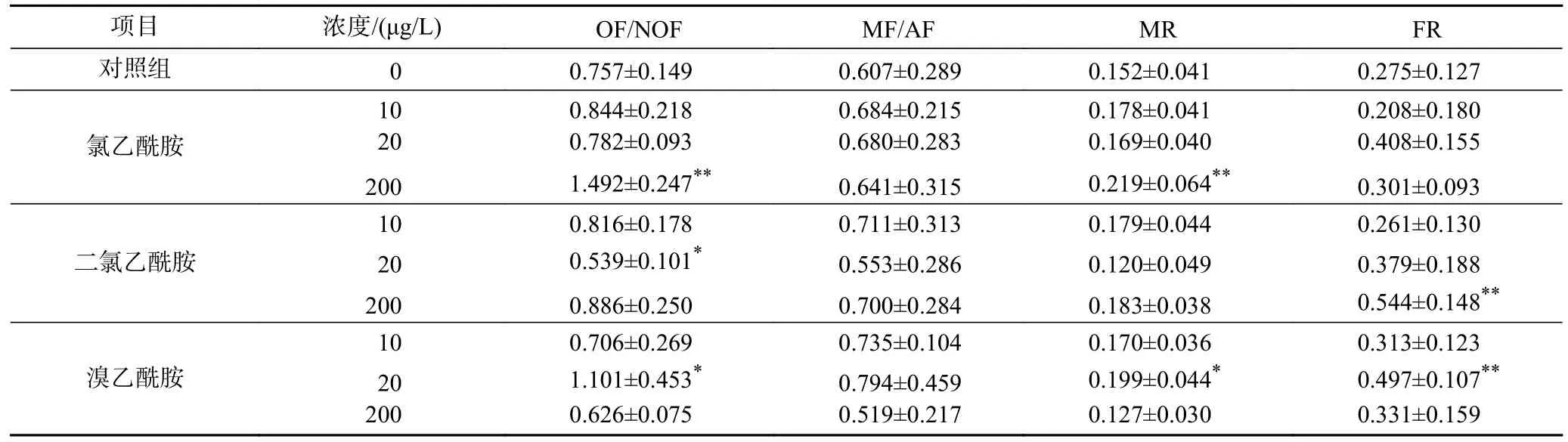
表2 暴露于不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺中萼花臂尾輪蟲的4 d 有性生殖參數Table 2 The reproductive parameters of Brachionus calyciflorus in four days exposed to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide
不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲7 d 休眠卵產量的影響如圖4 所示.由圖4 可見,與對照相比,10、20 和200 μg/L 氯乙酰胺,20 和200 μg/L 二氯乙酰胺以及10、20 μg/L溴乙酰胺均顯著增加了輪蟲休眠卵產量(P均小于0.05).
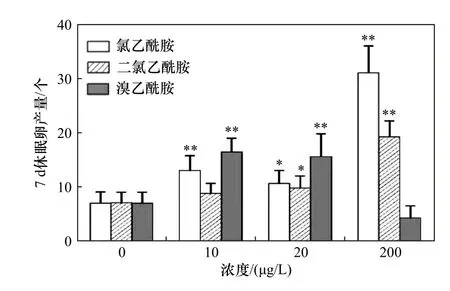
圖4 暴露于不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺中萼花臂尾輪蟲的7 d 休眠卵產量Fig.4 Seven-day resting egg production of Brachionus calyciflorus exposed to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide
2.3 氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲氧化應激指標的影響
不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲氧化應激指標的影響如圖5 所示.由圖5 可見:與對照組相比,20、200 μg/L 氯乙酰胺和10、20 μg/L 溴乙酰胺均顯著提高了萼花臂尾輪蟲體內SOD 活性(P均小于0.05);所有處理組均顯著提高了輪蟲體內CAT 活性(P均小于0.05);10、20 和200 μg/L 氯乙酰胺、20 μg/L 二氯乙酰胺以及200 μg/L溴乙酰胺均顯著提高了輪蟲體內GSH 含量(P均小于0.05);200 μg/L 二氯乙酰胺、溴乙酰胺均顯著降低了輪蟲體內POD 活性(P均小于0.05);20 μg/L 氯乙酰胺和二氯乙酰胺均顯著提高了輪蟲體內的總抗氧化能力水平(P均小于0.05);200 μg/L 氯乙酰胺、二氯乙酰胺和溴乙酰胺均顯著增加了輪蟲體內的MDA 含量(P均小于0.05),但所有指標均無劑量-效應關系.
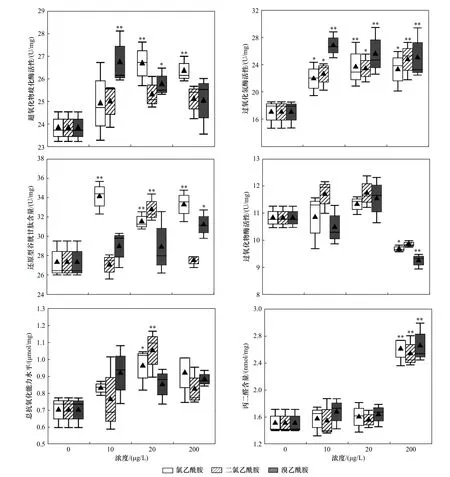
圖5 暴露于不同濃度氯乙酰胺、二氯乙酰胺和溴乙酰胺中12 h 后的萼花臂尾輪蟲氧化應激指標Fig.5 Oxidative stress biomarkers of Brachionus calyciflorus after exposure to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide for 12 h
3 討論
鹵乙酰胺是目前飲用水消毒副產物的研究熱點之一.在新修訂的《生活飲用水衛生標準》(GB 5749-2022)中,三鹵甲烷、鹵乙酸和溴酸鹽等消毒副產物被納入控制指標并規定了限值,然而卻不包括鹵乙酰胺類物質.研究顯示,鹵乙酰胺的細胞毒性和遺傳毒性分別是鹵乙酸的99 倍和19 倍,急性遺傳毒性和慢性細胞毒性分別是鹵乙酸的12 倍和142 倍[11],其中,二氯乙酰胺比磺胺甲惡唑對斑馬魚的神經毒性更強[27],毒性風險高于二氯甲烷[12].由于我國地表水源中有機物和溶解性氮含量普遍較高,水廠多采用氯和氯胺的消毒方式,為鹵乙酰胺類含氮消毒副產物的產生提供了很大可能,在出廠飲用水和經過長距離的輸送管網中均發現一定濃度的該類物質存在[28-29],因此其環境和生態風險值得關注,特別是低劑量、長期暴露對環境生物的影響.
淡水萼花臂尾輪蟲可通過快速無性繁殖建立單克隆種群,對重金屬、有機化合物和農藥等較為敏感,適合用于評價外界物質對淡水生態系統的生態風險,其中污染物對輪蟲急性半數致死濃度、輪蟲有性生殖參數和抗氧化酶活性等均是良好的實驗終點.例如,Snell 等[30]提出的輪蟲24 h-LC50標準測試方法簡單易行,避免了繁瑣的連續培養,已廣泛用于評價污染物對輪蟲的急性毒性作用[31].研究顯示,二氯乙酰胺對大鼠腎細胞和遺傳毒性的LC50分別為6 390 和431 mg/L[12],對斑馬魚成魚的LC50為315 mg/L[32],均大于筆者研究中此類物質對萼花臂尾輪蟲的LC50,說明與大鼠腎細胞和斑馬魚成魚相比,萼花臂尾輪蟲對鹵乙酰胺類物質更敏感,更適合用作監測此類物質的毒性影響.
研究[33]發現,消毒副產物鹵代乙酸的毒性與取代的氯原子數有關,一氯乙酸對小鼠無致癌性,二氯乙酸和三氯乙酸均會增加小鼠肝腫瘤的患病率,且溴代乙酸的毒性大于氯代乙酸.筆者研究中,3 種鹵乙酰胺對萼花臂尾輪蟲急性毒性呈溴乙酰胺?氯乙酰胺?二氯乙酰胺的特征,這與Plewa 等[11]研究此類物質對中國倉鼠卵巢細胞毒性的結論基本一致,表明鹵乙酰胺的毒性同樣受氯原子數、鹵代元素種類的影響.一般情況下,鹵素原子數量越多化合物毒性越高,而筆者研究顯示,氯乙酰胺對輪蟲的急性毒性大于二氯乙酰胺,表明其毒性大小還要視具體受試生物和試驗指標而定.此外,3 種鹵乙酰胺的試驗組濃度與萼花臂尾輪蟲24 h 死亡率之間呈現出明顯的劑量-效應關系,測試濃度的增大導致輪蟲死亡率逐漸上升,20 mg/L 溴乙酰胺導致受試輪蟲全部死亡.然而,由于鹵乙酰胺類消毒副產物的實際環境濃度較低,一般不會產生致死效應,因此要正確評價低劑量此類物質對輪蟲毒性影響,還需進一步開展慢性毒性研究.
種群增長率是最能體現輪蟲環境適應能力的綜合表現指標,累積反映了多個世代輪蟲的存活與繁殖特征改變[34].暴露污染物后輪蟲的種群增長率能更好地放大輪蟲個體水體上的微小亞致死效應,其改變能直接反映污染物對輪蟲種群的毒性結果,被認為是最敏感的毒性實驗終點.研究發現,2 d 萼花臂尾輪蟲種群增長測試要比7 d 網紋溞(Ceriodaphniadubia)生殖測試對污染物更加敏感,且測試工作量可減少近70%[35],適合用于評價苯酚、五氯苯酚鈉和銅等11 種污染物對輪蟲慢性毒性影響;同樣,氟他胺聯合睪酮、溴酸鹽和聚苯乙烯微塑料等對萼花臂尾輪蟲的慢性毒性測試也證明了2 d 種群增長率是一個敏感的指標[36-38].然而,Janssen 等[39]也曾指出,輪蟲3 d 測試得到的種群增長率比2 d 更接近最大值.筆者研究中,除20、200 μg/L 氯乙酰胺和200 μg/L 溴乙酰胺外,其他處理組中的2 d 種群增長率與對照組并均無顯著差異,從敏感性角度判斷,該指標對評估鹵乙酰胺類物質可能并非最佳選擇.一般而言,簡單易行的實驗方法有助于提高實驗結果的再現性[21],從此角度來看,該指標仍然不失為一個較好的實驗終點,是否最佳選擇還要視不同污染物的測試結果確定.此外,標準化程序的建立對提高輪蟲種群增長試驗結果的可靠性至關重要,而目前國內還未見此類標準.筆者研究表明,20、200 μg/L 氯乙酰胺和200 μg/L 溴乙酰胺存在抑制輪蟲種群增長甚至導致種群滅絕的風險,而其他處理組種群數量雖與對照無顯著差異,但后續生殖試驗證實其種群結構(如雌體類型)已然發生了改變.
單巢綱輪蟲(如萼花臂尾輪蟲)進行有性生殖是該類生物適應環境變化的重要生存和進化策略,而混交雌體產生是輪蟲啟動有性生殖的開始.研究[18]表明,溫度、食物、光照、pH 和種群密度等改變以及環境毒物脅迫均是誘導輪蟲進行有性生殖的外界因素,因此可通過分析輪蟲種群混交雌體的比例來評估有性生殖的水平,進而評價污染物對輪蟲的不利影響.筆者研究中,200 μg/L 氯乙酰胺和20 μg/L 溴乙酰胺處理組中輪蟲種群的OF/NOF 和混交率較對照組均明顯升高,表明在這2 個處理組中輪蟲已經感知到外界脅迫的壓力,開始主動調整生殖策略以適應環境的變化,最終7 d 休眠卵產量的顯著提高也進一步驗證了輪蟲繁殖策略調整的成功.同樣,所有處理組的MF/AF 指標均未受到顯著影響,攜帶休眠卵的輪蟲(也計為混交雌體)數量的上升是導致這一結果的直接原因,這也再次證實進行有性生殖是輪蟲應對此類物質脅迫時的首選生存策略.
經過產生混交雌體、孵化雄蟲、成功受精和產卵等一系列過程而形成的休眠卵是輪蟲有性生殖的最終產物,對輪蟲保種、繁殖和種群擴張等均有重要意義[40].輪蟲毒理學研究中,休眠卵產量常被看作是比其他有性生殖參數對污染物更為敏感的指標[31].研究[41]證實,0.001、0.01、1 和10 mg/L 溴酸鹽(另一種常見消毒副產物)能顯著提高萼花臂尾輪蟲的休眠卵產量,而100 和200 mg/L 溴酸鹽則顯著降低了休眠卵產量.筆者研究中,在9 個處理組中有6 個處理組的休眠卵產量都顯著高于對照組,其對測試液的敏感程度明顯高于其他有性生殖指標(只有3 個處理組種群的增長率和OF/NOF 以及2 個處理組的混交率和受精率受到顯著影響),適合用作評價鹵乙酰胺類消毒副產物對萼花臂尾輪蟲有性生殖的影響.一般認為,成功受精是輪蟲休眠卵形成的關鍵步驟,但其產量還受到其他環境因素和輪蟲種類的影響[42].該研究中,大部分處理組中受精率雖與對照組都無顯著差異,但卻大多高于對照組,最高上升了97.81%,推測這可能是導致多數處理組休眠卵產量顯著高于對照組的直接原因.
在受到內源性或外源性刺激時,輪蟲可通過提高體內SOD、CAT、POD 等抗氧化酶的活性和GSH 的含量來減少面臨的氧化損傷[43].研究發現,250 μg/L鹽酸氟西汀顯著提高了輪蟲SOD 活性和GSH 含量[44],300 μg/L 0.05 μm 輪胎磨損顆粒顯著提高了輪蟲SOD和CAT 活性[45],80 μg/L 多溴聯苯醚顯著提高了輪蟲MDA 含量[46].筆者研究中,輪蟲受到不同濃度鹵乙酰胺脅迫后,抗氧化酶活性和抗氧化劑含量均較對照組有所上升,部分濃度組上升顯著,表明輪蟲已經啟動了氧化應激反應,試圖來保護自身免受傷害.然而,部分抗氧化酶活性并未隨處理組濃度的增加而發生明顯改變,究其原因,除了暴露濃度外,酶活性還可能受到其他因素(如暴露時間等)的影響.值得注意的是,CAT 活性在所有處理組均顯著高于對照組,表現最為活躍;而POD 活性在200 μg/L 處理組中均顯著下降,呈現出完全不同的響應模式和指標特異性,其內在機理值得進一步研究.
Wang 等[47]發現,阻燃劑四溴二苯醚(BDE-47)可誘導褶皺臂尾輪蟲(B.plicatilis)體內過量產生活性氧(ROS),破壞輪蟲卵巢超微結構,抑制個體產卵和種群增長.理論上,SOD 等抗氧化酶是輪蟲清除ROS 的第一道防線,若該防御機制失效或氧化壓力超過耐受閾值時,膜脂過氧化將形成MDA[48].因此,MDA 是氧化傷害后的指標,其含量上升意味著細胞已經受到明顯的氧化傷害.筆者研究中,3 種鹵乙酰胺10 和20 μg/L 處理組中的MDA 含量與對照組基本一致,而200 μg/L 處理組中的MDA 含量均顯著高于對照,表明輪蟲抗氧化機制在低濃度組中成功建立,SOD 活性的提高表明抗氧化作用發揮明顯,而在高濃度組中SOD 活性提高但產生較高含量的MDA,表明抗氧化機制未見成效.推測可能原因有兩方面:一方面是高濃度組過量產生ROS 已經超過抗氧化酶的處理能力,無法被及時清除所致;另一方面是某些抗氧化酶在高濃度組中的含量雖然顯著增加,但其作用發揮受到不同程度的抑制.研究[47]表明,輪蟲體內過量ROS 會啟動激活線粒體和溶酶體等通路,誘導線粒體自噬和細胞凋亡,鹵乙酰胺對萼花臂尾輪蟲氧化應激毒性作用機制是否與此類似,還需開展進一步研究.
綜上,輪蟲是水生態系統物質循環和能量傳遞過程中的關鍵物種,其種群結構和規模的改變勢必影響水生態系統功能的正常發揮.新興含氮消毒副產物鹵乙酰胺自被檢出以來,其毒性作用已經引起廣泛關注[49].特別地,環境中檢出的典型鹵乙酰胺——氯乙酰胺、二氯乙酰胺和溴乙酰胺對重要水生生物的毒性影響值得關注.筆者研究表明,氯乙酰胺、二氯乙酰胺和溴乙酰胺對萼花臂尾輪蟲的存活、種群增長、有性生殖和氧化應激均有明顯毒性作用,長期暴露勢必影響輪蟲的種群結構和規模,進而影響水生態系統的安全.然而,全面、正確地評價鹵乙酰胺的潛在生態風險還需在更多物種范圍、更多評價指標層面開展研究工作.
4 結論
a) 3 種鹵乙酰胺對萼花臂尾輪蟲具有較強的急性毒性,對萼花臂尾輪蟲急性毒性呈溴乙酰胺?氯乙酰胺?二氯乙酰胺的特征.
b) 20、200 μg/L 氯乙酰胺和200 μg/L 溴乙酰胺均顯著降低了萼花臂尾輪蟲的2 d 種群增長率.
c) 除MF/AF 外,輪蟲4 d 有性生殖參數均受到3 種鹵乙酰胺的顯著影響,輪蟲主動調整生殖策略以適應環境的變化.
d) 10、20 和200 μg/L 氯乙酰胺,20 和200 μg/L 二氯乙酰胺以及10 和20 μg/L 溴乙酰胺均顯著增加了輪蟲7 d 休眠卵產量,該指標對3 種鹵乙酰胺的毒性最敏感,是評價鹵乙酰胺對萼花臂尾輪蟲有性生殖影響的合適指標.
e) 除200 μg/L 氯乙酰胺、二氯乙酰胺和溴乙酰胺中過氧化物酶活性下降外,其他處理組中輪蟲氧化應激指標值普遍上升,表明輪蟲已經啟動了氧化應激反應保護自身免受傷害;在3 種鹵乙酰胺200 μg/L處理組中,輪蟲MDA 水平均顯著高于對照組,表明受到明顯的氧化損傷.

