石屏臭豆腐來源的高產蛋白酶菌株篩選及酶學特性研究
劉 超
趙良忠1,2
王瑤瓊1
李 明3
馮緒忠4
(1. 邵陽學院食品與化學工程學院,湖南 邵陽 422000;2. 豆制品加工與安全控制湖南省重點實驗室,湖南 邵陽 422000;3. 廣州佳明食品科技有限公司,廣東 廣州 511458;4. 深圳尚古堂食品發展有限公司,廣東 深圳 518000)
石屏臭豆腐為發酵型臭豆腐[1],在發酵過程中可以產生多種有益化合物。例如,臭豆腐富含生物可利用的S-雌馬酚,有助于減少骨質流失和緩解更年期癥狀;大豆中蛋白質經生物降解為更易吸收的多肽和氨基酸,如谷氨酸、噻唑氨酸、酪氨酸和色氨酸等,這些氨基酸富含生物活性,能夠維持人體氮元素平衡[2];發酵過程中產生的維生素B12對預防老年癡呆有一定作用[3]。發酵臭豆腐中分離的血管緊張素I轉換酶抑制肽和γ-氨基丁酸有利于緩解高血壓,表面活性素、異拉奉、呋喃酮、胰蛋白酶抑制劑和3-羥基鄰氨基苯甲酸具有抗癌活性[4]。
發酵豆制品以細菌作為發酵劑,主要有枯草芽孢桿菌、地衣芽葡萄球菌、植物乳桿菌、醬油片球菌、醬油四聯球菌[5],鮮見以金黃桿菌屬菌株發酵豆制品的報道。金黃桿菌屬是一類自然界廣泛分布的細菌[6],主要從人體[7]、廢水[8]、垃圾處理廠[9]、土壤[10]中分離得到,是引起食品變質腐敗的重要因素。研究發現,金黃桿菌屬所產蛋白酶具有多種生理特性,如抑制革蘭氏陰性致病菌的增殖;促進屠宰場或家禽養殖場的羽毛廢棄物利用[11];可將農用廢棄物生物質轉化為乙醇[12]等。
石屏臭豆腐生產采用自然接種發酵工藝,即利用環境中存在的微生物進行接種發酵,這導致石屏臭豆腐發酵過程周期長,微生物種類不易控制,產品常因雜菌污染而變質,貯藏時間短[13]。研究擬從石屏臭豆腐中篩選高產蛋白酶優勢菌株,探究其發酵條件及相關酶學特性,以期利用石屏臭豆腐高產蛋白酶優勢菌株發酵提供臭豆腐生產菌種資源。
1 材料與方法
1.1 材料
1.1.1 樣品
石屏臭豆腐:采于云南省紅河哈尼族彝族自治區州石屏縣豆腐園區5個工廠,每個工廠隨機無菌采取3份樣品,液氮速凍處理,-40 ℃貯藏備用。
1.1.2 培養基
豆漿分離培養基:將黃豆與水按V水∶m黃豆=1∶8 (mL/g)制成豆漿,再稀釋3倍制成豆漿培養基,瓊脂1.5%;
腦花分離培養基:將黃豆與水按V水∶m黃豆=1∶8 (mL/g)制成豆漿,用酸漿點至成腦花后用豆漿機磨碎再用水稀釋4倍,制成腦花培養基,瓊脂1.5%;
初篩選培養基:大豆分離蛋白1.0%,瓊脂1.5%;
種子培養基:酪蛋白1.0%、酵母膏1.0%、葡萄糖1.0%、NaCl 0.5%、瓊脂1.5%、pH 7.0~7.5;
發酵培養基:酪蛋白1.0%、葡萄糖1.0%、NaCl 0.5%,pH 7.0~7.5;
培養基滅菌條件:121 ℃、15 min。
1.1.3 主要試劑和儀器
大豆分離蛋白:BR級,上海源葉生物科技有限公司;
福林酚試劑:BR級,國藥集團化學試劑有限公司;
瓊脂:福建眾邦海洋生物科技有限公司;
無水碳酸鈉:AR級,天津市光復科技發展有限公司;
三氯乙酸:AR級,天津市科密歐化學試劑有限公司;
鹽酸、磷酸氫二鈉:AR級,天津市科密歐化學試劑有限公司;
磷酸二氫鈉:AR級,天津市大茂化學試劑廠;
氫氧化鈉:AR級,成都金山化學試劑有限公司;
乳酸、乳酸鈉:AR級,天津市光復精細化工研究所;
硼酸:AR級,德州潤昕實驗儀器有限公司;
酪蛋白:上海希格瑪高技術有限公司;
L-酪氨酸:中國惠興生化試劑廠;
顯微鏡:BA210型,麥克奧迪實業集團有限公司;
恒溫振蕩器:IS-AX型,蘇州捷美電子有限公司;
雙人單面凈化工作臺:SW-CJ-2FD型,江蘇通凈凈化設備有限公司;
電熱恒溫水浴鍋:DZKW-4型,北京中心偉業世紀儀器有限公司;
紫外可見分光光度計:D-7型,南京菲勒儀器有限公司;
臺式高速離心機:3H16RI型,湖南赫西儀器裝備有限公司;
全波長酶標儀:EL340型,美國Bio-Tek公司。
1.2 方法
1.2.1 產蛋白酶菌株篩選 在無菌條件下,切取石屏臭豆腐樣品表皮25.0 g,充分研磨后倒入裝有225 mL無菌生理鹽水的廣口錐形瓶中充分混勻。采用10倍稀釋法,最終選擇10-4,10-5,10-63個梯度的稀釋液0.5 mL均勻涂布于豆漿分離培養基和腦花分離培養基,每種濃度稀釋液重復3次,30 ℃培養48~96 h挑選單菌落純化培養,多次劃線,直至獲得單一菌落。
將純化后的單菌落點接于初篩選培養基上,30 ℃培養72 h,觀察菌落大小和菌落周圍水解圈大小,以菌株水解大豆分離蛋白所形成的透明圈直徑D與菌落徑d之比值(D/d)為篩選依據,選取D/d值較大的菌株進一步復篩。
挑選初篩菌株接種發酵培養基中,30 ℃,160 r/min搖瓶培養48 h后取10 mL發酵液,10 000 r/min離心10 min,收集上清液,得到粗酶液。測定蛋白酶的活力,選取蛋白酶活力最高的菌株為試驗的目的菌株。
1.2.2 蛋白酶活力測定 按GB/T 23527—2009《蛋白酶制劑》執行。
1.2.3 菌株鑒定
(1) 菌落和個體形態學觀察:將菌株在初篩選培養基上劃線培養,30 ℃培養72 h,形成肉眼可觀察到的菌落形狀、顏色、表面質地等形態特征,制片染色,觀察顯微鏡下菌株的形態特征。
(2) 菌株生理生化鑒定:參考文獻[14]。
(3) 菌株分子生物學鑒定:斜面保存的菌株平板劃線得出菌株單菌落,細菌16S rRNA中最保守的序列設計引物,引物F:5′-AGAGITTGATCMTGGCTCAG-3′,引物R:5′-AAGGAGGTGWTCCARCC-3′,PCR反應體系20 μL。熱循環參數94 ℃預變性5 min,94 ℃變性30 s,55 ℃退火45 s,72 ℃延伸2 min,循環30次,72 ℃延伸10 min,取2 μL反應液進行10 g/L瓊脂糖電泳檢測,PCR擴增產物送至生工生物工程(上海)股份有限公司測序。測序所得16S rRNA基因序列結果與NCBI中blast比對,運用MEGA6軟件,Neighbor-Joining法構建系統進化樹。
1.2.4 菌株生長與產酶曲線繪制 以2%的接種量轉接于發酵培養基中,30 ℃、160 r/min恒溫振蕩培養,每間隔4 h取發酵液10 mL,未接種的作為空白對照,檢測OD600 nm值,繪制菌株生長曲線。每隔12 h取10 mL,檢測酶活,繪制不同生長時間下粗酶液中蛋白酶活力與時間的關系曲線。
1.2.5 菌株JX-11發酵條件優化
(1) 溫度:固定氮源蛋白胨添加量10 g/L,碳源葡萄糖添加量10 g/L,pH為7,金屬離子NaCl添加量5 g/L,考察溫度(20,25,30,35,40 ℃)對菌株JX-11產酶活力的影響。
(2) 碳源:固定氮源蛋白胨添加量10 g/L,pH為7,金屬離子NaCl添加量5 g/L,培養溫度30 ℃,考察碳源(葡萄糖、蔗糖、乳糖、麥芽糖、淀粉、麥芽糖,10 g/L)對菌株JX-11產酶活力的影響,確定最適碳源后進行最適碳源添加量(5,10,15,20,25 g/L)優化。
(3) 氮源:固定碳源葡萄糖添加量10 g/L,pH為7,金屬離子NaCl添加量5 g/L,培養溫度30 ℃,考察氮源(蛋白胨、酵母膏、牛肉膏、酪蛋白、尿素,10 g/L)對菌株JX-11產酶活力的影響,確定最適氮源后進行最適氮源添加量(5,10,15,20,25 g/L)優化。
(4) pH值:固定氮源蛋白胨添加量10 g/L,碳源葡萄糖添加量10 g/L,金屬離子NaCl添加量5 g/L,培養溫度30 ℃,考察pH(5,6,7,8,9,10,11)對菌株JX-11產酶活力的影響。
(5) 金屬離子:固定氮源蛋白胨添加量10 g/L,碳源葡萄糖添加量10 g/L,pH為7,培養溫度30 ℃,考察金屬離子(K+、Na+、Mg2+、Ca2+、Cu2+,10 g/L)對菌株JX-11產酶活力的影響,確定金屬離子后進行最適金屬離子添加量(5,10,15,20,25 g/L)優化。
1.2.6 菌株發酵條件優化的響應面試驗設計 在單因素試驗結果的基礎上,以培養溫度、葡萄糖、蛋白胨、pH為因素,酶活力為評價指標,設計四因素三水平響應面試驗。
1.2.7 菌株JX-11蛋白酶酶學性質 最佳發酵條件下的發酵液10 000 r/min離心10 min,取上清液作為粗酶液,用于酶學性質初步研究。
(1) 最適反應溫度和熱穩定性:固定反應時間1 h,考察在不同反應溫度(10,20,30,40,50,60 ℃)下,菌株JX-11的相對酶活力;固定粗酶液保溫時間1 h,將酶液置于上述溫度(10,20,30,40,50,60 ℃),考察在不同保溫溫度下,菌株JX-11的殘留酶活力。
(2) 最適反應pH值及酸堿穩定性:固定反應時間1 h,考察在不同pH值緩沖液中[乳酸—乳酸鈉緩沖液(pH 3.0)、檸檬酸—檸檬酸鈉緩沖液(pH 5.0)、磷酸氫二鈉—磷酸二氫鈉緩沖液(pH 7.0)、碳酸鈉—碳酸氫鈉緩沖溶液(pH 9.0)、硼酸—氫氧化鈉緩沖液(pH 11.0)]菌株JX-11的相對酶活力;固定粗酶液保溫時間1 h,將酶液置于上述緩沖液(pH 3.0,5.0,7.0,9.0,11.0),考察在不同pH下,菌株JX-11的殘留酶活力。最高酶活為100%,計算相對酶活力和殘留酶活力。
(3) 金屬離子及抑制劑對酶活性的影響:固定反應時間1 h,考察不同金屬離子(Mg2+、K+、Na+、Ca2+、Mn2+、Cu2+,100 mmol/L)對菌株JX-11的相對酶活力。
(4) 有機化學試劑對JX-11菌株蛋白酶的影響:固定反應時間1 h,考察不同有機試劑[吐溫80、乙醇、乙酸、丙酮、甘油、乙二胺四乙酸(EDTA)、甲醇、十二烷基硫酸鈉(SDS),100 mmol/L]對菌株JX-11的相對酶活力。不加金屬離子、有機試劑的蛋白酶活力為100%,計算相對酶活力。
2 結果與分析
2.1 產蛋白酶菌株篩選
菌株在初篩平板透明圈效果見圖1,在大豆分離蛋白培養液中初篩結果見表1。根據平板上菌落水解圈直徑及菌落直徑的比值(D/d)大小,篩選獲得酶活較強的菌株6株。由表1可知,編號為6的菌株D/d值最大(為2.91),但酶活力較低,僅有11.48 U/mL,初篩平板有一定的局限性。編號為4的菌株D/d值為1.94,蛋白酶酶活性最高,達23.25 U/mL,因此,選用該菌株進行下一步研究,并將其命名為JX-11。

表1 石屏臭豆腐中產高蛋白酶活力菌株的初篩?

圖1 不同菌株大豆分離蛋白板水解圈照片
2.2 菌株鑒定
2.2.1 菌株菌落形態 如圖2所示,JX-11菌落為圓形,邊緣呈鋸齒狀,表面水潤,顏色黃色,經革蘭氏染色結果為陽性桿菌。

圖2 JX-11菌落形態及革蘭氏染色圖
2.2.2 生理生化鑒定 由表2可知,JX-11菌株不適合高鹽環境,可以利用葡萄糖、麥芽糖、淀粉、甘露醇、甘油等碳源產酸。過氧化氫酶、氧化酶、明膠酶結果呈陽性,其他試驗結果均為陰性。

表2 JX-11菌株的生理生化特征表?
2.2.3 16S rRNA基因序列及系統發育分析 經過基因組DNA的提取,以總DNA為模板,利用27F/1492R引物,通過PCR擴增、瓊脂糖凝膠電泳后得到菌株約1 000 bp的16S rRNA基因條帶,結果見圖3。將菌株的16S rRNA基因序列提交至NCBI數據庫進行相似性比對。發現JX-11菌株與彭尼普爾金黃桿菌(C.pennipullorum)的16S rRNA基因序列自然聚類,相似度為99.65%,與10條相似性較高的序列構建系統發育樹如圖4所示,JX-11菌株與彭尼普爾金黃桿菌(C.pennipullorum)strain7 F195菌株在同一分支上,表明JX-11菌株與彭尼普爾金黃桿菌(C.pennipullorum)的親緣關系最近。

M. Marker 1. 其他菌株 2. JX-11

圖4 JX-11依據16S rRNA序列建立的系統發育樹
2.3 菌株JX-11生長與產酶情況
如圖5(a)所示,JX-11菌株在0~4 h時為生長延滯期,該菌株對生存環境的適應能力較弱,生長緩慢;在4~8 h時處于對數生長期,該菌株潛伏期短,生長迅速,對新鮮培養基的適應能力強[15],32 h后菌株生長進入衰亡期,可能是由于營養物質的減少,生長代謝產物的增加,導致菌株的生長繁殖受到抑制,逐步進入衰亡,菌落密度降低。如圖5(b)所示,JX-11菌株在0~36 h時處于生長時期,產蛋白酶能力弱;36~48 h細菌生長進入衰亡期,產蛋白酶能力增強;JX-11菌株培養48 h后,培養基中營養物質減少,細菌生長受到抑制,代謝產物增加,蛋白酶活力降低。因此,選擇48 h作為JX-11菌株的最適發酵時間。

圖5 JX-11菌株生長曲線及其產酶活力曲線
2.4 JX-11菌株發酵條件優化
如圖6(a)所示,JX-11菌株利用淀粉、乳糖、葡萄糖的活性在同一水平上,考慮到葡萄糖分子量,選擇葡萄糖為最適碳源,優化添加量結果[圖6(b)]為10 g/L;JX-11菌株利用碳源廣泛,可以有效降解可溶性淀粉,如Wang等[16]從土壤中分離得到的C.taeanenseTKU001可以有效降解可溶性淀粉,得到最終產物葡萄糖和麥芽糖;Dahal等[17]從北極土壤中分離得到的C.antibioticumRP-3-3能夠水解CM-纖維素、酪蛋白、淀粉和DNA。

小寫字母不同表示差異顯著(P<0.05)
以蛋白胨為氮源時蛋白酶活性最高,為(30.57±0.68) U/mL[圖6(c)],最適添加量為10 g/L[圖6(d)];且有機氮源比無機氮源更有利于促進該菌株蛋白酶的酶活,由此可以認為,有機氮源能為該菌體的生長提供更豐富的氨基酸、維生素和生長因子等營養物質,從而促進蛋白酶的產生。
溫度是催化蛋白酶活性和促進菌株生長發酵的重要因素之一,如圖6(e)所示,培養溫度為25 ℃的酶活力與20,30 ℃的有顯著性差異(P<0.05),培養溫度為25 ℃時酶活最高,達(35.13±0.81) U/mL;當培養溫度超過25 ℃時,隨著溫度的增加,酶活力逐漸降低,過高的溫度(>30 ℃)會抑制菌株的生長及產酶活力。因此,選擇最適培養溫度為25 ℃。
如圖6(f)所示,隨著pH的上升,酶活逐漸增加,在pH 6.0時酶活最高,為(36.25±0.84) U/mL;當pH繼續上升時,酶活逐漸降低。因此,選擇pH 6.0為最佳pH。
金屬離子對JX-11菌株產酶活力的影響在同一水平上[P>0.05,圖6(g)],選擇Na+作為最適金屬離子。進一步優化添加量結果顯示,不添加與添加0.5%的NaCl,JX-11菌株產酶活力無顯著性差異,低鹽度對JX-11菌株產酶活力無顯著促進作用[P>0.05,圖6(h)];且隨著NaCl添加量的增加,JX-11菌株產酶活力降低。高濃度NaCl會抑制JX-11菌株所產蛋白酶的活力。JX-11菌株更適合在低鹽度下發酵產酶,與何小玉等[18]的研究結果一致。因此,不選擇金屬離子Na+為響應面試驗因素。
2.5 發酵條件響應面試驗
2.5.1 試驗設計 在單因素試驗基礎上,選擇溫度、葡萄糖添加量、蛋白胨添加量和pH 4個因素的水平值,以酶活力為響應值,運用Design-Expert 8.0.6.1軟件進行Box-Behnken響應面設計和數據分析。響應面試驗因素水平見表3,試驗方案見表4。

表3 響應面試驗因素水平
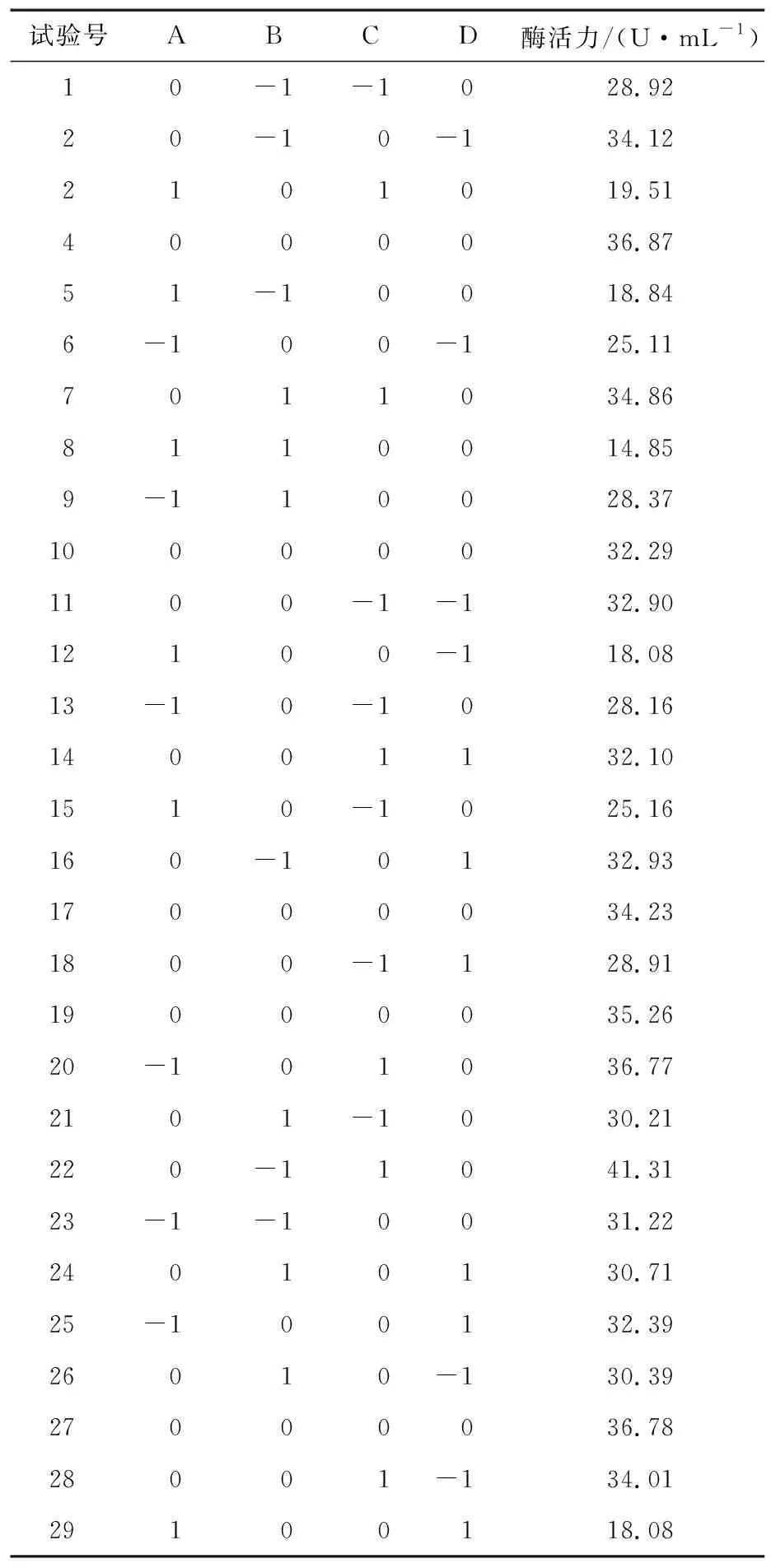
表4 Box-Behnken試驗方案及結果
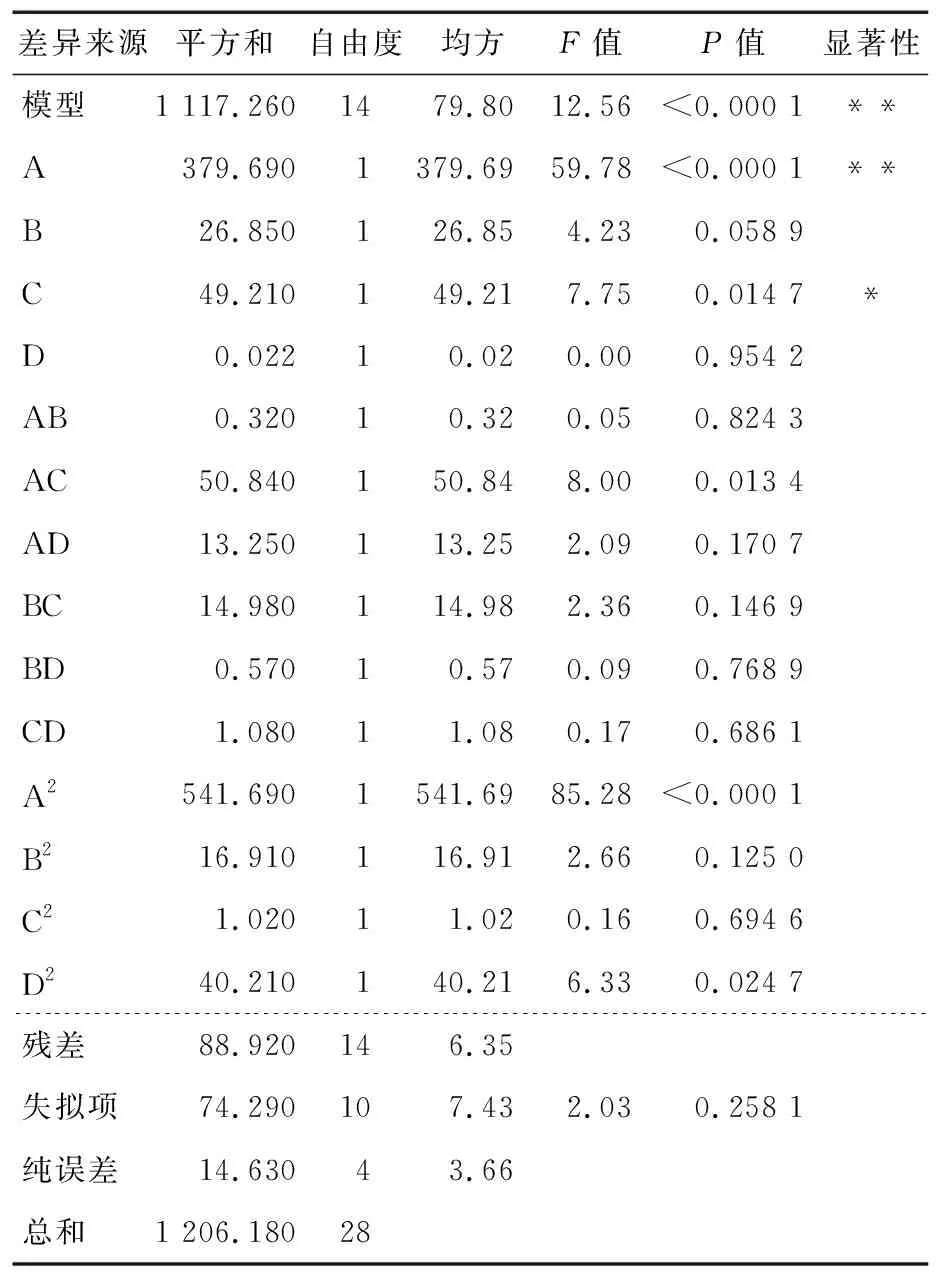
表5 回歸方程方差分析?
2.5.2 響應面模型建立與方差分析 通過Design-Expert 11對響應面試驗結果進行分析,得到酶活力與各因素的二次回歸方程:
Y=35.09-5.63A-1.50B+2.03C-0.043D-0.29AB-3.56AC-1.82AD-1.94BC-0.38BD-0.52CD-9.14A2-1.61B2+0.40C2-2.49D2。
(1)
由表3可知,模型P值<0.000 1,影響顯著;失擬項P=0.258 1,影響不顯著;R2=0.926 3,表明此回歸方程為回歸顯著型,與實際擬合程度較好。該回歸模型中,A、C對酶活力的影響達到極顯著效應(P<0.01);AC對酶活力的影響達到顯著效應(P<0.05),其他項對酶活力的影響不顯著(P>0.05)。從P值以及F值可以看出,4個因素對酶活力的影響顯著性大小依次為溫度>蛋白胨添加量>葡萄糖添加量>pH,溫度對JX-11菌株所產酶活力影響最大。
2.5.3 響應面交互作用分析 由圖7可知,溫度與蛋白胨添加量的響應面斜面較陡,交互作用較明顯,達到顯著水平(P<0.05);溫度對JX-11菌株所產酶活力的影響最大,葡萄糖添加量、蛋白胨添加量次之,pH的影響最小,與方差分析結果一致。

圖7 兩兩因素交互作用響應面與等高線圖
2.5.4 響應面結果及驗證實驗 通過Design-Expert 8.0.6.1軟件分析,預測出酶活力的最優工藝為溫度22.66 ℃,葡萄糖添加量6.66 g/L,蛋白胨添加量14.98 g/L,pH 6.4,模型預測菌株JX-11酶活力為41.32 U/mL,調整工藝為溫度23.00 ℃,葡萄糖添加量6.70 g/L,蛋白胨添加量15.00 g/L,pH 6.4,測定酶活力為(39.16±3.24) U/mL,與預測值的偏差<5%,模型有效。
在優化工藝條件下,JX-11菌株所產酶的活力已超過同屬的C.taeanenseTKU001 (0.14 U/mL)[19]、C.proteolyticum9670 (0.16 U/mL)[20]、C.indologenesTKU014 (0.47 U/mL)[21]和C.spkr6 (33.2 U/mL)[22]等菌株,為高產蛋白酶菌株。
2.6 JX-11菌株酶學性質
2.6.1 溫度對JX-11菌株的蛋白酶反應活性和穩定性的影響 如圖8所示,JX-11菌株所產蛋白酶在10~40 ℃幾乎保持了原有酶活力,相對酶活力>66.90%;但隨著溫度上升,酶活迅速降低,超過60 ℃時,殘留酶活僅剩4.14%,表明JX-11菌株所產蛋白酶對高溫敏感。當溫度為10~30 ℃時蛋白酶能保持原有的活性,相對酶活力>50%;JX-11菌株蛋白酶的最適反應溫度為30 ℃,但當溫度高于30 ℃后,保溫1 h,蛋白酶活力迅速下降,溫度達到60 ℃時保溫1 h,相對酶活力為16.35%,推測蛋白酶在高溫下活性的急劇下降與蛋白酶結構的變化和高溫下蛋白酶反應體系中溶解氧的減少有關。JX-11菌株所產蛋白酶有較廣的適應溫度,可以一定程度地適應粗放型工業生產條件,其蛋白酶產酶能力使其在工業生產中具有一定的應用價值。

圖8 溫度對JX-11菌株所產蛋白酶活力的影響
2.6.2 pH對JX-11菌株的蛋白酶反應活性和穩定性的影響 如圖9所示,pH>5.0時,相對酶活力快速增大,在pH 7.0時達到最大酶活力;pH在6.0~9.0時殘留酶活力為60%以上,有較好的穩定性;當pH>9.0,酶活性迅速下降,說明該粗酶液對堿性環境較敏感,不適合在強堿性環境下進行保存。反應體系的pH值會影響酶與不同底物的結合狀態,從而產生不同的催化效率。在pH 7.0~9.0范圍內反應1 h,相對酶活力>80%,最大酶活力pH為7.0,表明JX-11蛋白酶為中性蛋白酶,上清粗酶液對堿性環境較敏感,當pH>9.0時,酶活性迅速降低。因此,該酶在洗滌、制革、絲綢等行業具有較大的應用潛力。
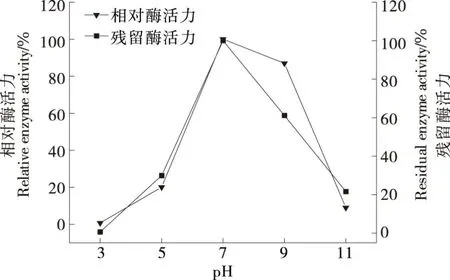
圖9 pH對JX-11菌株所產蛋白酶活力的影響
2.6.3 金屬離子對JX-11菌株蛋白酶活性的影響 如圖10所示,向蛋白酶粗酶液中加入金屬離子Zn2+、Cu2+、K+抑制該蛋白酶的活性,其中Zn2+抑制該蛋白酶的活性作用次之,相對酶活力72.92%,Cu2+抑制作用最強,相對酶活力僅有43.52%;Mn2+對該蛋白酶酶活力有顯著促進作用,對比空白,Mn2+對JX-11菌株所產酶活力促進率達到433.42%;而Na+、Mg2+、Ca2+對JX-11蛋白酶活力影響不大。其中Mn2+對JX-11菌株所產酶的影響和其他文獻報道有差異,Deng等[23]發現Mn2+對芽孢桿菌屬蛋白酶起抑制作用;殷方榮等[24]發現Mn2+對貝萊斯芽孢桿菌角蛋白酶有輕微抑制作用;張軍等[25]發現Mn2+完全抑制乙酰微小桿菌低溫蛋白酶。但Mageswari等[26]的研究表明,Mn2+具有促進金黃桿菌屬酶活的作用,當Mn2+存在時酶活性顯著增強,這是C.pennipullorum蛋白酶的罕見特征。此外,Bhavikatti等[27]從河水和河岸土壤樣品中分離出的C.cucumerisSARJS-2,Zn2+對其酶活無顯著抑制作用。Wang等[28]以紅曲稻為唯一的碳氮源,從土壤中分離得到C.taeanenseTKU001,Mg2+、Ca2+對其酶活無顯著影響,Zn2+抑制該酶活性,且在5 mmol Cu2+和Fe2+條件下完全失活,與JX-11菌株所產酶的特征相似。綜上,JX-11菌株所產酶可能是一種活性中心需Mn2+參與的金屬蛋白酶類,有關該酶分子的具體結構及活性中心有待進一步深入研究。
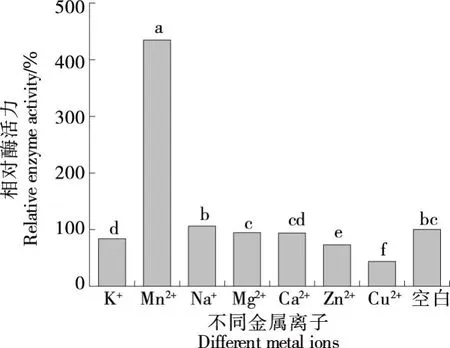
小寫字母不同表示差異顯著(P<0.05)
2.6.4 化學試劑對JX-11菌株蛋白酶活性的影響 如圖11所示,甘油對該酶有顯著的激活作用,相對酶活可達132.94%,甘油可作為非離子表面活性劑能夠與游離水進行水合,降低了游離水含量,減少了游離水對蛋白酶構象靈活性的影響[29];乙醇、丙酮對酶活基本無影響;吐溫80、乙酸、甲醇顯著抑制該酶活性,有機溶劑會削弱蛋白質的疏水鍵,使蛋白酶分子內斥力增加,造成蛋白質的三級結構延展,最終導致催化活性喪失;EDTA對該酶的抑制作用顯著,EDTA是一種金屬螯合劑,與酶分子中的金屬離子形成螯合物從而使酶失活,進一步表明該酶發揮作用需要金屬離子參與;而SDS對酶活具有顯著抑制作用,可能是因為SDS為離子型表面活性劑,可通過靜電作用結合到蛋白酶表面帶有電荷的氨基酸殘基上,從而產生抑制作用[30]。

小寫字母不同表示差異顯著(P<0.05)
3 結論
利用模擬豆腐營養成分培養基,從石屏臭豆腐中分離篩選出一株高產蛋白酶的菌株,命名為JX-11,經過鑒定,為彭尼普爾金黃桿菌(Chryseobacteriumpennipullorum)。研究對菌株JX-11培養條件進行優化,優化后酶活達到(39.16±3.24) U/mL,較優化前提高了40.63%。酶學性質結果表明菌株JX-11所產蛋白酶最適溫度為30 ℃,最適pH為7.0,是中性蛋白酶;在10~40 ℃和pH 6.0~9.0時酶活力穩定;金屬離子Mn2+對酶活力有明顯激活作用,可使酶活提高4.33倍,而Zn2+、Cu2+、K+對其有抑制作用,乙醇、丙酮對酶活基本無影響;吐溫80、乙酸、甲醇、SDS、EDTA顯著抑制該酶活性,金屬螯合劑EDTA對該酶活性的抑制作用最大,同時也進一步驗證了該酶為金屬蛋白酶類。考慮C.pennipullorum菌株的安全性,今后可采用代謝工程的方法對相關致病基因進行敲除;也可通過基因工程手段異源表達蛋白酶的基因,利用所產蛋白酶應用于石屏臭豆腐的發酵。

