蕪菁酸性多糖體內抗腫瘤活性研究
古麗米拉·卡德爾
阿曼妮薩·麥提如則1
李明珠1
康金森1
海力茜·陶爾大洪1,2,3
(1. 新疆醫科大學藥學院,新疆 烏魯木齊 830011;2. 新疆及中亞特色醫藥資源教育部工程研究中心,新疆 烏魯木齊 830011;3. 新疆天然藥物活性組分與釋藥技術重點實驗室,新疆 烏魯木齊 830011)
蕪菁(BrassicarapaL.)又名恰麻古、蔓菁,屬于十字花科蕓薹屬植物,以塊根入藥,富含多糖[1]。蕪菁多糖具有潤肺、開胸理氣的功效[1],還具有抗氧化[2-3]、抗衰老[4]、抗腫瘤[5]、抗疲勞[6]等作用。已有研究表明,蕪菁酸性多糖在體內具有抗Lewis肺癌活性[7];蕪菁多糖有降血糖作用[8],對LPS/ATP誘導的RAW264.7細胞焦亡具有抑制作用[9];蕪菁中性多糖能夠抑制LDH的生成、提高抗氧化酶活性、上調凋亡蛋白表達水平,改善PC12細胞氧化應激損傷[10],能有效提高D-半乳糖致衰老小鼠模型抗氧化能力,達到延緩衰老的作用[11]。
非小細胞肺癌是常見的一種肺癌類型。據調查[12-14],非小細胞肺癌的發病率和致死率均占惡性腫瘤的首位,傳統治療效果不理想、不良反應多,嚴重影響患者的生活質量。研究[15]表明,細胞壞死性凋亡可能在癌癥中發揮重要作用,作為一種腫瘤抑制效應,壞死性凋亡可作為一種“故障安全”機制,在細胞凋亡受到損害時防止腫瘤發展。在壞死性細胞死亡過程中,壞死性凋亡導致細胞器腫脹、細胞膜破裂及其內容物滲漏到細胞間隙中[16-17]。但與壞死不同的是,壞死性凋亡中的細胞裂解受到嚴格調控,其關鍵調控分子包括受體相互作用蛋白激酶1(receptor-interacting protein kinase 1,RIPK1)、RIPK3和混合譜系激酶域樣蛋白(mixed-lineage kinase domain-like proteins,MLKL),它們共同形成一個復合物激活壞死性凋亡通路[18]。
研究擬采用人H226細胞建立荷瘤小鼠模型,通過體內試驗分析蕪菁酸性均一多糖對荷瘤小鼠血清中白細胞介素18(interleukin-18,IL-18)、IL-1β和腫瘤壞死因子α(tumor necrosis factor,TNF-α)細胞因子水平、腫瘤組織中壞死性凋亡相關基因表達情況的影響,進一步闡明蕪菁酸性均一多糖體內抗腫瘤活性及其作用機制。
1 材料與方法
1.1 材料、試劑與儀器
蕪菁:采自新疆阿克蘇柯坪縣;
4~6周齡BALB/c裸鼠:湖南斯萊克景達實驗動物有限公司;
H226細胞株、細胞增殖毒性檢測試劑盒(cell counting Kit-8,CCK-8)、緩沖液(PBS):武漢普諾賽生命科技有限公司;
順鉑:北京索萊寶科技有限公司;
DMEM培養基:美國Gibco公司;
0.25%胰蛋白酶:美國Gibco公司;
胎牛血清(FBS):南京生航生物技術有限公司;
TB Green qPCR試劑盒:日本Takara Bio公司;
酶聯免疫試劑盒:武漢伊萊瑞特生物科技股份有限公司;
氯化鈉注射液:四川科倫藥業股份有限公司;
二抗:美國Affinity公司;
MLKL、RIP1、RIP3抗體:兔抗,英國Abcam公司;
GAPDH抗體:兔抗,武漢賽維爾生物科技有限公司;
倒置顯微鏡:IX71-12FL/PH型,賽默飛世爾科技公司;
離心機:5424R型,德國Eppendorf公司;
二氧化碳培養箱:Galaxy 170R型,賽默飛世爾科技公司;
熒光定量PCR儀:Quant Studio 6Fle型,美國ABI公司;
電熱恒溫水槽:SSW-600-2S型,上海博訊實業有限公司醫療設備廠;
電熱恒溫鼓風干燥箱:DHG-9023A型,上海精宏實驗設備有限公司;
全波長酶標儀:TECAN F50型,賽默飛世爾科技公司。
1.2 試驗方法
1.2.1 蕪菁酸性多糖提取物制備 蕪菁酸性多糖(BrassicarapaL. acid polysaccharides,BRAP)一組分和二組分(BRAP-1、BRAP-2)按課題組前期優化條件提取、分離、純化、除蛋白后得到[9],BRAP-1平均相對分子質量為6 080,糖醛酸含量為28.13%,由阿拉伯糖、葡萄糖、半乳糖和半乳糖醛酸組成,摩爾比為2.07∶4.53∶2.20∶1.00;BRAP-2平均相對分子質量為7 590,糖醛酸含量為20.80%,由鼠李糖、阿拉伯糖、葡萄糖、半乳糖和半乳糖醛酸組成,摩爾比為1.06∶1.00∶5.03∶2.22∶1.50[4]。
1.2.2 CCK-8法檢測蕪菁酸性多糖對H226細胞增殖情況的影響 取對數生長期的H226細胞,調整細胞密度為5×104個/mL,將細胞100 μL/孔接種于96孔細胞培養板中,設置空白組、對照組、BRAP-1/BRAP-2各劑量給藥組。37 ℃恒溫培養箱培養細胞24 h至細胞貼壁,給藥24 h后吸棄上清液,每組加100 μL完全培養液和10 μL CCK-8試劑,在37 ℃恒溫培養箱中孵育1~2 h后用酶標儀于450 nm處測定其OD值[5]。
1.2.3 H226細胞荷瘤小鼠模型的建立、分組及給藥情況
取對數生長的人肺鱗癌H226細胞,調整細胞濃度為1×107個/mL,將細胞懸液150 μL/只皮下注入到小鼠右腋上側。造模成功后進行分組,分組情況:正常對照組、模型組,陽性藥物順鉑組[3 mg/(kg·2 d)],BRAP-1低劑量組[50 mg/(kg·d)],BRAP-1中劑量組[100 mg/(kg·d)]和BRAP-1高劑量組[200 mg/(kg·d)],每組10只,腹腔注射給藥[19-20]。
1.2.4 腫瘤體積、抑瘤率及脾臟指數的計算 給藥當天開始每隔1 d測量活體腫瘤的大小(腫瘤的最大長徑a和最小短徑b),給藥結束第2天處理小鼠,眼球采血收集血清、腫瘤、脾臟等,腫瘤體積、抑瘤率及脾臟指數計算公式:
v=a×b2/2,
(1)
(2)
(3)
式中:
v——腫瘤體積,cm3;
a——腫瘤最大長徑,cm;
b——腫瘤最小短徑,cm;
c1——抑瘤率,%;
s——脾臟指數,mg/g;
m1——給藥組平均瘤重,g;
m2——模型組平均瘤重,g;
m3——脾臟質量,mg;
m4——小鼠體質量,g。
1.2.5 ELISA法檢測小鼠血清中IL-18、IL-1β、TNF-ɑ含量 小鼠全血靜置2 h,離心分離血清(4 ℃,1 200 r/min,20 min)-80 ℃的冰箱保存。根據試劑盒說明書檢測荷瘤小鼠血清中IL-18、IL-1β、TNF-ɑ的含量。
1.2.6 RT-RCR法檢測小鼠腫瘤組織中IL-18、IL-1β、MLKL、RIP1、RIP3RNA表達量 提取各組小鼠腫瘤中的RNA[22-24],按TB Green q-PCR試劑盒說明書操作。引物設計如表1所示。

表1 引物序列
1.2.7 Western Blot法檢測小鼠腫瘤組織中MLKL、RIP1、RIP3蛋白表達量 提取各組小鼠腫瘤中的蛋白[25-28],經蛋白定量、制膠并上樣、電泳、電轉后,將涂布顯影液的PDVF膜曝光后保存圖片。
1.2.8 統計分析 采用SPSS、Origin 2022軟件進行數據分析與繪圖。
2 結果與分析
2.1 BRAP-1、BRAP-2對H226細胞增殖率的影響
如圖1所示,BRAP-1對H226細胞增殖率的影響顯著,隨著給藥質量濃度從1 μg/mL增加到5 000 μg/mL,H226細胞增殖率逐漸降低,呈劑量依賴性[7]。相比BRAP-1,BRAP-2對H226細胞增殖率的影響較小,1 μg/mL干預細胞后增殖率仍較高,而在50~5 000 μg/mL的質量濃度范圍內,各組干預濃度雖有明顯差別,但對H226細胞增殖率的影響相近。BRAP-1對H226細胞的增殖有更顯著的抑制作用,可能是BRAP-1糖醛酸含量較高相對分子質量較小,有利于其發揮抗炎抗腫瘤作用[29],因此后續動物試驗以BRAP-1給藥。
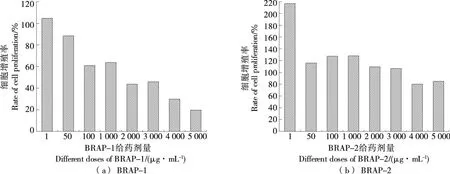
圖1 BRAP-1、BRAP-2質量濃度對H226細胞增殖率的影響
2.2 BRAP-1對H226細胞荷瘤小鼠腫瘤質量的影響
各組荷瘤小鼠抑瘤率從高到低依次為:陽性組>BRAP-1高劑量組>BRAP-1中劑量組>BRAP-1低劑量組。如圖2所示,隨著BRAP-1給藥劑量的增加,小鼠腫瘤生長出現遲緩現象,相比模型組,陽性組抑瘤效果顯著(P<0.01)、BRAP-1中、高劑量組均可減緩腫瘤生長速度,差別有統計學意義(P<0.05)。BRAP-1可能通過破壞腫瘤生長微環境、免疫細胞胞間復雜的相互作用網絡發揮抗腫瘤作用,抗腫瘤作用呈劑量依賴性[30-31]。

與模型組比較,*表示P<0.05,**表示P<0.01
2.3 BRAP-1對H226細胞荷瘤小鼠體重的影響
陽性組小鼠體重下降,可能是化療藥物順鉑在抑制腫瘤的過程中使荷瘤小鼠的食欲減退等毒副作用引起的。與陽性組相比,BRAP-1各劑量組荷瘤小鼠的體重前后變化較小,說明BRAP-1對小鼠毒副作用甚少,可在盡量不損傷機體正常組織的情況下防治腫瘤進一步發展,這便是植物多糖BRAP-1優勢所在(圖3)。
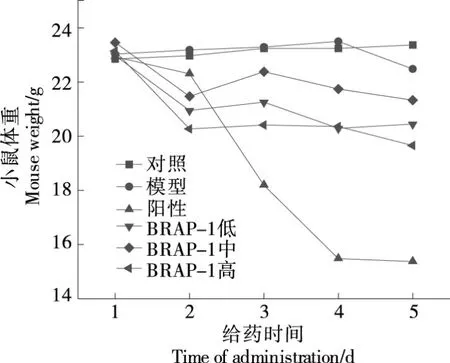
圖3 BRAP-1對H226細胞荷瘤小鼠體重的影響
2.4 BRAP-1對H226細胞荷瘤小鼠脾臟指數的影響
與對照組相比,陽性藥順鉑組小鼠脾臟指數均降低顯著(P<0.01),BRAP-1各劑量給藥組的脾臟指數均有所增加,差異有統計學意義(P<0.05),其中低、中、高劑量組間無顯著差異(圖4)。脾臟是免疫細胞居住的場所,屬于外周免疫器官,也是血液循環系統中重要的過濾器官,可清除血液內的病原體、衰亡的血細胞等[32-33]。機體免疫功能表現亢進或抑制時,脾臟細胞也相應的增殖或萎縮,因此,脾臟指數可在一定程度上體現BRAP-1對機體免疫功能的影響[34]。

與對照組比較,*表示P<0.05,**表示P<0.01
2.5 H226細胞荷瘤小鼠血清中IL-18、IL-1β、TNF-ɑ含量
模型組小鼠血清中IL-18、IL-1β、TNF-ɑ的含量均顯著增加,陽性組小鼠血清中IL-18、TNF-ɑ的含量與模型組相比有降低趨勢,而BRAP-1各組血清中細胞因子水平具有增長趨勢。陽性組和BRAP-1高劑量組的IL-1β明顯增加(P<0.05),而BRAP-1低、中劑量組小鼠血清中IL-1β含量均比模型組低(表2)。
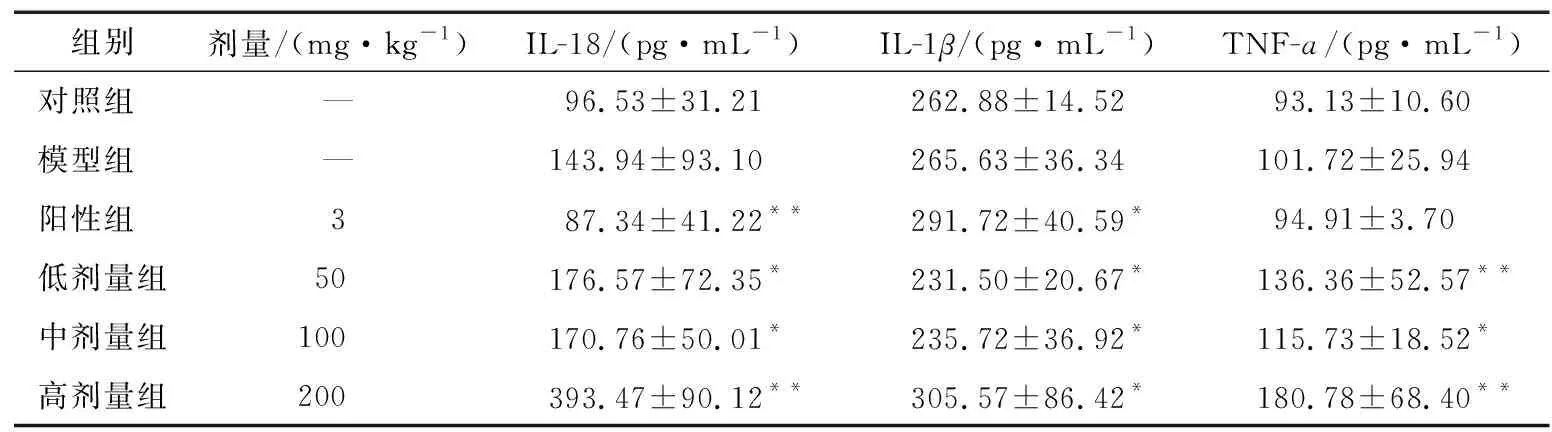
表2 BRAP-1對H226細胞荷瘤小鼠血清中IL-18、IL-1β、TNF-ɑ含量的影響?
有研究[29]表明,腫瘤壞死因子、白介素對腫瘤的增殖、發展具有重要作用。當IL-1β、IL-18被消除時,腫瘤生長會延遲。但IL-1β、IL-18在腫瘤發生中既可以是協作關系,也可以是對立關系,具體取決于腫瘤類型和背景。在一項肺癌細胞系研究[30]中,IL-1β可通過刺激炎癥介質(如IL-6、IL-8等)促進腫瘤轉移,還會增加乳腺癌細胞的侵襲性;TNF-α主要由活化的巨噬細胞、T淋巴細胞和自然殺傷細胞產生,其在一些細胞中的表達較低,包括成纖維細胞、平滑肌細胞和腫瘤細胞。綜上,BRAP-1可通過調節腫瘤相關細胞因子水平發揮抗腫瘤作用。
2.6 H226細胞荷瘤小鼠腫瘤中IL-18、IL-1β、MLKL、RIP1、RIP3 mRNA表達量
與模型組比較,陽性藥順鉑組小鼠腫瘤組織中IL-18、MLKL、RIP1、RIP3mRNA表達水平顯著升高(P<0.01),IL-1βmRNA表達量減小(P<0.05);BRAP-1組小鼠腫瘤組織中MLKL、RIP1、RIP3mRNA表達水平顯著升高(P<0.01),表明BRAP-1可激活壞死性凋亡通路,導致其關鍵因子基因轉錄水平升高(圖5)。壞死性凋亡受MLKL、RIP1、RIP3的調控,研究[35-36]表明,癌組織中RIPK1和RIPK3的表達量顯著低于周圍正常組織,此外,腫瘤中RIPK3和MLKL表達的降低與較差的總體生存率顯著相關。BRAP-1可通過上調MLKL、RIP1、RIP3基因的表達,促進腫瘤細胞發生壞死性凋亡,從而阻遏腫瘤細胞的進一步增殖及癌癥的繼續發展。

與模型組比較,*表示P<0.05,**表示P<0.01
2.7 H226細胞荷瘤小鼠腫瘤中MLKL、RIP1、RIP3蛋白表達量
感染、組織損傷、炎癥和癌癥都會導致MLKL、RIP3表達升高,雖然RIP1、RIP3是MLKL的上游蛋白,但在許多細胞系和組織中MLKL可在缺乏RIP3的情況下表達[37]。與模型組比較,陽性藥順鉑組小鼠腫瘤組織中MLKL、RIP1蛋白表達水平顯著升高,RIP3蛋白表達量無明顯差別;BRAP-1組小鼠腫瘤組織中MLKL、RIP1、RIP3蛋白表達水平顯著升高,可見BRAP-1通過激活壞死性凋亡通路發揮抗腫瘤作用(圖6)。

從左到右分別為模型組、陽性藥組、BRAP-1低劑量組、BRAP-1中劑量組、BRAP-1高劑量組
3 結論
蕪菁酸性多糖一組分可控制H226細胞荷瘤小鼠腫瘤生長,升高脾臟指數及荷瘤小鼠血清中的白細胞介素18、白細胞介素-1β、腫瘤壞死因子α細胞因子水平,上調MLKL、RIP1、RIP3基因及其蛋白的表達。通過調控MLKL/RIP1/RIP3壞死性凋亡通路,促進腫瘤細胞發生壞死性凋亡,從而抑制癌細胞增殖發揮抗腫瘤作用。

