基于Notch1/Jagged1/RBP-Jκ/Hes1信號通路調控巨噬細胞極化探討復方雷公藤制劑改善關節炎癥的機制
趙 磊,萬 磊,劉 健,黃傳兵,賈光輝,朱子衡,胡恩欽,婁淵和
(1. 界首市人民醫院,安徽 界首 236500;2. 安徽中醫藥大學第一附屬醫院,安徽 合肥 230031;3. 新安醫學教育部重點實驗室,安徽 合肥 230038)
類風濕關節炎(rheumatoid arthritis,RA)是一種以大量炎癥細胞伴隨滑膜、軟骨組織損傷的慢性自身免疫性疾病,影響全球約1 %的人口,其特征是炎癥和血管翳形成,隨后關節和軟骨退化[1-2]。雖然治療RA的藥物很多,但效果均不是很理想,且長期用藥不良反應明顯[3]。近些年生物制劑治療RA的療效得到肯定,但患者對治療的臨床反應表現出高度的異質性[4]。中醫中藥可通過多靶點和整體調節作用控制RA病情,且能減少西藥所致的不良反應[5]。復方雷公藤制劑(新風膠囊)為新安醫家劉健教授據多年臨床經驗所創,廣泛用于治療RA及免疫相關疾病。課題組臨床研究表明,復方雷公藤制劑可能通過調控炎性細胞因子和趨化因子平衡,抑制FAK/CAPN/PI3K通路異常激活而改善RA患者體內炎癥反應及關節癥狀[6];動物實驗研究表明,復方雷公藤制劑可通過調節巨噬細胞極化改善佐劑關節炎(AA)大鼠關節炎癥[7]。但復方雷公藤制劑調控巨噬細胞極化的作用機制尚不明確,故本實驗以Notch信號通路調控巨噬細胞極化為研究突破口,并以復方雷公藤制劑調控為切入點,研究了復方雷公藤制劑調節RA巨噬細胞極化平衡的機制。
1 實驗材料與方法
1.1動物 清潔級SD雄性大鼠30只,體重(190±20)g,由安徽醫科大學實驗動物中心提供,動物合格證號:Lscxk(皖)2017-001。大鼠飼養于溫度18~22 ℃、相對濕度50%~60%的標準清潔級動物房,保持通風排氣10~20次/h。本實驗經安徽中醫藥大學第一附屬醫院實驗動物倫理委員會批準(AHUCM-rats-2021022)。
1.2藥物及試劑 復方雷公藤制劑(由雷公藤、黃芪、薏苡仁、蜈蚣配伍組成,安徽中醫藥大學第一附屬醫院制劑中心提供,皖藥制字號Z20050062,批號:191015,規格:0.34 g/粒);甲氨蝶呤(上海上藥信誼藥廠有限公司,國藥準字H22022674,批號:191213,規格:2.5 mg/片);Notch1抑制劑(上海藍木化工有限公司,貨號:S7399);弗氏完全佐劑(美國Sigma公司,貨號:MB9887);白細胞介素-1β(IL-1β)、白細胞介素-4(IL-4)、白細胞介素-10(IL-10)、白細胞介素-13(IL-13)、腫瘤壞死因子-α(TNF-α) ELISA檢測試劑盒(武漢基因美科技有限公司,貨號分別為JYM0083Hu、JYM0142Hu、JYM0155Hu、JYM0151Hu、JYM0110Hu,批號均為GR2021-10);抗鼠M1型巨噬細胞標志物(CD86-PE)、M2型巨噬細胞標志物(CD206-AF647)(美國Santa Cruz公司,貨號分別為Sc19617、S58986);山羊抗小鼠IgG、山羊抗兔IgG、β-actin(北京中杉金橋生物技術有限公司,貨號分別為ZB-2305、ZB-2305、TA-09);兔Notch1、Jagged1、Hes1抗體(英國abcam公司,貨號分別為ab52627、ab109536、ab119776);兔RBP-Jκ抗體(中國bioss公司,貨號:bs-2966R)。
1.3儀器 流式細胞儀(美國貝克曼庫爾特有限公司,型號:navios);倒置顯微鏡(日本OLYMPUS公司,型號:CKX31);離心機(上海和欣科教設備有限公司,型號:80-2);電泳儀(上海天能科技有限公司,型號:EPS300);生物組織自動脫水機、生物組織包埋機、生物組織攤烤片機(湖北亞光公司,型號分別為ZT-12M、YB-7LF、YT-7FB)。
1.4實驗方法 將30只大鼠隨機分為正常組、模型組、復方雷公藤組、甲氨蝶呤組、Notch1抑制劑組,每組6只。除正常組不造模外,其余組大鼠參考文獻[8-9]方法向右后足跖皮內注射弗氏完全佐劑(0.1 mL/只)構建佐劑關節炎模型。致炎后第19天開始,根據人與動物體表面積比值[10]計算給藥劑量,復方雷公藤組給予340 mg/L復方雷公藤制劑混懸液(將復方雷公藤制劑粉末溶于0.9%氯化鈉溶液制成)灌胃,每天1次;甲氨蝶呤組給予0.95 mg/L甲氨蝶呤混懸液(甲氨蝶呤片研成細粉后溶于0.9%氯化鈉溶液制成)灌胃,每周1次;Notch1抑制劑組給予0.56 mg/L Notch1抑制劑混懸液(將Notch1抑制劑溶于0.9%氯化鈉溶液制成)尾靜脈注射,隔天1次;正常組及模型組給予生理鹽水10 mL/kg灌胃,每天1次。各組均連續干預30 d。
1.5檢測指標及方法
1.5.1足趾腫脹度、關節炎指數 造模前1 d、干預前1 d、干預30 d后測量各組大鼠足趾容積,計算干預前1 d、干預30 d后的足跖腫脹度、關節炎指數。足跖腫脹度=(造模后足趾容積-造模前足趾容積)/造模前足趾容積。關節炎病變指數按5級評分法評價,無紅腫現象為0分,小趾關節出現紅腫為1分,趾關節和足跖出現腫脹為2分,踝關節以下的足爪發生腫脹為3分,包括踝關節在內的全部足爪發生腫脹為4分[11]。
1.5.2外周血炎癥極化標志物CD86、CD206表達情況 末次干預結束后麻醉大鼠,取腹主動脈血100 μL,按照說明書每106個細胞/管分別加入抗鼠CD86-PE、CD206-AF647各0.25 μg,渦旋混勻后避光室溫染色20 min;加入1 mL紅細胞裂解液,4 ℃靜置15 min,2 500 r/min 室溫離心10 min,棄上清;用預冷PBS 500 μL重懸細胞,2 500 r/min 室溫離心5 min,棄上清;用預冷PBS 500 μL重懸細胞,上機檢測;用 flowJoV10軟件對流式細胞圖像進行分析。
1.5.3血清炎癥因子水平 腹主動脈采血,離心取上清液,依照ELISA試劑盒說明檢測IL-1β、IL-4、IL-10、IL-13、TNF-α水平。
1.5.4關節滑膜組織中Notch1、Jagged1、RBP-Jκ、Hes1蛋白表達情況 分別采用免疫組化和免疫印跡法檢測。
1.5.4.1免疫組化檢測方法 處死各組大鼠,取右后肢關節滑膜組織,切片后放入干燥箱66 ℃烤片20~30 min;二甲苯處理,3×5 min;梯度乙醇處理(100%,95%,80%),每次3 min;將切片放入燒杯中,流水緩慢沖洗,洗去乙醇至切片干凈透明;脫水后加入Notch1(1∶50)、Jagged1(1∶350)、RBP-Jκ(1∶50)、Hes1(1∶200)一抗4 ℃孵育過夜,結合山羊抗兔二抗、DAB顯色、封片,顯微鏡觀察Notch1、Jagged1、RBP-Jκ、Hes1陽性表達情況并拍照。
1.5.4.2免疫印跡檢測方法 用蛋白提取試劑盒提取滑膜總蛋白,電泳分離,采用半干法轉膜使蛋白質從膠轉移至膜上,用室溫5%的脫脂奶粉封閉膜2 h。免疫反應:將兔Notch1、Jagged1、RBP-Jκ、Hes1抗體1∶2 000稀釋,和膜室溫下孵育2 h,采用Anti-Rabbit二抗(稀釋比例均為1∶8 000)室溫孵育1 h。采用增強化學發光法顯色并拍照。計算各組目的蛋白條帶的灰度值,以條帶與各組內參β-actin灰度值的比值作為相對表達量。
2 結 果
2.1各組大鼠足趾腫脹度比較 造模前1 d各組大鼠足容積與正常組比較差異均無統計學意義(P均>0.05);干預前1 d,各造模組大鼠足趾腫脹度均明顯高于正常組(P均<0.05),各造模組間比較差異均無統計學意義(P均>0.05);干預30 d后,模型組大鼠足趾腫脹度明顯高于正常組(P<0.05),復方雷公藤組、甲氨蝶呤組、Notch1抑制劑組大鼠足趾腫脹度均明顯低于模型組(P均<0.05);3個給藥組大鼠足趾腫脹度比較差異均無統計學意義(P均>0.05)。見表1。
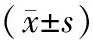
表1 正常組和佐劑關節炎各組大鼠足趾腫脹度比較
2.2各組大鼠關節炎指數比較 干預前1 d,各造模組大鼠關節炎指數均明顯高于正常組(P均<0.05),各造模組間比較差異均無統計學意義(P均>0.05);干預30 d后,模型組大鼠關節炎指數明顯高于正常組(P<0.05),復方雷公藤組、甲氨蝶呤組大鼠關節炎指數均明顯低于模型組(P均<0.05),Notch1抑制劑組大鼠關節炎指數與模型組比較差異無統計學意義(P>0.05);3個給藥組大鼠關節炎指數比較差異均無統計學意義(P均>0.05)。見表2。
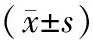
表2 正常組和佐劑關節炎各組大鼠關節炎指數比較
2.3各組大鼠血清炎癥因子水平比較 與正常組比較,模型組大鼠血清IL-1β、TNF-α水平均明顯升高(P均<0.05),血清IL-4、IL-10、IL-13水平均明顯降低(P均<0.05);與模型組比較,復方雷公藤組、甲氨蝶呤組、Notch1抑制劑組血清IL-1β、TNF-α水平均明顯降低(P均<0.05),血清IL-4、IL-10、IL-13水平均明顯升高(P均<0.05);復方雷公藤組血清IL-1β、TNF-α水平均明顯低于甲氨蝶呤組和Notch1 抑制劑組(P均<0.05),血清IL-4、IL-10、IL-13水平均明顯高于甲氨蝶呤組(P均<0.05)。見表3。

表3 正常組和佐劑關節炎各組大鼠血清炎癥因子水平比較
2.4各組大鼠外周血炎癥極化標志物CD86、CD206表達情況比較 與正常組比較,模型組大鼠外周血CD86表達占比明顯升高(P<0.05),CD206表達占比明顯降低(P<0.05);與模型組比較,復方雷公藤組、甲氨蝶呤組、Notch1抑制劑組大鼠外周血CD86表達占比均明顯降低(P均<0.05),CD206表達占比均明顯升高(P均<0.05);復方雷公藤組大鼠外周血CD86表達占比均明顯低于甲氨蝶呤組、Notch1抑制劑組(P均<0.05),CD206表達占比均明顯高于甲氨蝶呤組、Notch1抑制劑組(P均<0.05)。見表4。
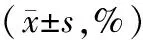
表4 正常組和佐劑關節炎各組大鼠外周血炎癥極化標志物CD86、CD206表達占比比較
2.5各組大鼠關節滑膜組織中Notch1、Jadded1、RBP-Jκ、Hes1蛋白表達情況比較 模型組Notch1、Jadded1、RBP-Jκ、Hes1蛋白相對表達量均明顯高于正常組(P均<0.05);復方雷公藤組、甲氨蝶呤組、Notch1抑制劑組Notch1、Jadded1、RBP-Jκ、Hes1蛋白相對表達量均明顯低于模型組(P均<0.05);復方雷公藤組Notch1、Jadded1、RBP-Jκ、Hes1蛋白相對表達量均明顯低于甲氨蝶呤組(P均<0.05),且Jadded1、RBP-Jκ、Hes1蛋白相對表達量均明顯低于Notch1抑制劑組(P均<0.05)。見圖1、圖2及表5。

圖1 正常組和佐劑關節炎各組大鼠關節滑膜組織中Notch1、Jagged1、RBP-Jκ、Hes1蛋白陽性表達情況(免疫組化染色,×200)

圖2 正常組和佐劑關節炎各組大鼠關節滑膜組織中Notch1、Jagged1、RBP-Jκ、Hes1蛋白表達條帶

表5 正常組和佐劑關節炎各組大鼠關節滑膜組織中Notch1、Jagged1、RBP-Jκ、Hes1蛋白相對表達量比較
3 討 論
RA是一種慢性進展性免疫炎癥性疾病,會導致關節軟骨退化和骨侵蝕,目前治療方案主要是抑制炎癥、延緩疾病進展。中醫認為RA多存在“脾虛濕盛、痰瘀膠著”的特點[12]。復方雷公藤制劑即根據該病機特點而創制,方中雷公藤有祛風除濕、通絡鎮痛之功,現代研究表明雷公藤具有抗炎、免疫抑制作用[13];薏苡仁健脾利濕、舒筋除痹,薏苡仁提取物能通過抑制促炎因子表達和減輕氧化應激反應發揮抗RA的作用[14];黃芪益氣養血固表,其有效成分黃芪多糖具有免疫調節作用[15];蜈蚣祛風止痙、通絡止痛,其有效成分蜈蚣多肽具有明顯抗炎鎮痛作用[16]。諸藥合用,共奏健脾化濕、通絡止痛之功,且能制約雷公藤的毒性。
巨噬細胞極化參與RA炎癥反應,其可大量分泌促炎性細胞因子,激活成纖維細胞和破骨細胞,加速機體炎癥反應,造成關節破壞[17-19]。Notch信號通路協調許多細胞過程,可調節免疫細胞,促進巨噬細胞極化參與炎癥反應[20-21]。有研究表明, Notch1可以促進TNF-α誘導的RA滑膜細胞的增殖和炎癥因子的分泌,從而延遲巨噬細胞的凋亡,促進機體炎癥的發生和擴散;同時研究發現Jagged1在滑膜增生性病變的滑膜襯里和亞襯里細胞中過度表達[22-23]。當Notch1受體和Jagged1配體相互接觸結合后,其跨膜細胞內段在分泌蛋白酶(如解聚素及金屬蛋白酶和γ-分泌蛋白酶)的作用下裂解入核,結合下游信號蛋白形成轉錄復合物,與轉錄因子RBP-Jκ結合,從而影響靶基因Hes1的表達,致巨噬細胞向M1型極化,誘導IL-1、IL-13、TNF-α炎癥細胞因子浸潤,參與RA炎癥反應[24-25]。另外Choi等[26]研究表明,Notch1信號通路可通過抑制調節性T細胞群的數量,促進TNF-α的產生,從而促進關節炎癥的發展。因此,RA的發生發展及其關節炎癥反應可能與Notch通路及其巨噬細胞極化有關。
本研究中模型組外周血CD86表達量及血清IL-1β、TNF-α水平和關節滑膜組織中Notch1、Jagged1、RBP-Jκ、Hes1蛋白相對表達量均明顯升高,外周血CD206表達量及血清IL-4、IL-10、IL-13水平均明顯降低,說明AA大鼠體內Notch1/Jagged1/RBP-Jκ/Hes1信號通路被異常激活,且該信號通路與巨噬細胞炎癥極化之間存在相關性,巨噬細胞極化促進了巨噬細胞向M1型巨噬細胞的極化,從而引起炎癥細胞因子的大量分泌,促進AA大鼠體內炎癥免疫反應,造成關節、軟骨等的損傷。復方雷公藤組外周血CD86表達量及血清IL-1β、TNF-α水平和關節滑膜組織中Notch1、Jagged1、RBP-Jκ、Hes1蛋白相對表達量均明顯降低,外周血CD206表達量及血清IL-4、IL-10、IL-13水平均明顯升高,且復方雷公藤的作用與Notch1抑制劑的作用不相上下,說明復方雷公藤制劑具有Notch1抑制劑樣作用,可通過抑制Notch1/Jagged1/RBP-Jκ/Hes1信號通路的異常激活,抑制巨噬細胞炎癥極化,減輕炎癥免疫反應損傷。
綜上所述,復方雷公藤制劑能調節Notch1/Jagged1/RBP-Jκ/Hes1信號通路調控巨噬細胞炎癥極化,調節炎癥免疫反應,從而抑制炎癥因子對關節、軟骨等的刺激和破壞。
利益沖突:所有作者均聲明不存在利益沖突。

