血栓心脈寧片通過調控TGF-β1和Runx2表達抑制血管平滑肌細胞鈣化的研究
張 晶,鄧毅凡,張釗源,劉 娟,朱米雪,余吉玲,何勝虎,周 瑋
(1. 揚州大學臨床醫學院/江蘇省蘇北人民醫院,江蘇 揚州 225001;2. 大連醫科大學揚州臨床醫學院,江蘇 揚州 225001;3. 揚州大學附屬醫院,江蘇 揚州 225001)
冠狀動脈疾病是全球范圍內致死和致殘的主要原因之一,冠狀動脈鈣化是一類嚴重的冠狀動脈疾病,其改變了冠狀動脈機械性質,增加斑塊和血管破裂的風險,造成血栓形成、外周血管堵塞及心肌缺血甚至梗死等臨床不良事件的發生[1]。冠狀動脈鈣化形成過程包括血管平滑肌細胞的異常增殖及其轉化為成骨特性的細胞表型[2]。轉化生長因子β1(TGF-β1)作為轉化生長因子家族主要成員之一,可以通過調節成纖維細胞及損傷血管的血管平滑肌細胞增生,促進血管重構,導致新生血管內膜增生等一系列病理過程。Runt相關轉錄因子2(Runx2)屬于Runt家族成員,對成骨細胞分化和軟骨細胞成熟至關重要,并參與了血管平滑肌細胞的鈣化過程[3]。血栓心脈寧片是基于《黃帝內經》的氣血理論辨證組方而成,可擴張血管、溶解血栓、改善血液循環[4]。網絡藥理學分析發現血栓心脈寧片抗動脈粥樣硬化的潛在治療靶標基因有2 201個,有78條通路顯著富集,其中對TGF-β1通路作用明顯[5]。β-磷酸甘油(β-GP)是一種堿性磷酸酶的作用底物,分解后能產生超生理劑量無機磷酸鹽導致細胞內鈣沉積,繼而誘導平滑肌細胞鈣化,是目前鈣化模型構建的最常用試劑[6]。本研究以β-GP誘導大鼠血管平滑肌細胞構建細胞鈣化模型,探討了血栓心脈寧片是否可通過調控TGF-β1和Runx2表達抑制血管平滑肌細胞鈣化,以進一步明確其作用機制。
1 實驗材料與方法
1.1細胞及藥物 大鼠血管平滑肌細胞由南京醫科大學病理生理學系惠贈;血栓心脈寧片(吉林華康藥業股份有限公司,國藥準字Z20030145)。
1.2主要試劑 胎牛血清、DMEM培養基購自美國 Hyclone 公司,CCK-8細胞活力檢測試劑盒購自日本銅仁有限公司,堿性磷酸酶(ALP)活性檢測試劑盒、鈣含量檢測試劑盒均購自南京建成生物公司,TGF-β1ELISA試劑盒購自武漢華美生物工程有限公司,GAPDH購自美國Sigma Aldrich公司,聚偏二氟乙烯(PVDF)膜購自美國Merck Millipore 公司,ECL顯影試劑盒購自美國Thermo Scientific公司,Runx2購自美國CST 公司,β-GP、RIPA 蛋白裂解液、BCA 蛋白定量試劑盒購自北京索萊寶公司。
1.3主要儀器 Tecan M2000多功能酶標儀購自美國Tecan公司,ChemiDoc XRS化學發光成像分析系統購自美國Bio-Rad公司。
1.4細胞培養和實驗分組 取大鼠血管平滑肌細胞,使用完全培養基于37 ℃、含5%二氧化碳的細胞培養箱中常規培養。采用0.25%胰酶消化傳代,取10代以內生長狀態良好的對數期細胞進行實驗。實驗分為5組:陰性組僅加入DMEM培養液培養;鈣化組加入終濃度為10 μmol/L的β-GP作用24 h誘導血管平滑肌細胞鈣化;血栓心脈寧低、中、高劑量組先分別加入125 mg/L、250 mg/L、500 mg/L的血栓心脈寧片培養24 h后再給予終濃度為10 μmol/L的β-GP作用24 h。
1.5檢測指標及方法
1.5.1細胞活力 取上述各組細胞,1×105個/孔接種于96孔板中,繼續培養48 h后,每孔加入100 μL培養基和10 μL的CCK-8試劑,避光孵育2 h,酶標儀上檢測450 nm波長時待測樣品OD值,計算每組3個復孔的平均值。
1.5.2細胞中鈣含量 取上述各組細胞,2×106個/孔接種到6孔板中,用PBS清洗細胞3次,加入1 mL 0.6 mol/L HCl,置于4 ℃進行細胞脫鈣,24 h后收集細胞上清液作為待測樣品。按照說明書配制鈣標準液和鈣測定工作液,向250 μL鈣測定工作液中依次加入10 μL待測樣品、10 μL鈣標準液和10 μL去離子水,充分混勻后靜置10 min,轉移至96孔板中,通過酶標儀測定610 nm波長時待測樣品OD值,計算細胞中鈣含量。
1.5.3細胞中ALP活性 取上述各組細胞,2×106個/孔接種于6孔板中,待細胞生長狀態良好時棄去培養基,用PBS清洗細胞培養板3次。向待測細胞中加入200 μL細胞裂解液(0.1 mol/L NaOH+0.1% SDS),4 ℃孵育30 min,使細胞充分裂解。收集細胞裂解產物,12 000 r/min離心5 min,收集細胞上清液。向96孔板的孔中分別加入30 μL滅菌超純水(陰性組)、30 μL酚標準液(標準組)和30 μL待測細胞上清液(待測組)。向各組孔中依次加入50 μL緩沖液和50 μL基質液,37 ℃孵育20 min后加入150 μL顯色劑,充分混勻。使用酶標儀檢測波長520 nm時待測樣品OD值;并測定細胞總蛋白含量。ALP計算公式:(待測組OD值-陰性組OD值)/(標準組OD值-空白組OD值)×0.02 mg/mL(酚標準品濃度)/待測樣品(細胞)蛋白濃度。
1.5.4細胞中TGF-β1含量 嚴格按照標準操作,分別設標準品孔和待測樣本孔。每孔分別加入100 μL標準品或待測樣品,混勻后37 ℃孵育2 h。充分棄去液體,不洗滌,每孔加入100 μL生物素標記抗體工作液,37 ℃孵育1 h。棄去孔內液體,甩干,每孔加入200 μL洗滌工作液,浸泡2 min,甩干,重復3次。每孔加100 μL辣根過氧化氫酶標記親和素工作液,37 ℃下孵育1 h。棄去孔內液體,甩干,每孔加入200 μL洗滌工作液,浸泡2 min,甩干,重復5次。按照順序每孔加顯色液90 μL,37 ℃下避光孵育30 min后,加入終止液50 μL終止反應。酶標儀上檢測波長450 nm時待測樣品OD值。
1.5.5細胞中Runx2蛋白表達情況 采用Western blot法檢測:取上述各組細胞,嚴格按照RIPA蛋白提取試劑盒說明書操作,每孔加入蛋白裂解液,冰上充分裂解10 min后,4 ℃下12 000×g離心10 min,吸取上清,采用BCA蛋白定量試劑盒檢測各目的蛋白濃度。將蛋白樣本與5×蛋白上樣緩沖液混勻,100 ℃煮沸10 min使蛋白充分變性,置于-20 ℃冰箱中保存。每孔總蛋白上樣量為30 μg,使用10%聚丙烯酰胺凝膠電泳,蛋白電轉至PVDF膜,5%脫脂奶粉封閉2 h。分別加入Runx2抗體(1∶1 000)和GAPDH抗體(1∶1 000)于4 ℃孵育過夜,次日用含0.1%吐溫-20的PBS(PBST)溶液洗膜3次,對應的HRP標記二抗室溫孵育1 h,PBST溶液洗膜3次后經ChemiDocXRS化學發光成像分析系統檢測各條帶灰度值,以GAPDH作為內參蛋白,各目的蛋白與內參蛋白灰度值比值即為目的蛋白相對表達量。
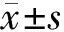
2 結 果
2.1各組細胞增殖活性OD值比較 鈣化組OD值為0.417±0.034,明顯低于陰性組的0.882±0.039(P<0.05);血栓心脈寧低、中、高劑量組OD值分別為0.529±0.031,0.648±0.039,0.752±0.044,均明顯高于鈣化組(P均<0.05),且OD值呈濃度依賴性升高,兩兩比較差異均有統計學意義(P均<0.05)。
2.2各組細胞中鈣含量、ALP活性及TGF-β1含量比較 鈣化組細胞中鈣含量、ALP活性及TGF-β1含量均明顯高于陰性組(P均<0.05);血栓心脈寧各組細胞中鈣含量、ALP活性及TGF-β1含量均明顯低于鈣化組(P均<0.05),且鈣含量、ALP活性及TGF-β1含量呈濃度依賴性降低,兩兩比較差異均有統計學意義(P均<0.05)。見表1。
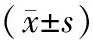
表1 各組血管平滑肌細胞中鈣含量、ALP活性及TGF-β1含量比較
2.3各組細胞中Runx2蛋白表達情況比較 鈣化組細胞中Runx2蛋白相對表達量明顯高于陰性組(P<0.05);血栓心脈寧各組細胞中Runx2蛋白相對表達量均明顯低于鈣化組(P均<0.05),且呈濃度依賴性降低,兩兩比較差異均有統計學意義(P均<0.05)。 見圖1。

圖1 各組血管平滑肌細胞中Runx2蛋白表達情況
3 討 論
冠狀動脈鈣化主要是由平滑肌細胞、巨噬細胞等炎癥介質共同參與的一種病變,大多數鈣化出現在粥樣硬化的壞死核心,凋亡的巨噬細胞和平滑肌細胞釋放細胞外囊泡,而這些囊泡為鈣化形成提供了支撐作用。當局部鈣和磷酸鹽濃度異常升高時,自噬體可通過類似于骨/軟骨形成轉化的活性過程形成鈣化組織,因此冠狀動脈鈣化多見于鈣磷代謝異常的腎臟疾病患者[7]。Jia等[8]大樣本量統計顯示,中重度冠脈鈣化患者的5年內主要心血管不良事件發生率較輕度/無鈣化患者高(20.7%比17.9%),其中血運重建發生率為15.2%。因此,防治冠狀動脈鈣化是目前預防心血管不良事件發生的研究熱點。
除了上述機制,冠狀動脈平滑肌細胞成骨樣轉化同樣是鈣化病變進展的重要機制。在此過程中,平滑肌細胞能夠從收縮表型轉化為合成型,最終丟失平滑肌細胞標記基因形成擁有成骨樣標記基因的細胞[9]。Runx2作為一種重要的成骨轉錄控制因子,是人體骨骼系統發育、成骨的重要調節因素,但是在一些異常因素影響下,其功能可超出成骨轉錄的作用[10]。如Balderman等[11]研究發現,經100 ng/mL骨形態發生蛋白2(BMP-2)處理的人冠狀動脈平滑肌細胞在24 h內 Runx2蛋白表達增加了1.7倍,在此過程中BMP-2下調miR-30b和miR-30c以增加平滑肌細胞中的Runx2表達,并促進了冠狀動脈的鈣化;Cobb等[12]研究報道,一些遺傳性的損傷可以誘導Runx2表達積累及其成骨靶基因的激活,導致鈣化增強,抑制DNA損傷信號則可減弱這種反應。由此可見,Runx2在平滑肌細胞成骨樣轉化中發揮了重要作用,但是在血管損傷部位沒有鈣化的情況下,Runx2會暫時上調,而Runx2在體內血管平滑肌細胞中的靶向過表達不足以導致鈣化,表明需要額外的因素或修飾來激活其成骨能力,而大量的研究證實TGF-β1是其有效的上游調控因素。
TGF-β1是一種多功能細胞因子,可以調節廣泛的生物過程,包括細胞增殖、遷移、分化、凋亡和細胞外基質沉積。在TGF-β1/Smad、ERK/MAPKs等通路影響下,平滑肌細胞表型能夠發生改變并向成骨樣細胞轉化。如Arumugam等[13]研究發現,TGF-β1刺激Runx2在絲氨酸氨基酸處的磷酸化,加速了大鼠細胞成骨樣的變化,當用ERK抑制劑預處理細胞時,TGF-β1介導的MMP-13mRNA表達減少;熒光素酶報告基因測定確定TGF-β1僅在存在野生Runx2構建體的情況下刺激這些細胞中的MMP-13啟動子活性。Convento等[14]報道,TGF-β1可誘導收縮型平滑肌細胞轉化為成骨樣平滑肌細胞,加速平滑肌細胞鈣化,這個過程中Runx2同樣出現了過表達的情況。本研究發現鈣化的大鼠平滑肌細胞中TGF-β1和Runx2均高表達,與上述研究結果相似。
目前缺乏改善甚至逆轉冠狀動脈鈣化病變的特效藥物,主要采用冠狀動脈旋磨術、切割球囊等介入術去除鈣化組織,但是手術存在損傷冠狀動脈組織等風險。中醫藥是祖國傳統醫學的瑰寶,中醫認為冠狀動脈鈣化屬于“胸痹”范疇,單一證候主要包括血瘀證、寒凝證、氣滯證、痰濁證、氣虛證,復合證候常見的為心血瘀阻證、痰濁內阻證和心氣虛弱證,其中重度鈣化多為血瘀證和寒凝證,復合證候以心血瘀阻證較為常見[15-16]。治療以扶正祛邪為主。血栓心脈寧片是基于血脈雙治的中醫理論,根據現代技術將川芎、丹參、毛冬青、水蛭、槐花、麝香、冰片等10味中藥精華濃縮研制而成。其中丹參、川芎為君藥,二者均歸心經,具有益氣活血、通經止痛之效,能擴張血管,改善微循環,調理血脈兼治血管;毛冬青、麝香、水蛭等為臣藥,冰片、牛黃、蟾酥等為佐使,益氣活血配以開竅醒神、活血通經、軟堅散結。全方血脈雙治、雙心共調,體現出中醫藥全方位、多靶點的治療優勢。張曉天等[17]的研究發現,血栓心脈寧片對于氧化損傷內皮細胞有一定的保護作用,并具有藥物濃度相關性。本實驗結果顯示,血栓心脈寧片可濃度依賴性抑制鈣化血管平滑肌細胞中TGF-β1和Runx2的表達,增強細胞活力,降低細胞內鈣含量和ALP活性。
綜上所述,血栓心脈寧片對鈣化大鼠血管平滑肌細胞具有一定的抑制作用,其機制可能與調控TGF-β1和Runx2的表達有關,為冠狀動脈鈣化的防治提供了新思路,值得進一步研究。
利益沖突:所有作者均聲明不存在利益沖突。

