基于豬流行性腹瀉病毒GⅡb亞型重組熒光病毒中和抗體檢測方法的建立
林莉莉,張夢迪,朱琳琳,馬海龍,孫 琪,何啟蓋,張夢佳*,李文濤,4*
(1.華中農業大學動物醫學院,武漢 430070;2.農業微生物資源發掘與利用全國重點實驗室,武漢 430070;3.農業農村部獸用診斷制劑創制重點實驗室,武漢 430070;4.湖北洪山實驗室,武漢 430070)
豬流行性腹瀉(porcine epidemic diarrhea, PED)是由豬流行性腹瀉病毒(porcine epidemic diarrhea virus, PEDV)引起的一種急性、高度接觸性的腸道傳染病,導致感染仔豬發生嚴重腹瀉而死亡,造成了嚴重的經濟損失。PEDV是直徑為95~190 nm,具有“花冠樣”形態的單股正鏈RNA病毒[1],其基因組大小約28 kb,屬于α冠狀病毒屬[2]。PEDV有7個開放閱讀框[3]:ORF1a、ORF1b和ORF2~6[4]。ORF1a和ORF1b基因編碼非結構蛋白,ORF2和ORF4~6基因編碼4種結構蛋白:刺突(S)蛋白、包膜(E)蛋白、膜(M)蛋白和核衣殼(N)蛋白,ORF3基因編碼輔助蛋白ORF3[2]。
目前,疫苗免疫是PED防控的有效手段,但近幾年PED再次出現了暴發流行的趨勢,其主要原因是疫苗和實際流行株之間的抗原性、遺傳和系統發育(GⅠvsGⅡ)差異較大,致使PEDV現有疫苗免疫保護效力降低[5-6]。因此,開發一款針對現流行PEDV臨床毒株的有效疫苗至關重要[7]。反向遺傳技術(reverse genetics, RG)能快速拯救已知基因序列的病毒,是一種獲取病毒的有效工具。隨著分子工具和基因組測序的發展,反向遺傳學在20世紀70年代末得以發展,特別是隨著一些先進的技術、特殊的載體和策略的出現[8],冠狀病毒反向遺傳學系統也已成功建立[9]。此外,利用反向遺傳技術可構建工具病毒,如將熒光蛋白或熒光素酶基因插入病毒,并隨著病毒復制穩定表達,為相關研究提供有力工具。
PEDV有多種血清學檢測方法,包括酶聯免疫吸附試驗(ELISA)、熒光微球免疫分析法、間接免疫熒光試驗(indirect immunofluorescence assay, IFA)、病毒中和試驗(virus neutralization test, VNT)和免疫層析檢測方法。ELISA為最常見的血清學檢測方法,主要用于血清、牛奶、初乳、口腔液和肉汁等多種樣品的抗體檢測。PEDV的ELISA檢測方法中,抗原主要使用S、M、N和E四種結構蛋白。S蛋白含有多個能夠誘導機體產生中和抗體的中和表位,其中大多數位于S1區,因此S1蛋白可取代全長S蛋白作為抗原[10-11]。此外,相較于全病毒蛋白抗原[12]和原核表達的蛋白抗原[13],真核表達系統表達的蛋白抗原具有更好的敏感性和特異性[14]。VNT是檢測PEDV特異性中和抗體應用最廣泛的血清學檢驗方法。目前常見的測定方式為細胞病變效應(CPE)測定[15]和熒光焦點中和試驗(fluorescent focus neutralization assay, FFN)[16-17],但二者均在依賴胰酶感染的Vero細胞進行,故均存在血清蛋白成分對胰酶活性的干擾現象,致使試驗操作復雜和結果不穩定。
本研究基于當前流行的GⅡb毒株建立了PEDV的反向遺傳操作系統,成功拯救出攜帶EGFP基因的重組工具病毒。利用熒光工具病毒篩選到一株Huh7.10亞克隆細胞,可有效支持PEDV在無外源添加胰酶條件下有效感染和復制。最終利用熒光工具病毒與Huh7.10細胞系建立了穩定可靠的中和抗體檢測方法,為疫苗免疫效果的評估和精準防控提供了技術支持手段。
1 材料與方法
1.1 細胞、病毒和菌株
細胞:Vero-CCL81細胞、Huh7細胞、ST細胞、293 T細胞、穩定表達鼠肝炎病毒MHV-A59受體Ceacam1a的細胞系Vero-CCM1a由本實驗室制備并保存。
毒株:PEDV-GDU毒株(GenBank登錄號KU985230)由本實驗室分離、保存;重組病毒mPEDV由本實驗室制備并保存。
菌株:質粒構建所用的感受態大腸桿菌DH10β由本實驗室制備及保存。靶向PEDV-S1蛋白不同表位具有中和活性的單克隆抗體PEDV-Ab1/2/3由本實驗室制備及保存。
1.2 質粒與主要試劑
pUC57克隆載體和攜帶EGFP基因的pEGFP-N1質粒由本實驗室保存。體外轉錄試劑盒購自Thermo Fisher Scientific公司;37%多聚甲醛及Triton-X100均為Sigma公司產品;PVDF膜購自Millipore公司;增強型Western化學發光檢測試劑Super Signal West Pico Luminal Kit為Pierce公司產品;HRP標記的羊抗豬IgG二抗(ANT085)購自武漢安特捷生物技術有限公司(AntGene)。
1.3 攜帶EGFP重組PEDV-GDU病毒的構建、拯救與鑒定
1.3.1 感染性克隆質粒pUC57-PEDV-GDU-dORF3-EGFP的構建 利用ORF1b-BglⅡ-F和3′UTR-PacⅠ-R(表1)引物對擴增PEDV-GDU毒株的ORF1b-3′UTR基因片段,通過限制性核酸內切酶BglⅡ和PacⅠ將ORF1b-3′UTR基因片段與pUC57載體質粒進行在37 ℃酶切3 h,獲得目的基因和載體片段,再使用T4 DNA Ligase 25 ℃連接1 h,獲取中間質粒1(pUC57-PEDV-GDU-ORF1b-3′UTR)。利用5′UTR-BamHⅠ-F和ORF1a-BglⅡ-R(表1)引物對擴增5′UTR-ORF1a基因片段,使用BamHⅠ和BglⅡ將5′UTR-ORF1a基因片段克隆至中間質粒1獲得中間質粒2(pUC57-PEDV-GDU-5′UTR-3′UTR)。以pEGFP-N1為模板,擴增EGFP基因片段,以中間質粒2為模板,擴增載體片段;使用2×MultiF Seamless Assembly Mix將線性化載體與EGFP進行50 ℃連接15 min,連接產物轉化DH10β感受態細胞,最終得到感染性克隆質粒pUC57-PEDV-GDU-dORF3-EGFP(圖1)。
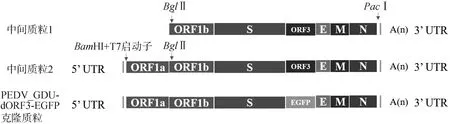
圖1 攜帶EGFP標簽重組PEDV-GDU病毒穿梭質粒的構建策略Fig.1 Schematic representation of the construction of shuttle plasmid carrying PEDV-GDU genome with EGFP gene
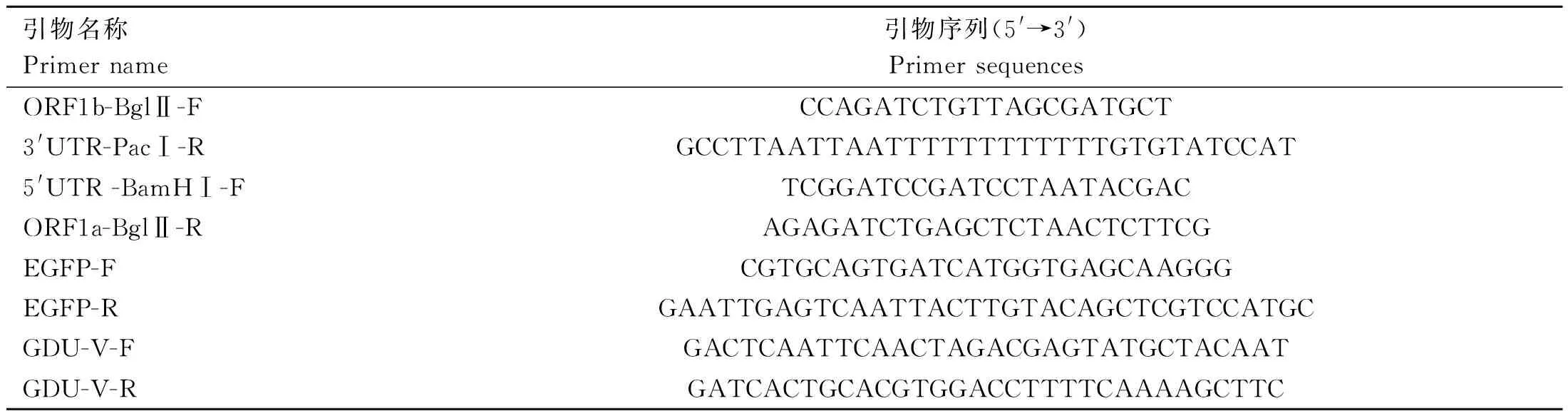
表1 引物序列表Table 1 Primers information
1.3.2 重組熒光病毒rPEDV-GDU-dORF3-EGFP的拯救 根據文獻[18]描述方法進行重組熒光病毒rPEDV-GDU-dORF3-EGFP拯救。將pUC57-PEDV-GDU-dORF3-EGFP克隆質粒用SmaⅠ進行單酶切獲得線性化質粒,隨后使用Ambion mMesseage mMachine T7 kit試劑盒進行體外轉錄獲取轉錄本。將mPEDV感染Vero-CCM1a細胞,在感染4 h后通過胰酶消化獲取細胞懸液,隨后通過電轉將轉錄本電轉(450 V,50 μF)至mPEDV孵育感染4 h的Vero-CCM1a細胞懸液中,隨后迅速將細胞懸液鋪到長滿單層的Vero-CCL81細胞上,置于37 ℃培養4 h后洗滌細胞,然后加入含有10 μg·mL-1胰蛋白酶的細胞培養基,觀察細胞病變情況和熒光表達情況,并通過噬斑純化得到重組熒光病毒rPEDV-GDU-dORF3-EGFP。
1.3.3 重組熒光病毒rPEDV-GDU-dORF3-EGFP的鑒定 在24孔板中接種Vero-CCL81細胞,當細胞融合度達到100%,用PBS洗板2次,將0.1 MOI的rPEDV-GDU-dORF3-EGFP與PEDV-GDU感染細胞,在感染36 h后,使用倒置熒光顯微鏡觀察細胞病變及綠色熒光。在觀察到典型PEDV細胞病變及綠色熒光之后,收取細胞樣品進行間接免疫熒光試驗。4%多聚甲醛室溫固定15 min,Triton-x100室溫透化15 min;含3% BSA的PBS于37 ℃封閉2 h;加入2 μg·mL-1抗PEDV-S1蛋白的單克隆抗體,37 ℃孵育1 h;加入稀釋比為1∶400的Alexa-594標記的羊抗人IgG二抗,37 ℃孵育45 min;加入適量 DAPI室溫避光染色8 min;在倒置熒光顯微鏡下觀察熒光并拍照記錄。
1.4 不同代次重組熒光病毒穩定性觀察與半數細胞培養物感染量(TCID50)測定
接種Vero-CCL81細胞于96孔板中,待細胞鋪滿至單層時,將不同代次(P5、P10、P15、P20、P30、P40)的rPEDV-GDU-dORF3-EGFP用病毒維持液進行稀釋度為10-1~10-9的倍比稀釋,再將各個稀釋度的病毒液加入96孔板,100 μL·孔-1,每組8個重復,并設置空白細胞對照,于37 ℃ 5% CO2細胞培養箱培養。12 h后觀察10-1稀釋度下不同代次重組熒光病毒的綠色熒光信號;36~48 h后觀察并記錄每個梯度綠色熒光的陽性孔數。試驗重復三次,按Reed-Muench兩氏法計算TCID50。
1.5 重組熒光病毒與親本毒株生物學特性
IFA:接種 Vero-CCL81細胞于24孔板中,以MOI=0.1分別感染rPEDV-GDU-dORF3-EGFP與PEDV-GDU,并設置空白對照,37 ℃ 5% CO2細胞培養箱培養24 h后收取細胞樣品進行間接免疫熒光試驗,具體步驟參照“1.3.3”,通過倒置熒光顯微鏡觀察并記錄rPEDV-GDU-dORF3-EGFP與PEDV-GDU在Vero-CCL81細胞上產生的細胞病變與S蛋白的表達情況。
蛋白質免疫印跡(WB):接種 Vero-CCL81細胞于6孔板中,以MOI=0.1分別感染rPEDV-GDU-dORF3-EGFP與PEDV-GDU,在感染后24 h使用含1%蛋白酶抑制劑的RIPA裂解液裂解細胞收取細胞樣品,加入SDS Buffer 95 ℃孵育10 min,隨后將樣品經SDS-PAGE電泳分離蛋白,并轉印至PVDF 膜,5%脫脂牛奶室溫孵育2 h,PEDV-S1單克隆抗體室溫孵育1 h,二抗anti-human-IgG-HRP室溫孵育50 min后化學發光顯色檢測分析二者S蛋白的表達量差異。
一步生長曲線:將 Vero-CCL81 細胞接種12孔板,按照病毒感染數MOI為0.1分別感染rPEDV-GDU-dORF3-EGFP與PEDV-GDU,37 ℃孵育2 h后,PBS 洗滌 2 次,加入病毒維持液繼續培養。分別于第6、12、18、24、30、36、42和48小時收取細胞樣品,保存于-80 ℃,反復凍融三次后,測定各個時間點的TCID50,用GraphPad Prism 8繪制病毒的生長曲線。
1.6 重組熒光病毒的細胞嗜性試驗及細胞亞克隆
在24孔板中分別接種Vero-CCL81、293T、ST、Huh7細胞,當細胞融合度達到100%時,按照每孔0.01 MOI分別在不含胰酶和含有胰酶的條件下感染重組熒光病毒,感染24 h后,用倒置熒光顯微鏡進行觀察和拍照記錄。將感染比例最多的細胞消化進行細胞計數后,按照1個細胞·孔-1的密度稀釋接種至96 孔板培養,待細胞長滿孔后擴大培養,通過rPEDV-GDU-dORF3-EGFP感染試驗篩選最好的一株細胞克隆進行后續試驗。
1.7 基于Huh7.10細胞和重組熒光病毒的中和試驗的初步建立與評估
1.7.1 基于Huh7.10細胞和重組熒光病毒的中和試驗的初步建立 將Huh7.10細胞與Vero-CCL81細胞接種 96 孔板中,待生長至100%融合后進行中和試驗。用病毒維持液(Huh7.10,DMEM;Vero-CCL81,含15 μg·mL-1胰酶的DMEM)將PEDV-Ab1/2/3按照連續2倍倍比稀釋至256倍,隨后與200 TCID50重組熒光病毒混合,37 ℃孵育1 h后接種細胞,37 ℃吸附2 h,37 ℃、5%CO2培養箱培養48~72 h,觀察病毒綠色熒光蛋白的表達,根據綠色熒光蛋白的表達情況計算中和抗體效價。同時設病毒對照和正常細胞對照,病毒對照設置200 TCID50、20 TCID50、2 TCID50、0.2 TCID504個不同濃度。每份單克隆抗體重復3孔。其中Vero-CCL81細胞需PBS洗滌細胞2次后,再加入病毒維持液。
1.7.2 臨床豬源血清的收集、間接ELISA檢測及中和抗體的檢測評估 將臨床豬源血清56 ℃滅活30 min,過濾除菌。在包被板中加入100 μL·孔-1的0.1 μg·mL-1的PEDV-S1真核蛋白,室溫孵育4 h;加入100 μL·孔-1的10%脫脂奶,4 ℃封閉過夜;加入100 μL·孔-1的滅活血清(1∶200稀釋),25 ℃孵育1 h;按照100 μL·孔-1加入羊抗豬IgG-HRP抗體(1∶12 000稀釋),37 ℃孵育45 min;50 μL·孔-1酶和50 μL·孔-1加入底物,避光反應10 min后加入終止液,通過酶標儀測定樣品的OD630 nm值。同時,利用所初步建立的方法對滅活血清進行中和抗體檢測。根據綠色熒光蛋白的表達情況計算中和效價,最終比對在Huh7.10細胞和Vero-CCL81細胞的中和試驗結果。
1.7.3 間接ELISA與病毒中和試驗的相關性 各豬源血清的中和效價與其相應的ELISAP/N值,利用 Graphad prism 8.0 軟件開展相關性分析,對在Huh7.10細胞上的中和試驗進行評估。
2 結 果
2.1 攜帶EGFP重組PEDV-GDU病毒的拯救與鑒定
將克隆質粒pUC57-PEDV-GDU-dORF3-EGFP的轉錄本電轉至感染mPEDV的Vero-CCM1a細胞中,在電轉后36 h,觀察到Vero-CCL81細胞出現典型的合胞體病變,與PEDV-GDU毒株產生的細胞病變相似,且在熒光顯微鏡下能觀察到特異性的綠色熒光信號(圖2),初步證明成功拯救該病毒,收獲上清為P1代,命名為rPEDV-GDU-dORF3-EGFP。
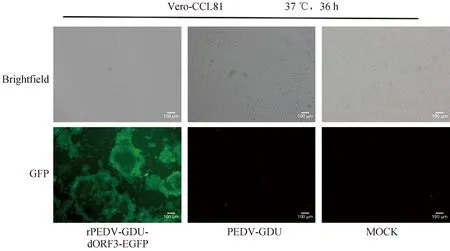
圖2 拯救病毒感染Vero-CCL81細胞產生的細胞病變及熒光觀察(標尺=100 μm)Fig.2 Observation of the CPE and fluorescence of Vero-CCL81 cells infected with rescued virus (bar=100 μm)
為了進一步鑒定拯救的重組病毒,將重組熒光病毒及親本病毒感染Vero-CCL81細胞后,利用PEDV-GDU-S1單克隆抗體進行IFA。結果如圖3所示,在rPEDV-GDU-dORF3-EGFP感染的細胞中EGFP及Spike蛋白均正常表達,說明成功拯救rPEDV-GDU-dORF3-EGFP。
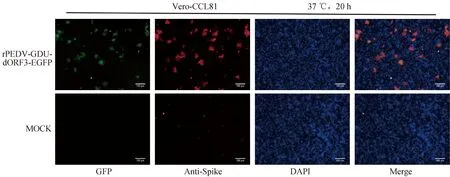
圖3 拯救重組病毒感染Vero-CCL81細胞 IFA驗證(標尺=100 μm)Fig.3 Detection of recombinant PEDV in Vero-CCL81 cells by IFA (bar=100 μm)
2.2 不同代次重組熒光病毒穩定性觀察與TCID50測定
將重組熒光病毒在Vero-CCL81細胞上進行連續傳代,分析其病毒感染時熒光蛋白表達的穩定性。結果顯示,不同代次重組熒光病毒感染Vero-CCL81細胞后均表達綠色熒光,且隨著代次的增加,熒光信號增強,說明該熒光病毒對細胞的適應性增強(圖4A)。進一步測定不同代次重組熒光病毒的滴度,發現隨著傳代次數的增加病毒滴度也不斷增加(圖4B),與病毒穩定性試驗結果一致,表明重組熒光病毒能穩定增殖并表達綠色熒光蛋白EGFP,可作為穩定的工具病毒。
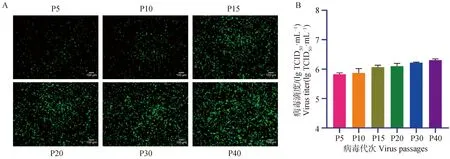
圖4 不同代次重組熒光病毒感染Vero-CCL81細胞的熒光圖(A,標尺=100 μm)及病毒滴度(B)Fig.4 Fluorescence images (A, bar=100 μm) and virus titers (B) of Vero-CCL81 cells infected by recombinant fluorescent PEDVs of different passages
2.3 重組熒光病毒與親本毒株生物學特性對比
為了評估ORF3基因的缺失和EGFP基因的插入對PEDV入侵、復制和S蛋白表達有無影響,將重組熒光病毒與親本病毒分別以0.1 MOI感染Vero-CCL81細胞,進行IFA、Western blot和一步生長曲線試驗。IFA結果顯示,親本病毒和重組熒光病毒在相同的接毒劑量和感染時間下,重組熒光病毒的熒光信號能完全指示病毒的感染情況(圖5A)。Western blot結果顯示,利用PEDV-S1單克隆抗體在二者的細胞樣品中均檢測到150 ku左右的特異性條帶,且大小及表達量均無明顯差異(圖5B)。此外,生長曲線結果顯示,二者在Vero-CCL81細胞中表現相似的生長曲線,均在感染后36 h病毒滴度達到峰值,隨后病毒的滴度逐漸降低(圖5C)。以上結果表明,重組熒光病毒與親本病毒生物學特性無顯著差異。
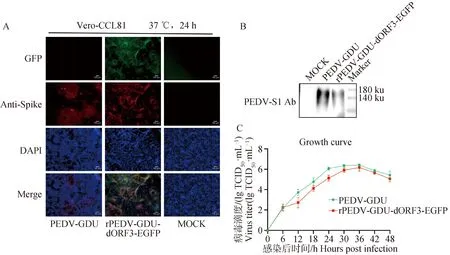
A.IFA試驗(標尺=100 μm);B. Western blot;C.生長曲線A.IFA (scale bar=100 μm); B. Western blot; C. Growth curve圖5 拯救重組病毒與親本病毒感染Vero-CCL81細胞IFA、 Western blot及生長曲線Fig.5 IFA, Western blot and growth curve of Vero-CCL81 cells infected with recombinant PEDVs and parental virus
2.4 重組熒光病毒的細胞嗜性
為篩選在不添加胰酶條件下可有效支持PEDV感染和復制的細胞系,進行了重組熒光病毒的細胞嗜性試驗。結果顯示,重組熒光病毒在添加胰酶的條件下均能成功感染四種細胞,但在不添加胰酶的條件下均不能感染Vero-CCL81、ST和293 T細胞,僅Huh7細胞能在不添加胰酶的情況下被成功感染(圖6)。為了篩選一株感染性能更好的細胞,通過對Huh7細胞進行亞克隆,篩選了一株感染效率最高的Huh7.10細胞。
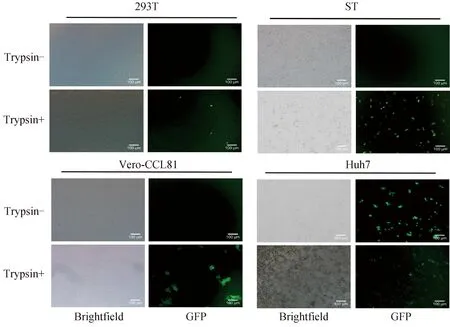
圖6 拯救重組病毒感染不同細胞的胰蛋白酶依賴性(標尺=100 μm)Fig.6 Trypsin dependence of recombinant PEDVs infection in different cells (bar=100 μm)
2.5 基于Huh7.10細胞和重組熒光病毒的中和試驗的初步建立與評估
為初步建立重組熒光病毒在Huh7.10細胞上的中和試驗方法,本研究將表達的3株具有中和活性的PEDV單克隆抗體和重組熒光病毒在Huh7.10細胞和Vero-CCL81細胞進行中和試驗,于試驗后48 h利用熒光顯微鏡觀察熒光表達情況,并計算#Ab1、#Ab2、#Ab3的中和效價。結果顯示,3株中和抗體在Vero-CCL81細胞(圖7A)和Huh7.10細胞(圖7B)上測得的中和效價一致,#Ab1、#Ab2和#Ab3的中和效價分別是1∶32、1∶2和1∶8。這些結果說明基于Huh7.10細胞和重組熒光病毒的中和試驗能準確評估PEDV單克隆抗體的中和效價,該方法成功初步建立。
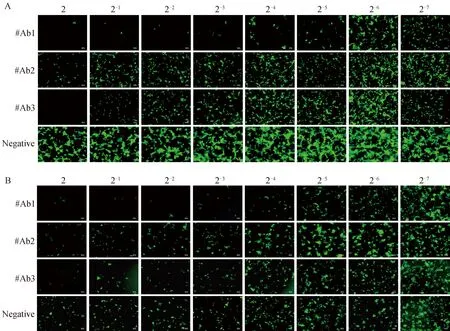
A.在Vero-CCL81中的中和抗體效價測定;B.在Huh7.10中的中和抗體效價測定A. Neutralization test results of PEDV neutralizing antibodies in Vero-CCL81 cells; B. Neutralization test results of PEDV neutralizing antibodies in Huh7.10 cells圖7 3株PEDV中和抗體中和試驗結果圖(標尺=100 μm)Fig.7 Neutralization test results of 3 strains of PEDV neutralizing antibodies (scale bar=100 μm)
2.6 基于Huh7.10細胞和重組熒光病毒的血清中和試驗的評估
為評估上述中和試驗方法是否能穩定檢測臨床血清中和抗體水平,作者收集了36份臨床豬源血清,利用實驗室建立的基于PEDV-S1蛋白的間接ELISA方法對收集的血清進行檢測,并對比在Huh7.10細胞和Vero-CCL81細胞上的中和抗體檢測結果,最后對所得數據進行分析,當樣品值與陰性值比(P/N)≥2.1時判為陽性。試驗結果如表2所示,首先,ELISA抗體陰性的血清在Vero-CCL81細胞上的呈現有中和效價(1∶4),但在Huh7.10細胞沒有;其次,在Vero-CCL81細胞上ELISA檢測結果陽性血清中和效價高于Huh7.10細胞,但在Huh7.10細胞與Vero-CCL81細胞上血清中和抗體效價評估趨勢一致。

表2 豬源血清中和效價及ELISA P/N值Table 2 Neutralizing antibody titer and ELISA P/N value
2.7 間接 ELISA 與病毒中和試驗的相關性
將各豬源血清的中和效價與其相應的ELISA 檢測的P/N值開展相關性分析。結果顯示(圖8):在Huh7.10細胞上的相關性直線方程(y=0.051 54x+0.186 0)與在Vero-CCL81細胞上的相關性直線方程(y=0.050 01x+0.724 0)的回歸系數相近,說明二者對血清中和效價的整體評判結果基本一致。但在Huh7.10細胞上的R2值(0.978 7)遠遠高于在Vero-CCL81細胞上的R2值(0.739 6),表明在Huh7.10細胞上進行血清中和抗體效價評估結果更為準確可靠。
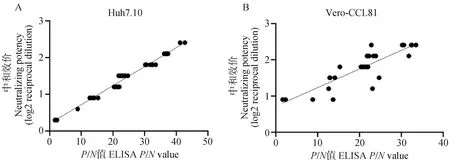
A.豬源血清中和抗體在Huh7.10細胞上相關性分析;B. 豬源血清中和抗體在Vero-CCL81細胞上相關性分析。中和效價(Y軸)為log2(1/中和效價)、 ELISA值(X軸)為P/N值A. Correlation analysis of porcine-derived serum neutralizing antibody on Huh7.10 cells; B. Correlation analysis of porcine-derived serum neutralizing antibody on Vero-CCL81 cells. The neutralizing potency (Y-axis) is log2 (1/neutralizing titer) and the ELISA value (X-axis) is the P/N value 圖8 豬源血清P/N值與病毒中和抗體效價之間的關系Fig.8 Relationship between swine serum P/N value and viral neutralizing antibody titer
3 討 論
反向遺傳學技術是通過構建RNA病毒的cDNA感染性分子克隆,在DNA水平上對RNA病毒進行體外操作,從而研究該病毒基因結構和功能[19],加速了人們對病毒的認識。有研究人員利用該技術將外源報告基因如綠色熒光蛋白和熒光素酶等插入病毒基因組中,重建含有標記的工具病毒,用于病毒組織細胞嗜性和抗病毒藥物篩選等研究,比如拯救的報告病毒用于追蹤嗜神經病毒在體外的感染情況和在體內的分布[20-21]。靶向RNA重組技術考慮到冠狀病毒全長cDNA克隆的復雜性,克服了ORF1ab(復制酶基因)部分基因片段不穩定的問題,所以通常這種技術利用病毒全長RNA(通常通過感染)和病毒RNA片段之間在細胞內的重組,最終拯救出目標病毒,這有利于快速構建冠狀病毒的目標感染性克隆載體質粒[22]。本研究利用基于RNA定向重組技術,成功構建了攜帶熒光報告基因的感染性克隆質粒,并在體外成功拯救了能夠穩定表達綠色熒光蛋白的PEDV-GDU重組病毒,且該重組病毒生物學特性與親本病毒基本一致。并且建立的PEDV-GDU毒株的反向遺傳操作平臺可為PED新型疫苗候選毒株的快速制備提供有力的工具。
PEDV經典中和試驗在Vero細胞上進行,Vero細胞來源于非洲綠猴的腎上皮細胞[23],在1988年首次報道了PEDV成功在該細胞上的體外增殖[24],并且該細胞現在廣泛應用于PEDV的研究。在PEDV經典中和試驗中,病毒的感染嚴格依賴外源胰酶的添加,但胰酶與待檢血清之間存在矛盾:血清中和胰酶的作用及胰酶切割降解血清中和抗體的作用,導致中和抗體評估不準確。所以亟需篩選一株能支持PEDV在無胰酶條件下感染和復制的細胞系,用于PEDV中和抗體研究。因此,本研究根據相關研究人員關于傳統和新建立的細胞系的研究結果[25-26],選擇Vero-CCL81、ST、293 T和Huh7四種均能被PEDV感染的細胞系進行目的細胞的篩選,其中Vero-CCL81細胞作為陽性對照;ST細胞是豬睪丸細胞,常用于腹瀉冠狀病毒研究[26-27];Huh7細胞是人肝癌細胞,是包括SARS-COV-2在內冠狀病毒的常用細胞模型[28];293 T細胞是人胚胎腎細胞,作為人源細胞的對照。最終利用拯救的PEDV-GDU熒光病毒篩選到一株Huh7.10細胞系,該細胞可支持PEDV在無外源胰蛋白酶條件下進行高效感染和復制,并基于此建立了一種新型PEDV中和試驗。
有研究表明,PEDV-S1 IgG-ELISA與病毒中和試驗有高度相關性[10]。因此,為了對新型PEDV中和試驗進行評估,本研究通過PEDV-S1 ELISA試驗進行臨床豬源血清抗體檢測,并在Huh7.10 細胞和Vero-CCL81細胞上進行血清中和抗體水平測定比較,最終進行相關性分析。結果顯示,新型PEDV中和抗體效價評價方法與S1-ELISA的試驗結果的關聯性優于經典方法。這可能主要與冠狀病毒入侵靶細胞依賴的各種宿主細胞蛋白酶水解病毒 S 蛋白的作用有關(例如Furin、胰蛋白酶和TMPRSS2)[29-30]。經典方法中,外源添加的胰酶與血清中的蛋白作用,減少有效作用的胰酶含量,從而影響病毒的入侵,此外,高濃度的胰酶還能降解血清中的抗體,從而導致中和抗體的測定不準確。在Huh7.10細胞中,由于細胞表達大量的宿主蛋白酶[31],能替代胰蛋白酶的作用,使得PEDV在不添加胰酶的條件下能有效地感染和復制,因此利用該系統能更準確地評估血清中的中和抗體。同樣,以前被使用的FFN是將PEDV感染Vero細胞后,通過染色手段觀察熒光,從而評估血清中和抗體水平[16]。雖然該方法相較于經典CPE方法能更快和更準確地進行血清中和抗體檢測分析,但其仍存在外源胰酶的添加導致試驗結果不穩定的問題。所以本研究在Huh7.10細胞上建立的新型PEDV中和試驗方法同樣優于FFN,是一種耗時短、操作簡便、準確性高、重復性好的新型PEDV中和試驗方法。
PED主要導致新生仔豬腹瀉的高感染率和高死亡率,預防和控制PEDV感染的主要策略是對易感動物進行疫苗接種[32]。傳統PEDV的分離方法分離率低,不能順利獲取流行毒株,并且對疫苗接種后誘導的中和抗體水平檢測的傳統方法不能穩定評估免疫效果,故無法有效地解決當前防控PEDV變異毒株所導致腹瀉的難題。本研究基于RNA定向重組技術建立了PEDV-GDU的反向遺傳操作系統,構建并拯救PEDV-GDU熒光病毒,為篩選能有效增殖病毒且不依賴外源胰酶添加的細胞系和新型PEDV中和試驗方法的建立提供一種快速有效的工具,此外,利用該平臺能夠加快研制與PEDV流行毒株匹配疫苗毒株的制備進程,并對免疫后效果進行有效評估,符合當前防控PED防控的迫切需求。
4 結 論
本研究基于RNA定向重組技術建立了PEDV-GDU反向遺傳操作系統,成功拯救了攜帶EGFP基因的重組工具病毒,并利用熒光工具病毒篩選到一株Huh7.10亞克隆細胞,該細胞可有效支持PEDV在無外源添加胰蛋白酶條件下有效感染和復制,最后,利用熒光工具病毒與Huh7.10細胞系建立了優于傳統方法且穩定可靠的中和抗體檢測方法。

