基于蛋白組學分析不同解凍方式下牛肉的品質變化機制
林穎 鄺金艷 王麗 閆子康 李宗軍
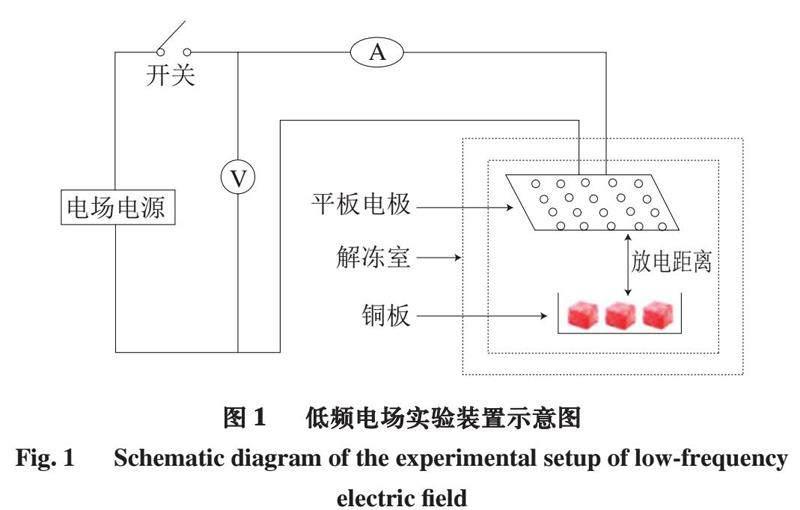

摘 要:低頻電場解凍(low-frequency electric field thawing,LFEFT)與常溫解凍(room temperature thawing,RTT)會導致牛肉pH值、顏色、總揮發性鹽基氮(total volatile base nitrogen,TVB-N)含量、質構特性和持水力等方面顯著不同,從分子水平解析LFEFT對牛肉品質影響的可能機制,采用蛋白質組學技術對2 種解凍方式牛肉進行分析。結果表明:LFEFT組與RTT組之間有551 個差異豐度蛋白(differentially abundant proteins,DAPs),其中14 種DAPs與牛肉品質特性(pH值、色澤、TVB-N含量、質構和持水力)呈顯著相關;生物信息學分析表明,DAPs主要參與蛋白結合、代謝酶和蛋白質周轉等生物功能。LFEFT既可以提高生產效率,又保證了牛肉品質。
關鍵詞:低頻電場解凍;常溫解凍;牛肉;肉品質;蛋白組學
Proteomics-Based Analysis of the Quality Change Mechanism of Frozen Beef under Different Thawing Methods
LIN Ying, KUANG Jinyan, WANG Li, YAN Zikang, LI Zongjun*
(College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China)
Abstract: Low-frequency electric field thawing (LFEFT) and room temperature thawing (RTT) lead to significant differences in the pH, color, volatile base nitrogen (TVB-N) content, textural properties and water-holding capacity of beef. In order to elucidate a possible mechanism for the effect of LFEFT on the quality of beef at the molecular level, the current study conducted a proteomic analysis of frozen beef thawed by LFEFT or RTT. The results showed that there were 551 differentially abundant proteins (DAPs) between the LFEFT and RTT groups. Among these, 14 were significantly correlated with quality traits (pH, color, TVB-N content, texture and water-holding capacity). Bioinformatics analysis showed that DAPs were mainly involved in biological functions such as protein binding, metabolic enzymes and protein turnover. In summary, LFEFT can improve production efficiency while ensuring beef quality.
Keywords: low-frequency electric field thawing; room temperature thawing; beef; meat quality; proteomics
DOI:10.7506/rlyj1001-8123-20240220-040
中圖分類號:TS251.1? 文獻標志碼:A? 文章編號:1001-8123(2024)02-0009-08
引文格式:
林穎, 鄺金艷, 王麗, 等. 基于蛋白組學分析不同解凍方式下牛肉的品質變化機制[J]. 肉類研究, 2024, 38(2): 9-16. DOI:10.7506/rlyj1001-8123-20240220-040.? ? http://www.rlyj.net.cn
LIN Ying, KUANG Jinyan, WANG Li, et al. Proteomics-based analysis of the quality change mechanism of frozen beef under different thawing methods[J]. Meat Research, 2024, 38(2): 9-16. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20240220-040.? ? http://www.rlyj.net.cn
牛肉是人類飲食結構中蛋白質的重要來源[1]。過去10 年中,我國牛肉消費量增長55%,占全球消費量的11%,使我國成為世界上牛肉進口增長最快的國家[2]。冷凍是保存肉類和肉制品的重要且方便的方法,在肉類工業中起至關重要的作用[3]。解凍是冷凍食品的最后一道工序[4]。解凍技術使用不當會引起肉的物理、化學和質構特性變化,損害肉的品質[5]。傳統的解凍技術,如常溫解凍(room temperature thawing,RTT),解凍時間長,肉的持水力下降,總揮發性鹽基氮(total volatile base nitrogen,TVB-N)含量高,蛋白質降解嚴重,影響其品質。針對傳統解凍的不足,目前國內外學者對多種新型解凍技術進行了研究,如微波解凍[6]、射頻解凍[7]等。微波解凍加熱效率快、解凍時間短,但在解凍較大的樣品時,存在局部過熱、樣品滲透性差和解凍不完全等問題。射頻解凍具有能量利用率高、解凍快等優點,但是食品的介電特性、物料狀態等因素會影響該解凍方式的解凍效果,進而影響食品感官品質。因此,亟待探尋一種可改善牛肉解凍品質、降低其脂質和蛋白氧化程度的解凍技術,提高牛肉產業的經濟效益。低頻電場解凍(low-frequency electric field thawing,LFEFT)作為一種新型解凍技術,解凍效率高,肉類新鮮度保持較好,汁液損失率低,具有改善肉類解凍品質的效果,在肉制品解凍領域具有較高的研究熱度。
蛋白質組學作為生命科學的研究熱點,是在分子水平上探索肌肉蛋白質與品質特性間關系以及在蛋白質水平揭示影響品質性狀的生化過程和機制的有影響力的工具[8]。
蛋白質作為肌肉的重要組成部分,其變化能夠引起肉品質的改變。目前蛋白組學在國內外肉類宰前應激、宰后老化過程及品種鑒定中已有一定的應用。趙娟紅[9]采用同位素標記相對和絕對定量技術定量分析豬肉貯藏過程中的蛋白變化規律,將不同貯藏溫度條件下的豬肉差異蛋白與品質指標進行相關性分析,發現肌球結合蛋白C、肌鈣蛋白I、原肌球蛋白α1鏈等與pH值、TVB-N含量和色澤呈顯著相關。Malheiros等[10]利用雙向電泳結合噴霧串聯質譜技術測定內洛爾公牛的蛋白質組,確定熱休克蛋白、抗氧化蛋白及骨骼肌的代謝和結構蛋白與牛的嫩度相關。Morzel等[11]提出,肌肉主要由大量的水分和蛋白質組成,肉品科學與功能蛋白質結構研究密不可分。Fuente-Garcia等[12]評估牛屠宰前應激相關的蛋白質組生物標志物,發現有5 條蛋白條帶在正常肉和干硬肉之間具有顯著差異(P<0.05),肌動蛋白、磷酸葡萄糖變位酶1、α-晶狀體蛋白B、熱休克蛋白β6和熱休克蛋白β1作為應激病癥的生物標志物。蛋白質組學技術同樣已經被應用于檢測與牛肉顏色穩定性相關的分子機制,胴體宰后溫度和pH值的下降均會導致顏色穩定性的變化[13]。Zhang Yimin等[14]分析牛胸長肌宰后早期與能量代謝相關酶的變化,24 種代謝相關酶和熱休克蛋白在宰后不同時間采集的樣品中發生了變化。
蛋白組學在肉類領域具有一定的研究和應用,但是關于新型解凍技術對比傳統解凍技術所引起肉類品質差異的研究較少。本研究對LFEFT和RTT牛肉進行差異蛋白組學研究,篩選差異蛋白,探究其功能和解凍機制,為提高冷凍肉品質提供理論依據和新的思路。
1 材料與方法
1.1 材料與試劑
澳洲新鮮谷飼牛肉塊(后腿肉)購自沃爾瑪(湖南)商業零售有限公司。
濃硫酸、濃鹽酸、氯化鈉、甲基紅、亞甲基藍、乙醇、氧化鎂、硼酸、三氯乙酸、戊二醛、丙酮(均為分析純) 上海國藥集團化學試劑有限公司;NH4HCO3? ?美國Sigma公司;TMT標記試劑盒、PierceTM肽段分級試劑盒 美國Thermo Scientific公司。
1.2 儀器與設備
低頻電場裝置 呼和浩特綠碧電子科技有限公司;3-18R型冷凍離心機 湖南恒諾儀器設備有限公司;NR200型色差儀 深圳三恩時科技有限公司;PHS-3E型pH計 上海儀電科學儀器股份有限公司;TVT-6700型食品物性測試儀 英國Stable Micro Systems公司;Q-Exacitve HF-X型質譜儀、Easy-nLC 1200型色譜系統、Trap column C18反相色譜柱(100 μm×20 mm,5 μm)? ?美國Thermo Scientific公司。
1.3 方法
1.3.1 樣品制備
購買牛肉后1 h內將其放入裝有冰袋的保溫袋中運往實驗室,去除外部可見脂肪和結締組織后切成質量500 g、10 cm×8 cm×3 cm的塊狀,隨后放置于-20 ℃冰箱中凍結備用。
1.3.2 解凍方法
RTT:將密封袋包裝的肉樣放置在25 ℃恒溫培養箱中進行解凍,以肉塊中心溫度達到4 ℃為解凍終點。
LFEFT:將肉樣放置于低頻解凍設備,將溫度設置為4 ℃后開始解凍,以肉塊中心溫度達到4 ℃為解凍終點。
本實驗使用的低頻電場裝置由電壓發電機(交流電220 V、50 Hz)和平板電極(580 mm×280 mm)組成。由于板電極垂直放置,牛肉沒有直接接觸板電極,與板電極平行。低頻電場裝置和肉樣放置如圖1所示,電壓發電機輸出電壓為4 000 V,電流為0.2 mA,放電距離為290 mm。在LFEFT組,低頻電場裝置應用于解凍的整個過程。
采用不同方式解凍后,收集肉塊中心部分(約5 g),每組樣品分別含3 個生物學重復樣本,立即在液氮中冷凍,保存于-80 ℃,用于蛋白組學分析,其余部分用于肉質指標測定。
1.3.3 肉質指標測定
1.3.3.1 pH值
參照GB 5009.237—2016《食品安全國家標準 食品pH值的測定》。
1.3.3.2 色度
參照張莉等[15]的方法,將肉樣取出后用吸水紙擦干其表面的水分并置于實驗臺表面,同時對色差儀進行校準,校準完畢測定樣品的亮度值(L*)、紅度值(a*)及黃度值(b*),每個樣品隨機選取6 個點進行測定,結果取平均值。
1.3.3.3 質構特性
取解凍后的牛肉,切為2.0 cm×2.0 cm×1.0 cm,使用P36R平底柱形探頭,設置參數為:回程距離25 mm,形變量50%,測前速率2 mm/s,測試速率1 mm/s,2 次測量間隔5 s,探針自動觸發。每組樣品平行測定3 次。測定樣品的硬度、彈性和咀嚼性。
1.3.3.4 TVB-N含量
參照GB 5009.228—2016《食品中揮發性鹽基氮的測定》。
1.3.3.5 汁液損失率
離心損失率:參照馬翼飛等[16]的方法,稱取解凍后的牛肉2 g,用濾紙包好后,4 ℃、5 000 r/min條件下離心25 min,去掉濾紙后,測定離心后牛肉的質量,離心損失率按式(1)計算:
式中:m1為實驗前肉樣質量/g;m2為離心后肉樣質量/g。
滴水損失率:參照雷露等[17]的方法,將解凍后的肉樣修剪成20 mm×30 mm×50 mm的肉塊,用細鐵絲掛住,套上保鮮袋(肉樣與保鮮袋不接觸),懸掛于4 ℃冰箱中,24 h后測定肉塊質量,滴水損失率按式(2)
計算:
式中:m3為實驗前肉樣質量/g;m4為24 h后肉樣質量/g。
總損失率按式(3)計算:
1.3.4 蛋白樣品制備
將樣品置于4 ℃復融,每個樣品中分別加入200 ?L蛋白裂解液(含4 g/100 mL十二烷基磺酸鈉、100 mmol/L
二硫蘇糖醇、150 mmol/L三羥甲基氨基甲烷-鹽酸緩沖液),冰浴超聲2 min。4 ℃、16 000×g離心20 min,取上清,采用二喹啉甲酸試劑盒進行蛋白定量。每個樣品各取300 μg蛋白進行溶液內酶解,步驟如下:每個樣品中分別加入適量1 mol/L二硫蘇糖醇至終濃度10 mmol/L,沸水浴5 min,冷卻至室溫;加入適量800 mmol/L吲哚乙酸至終濃度50 mmol/L,600 r/min振蕩1 min,避光室溫放置30 min;加入6 倍體積冷丙酮試劑,置于-20 ℃孵育過夜,沉淀蛋白;16 000×g離心30 min,去除上清液,保留蛋白沉淀;加入適量丙酮試劑清洗蛋白沉淀,重復2 次;將蛋白沉淀樣品置于通風櫥風干,去除有機試劑;加入150 ?L 0.04 μg/μL胰酶緩沖液,600 r/min振蕩1 min,37 ℃孵育酶解16~18 h;加入100 μL 0.1 g/100 mL三氯乙酸溶液,酶解后的肽段使用C18色譜柱脫鹽,真空凍干后用0.1 g/100 mL三氯乙酸溶液復溶,脫鹽處理,進行肽段定量。
1.3.5 TMT肽段標記與肽段分級
每個樣品分別取100 μg肽段進行標記。將每組標記后的肽段等量混合,干燥后的肽段使用High-pH反相色譜柱進行分級分離,最終將樣品收集合并為10 個組分,每個組分的肽段干燥后用0.1%甲酸復溶,待液相色譜-串聯質譜(liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析。
1.3.6 LC-MS/MS分析
每個樣品取適量肽段使用納升流速色譜系統進行色譜分離。緩沖液:A液為0.1%甲酸溶液,B液為體積分數95%乙腈溶液(含0.1%甲酸)。色譜柱以100%的A液平衡。樣品進樣到Trap column C18色譜柱(100 ?m×20 mm,5 ?m)后經過C18色譜分析柱(75 ?m×150 mm,3 ?m)進行梯度分離,流速為300 nL/min。液相分離梯度如下:0~2 min,2%~8% B;2~42 min,8%~30% B;42~49 min,30%~45% B;49~50 min,45%~100% B;50~60 min,100% B。肽段分離后進行數據依賴采集(data-dependent acquisition,DDA)質譜分析。
1.3.7 數據庫搜索和分析
采用Proteome Discoverer 2.4軟件分析數據,根據DDA數據庫進行數據解析和蛋白質鑒定,從而獲得蛋白質的鑒定結果、功能注釋和相對定量等數據。肽和蛋白質鑒定的錯誤發現率設為1%。采用TMT報告離子強度進行定量。
1.3.8 生物信息學分析
使用Perseus軟件、Microsoft Excel和R統計計算軟件對生物信息學數據進行分析。以蛋白表達差異倍數(fold change,FC)>1.2或<0.83且P<0.05為臨界值,篩選出差異豐度蛋白(differentially abundant proteins,DAPs)。根據表達水平對DAPs進行分層聚類。序列注釋信息來自UniProtKB/Swiss-Prot、京都基因和基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)和基因本體論(gene ontology,GO)。此外,利用STRING數據庫和Cytoscape軟件構建蛋白質-蛋白質相互作用(protein-protein interaction,PPI)網絡。
1.4 數據統計分析
肌肉質量數據通過SPSS Statistics 26.0軟件和Duncan多重范圍進行統計分析,顯著性定義為P<0.05。使用R語言工具包(RVersion 4.1.2)對圖像進行分析,并對肌肉品質特征與蛋白質表達結果進行Pearson相關性分析、火山圖繪制和層次聚類。
2 結果與分析
2.1 不同解凍方式下牛肉的品質特性
由表1可知,RTT組牛肉pH值顯著低于LFEFT組牛肉(P<0.05),其原因是解凍方式誘導的蛋白質變性導致氫離子的釋放[18]和肉中水分的損失。低頻電場通過減少牛肉的收縮而潛在地減少能量代謝,從而延緩pH值的降低。在色澤方面,RTT組L*和a*均顯著低于LFEFT組,是由于冷凍-解凍處理后會損耗肉中的水分,導致L*降低,a*的降低是由于在解凍過程中肌紅蛋白氧化生成高鐵肌紅蛋白。RTT組牛肉b*顯著高于LFEFT組,原因是肌肉中的蛋白質發生氧化,導致黃色色素積累。牛肉在電場環境下解凍b*較低,說明肌肉中的蛋白質氧化程度較低。這進一步表明LFEFT可以改善肉品色澤。與RTT組牛肉相比,LFEFT處理后的牛肉硬度、彈性和咀嚼性均有所提高,這與李翰卿等[19]的研究一致,電場解凍時間短,樣品內外同時解凍,溫差小使肉樣的肌肉纖維結構緊密,肌肉質構特性保持較好。而TVB-N產生是由于肉品在腐敗過程中,微生物的分解會使蛋白質產生氮及胺類等揮發性堿性含氮物質[20]。LFEFT處理后的牛肉TVB-N含量顯著低于RTT組,新鮮度較高,這與王麗等[21]研究結果一致。這表明LFEFT能夠減少牛肉蛋白質分解,有效延長其貨架期。LFEFT處理后的牛肉離心損失率和滴水損失率均顯著低于RTT組,這與Zhang Yaming等[22]的研究結果一致。由于LFEFT速率快,對牛肉的蛋白質變性程度影響較小,冰晶生長速率較均勻,從而導致解凍過程中對細胞的刺穿更少,肌肉的組織結構保持更好,汁液損失減少[23],牛肉持水力較高。且在解凍過程中,隨著冰晶的融化,出現細胞內親水膠質體吸收水分,使水分逐漸向細胞內滲透和擴散的現象,電場解凍速率大,因此冰晶解凍的汁液全部向細胞內滲透而不至外溢流失。
2.2 蛋白質鑒定和定量
經數據篩選,共檢出15 507 條多肽和11 338 條獨特多肽,與2 333 個蛋白匹配,如圖2所示,大多數蛋白的肽段數量≤3,占55.29%。如圖3所示,篩選的蛋白序列覆蓋率較高,46.4%的蛋白序列覆蓋率超過10%,22.9%的蛋白序列覆蓋率超過20%。
2.3 DAPs的比較
如圖4所示,在LFEFT與RTT組的比較中,共有551 個DAPs。火山圖直觀顯示了DAPs的變化,其中藍色為上調蛋白,紅色為下調蛋白。采用分層聚類熱圖可視化區分蛋白質子集和DAPs,觀察2 個處理組樣本的差異,有助于蛋白質的量化。如圖5所示,實驗具有可重復性,且不同處理組間存在顯著差異。
2.4 DAPs的GO和KEGG富集分析
GO富集包含3 個重要的生物功能本體:生物過程(biological process,BP)、細胞成分(cellular component,CC)和分子功能(molecular function,MF)。如圖6所示,通過對551 個DAPs進行序列比對,GO條目匹配到526 個DAPs,共分為40 類,23 個注釋到BP,2 個注釋到MF,15 個注釋到CC。BP以細胞過程和代謝過程最為顯著,CC主要富集在細胞解剖結構和含蛋白質的復合物等組分中,MF主要富集在結合力和催化活性2 個方面。就GO結果而言,這些DAPs最有可能被識別出是因為它們受到冷凍過程中產生冰晶的影響,破壞肌肉的完整性,導致解凍損失,進而導致蛋白質損失,并改變肉中蛋白質的功能特性。
利用KEGG數據庫對LFEFT和RTT處理后的牛肉進行差異蛋白代謝通路分析,共富集到263 條代謝通路,其中顯著富集(P<0.05)的有58 條,排名前20的通路如圖7所示。LFEFT與RTT組牛肉的DAPs主要參與代謝途徑、氧化磷酸化、氨基酸生物合成、三羧酸(tricarboxylic acid,TCA)循環、碳代謝、糖酵解和產熱。肉類在冷凍和解凍過程中會導致蛋白質降解,影響肉質。蛋白質降解過程中,當肽鍵斷裂時產生氨基酸,這些氨基酸進一步脫氨基形成碳骨架,參與碳代謝。氨基酸碳骨架氧化的主要途徑是TCA循環,其中丙酮酸被代謝。此外,在解凍過程中,能量主要通過糖酵解代謝產生,從而參與產熱。
2.5 PPI網絡分析
PPI網絡中,節點代表蛋白質,連接線代表蛋白質-蛋白質關聯。如圖8所示,還原型輔酶I(nicotinamide adenine dinucleotide,NADH)脫氫酶[泛醌]1α亞復合物亞基8(P42029)、線粒體(NDUFB8)、ATP合酶亞基δ(ATP5F1D)、細胞色素b-c1(P00129)、羥酰輔酶A脫氫酶(Q2KJC5)、肌球蛋白重鏈(F1MM07)、蘋果酸脫氫酶(Q32LG3)等與其他蛋白質的相互作用評分高于0.99,表明這些蛋白質的相互作用對解凍牛肉的質量至關重要。
2.6 DAPs與牛肉品質特性的相關性
如圖9所示,各DAPs與多個肌肉品質指標均呈顯著相關,表明這些DAPs可作為評價LFEFT對牛肉品質影響的潛在生化指標。
NADH脫氫酶(P42029)位于線粒體內膜,催化NADH向輔酶Q的電子傳遞,是線粒體氧化磷酸化的開始,是厭氧代謝中電子由NADH或還原型黃素二核苷酸傳遞合成ATP的主要途徑。NADH脫氫酶(P42029)與pH值呈高度顯著負相關(P<0.001)。LEFET組NADH脫氫酶(P42029)表達下調,導致電子轉移活性降低,終止速率加快,后期生化反應ATP產生減少。而RTT組ATP消耗更快,因此進行更多的無氧呼吸,產生更多乳酸,pH值下降[24]。L-乳酸脫氫酶(B0JYN3)將(S)-乳酸和氧化型輔酶I轉化為丙酮酸和NADH,可能對糖酵解過程有抑制作用[25]。由相關性分析結果可知,L-乳酸脫氫酶(B0JYN3)與pH值呈高度顯著正相關(P<0.001),說明與RTT組相比,LFEFT組牛肉的糖酵解速率減慢,從而延緩了pH值的降低。
PDZ結構域是一種由80~100 個氨基酸殘基組成的保守序列,是一種介于二級結構和三級結構之間的結構[26]。LIM蛋白在機體的生長發育過程中發揮重要作用[27]。PDZ和LIM結構域蛋白1(A6H7E3)與TVB-N含量呈高度顯著負相關(P<0.001),說明PDZ和LIM結構域蛋白1的豐度越高,TVB-N含量越少,牛肉的新鮮度越高。LFEFT組的PDZ和LIM結構域蛋白1(A6H7E3)的豐度高于RTT組,說明LFEFT牛肉品質較好。
在與色澤的相關性分析中,細胞色素C(P62894)與L*呈顯著正相關(P<0.05),與b*呈顯著負相關(P<0.05)。細胞色素C(P62894)是生物氧化過程中一個非常重要的電子傳遞體,在線粒體嵴上與其他氧化酶排列成呼吸鏈,參與細胞呼吸過程[28]。LFEFT組中細胞色素C(P62894)的豐度高于RTT組,說明采用LFEFT更有利于維持牛肉色澤的穩定性。超氧化物歧化酶也是和肉色相關的一種抗氧化蛋白,它可以破壞在細胞內產生且對生物系統有毒的自由基,維持牛肉品質的穩定,與RTT組相比,LFEFT組超氧化物歧化酶(E1BHL1)上調,與L*呈高度顯著正相關(P<0.001),與a*呈極顯著正相關(P<0.01),與b*呈高度顯著負相關(P<0.001)。說明低頻電場有助于防止解凍引起的牛肉變色。
在與質構特性的相關性分析中,肌球蛋白重鏈(F1MM07)、肌鈣蛋白(P63315)與質構特性(硬度、彈性和咀嚼性)呈高度顯著正相關(P<0.001)。肌球蛋白重鏈是肌球蛋白的基本組成單位,在保證肌細胞發揮正常作用中具有重要作用。Lan Weiqing等[29]指出,不適當的解凍可能會造成肌球蛋白重鏈降解。本研究結果表明:LFEFT組牛肉中肌球蛋白重鏈(F1MM07)上調,說明相比于RTT,LFEFT對牛肉的硬度、彈性和咀嚼性具有更小的影響。肌鈣蛋白是橫紋肌特定的蛋白質,在肌肉收縮和舒張過程中起重要調節作用[9]。RTT組牛肉中肌鈣蛋白(P63315)下調,說明LFEFT對牛肉的彈性和咀嚼性影響更小。
核糖體可以將遺傳密碼翻譯成氨基酸序列,并從氨基酸單體構建蛋白質聚合物。核糖體相關蛋白在LFEFT組中全部上調,進一步證明低頻電場能有效維持肌肉組織細胞的完整性。此外,核糖體參與許多生物過程,包括mRNA轉錄和抑制[30]。當肌肉受到低頻電場的作用時,核糖體試圖通過促進mRNA衰變進一步維持細胞穩定性,因此相關蛋白上調[31]。如圖9所示,核糖體蛋白(G5E6D6)與pH值、硬度和彈性呈顯著正相關(P<0.05)。在先前的報道中,核糖體途徑相關蛋白在冷應激下發生改變[32],并且核糖體蛋白質的平衡水平抑制細胞生長和增殖[33],可以推斷,在低頻電場的幫助下,解凍期間肌肉的冷收縮程度降低。
張淼[34]發現,在汁液損失高的樣品中結蛋白含量較高,肌原纖維的橫向交聯加強,增加了肉的汁液損失,而結蛋白的降解消除了肌原纖維間的交聯,迫使水分遷移至細胞間的力消失,而且已經遷移至細胞間的水分可能回吸至細胞內,增加肉的持水性。LFEFT組的結蛋白(O62654)下調,汁液損失率低,因而,結蛋白與總損失率呈高度顯著正相關(P<0.001)。
整合素是細胞外基質和肌動蛋白之間的連接點。局灶性黏連是含有多蛋白整合素的復合物[35]。Talin-1(A0A3Q1MLQ7)作為黏著斑的中心蛋白,參與整合素的激活并將其連接到肌動蛋白細胞因子[36]。蛋白質整合素的降解可能不利于保水能力,也被證明與牛肉中滴漏通道的形成有關[37]。在LFEFT與RTT組牛肉比較中,Talin-1(A0A3Q1MLQ7)與滴水損失率呈高度顯著負相關(P<0.001),滴水通道的形成有助于提高水分從肌肉細胞“逃逸”的能力,說明LFEFT組的保水能力高于RTT組。
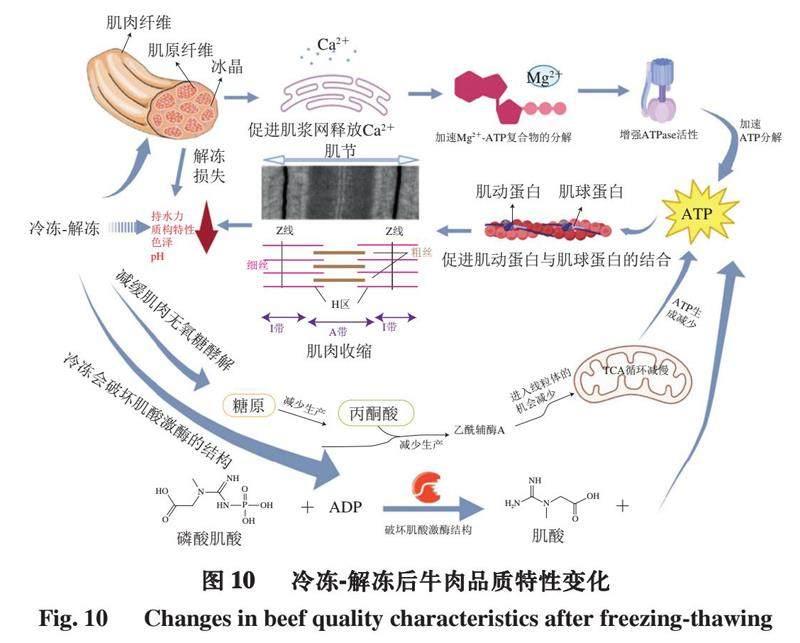
綜上,在冷凍和貯藏過程中,肌肉組織中形成的冰晶不僅在解凍過程中造成水分損失,而且還通過破壞肌漿網,導致肌漿網釋放鈣離子,激活ATPase并加速ATP分解,還可以暴露肌動蛋白和肌球蛋白的結合位點,使肌動蛋白和肌球蛋白結合,從而引起肌肉收縮,進一步影響肌肉質量;并且ATP的產量也有所下降,同時冷凍形成的冰晶破壞肌酸激酶活性,從而減少磷酸肌酸轉化產生ATP的量(圖10)。在低頻電場的幫助下,水分子之間的氫鍵被破壞,水分子旋轉形成小而密集的冰晶,減少對肌肉纖維的損傷,進一步有效改善肉質。
3 結 論
低頻電場通過破壞水分子之間的氫鍵,形成小而密集的冰晶,減少肌肉纖維損傷,從而有效改善解凍后的肉質。從DAPs與品質性狀的相關性結果可知,有43 個DAPs與品質指標顯著相關,其中高度相關的14 種DAPs有望作為牛肉pH值、色澤、質構特性、TVB-N含量和持水力的潛在標志物。這些新發現有助于了解解凍后肉類中發生的蛋白質組變化,以及低頻電場作用影響肉質的潛在機制。在工業生產中,LFEFT既提高了生產效率,又保證了牛肉品質,對于牛肉在貯藏和加工過程中的質量控制具有重要意義。
參考文獻:
[1] 吳怡. 西門塔爾牛及其雜交牛肉品質、轉錄組及腸道菌群的對比研究[D]. 呼和浩特: 內蒙古農業大學, 2023.
DOI:10.27229/d.cnki.gnmnu.2023.001029.
[2] ZHU W B, CHEN Y F, ZHAO J, et al. Impacts of household income on beef at-home consumption: evidence from urban China[J]. Journal of Integrative Agriculture, 2021, 20(6): 1701-1715. DOI:10.1016/S2095-3119(20)63582-1.
[3] 張馨月, 鄧紹林, 胡洋健, 等. 幾種新型解凍技術對肉品質影響的研究進展[J]. 食品與發酵工業, 2020, 46(12): 293-298. DOI:10.13995/j.cnki.11-1802/ts.023813.
[4] HU R, ZHANG M, JIANG Q Y, et al. A novel infrared and microwave alternate thawing method for frozen pork: effect on thawing rate and products quality[J]. Meat Science, 2023, 198: 109084. DOI:10.1016/j.meatsci.2022.109084.
[5] ZHANG Y L, LIU G S, XIE Q W, et al. A comprehensive review of the principles, key factors, application, and assessment of thawing technologies for muscle foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2023, 22(1): 107-134. DOI:10.1111/1541-4337.13064.
[6] CAI L Y, ZHANG W D, CAO A L, et al. Effects of ultrasonics combined with far infrared or microwave thawing on protein denaturation and moisture migration of Sciaenops ocellatus (red drum)[J].?Ultrasonics Sonochemistry, 2019, 55: 96-104. DOI:10.1016/j.ultsonch.2019.03.017.
[7] LLAVE Y, TERADA Y, FUKUOKA M, et al. Dielectric properties of frozen tuna and analysis of defrosting using a radio-frequency system at low frequencies[J]. Journal of Food Engineering, 2014, 139(10): 1-9. DOI:10.1016/j.jfoodeng.2014.04.012.
[8] CAO C W, XIAO Z C, GE C R, et al. Application and research progress of proteomics in chicken meat quality and identification: a review[J]. Food Reviews International, 2022, 38(3): 313-334. DOI:10.1080/87559129.2020.1733594.
[9] 趙娟紅. 基于蛋白質組學分析不同貯藏溫度下豬肉的品質變化機制[D]. 長沙: 中南林業科技大學, 2019.
[10] MALHEIROS J M, ENRIQUEZ C E, BRAGA C P, et al. Application of proteomic to investigate the different degrees of meat tenderness in Nellore breed[J]. Journal of Proteomics, 2021, 248: 104331. DOI:10.1016/j.jprot.2021.104331.
[11] MORZEL M, CHAMBON C, HAMELIN M, et al. Proteome changes during pork meat ageing following use of two different pre-slaughter handling procedures[J]. Meat Science, 2004, 67(4): 689-696. DOI:10.1016/j.meatsci.2004.01.008.
[12] FUENTE-GARCIA C, ALDAI N, SENTANDREU E, et al. Search for proteomic biomarkers related to bovine pre-slaughter stress using liquid isoelectric focusing (OFFGEL) and mass spectrometry[J]. Journal of Proteomics, 2019, 198: 59-65. DOI:10.1016/j.jprot.2018.10.013.
[13] SUMAN S P, WANG Y, GAGAOUA M, et al. Proteomic approaches to characterize biochemistry of fresh beef color[J]. Journal of Proteomics, 2023, 281: 104893. DOI:10.1016/j.jprot.2023.104893.
[14] ZHANG Y M, ZHANG X Z, WANG T T, et al. Implications of step-chilling on meat color investigated using proteome analysis of the sarcoplasmic protein fraction of beef longissimus lumborum muscle[J]. Journal of Integrative Agriculture, 2018, 17(9): 2118-2125. DOI:10.1016/S2095-3119(18)62028-3.
[15] 張莉, 孫佳寧, 朱明睿, 等. 解凍方式對羊肉品質及微觀結構的影響[J]. 核農學報, 2022, 36(8): 1607-1617. DOI:10.11869/j.issn.100-8551.2022.08.1607.
[16] 馬翼飛, 劉歡, 單錢藝, 等. 不同解凍方式對小黃魚品質的影響[J].?食品與發酵工業, 2021, 47(1): 222-228. DOI:10.13995/j.cnki.11-1802/ts.025025.
[17] 雷露, 許浩翔, 周景瑞, 等. 貴州關嶺黃牛不同部位肌肉中營養成分含量及品質分析[J]. 黑龍江畜牧獸醫, 2023(20): 52-56. DOI:10.13881/j.cnki.hljxmsy.2022.10.0222.
[18] ZHANG Y, PUOLANNE E, ERTBJERG P. Mimicking myofibrillar protein denaturation in frozen-thawed meat: effect of pH at high ionic strength[J]. Food Chemistry, 2021, 338: 128017. DOI:10.1016/j. foodchem.2020.128017.
[19] 李翰卿, 馬儷珍, 陳勝軍, 等. 不同解凍方式對鳶烏賊胴體肌肉品質的影響[J]. 食品與生物技術學報, 2023, 42(5): 20-28. DOI:10.3969/j.issn.1673-1689.2023.05.003.
[20] 王芊彤, 段鑫鑫, 梁榮蓉, 等. 真空貼體包裝對長期冰溫貯藏牛肉貨架展示期間肉色和貨架期的影響[J]. 食品研究與開發, 2024, 45(1): 43-50. DOI:10.12161/j.issn.1005-6521.2024.01.006.
[21] 王麗, 陳偉, 王遠亮, 等. 解凍方式對豬肉品質、理化性質與微觀結構的影響[J]. 食品與機械, 2023, 39(10): 35-41. DOI:10.13652/j.spjx.1003.5788.2023.80371.
[22] ZHANG Y M, DING C J, NI J B, et al. Effects of high-voltage electric field process parameters on the water-holding capacity of frozen beef during thawing process[J]. Journal of Food Quality, 2019, 2019: 1-11. DOI:10.1155/2019/9140179.
[23] CHEN B, ZHANG M, WANG Y C, et al. Comparative study of conventional and novel combined modes of microwave-and infrared-assisted thawing on quality of frozen green pepper, carrot and cantaloupe[J]. LWT-Food Science and Technology, 2022, 154: 112842. DOI:10.1016/j.lwt.2021.112842.
[24] MATARNEH S K, SCHEFFLER T L, GERRARD D E. The conversion of muscle to meat[M]//TOLDR? F. Lawries meat science. Woodhead Publishing, 2023: 159-194. DOI:10.1533/9781845691615.128.
[25] MISHRA M, DIXIT P K. Cellular lactate and pyruvate are key intermediates for intracellular energy metabolism regulated by lactate dehydrogenase (LDH) in age-related phenomenon[J]. International Journal of Clinical Biochemistry and Research, 2020, 7(2): 285-290. DOI:10.18231/j.ijcbr.2020.062.
[26] GUCLUT F, ATILGAN A R, ATILGAN C. Dynamic community composition unravels allosteric communication in PDZ3[J]. The Journal of Physical Chemistry B, 2021, 125(9): 2266-2276. DOI:10.1021/acs.jpcb.0c11604.
[27] ABBARIKI T N, GONDA Z, KEMLER D, et al. The LIM domain protein nTRIP6 modulates the dynamics of myogenic differentiation[J]. Scientific Reports, 2021, 11: 12904. DOI:10.1038/s41598-021-92331-8.
[28] CAO M J, CAO A L, LI Y C, et al. Effects of magnetic nanoparticles plus microwave on the thawing of largemouth bass (Micropterus salmoides) fillets based on iTRAQ quantitative proteomics[J]. Food Chemistry, 2019, 286: 506-514. DOI:10.1016/j.foodchem.2019.02.051.
[29] LAN W Q, ZHAO Y N, GONG T S, et al. Effects of different thawing methods on the physicochemical changes, water migration and protein characteristic of frozen pompano (Trachinotus ovatus)[J]. Journal of Food Biochemistry, 2021, 45(8): e13826. DOI:10.1111/jfbc.13826.
[30] WEN Y, ALIMOV A P, MCCARTHY J J. Ribosome biogenesis is necessary for skeletal muscle hypertrophy[J]. Exercise and Sport Sciences Reviews, 2016, 44(3): 110. DOI:10.1249/jes.0000000000000082.
[31] VALVERDE R, EDWARDS L, REGAN L. Structure and function of KH domains[J]. The FEBS Journal, 2008, 275(11): 2712-2726. DOI:10.1111/j.1742-4658.2008.06411.x.
[32] QIAN S Y, LI X, LIU C J, et al. Proteomic changes involved in water holding capacity of frozen bovine Longissimus dorsi muscles based on DIA strategy[J]. Journal of Food Biochemistry, 2022, 46(10): e14330. DOI:10.1111/jfbc.14330.
[33] ZHANG S H, KANG Z H, CAI H F, et al. Identification of novel alternative splicing of bovine lncRNA lncFAM200B and its effects on preadipocyte proliferation[J]. Journal of Cellular Physiology, 2021, 236(1): 601-611. DOI:10.1002/jcp.29887.
[34] 張淼. 應激過程中組織和細胞內HSPs表達與應激性損傷機理研究[D].?南京: 南京農業大學, 2011.
[35] GU L H, CHEN J L, HU C J, et al. Integrated transcriptomics and metabolomics study of embryonic breast muscle of Jiaji ducks[J]. 2023, 452: 131214. DOI:10.21203/rs.3.rs-3444280/v1.
[36] ZHAO Y, LYKOV N, TZENG C M. Talin?1 interaction network in cellular mechanotransduction[J]. International Journal of Molecular Medicine, 2022, 49(5): 1-12. DOI:10.3892/ijmm.2022.5116.
[37] DU L L, CHANG T P, AN B X, et al. Transcriptome profiling analysis of muscle tissue reveals potential candidate genes affecting water holding capacity in Chinese Simmental beef cattle[J]. Scientific Reports, 2021, 11(1): 11897. DOI:10.1038/s41598-021-91373-2.
基金項目:2022湖南省農業產業技術體系項目(湘農發2022-67);湖南省重點研發計劃項目(2022NK2035)
第一作者簡介:林穎(1998—)(ORCID: 0009-0002-1084-4517),女,碩士研究生,研究方向為食品生物技術。E-mail: linying2310@163.com
*通信作者簡介:李宗軍(1967—)(ORCID: 0000-0001-7495-3822),男,教授,博士,研究方向為食品生物技術。E-mail: hnlizongjun@163.com

