血漿抗凝血酶Ⅲ、D-二聚體、纖維蛋白原降解產物聯合檢測在突聾患者診斷和治療中的臨床分析
諶祎瑋,王 寧,肖旭平,周建波
湖南省人民醫院耳鼻喉咽喉頭頸外科,湖南 長沙 410005
2019年,美國耳鼻咽喉頭頸外科基金會更新了突發性聾(SHL)的臨床實踐指南[1]。SHL 中聽力損失可以是傳導性、感音神經性或混合性。突發感音神經性聾(SSNHL)是SHL 的一個亞型,SSNHL 作為耳鼻喉科常見急癥,其發病率呈逐年上升趨勢[2],常伴隨耳鳴、眩暈、耳悶脹感、聽覺過敏、耳周感覺異常,嚴重影響患者生活質量,部分患者還會面臨一定程度的精神心理方面問題,如焦慮、抑郁、睡眠障礙等[3]。SSNHL病因與發病機制目前尚不明確,多與炎癥反應和微循環障礙相關。其中內耳微循環障礙學說的觀點被大部分學者接受,認為由于多因素導致內耳血管痙攣、栓塞、出血等,引起局部毛細血管擴張、組織水腫、缺血缺氧、代謝紊亂等,進而導致SSNHL 的發生。因此,改善內耳微循環是治療SHL 的關鍵[4]。因此,本研究通過對血漿抗凝血酶Ⅲ(AT-Ⅲ)、D-二聚體(D-dimer)、纖維蛋白原降解產物(FDP)的聯合分析,探討微血栓形成在SSNHL中的臨床價值,從而為臨床的治療及疾病的預后提供理論支持。現將結果報告如下。
1 資料與方法
1.1 一般資料
選取2021 年1 月—2022 年5 月湖南省人民醫院收治的60 例SHL 患者作為突聾組,另選70 例同期住院治療的鼻中隔偏曲、聲帶息肉、耳前瘺管、成人鼾癥中聽力正常患者作為對照組。突聾組男33例,女27例;年齡20~69歲,平均年齡(45.25±3.38)歲;發病時間1 周~1 個月;根據治療前的純音聽閾結果參照國內2015年指南分型意見將突聾組患者分為:低頻下降型(低頻組)12例、高頻下降型(高頻組)18 例、平坦型和全聾型(統稱為全頻型,全頻組)30例。
對照組男41 例,女29 例;年齡32~66 歲;平均年齡(44.66±4.58)歲。兩組患者一般資料具有可比性(P>0.05)。本研究經醫院倫理委員會審批通過。
納入標準:突聾組患者均符合SSNHL診斷標準;突聾組患者在入院前均未接受過治療;所有患者1 個月內未服用過抗血小板、抗凝和溶栓類藥物;所有患者自愿參加本次研究,且患者及家屬均簽署知情同意書。
排除標準:心、腦、肝、腎、自身免疫性疾病,惡性腫瘤,重癥肝病,可能導致凝血功能異常的血液系統疾病。
1.2 方法
兩組患者均禁食禁飲8 h,抽取靜脈血2 mL,離心后分離出血漿冷凍待檢。采用發色底物法檢測血漿AT-Ⅲ活性水平,采用免疫比濁檢測血漿D-Dimer、FDP 含量。觀察兩組患者的血漿AT-Ⅲ、D-Dimer、FDP水平。
1.3 統計學方法
應用SPSS 22.0 軟件進行統計分析。計量資料以均數±標準差(±s)表示,經正態性檢驗與方差齊性檢驗后,正態分布且方差齊性的計量資料,組間比較行LSD-t檢驗,組內比較行單樣本t檢驗,偏態分布的數據用秩和檢驗。計數資料以例數和百分比(%)表示,組間比較采用χ2或Fisher檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者實驗指標情況
突聾組D-dimer、FDP 水平低于對照組,AT-Ⅲ高于對照組,差異有統計學意義(P<0.05),見表1。
表1 兩組患者實驗指標情況(±s)
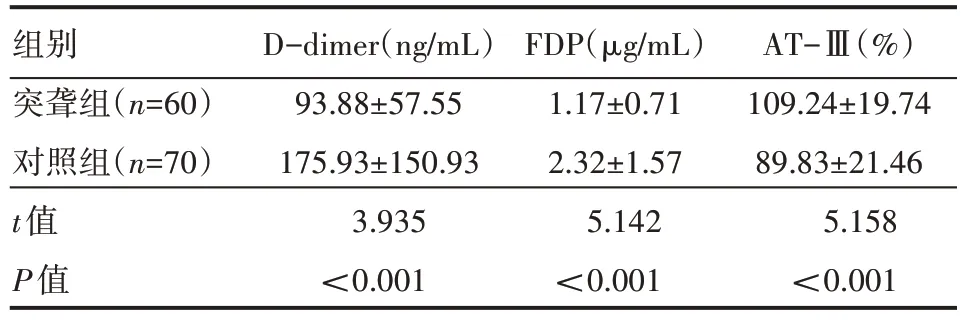
表1 兩組患者實驗指標情況(±s)
組別突聾組(n=60)對照組(n=70)t值P值D-dimer(ng/mL)93.88±57.55 175.93±150.93 3.935<0.001 FDP(μg/mL)1.17±0.71 2.32±1.57 5.142<0.001 AT-Ⅲ(%)109.24±19.74 89.83±21.46 5.158<0.001
2.2 各組實驗指標情況
高頻組、全頻組D-dimer、FDP 水平高于對照組、低頻組,AT-Ⅲ水平低于對照組、低頻組,差異有統計學意義(P<0.05),見表2。
表2 各組實驗指標情況(±s)

表2 各組實驗指標情況(±s)
a表示與對照組比較,P<0.05;b表示與低頻組比較,P<0.05。
組別對照組(n=70)突聾組(n=60)低頻組(n=12)高頻組(n=18)全頻組(n=30)F值P值D-dimer(ng/mL)93.88±57.55 FDP(μg/mL)1.17±0.71 AT-Ⅲ(%)109.24±19.74 98.58±46.99 184.11±140.27ab 201.97±175.37ab 7.896<0.005 1.23±0.55 2.83±1.48ab 2.45±1.72ab 14.588<0.005 105.37±14.93 89.62±16.80ab 73.73±23.42ab 12.839<0.005
3 討論
SHL 是指在不明原因的情況下發生的聽力損失,常在3 d 內出現的急性感音神經性聽力下降,是耳內科的常見病、多發病。SHL 起病急、病程短,患者主觀感受較強,部分患者伴有耳鳴、眩暈、耳悶,甚至出現焦慮、抑郁等心理癥狀,嚴重影響患者的生活及工作,近年來隨著生活壓力的增加,SHL 的發病率逐年上升。目前,SSNHL 病因及發病機制暫不明確,可能與內耳血管痙攣、病毒感染、血管微循環因素、傳染性疾病、自身免疫性內耳疾病等有關[6],而現有的治療方案主要是通過改善內耳微循環來進一步挽救聽力。
中華醫學會發布了《突發性聾診療指南(2015)》[7],按照聽力損失的類型,將SHL 分為低頻型、高頻型、平坦型及全聾型。不同類型的發病機制也不同。低頻下降型SSNHL 多以輕、中度聽力損失為主,下降頻率主要集中在1 000 Hz 及以下,其主要發病機制可能與內耳膜迷路積水[8]、螺旋韌帶供血障礙相關,因該類型主要損失耳蝸頂周毛細胞,此處正常代謝耗氧量較少,且血供較蝸底豐富,耐受力較好,故該類型患者預后較好。高頻下降型SSNHL主要表現為2 000 Hz及以上頻率的聽力受損,多數患者伴有嚴重的耳鳴,在疾病發生早期,耳鳴較為明顯,常可掩蓋聽力損失,從而延誤治療時機,其治療總體有效率是所有類型中最低的,可能與該聽力區域存在螺旋韌帶局部供血障礙、Corti 器的缺氧[9]導致外毛細胞(最多50 dB 聽力損失)或者內毛細胞(至少60 dB 聽力損失)損傷。毛細胞損傷是不可逆的,在治療中恢復較為困難,故及時就診早期治療尤為關鍵。所有頻率均受損的SSNHL根據聽力下降程度可分為平坦型及全聾型,其中平坦下降型損傷較全聾型輕,但目前兩者的主要發病機制多與血管痙攣、血管栓塞、血栓形成相關[9],故治療靶點一致,都致力于解決微循環障礙。目前各類型發病機制仍不能完全闡明,其治療及預防上有一定難度,但內耳微循環障礙是比較公認的病因之一[10]。耳蝸位于顳骨內,為迷路動脈的末梢動脈,血供非常單一。當迷路動脈出現血栓栓塞、血管痙攣等急性病變時,不能及時有效地形成側支循環代償,內耳微循環會出現障礙,在缺血缺氧的情況下,血管內皮細胞受損、氧自由基增加,進一步導致內耳毛細胞、蝸神經損害,從而出現聽力下降、耳鳴、眩暈、耳悶等癥狀。本研究通過對AT-Ⅲ、D-dimer、FDP 的聯合分析,探討微血栓形成在SSNHL中的臨床價值。
D-dimer是交聯纖維蛋白相關的一種特異性降解產物,其分子量約62 ku,在體內半衰期約3 h,主要經腎臟排泄與網狀內皮系統破壞。正常機體內,纖溶酶和抑制酶處于動態平衡,當出現急性血栓時,由于凝血和纖維蛋白溶解系統的雙重激活,D-dimer 值會升高,是體內早期血栓形成的重要指標之一,也是目前血液高凝狀態和纖溶亢進的重要指標。D-dimer 常用酶聯免疫吸附、膠體金免疫過濾檢測、乳膠顆粒凝集等方法來檢測,簡單、快速且有較高的敏感性,在血栓形成性疾病、溶栓治療評估、心腦血管疾病的發生中有重要診斷價值[11]。
FDP 是在纖溶亢進時,在纖維蛋白溶解酶的作用下所產生的產物,包括Fg降解產物、非交聯纖維蛋白,是纖溶亢進的標志性指標,FDP 增高反應纖溶功能亢進。有研究[12]結果表明,FDP 可以調節炎癥細胞的粘連和趨附,刺激血管內皮細胞和血液中單核細胞、白細胞、可溶性粘附分子和細胞因子的表達增加,進而導致一系列炎性反應,損耗毛細胞內外環境,引起毛細胞損傷,導致全血黏稠度增加、血液流變學改變,進而微血管血栓形成,從而參與突聾發生。
AT-Ⅲ是體內重要的天然抗凝蛋白,主要由肝細胞、血管內皮細胞合成的絲氨酸蛋白酶抑制物,維生素K 依賴的可抑制凝血酶活性,血漿中抗凝血酶活性基本來源于AT-Ⅲ,是重要的生理性抗凝物。血栓前狀態或者血栓形成性疾病時,由于消耗過多,常引起AT-Ⅲ偏低,從而影響血液流變學及血液粘滯度。
突聾組患者D-dimer、FDP 水平高于對照組,AT-Ⅲ水平低于對照組,與國內相關研究[13]結果類似。低頻組各項指標與對照組相比,差異無統計學意義,這可能是低頻下降型突聾主要病因為耳蝸頂轉毛細胞水腫受損,該處毛細胞代謝消耗氧量較低,且血供較為豐富,所以對缺血缺氧耐受性較好,故血栓相關性指標無明顯改變,不建議常規使用改善血液循環類藥物[14]。高頻下降型患者主要是蝸底毛細胞受損,該區域毛細胞比較脆弱,容易受到缺血缺氧環境影響,耳蝸毛細胞損傷為不可逆性。本研究結果表示,盡早使用溶栓類藥物,可降低血液黏稠度,盡早實現血流再灌注,減輕毛細胞損傷,保護神經細胞。全頻組患者有不同程度的微循環障礙、血管痙攣、血栓形成,故個體化藥物使用,在治療上加用溶栓類藥物,可以有效地增加血流灌注量、改善局部缺血缺氧狀態,對控制病情、緩解癥狀有一定的臨床意義,能為患者聽力的挽救贏得時間。
綜上所述,目前突發性耳聾發病機制尚不明確,但內耳微循環障礙是目前較為公認的原因之一。故AT-Ⅲ、Ddimer、FDP聯合檢測方便快捷,準確度較高,可為臨床上不同類型患者溶栓治療提供理論依據,進而制定個體化診療方案,使用改善微循環、溶栓類藥物,以獲得更好的臨床療效。但本研究上需要樣本量有限,且沒有比較治療前后AT-Ⅲ、D-dimer、FDP 等指標的變化,尚需要多中心大樣本的研究。

