仿制藥專利聲明中1類聲明數據分析及對仿制藥研發的啟示Δ
汪宇 ,顧東蕾 (1.中國藥科大學黨委辦公室,南京 211198;2.中國藥科大學圖書與信息中心,南京 211198)
藥品專利早期糾紛解決機制,亦稱藥品專利鏈接制度,是指藥品上市審評審批過程中,藥品上市許可申請人與有關專利權人或者利害關系人,因申請注冊的藥品相關的專利權產生糾紛的,相關當事人可以向人民法院起訴,請求就申請注冊的藥品相關技術方案是否落入他人藥品專利權保護范圍作出判決。其目的是使藥品審批程序與藥品相關專利進行關聯,降低可能發生的專利侵權風險。建立符合我國國情的藥品專利鏈接制度,是平衡原研藥企和仿制藥企間利潤分配、應對不同程度的公共衛生領域健康安全風險、促進新藥研發、鼓勵仿制藥發展以及防止因專利侵權而造成的社會資源浪費等一系列問題的根本之舉[1]。與國外相比,我國藥品專利鏈接制度起步較晚,于2021年才正式實施,仍處于起步階段,還有部分問題未能引起重視。
“藥品專利聲明”是藥品專利鏈接制度的基本構成單元之一,指仿制藥申請人在藥物上市前的申請注冊環節對仿制藥物的基本信息和專利權利狀態進行聲明,其目的是不與其他藥品專利內容產生沖突,由此造成專利糾紛[2]。2021年國家藥品監督管理局和國家知識產權局出臺的《藥品專利糾紛早期解決機制實施辦法(試行)》第六條將專利聲明類型分成4類,其中的1類聲明是指中國上市藥品專利信息登記平臺中沒有登記被仿制藥的相關專利信息,是我國仿制藥研發面臨最多的情形。因此,本文以仿制藥的1類聲明數據為切入點,探討近幾年1類聲明制度施行的現狀,并結合我國的醫藥市場實踐,剖析我國仿制藥的1類聲明制度可能存在的問題,為完善中國藥品專利鏈接制度,增強中國上市藥品專利信息登記平臺的功能提供依據,同時為仿制藥企選擇合適的仿制藥品種提供參考。
1 數據來源及方法
1.1 數據來源
以國家藥品監督管理局、中國上市藥品專利信息登記平臺、國家知識產權局等網站為數據源,以中國藥品專利1類專利申明登記的藥品名稱及對應的藥品專利號為關鍵詞,檢索相關數據。檢索截止日期為2023年3月31日,部分信息的修正截止日期為2023年8月31日。
1.2 研究方法
對中國上市藥品專利信息登記平臺上的1類聲明進行整體分析,即確定藥品并根據專利信息聲明事項進行逐一比對或適當描述,找出仿制藥聲明居多的品種,預判研發市場傾向以供仿制藥企借鑒。整體分析亦是對1類聲明數據的宏觀把握和分析,可發現當前1類聲明中存在的問題。
在此基礎上,進一步對1類聲明中數量綜合排名靠前的品種進行剖析,包括其1類聲明狀態及獲批狀態,同時分析其市場銷售情況,為仿制藥企追蹤仿制藥品種提供線索。
2 結果
2.1 仿制藥1類聲明整體數據分析
在2021年7月9日-2023年3月31日登記的1類聲明共涉及797種通用名藥物,涉及976個不同仿制藥廠家。不同藥品注冊類型的1類聲明統計情況見表1。

表1 不同藥品注冊類型的1類聲明統計情況
截至2023年3月31日,對仿制藥1類聲明數據的挖掘發現,由于藥品專利聲明制度對原研藥專利權人初次登記的要求尚不全面,影響了仿制藥企從登記聲明中及時了解原研藥研發、生產進展,會出現部分原研藥品種在發布1類聲明一段時間后,原研藥專利權人對其專利信息進行補充登記公示的情況,導致仿制藥企必須重新制定研發和生產方略,以規避發布的聲明范圍,避免法律糾紛。例如,四川科倫藥業股份有限公司、宜昌人福藥業有限責任公司和樂普制藥科技有限公司分別于2021年的8月18日、12月11日及2022年的2月11日對輝瑞公司的枸櫞酸托法替布緩釋片(規格11 mg,批準文號為國藥準字HJ20210071)提出了1類聲明,但在批準等待過程中,作為原研專利人的輝瑞公司又于2022年11月22日對該藥的專利信息進行了補充登記公示,而作為仿制藥企的四川科倫藥業股份有限公司和宜昌人福藥業有限責任公司則只能重新提交聲明,以避免陷入專利侵權糾紛。直到2023年8月15日,這2家仿制藥企才獲批藥品生產批準文號。這種情形反映了藥品專利聲明制度設計的缺陷——盡管藥品專利聲明制度對仿制藥企起到了很好的約束作用,但對原研藥專利權人濫用權利的約束措施不完善,這可使原研藥專利人利用中國上市藥品專利信息登記平臺錄取信息登記不全的漏洞,將一批藥品專利分不同批次報送,以此延長專利保護期,從而獲得政策紅利。這種行為無疑損害了仿制藥企合法利用專利的權利。
筆者在對仿制藥1類聲明數據的挖掘中還發現另一種情況——個別藥品在已具有原研藥專利公示的情況下,仍公開仿制藥1類聲明。例如,山東京衛制藥有限公司對H·隆德貝克有限公司的氫溴酸伏硫西汀片(規格分別為5、10 mg,批準文號分別為國藥準字HJ20170381、國藥準字HJ20170383)于2022年11月23日提出了1類聲明,但原研藥企H·隆德貝克有限公司已經于2021年7月5日進行了專利信息登記公示。這有可能是因為當前中國上市藥品專利信息登記平臺主要依賴《中國上市藥品目錄集》收集藥品專利信息,但由于《中國上市藥品目錄集》僅對“特定藥品”專利信息的基礎內容實現了基本全面公開,而對于“其他藥品”的專利信息只公開了基礎信息,如專利號、類型、專利到期時間等,反而對一些能幫助仿制藥企提前規避可能出現專利糾紛的藥品專利法律狀態并未進行收集,甚至還有一些藥品在《中國上市藥品目錄集》中的專利信息一欄顯示為空白。這直接影響了仿制藥企的信息收集和判斷,導致其無法提前規避侵權風險。故截至2023年8月15日,山東京衛制藥有限公司對于該藥的1類聲明仿制藥還未獲批。
2.2 不同類型仿制藥品的1類聲明和市場分析
2.2.1 中藥仿制藥
截至2023年3月31日,涉及中藥同名同方藥的1類聲明只有1件,由浙江佐力藥業股份有限公司針對杭州中美華東制藥有限公司的百令膠囊(批準文號為國藥準字Z10910036)提出。百令膠囊從1997年至2011年獲得了15年的中藥品種保護期。截至2023年3月31日,浙江佐力藥業股份有限公司仍未見獲批。
2.2.2 生物制品仿制藥
截至2023年3月31日,10家仿制藥企對10家藥品上市許可持有人的14款治療用生物制品原研藥提出了26件1類聲明。截至2023年5月31日,已有6種生物類似藥獲批,詳見表2。
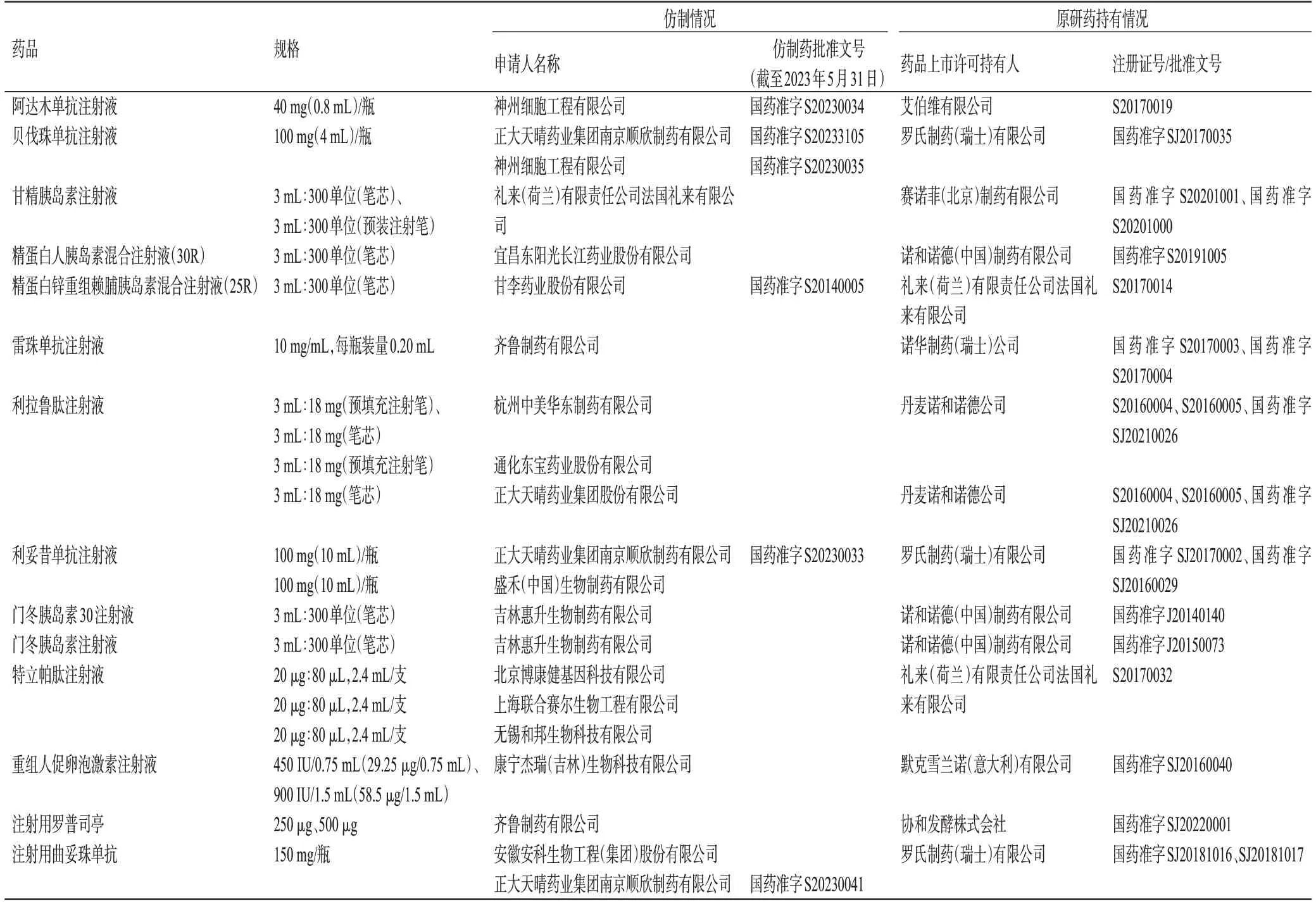
表2 治療用生物制品1類聲明數據
2.2.3 化學仿制藥
從表1統計數據來看,化學仿制藥1類聲明占到總數的99%以上。因此,本研究選取化學仿制藥1類聲明件數排前5位的品種進行剖析,為仿制藥企的品種篩選提供參考和借鑒。
(1)他達拉非片。他達拉非片是治療男性勃起功能障礙的藥物。據米內網數據統計的中國樣本醫院(包括城市公立、城市社區、縣級公立、鄉鎮衛生醫療機構)年度銷售數據顯示:2019年至2021年他達拉非片的年度銷售額依次為13 454萬、10 239萬、13 135萬元;據中國城市實體藥店年度銷售數據顯示,2019年至2021年他達拉非片的年度銷售額依次為67 928萬、76 711萬、94 226萬元;2022年他達拉非片在中國的銷售額約為12.17億元,躍居2022第一季度中國城市實體藥店終端化學藥前20位產品的第14位。
截至2023年6月30日,藥品上市許可持有人美納里尼(中國)投資有限公司在中國獲批上市美國禮來制藥有限公司生產的他達拉非片的規格有2.5、5、10、20 mg(H20170284、H20170285、H20170283、H20170286、國藥準字H20170021、國藥準字H20170022)。24家仿制藥企對他達拉非片(規格為2.5、5、10、20 mg)提出了41件1類仿制藥專利聲明(截至2023年3月31日),其中已有4家企業獲批,分別為海南卓力制藥有限公司(國藥準字H20233199,規格20 mg)、河南羚銳制藥股份有限公司(國藥準字H20233764,規格20 mg)、江蘇聯環藥業股份有限公司(國藥準字H20233231,規格20 mg)和上海匯倫江蘇藥業有限公司(國藥準字H20233235、國藥準字H20233240,規格為20、5 mg)。
(2)玻璃酸鈉滴眼液。玻璃酸鈉滴眼液是一種人工淚液,主要用于治療干眼癥以及角結膜上皮損傷修復等。米內網數據顯示,玻璃酸鈉滴眼液2022年在中國公立醫療機構的終端銷售額超過7億元。
截至2023年7月9日,藥品上市許可持有人日本參天制藥株式會社在中國獲批上市玻璃酸鈉滴眼液的規格有0.1%(10 mL∶10 mg)、5 mL∶15 mg(0.3%)、0.3%(0.4 mL∶1.2 mg)、0.1%(0.4 mL∶0.4 mg)(國藥準字H20150150、國藥準字H20171192、國藥準字H20130587、國藥準字H20130585)。23家仿制藥企對玻璃酸鈉滴眼液[0.1%(10 mL∶10 mg)、5 mL∶15 mg(0.3%)、0.3%(0.4 mL∶1.2 mg)、0.1%(0.4 mL∶0.4 mg)]提出了31件1類仿制藥專利聲明(截至2023年3月31日),目前還未見獲批。
(3)磷酸奧司他韋膠囊。磷酸奧司他韋膠囊是神經氨酸酶抑制劑,只對甲型和乙型流感起預防和治療兩方面的作用。藥融云數據庫顯示,磷酸奧司他韋膠囊2022年的國內銷售額為8.6億元,約占奧司他韋市場總額的38%。東陽光藥業發布的2022年年報顯示,磷酸奧司他韋膠囊2021、2022年的銷售額分別為0.85億、5.07億元。
截至2023年7月10日,藥品上市許可持有人上海羅氏制藥有限公司在中國獲批上市磷酸奧司他韋膠囊的規格有30、45、75 mg(國藥準字H20140342、國藥準字H20140344、國藥準字H20140828、國藥準字H20140343)。16家仿制藥企對磷酸奧司他韋膠囊(規格有30、45、75 mg)提出了20件1類仿制藥專利聲明(截至2023年3月31日),其中已有4家企業獲批,分別為北京雙鷺藥業股份有限公司(國藥準字H20223918、國藥準字H20223919,規格為30、75 mg)、重慶圣華曦藥業股份有限公司(國藥準字H20233404,規格75 mg)和珠海同源藥業有限公司(國藥準字H20233859,規格75 mg)。
(4)磷酸奧司他韋干混懸劑。磷酸奧司他韋干混懸劑是神經氨酸酶抑制劑,只對甲型和乙型流感起預防和治療兩方面的作用。米內網數據顯示,2022年中國三大終端(公立醫院終端、零售藥店終端和公立基層醫療機構終端)六大市場(城市公立醫院市場、縣級公立醫院市場、實體藥店市場、網上藥店市場、城區社區衛生中心市場和鄉鎮衛生院市場)的磷酸奧司他韋干混懸劑銷售額合計近40億元。其中,院內市場(公立醫院終端+公立基層醫療機構終端)是主要銷售渠道,增長超過160%;在院外市場(零售藥店終端,城市實體藥店+網上藥店)的增速更大,超過200%。
截至2023年8月5日,藥品上市許可持有人Hetero Labs Limited在中國獲批上市磷酸奧司他韋干混懸劑的規格為0.36 g(國藥準字HJ20210075),2家仿制藥企對磷酸奧司他韋干混懸劑(規格0.36 g)提出了2件1類仿制藥專利聲明(截至2023年3月31日),目前還未見獲批。
(5)鹽酸烏拉地爾注射液。鹽酸烏拉地爾注射液是高血壓急癥的一線治療藥物,在臨床中被廣泛應用于高血壓危象、外科手術降壓及預防血壓峰值等各種降壓治療。根據醫藥魔方數據庫的銷售數據統計結果,鹽酸烏拉地爾注射液2022年的市場容量在4 000萬支左右,銷售額超過12億元。米內網數據顯示,2022年中國公立醫療機構終端的鹽酸烏拉地爾注射液銷售額超過10億元。
截至2023年7月11日,藥品上市許可持有人武田制藥有限公司在中國獲批上市鹽酸烏拉地爾注射液的規格為5 mL∶25 mg(國藥準字HJ20160363)。20家仿制藥企對鹽酸烏拉地爾注射液(規格5 mL∶25 mg)提出了20件1類仿制藥專利聲明(截至2023年3月31日),其中已有3家企業獲批,分別為石家莊四藥有限公司(國藥準字H20233626)、錦州奧鴻藥業有限責任公司(國藥準字H20233175)和江西青峰藥業有限公司(國藥準字H20233621)。
通過上述分析可知,1類聲明件數排前5位的化學類藥物品種,其原研藥均是在公眾健康、醫療市場、臨床診斷等方面有不俗表現的主流藥物。對公眾而言,仿制藥能夠打破專利壟斷,使其享受遠遠低于原研藥的價格。對藥品企業而言,專利聲明制度以制度協作的方式實現了藥品專利權人和仿制藥企、社會公眾與藥品生產制造商、藥品可及性與知識產權壟斷權之間的平衡。
3 討論及建議
本研究對2021年7月9日-2023年3月31日中國上市藥品專利信息登記平臺登記的1類聲明的相關數據進行挖掘和分析,發現涉及3類、4類及5.2類化學藥品,3.3類治療用生物制品和4類中藥等。依賴中國上市藥品信息登記平臺獲得的原研藥的實際信息資料,切實實現了規避因原研藥專利情況不透明可能產生的早期糾紛的大部分設想,但因制度設計存在原生缺陷,還是有些問題無法避免。為了進一步完善我國的藥品專利鏈接制度,筆者提出如下建議。
3.1 完善中國上市藥品專利信息登記平臺功能
筆者在整理1類聲明數據時發現,盡管1類聲明制度在規避仿制藥品研制早期糾紛方面發揮了顯著作用,但仍存在少量未能避免的糾紛:一類情形是部分品種在1類聲明后,其原研藥又進行了專利信息的登記公示,如前文所述的枸櫞酸托法替布緩釋片;另一類情形是部分品種在原研藥已經作出專利信息登記公示的前提下,還提出了1類聲明,如前文所述的氫溴酸伏硫西汀片。這2類情形可能會導致原研藥企與仿制藥企的后期糾紛,同時反映出當前我國藥品專利鏈接制度尚有缺陷。對此,筆者建議藥監部門在中國上市藥品專利信息登記平臺設立專門通知“登記”及“異議”的板塊,即仿制藥申請人在其申請被受理后規定的工作日內,不僅應當將其作出的最新專利聲明及聲明依據通知原研藥的藥品上市許可持有人,還應當將能夠證明其已作出有效通知的相關證明材料登記在該平臺上。此外,藥監部門可以對已登記的存有異議的專利聲明提供可申訴板塊,讓仿制藥申請人提供相應證明和理由[3],供其他同類競爭企業查詢。
3.2 建立知情權救濟機制
藥監部門可建立知情權救濟機制,原研藥的藥品上市許可持有人或專利權人在接到通知后如有異議,應當在規定期限內在中國上市藥品專利信息登記平臺的相應板塊向藥監部門提出。因藥品上市許可持有人的緣由致使專利權人未獲知專利聲明相關事宜的,應當根據實際情況減輕或免除仿制藥申請人的責任,并對藥品上市許可持有人作出相應的行政處罰。
3.3 建立依職權審查機制
藥監部門可設置依職權審查機制,包括形式審查和實質審查。形式審查主要針對專利聲明的各項格式,如專利號的書寫、原研藥批準文號的標注等;實質審查主要針對專利聲明的準確性,如提出的1類聲明所對應的品種在中國上市藥品專利信息登記平臺上是否登記。并且在追蹤審查提出1類聲明后原研藥再被公示專利信息時,建議對仿制藥企提出的1類聲明有誤的進行警示,對仿制藥企故意不提出1類聲明或故意提出有誤的1類聲明的依法處理。
3.4 加強仿制藥企在批準等待期的數據跟蹤
針對原研藥藥品上市許可持有人或專利權人持續登記外圍專利對抗仿制藥上市的情況,一方面建議仿制藥企在提出1類聲明前,應該進行平臺全面檢索,確認原研藥企沒有進行相關的專利信息公示。如除了檢索在中國上市藥品專利信息登記平臺上登記的處方、工藝、用途等類型專利信息外,還應進一步檢索其活性成分、劑型、晶體等專利信息。仿制藥企在提出1類聲明后,應該進行平臺跟蹤檢索,確認原研藥企后續沒有進行相關的專利信息公示,以進一步規避專利侵權風險,確保仿制藥順利研發上市。
3.5 增設仿制藥品種篩選功能
建議中國上市藥品專利信息登記平臺在自身建設時,可進一步主動增設關于仿制藥品種篩選功能,增加市場銷售數據收集和分析功能。此外,該平臺可進一步跟蹤化學仿制藥1類聲明的發展數據,同時結合國家藥品監督管理局等五部委聯合頒布的《第三批鼓勵仿制藥品目錄》[4―5],跟蹤其原研藥企專利信息公示的進展,適時篩選仿制藥品種以供參考。
綜上,無論原研藥是否在國內獲批,以藥品專利鏈接制度為依托的中國上市藥品信息登記平臺均可幫助仿制藥企獲得原研藥的實際信息資料,切實發揮了規避可能產生的早期侵權糾紛的重要作用。我國應完善藥品專利鏈接制度,通過建立知情權救濟機制和建立依職權審查機制,完善中國上市藥品專利信息登記平臺功能,通過加強仿制藥企在批準等待期的數據跟蹤以及增設仿制藥品種篩選功能,從而為仿制藥企適時篩選仿制藥品種提供參考。

