血細胞參數在評估原發性高血壓患者并發頸動脈粥樣硬化中的價值
錢禹林,沈國飛
1.蘇州市吳江區中醫醫院心內科,江蘇 蘇州 215221;2.蘇州市吳江區中醫醫院內分泌科,江蘇 蘇州 215221
原發性高血壓與動脈粥樣硬化互為因果,互相促進,因此,對原發性高血壓動脈粥樣硬化的監測十分必要。越來越多的研究顯示,血細胞及其相關參數如中性粒細胞、淋巴細胞、中性粒細胞與淋巴細胞比值(NLR)等與動脈粥樣硬化有關。本研究通過分析血細胞參數與原發性高血壓患者并發頸動脈粥樣硬化(CAS)的關系,為臨床早期識別及動態評估原發性高血壓患者并發CAS 提供數據支持及預測模型,現將研究結果報告如下。
1 資料與方法
1.1 一般資料
選取2021 年1 月—2022 年6 月經蘇州市吳江區中醫醫院心血管內科第一診斷為原發性高血壓的123 例患者作為研究對象,將頸動脈正常的患者列為對照組(60 例),合并CAS 的患者列為觀察組(63 例)。納入標準:所有患者均符合原發性高血壓診斷標準[1],未使用降壓藥物的情況下,非同日3 次測量血壓,收縮壓≥140 mmHg(1 mmHg=0.133 kPa)和/或舒張壓≥90 mmHg;或既往有高血壓史,目前正在使用降壓藥物。排除標準:繼發性高血壓,感染性疾病,血液系統疾病,免疫性疾病,惡性腫瘤,其他慢性消耗性疾病,嚴重肝腎功能異常,2 周內未服用影響血細胞生成和功能的藥物,資料不全。本研究經醫院醫學倫理委員會審批通過。
1.2 方法
1.2.1 病史采集及體格檢查 病史采集包括年齡、性別、既往史、服藥史等。體格檢查包括身高、體重、血壓、體重指數(BMI)。將中華人民共和國衛生行業標準《成人體重判定》(WS/T 428—2013)作為成人超重和肥胖的判定依據[2]。超重:24.0 kg/m2≤BMI<28.0 kg/m2;肥胖:BMI≥28.0 kg/m2。血壓測量使用魚躍牌臺式汞柱血壓計(蘇械注準20152070945),以患者安靜休息15 min 后3 次測量的收縮壓和舒張壓的平均值為記錄值。
1.2.2 頸動脈粥樣硬化的測定及判定標準 使用PhilipsIU22 彩色多普勒超聲診斷儀,測定頸動脈各段內膜中層厚度,取平均值為內膜中層厚度(IMT),觀察患者有無粥樣斑塊。頸動脈粥樣硬化的判定標準:IMT>0.9 mm或發現動脈粥樣斑塊[1]。
1.2.3 血細胞參數的測定 采集患者靜脈血3 mL,使用Sysmex 2100 型血細胞分析儀,測定白細胞、中性粒細胞、淋巴細胞、嗜酸性粒細胞、單核細胞、紅細胞、血紅蛋白、紅細胞平均體積、平均血紅蛋白量、平均血紅蛋白濃度、紅細胞分布寬度、血小板、平均血小板體積、血小板壓積、血小板分布寬度、大型血小板比率。
1.2.4 實驗室生化指標的測定 采集患者靜脈血3 mL,使用HITACHI7600-020 自動生化分析儀,測定谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、尿酸(UA)、肌酐(CRE)、葡萄糖(GLU)、總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDLC)水平。
1.3 統計學方法
采用SPSS 26.0 軟件進行統計分析。計量資料以均數±標準差(±s)表示,組間比較采用t檢驗。計數資料以例數和百分比(%)表示,組間比較采用χ2檢驗。采用多因素logistic 回歸分析,經單因素分析篩選(P<0.1)自變量,以是否并發CAS 作為因變量,進行向前似然比法(Forword∶LR)回歸分析,建立logistic 回歸模型(納入標準P<0.05,排除標準P>0.1),對回歸參數估計值采用Waldχ2檢驗;ROC 曲線評價建立各模型的預測能力, 計算曲線下面積(AUC),AUC>0.5 表示具有預測價值。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者一般資料
兩組患者年齡、收縮壓比較,差異有統計學意義(P<0.05),見表1。

表1 兩組患者一般資料
2.2 兩組患者血細胞參數情況
兩組患者白細胞、中性粒細胞、單核細胞、淋巴細胞比較,差異有統計學意義(P<0.05);兩組患者其他血細胞參數比較;差異無統計學意義(P>0.05),見表2。
表2 兩組患者血細胞參數情況(±s)
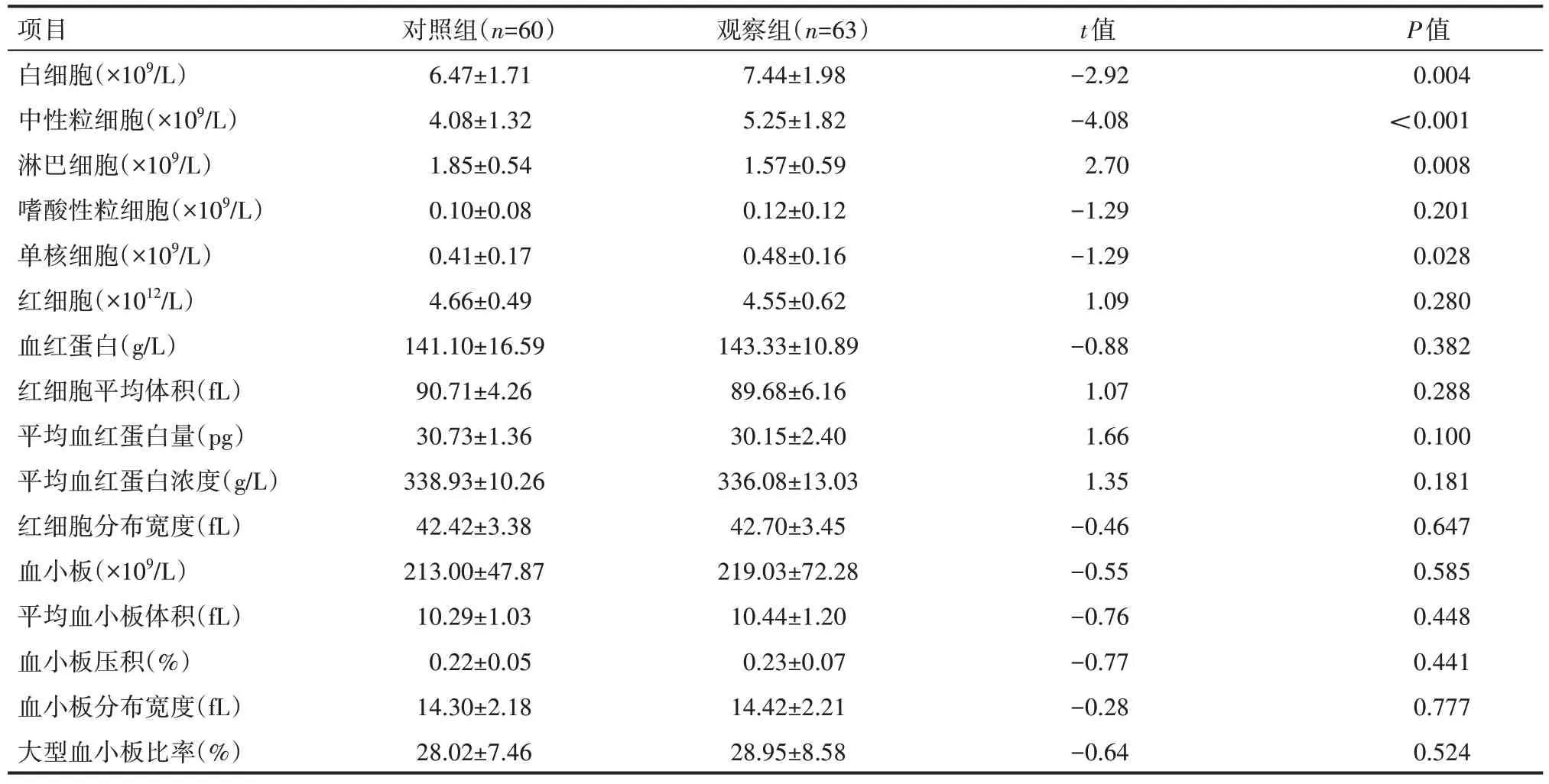
表2 兩組患者血細胞參數情況(±s)
項目白細胞(×109/L)中性粒細胞(×109/L)淋巴細胞(×109/L)嗜酸性粒細胞(×109/L)單核細胞(×109/L)紅細胞(×1012/L)血紅蛋白(g/L)紅細胞平均體積(fL)平均血紅蛋白量(pg)平均血紅蛋白濃度(g/L)紅細胞分布寬度(fL)血小板(×109/L)平均血小板體積(fL)血小板壓積(%)血小板分布寬度(fL)大型血小板比率(%)對照組(n=60)6.47±1.71 4.08±1.32 1.85±0.54 0.10±0.08 0.41±0.17 4.66±0.49 141.10±16.59 90.71±4.26 30.73±1.36 338.93±10.26 42.42±3.38 213.00±47.87 10.29±1.03 0.22±0.05 14.30±2.18 28.02±7.46觀察組(n=63)7.44±1.98 5.25±1.82 1.57±0.59 0.12±0.12 0.48±0.16 4.55±0.62 143.33±10.89 89.68±6.16 30.15±2.40 336.08±13.03 42.70±3.45 219.03±72.28 10.44±1.20 0.23±0.07 14.42±2.21 28.95±8.58 t值-2.92-4.08 2.70-1.29-1.29 1.09-0.88 1.07 1.66 1.35-0.46-0.55-0.76-0.77-0.28-0.64 P值0.004<0.001 0.008 0.201 0.028 0.280 0.382 0.288 0.100 0.181 0.647 0.585 0.448 0.441 0.777 0.524
2.3 原發性高血壓患者并發CAS的多因素logistic回歸分析
經單因素分析篩選,納入原發性高血壓患者并發CAS的多因素logistic 回歸的自變量有年齡、收縮壓、白細胞、中性粒細胞、淋巴細胞、單核細胞。多因素logistic 回歸分析結果顯示,收縮壓、中性粒細胞、淋巴細胞是原發性高血壓并發CAS 的獨立預測因子。差異有統計學意義(P<0.05),見表3。

表3 原發性高血壓患者并發CAS的多因素logistic回歸分析結果
2.4 各檢驗變量ROC曲線相關參數情況
根據NLR=中性粒細胞(×109/L)/淋巴細胞(×109/L)計算NLR。以收縮壓、NLR 建立logistic 回歸模型,形成P-NLR 聯合SBP 預測模型,P-NLR 聯合SBP 預測模型=[1+e-(-35.624+0.220×收縮壓+0.880×NLR)]-1。以收縮壓、中性粒細胞及淋巴細胞建立logistic 回歸模型,形成P-logistic 預測模型,P-logistic預 測 模 型 =[1+e-(-32.382+0.213×收縮壓+0.505×中性粒細胞-1.149×淋巴細胞)]-1。以NLR 建立logistic 回歸模型,形成P-NLR 預測模型,P-NLR 預測模型=[1+e-(-2.575+0.920×NLR)]-1。以中性細胞數建立logistic 回歸模型, 形 成P-N 預 測 模 型, P-N 預 測 模 型= [1+e-(-2.221+0.494×中性粒細胞)]-1。以淋巴細胞數建立logistic 回歸模型,P-L 預測模型=[1+e-(1.568-0.892×淋巴細胞)]-1。以P-logistic 預測模型、P-NLR 聯合SBP 預測模型、P-NLR 預測模型、P-N 預測模型、P-L 預測模型為檢驗變量,以原發性高血壓患者并發CAS為狀態變量作ROC曲線評價,結果顯示,預測能力以P-NLR聯合SBP預測模型最優。見表4。

表4 各檢驗變量ROC曲線相關參數情況
3 討論
近20年來,我國三次高血壓流行病學調查顯示高血壓患病率呈上升趨勢[3]。高血壓常隱匿發生,有時在發現時已出現了動脈粥樣硬化,甚至發展到冠心病、腦卒中和外周血管疾病等嚴重程度[4]。因此,及早發現以及動態評估原發性高血壓患者動脈粥樣硬化情況非常重要。頸動脈多普勒血管超聲因其對CAS 的敏感和非侵入的特點常作為全身動脈粥樣硬化篩查和復查的選擇,但頸動脈多普勒血管超聲目前在基層醫院的全面普及仍不具備條件。而基層醫院迫切希望獲得簡便、穩定、具有高敏感性和特異性的生物學標志物來評價(頸)動脈粥樣硬化情況。
血細胞在臨床上多用于評估人體的整體健康情況。中性粒細胞作為數量占比最多的白細胞,有較強的趨化和吞噬作用,廣泛參與體內炎癥和免疫反應。有研究[5-6]發現,中性粒細胞在動脈粥樣硬化的各個階段發揮重要作用。中性粒細胞在動脈粥樣硬化早期通過聚集加速內皮細胞損傷和功能失調;后期通過釋放活性物質,激活巨噬細胞[7],促進泡沫細胞生成并形成斑塊以及觸發斑塊的不穩定和血栓形成[8-9]。淋巴細胞是體積最小的白細胞,是免疫反應的核心。有研究[10]顯示,淋巴細胞凋亡可導致動脈粥樣斑塊的形成、生長以及斑塊破裂和血栓形成。同時淋巴細胞的減少導致抗炎細胞因子分泌減少,間接影響動脈粥樣硬化進程。單核細胞作為體積最大的白細胞,占白細胞總數的3%~8%,是啟動免疫反應的主要成分。近期研究[11]發現,單核細胞計數和動脈粥樣硬化的嚴重程度密切相關,與參與內源性炎癥反應有關[12]。本研究發現觀察組患者,白細胞、中性粒細胞、單核細胞較對照組升高,淋巴細胞較對照組減少。多因素logistic 回歸分析結果顯示,中性粒細胞、淋巴細胞是原發性高血壓并發CAS 的獨立預測因子。中性粒細胞與淋巴細胞對原發性高血壓并發CAS具有相反的貢獻作用,與既往研究結果一致。
原發性高血壓患者(頸)動脈粥樣硬化目前認為是一種炎癥性疾病[13],呈現出慢性炎癥細胞浸潤的特征。中性粒細胞反映了非特異性炎癥反應,淋巴細胞反映了免疫調控。NLR 因綜合了細胞與體液免疫兩部分信息,且不受血液濃縮或稀釋的影響,成為一種新的具有可及性、可靠性的炎癥標志物,有助于提高臨床評估及預測。相關研究[14]發現,NLR 與頸動脈粥樣患病率相關。劉建峰等[15]研究證實,在高血壓患者中NLR水平與頸動脈內膜厚度呈正相關。本研究建立P-NLR 聯合SBP 預測模型、P-logistic預測模型、P-NLR 預測模型、P-N 預測模型、P-l 預測模型,通過ROC 曲線評價各模型的預測能力,得到的AUC分別為0.892,0.875,0.792,0.699,0.667,表明P-NLR聯合SBP 預測模型診斷效能最優。同時可以看到以收縮壓、NLR構建的P-NLR 聯合SBP預測模型診斷效能優于以收縮壓、中性粒細胞、淋巴細胞構建的P-logistic 預測模型,以NLR 構建的P-NLR 預測模型診斷效能優于以中性粒細胞構建的P-N 預測模型和以淋巴細胞構建的P-L 預測模型,說明構建的模型中NLR比中性粒細胞、淋巴細胞無論單獨或聯合的情況下在診斷或預測方面價值更有優勢。因此,原發性高血壓患者在積極控制已知危險因素的情況下,對NLR 監測有助于提高對原發性高血壓患者并發CAS的預測和評估。
綜上所述,血細胞中,中性粒細胞、淋巴細胞與原發性高血壓并發CAS 密切相關。原發性高血壓患者中,中性粒細胞水平升高并發CAS 風險越高,淋巴細胞水平越低并發CAS風險越高。對NLR測定有助于對原發性高血壓患者并發CAS 的早期篩查、動態評估的開展。但需要指出的是,目前研究發現NLR還與多種疾病的嚴重情況有關。同時考慮到本研究屬于回顧性研究,不能完全排除混雜因素的影響,可能存在偏倚。

