沿黃稻區土壤菌群結構與生態功能研究
田瑩瑩 郭琦 陳星儒 孫向輝 趙京


摘? 要:為了解沿黃稻區不同基質土壤的微生物組成,采集了河灘砂質土壤(sand soil,SS)和毗鄰稻田土壤(paddy soil,PS).利用16S rRNA基因高通量測序技術揭示沿黃稻區土壤菌群的組成及其潛在的生態功能.Alpha多樣性分析顯示兩種土壤的菌群豐富度和多樣性指數無顯著性差異.進一步的物種組成分析,發現unclassified_f? Micrococcaceae、鞘氨醇單胞菌屬(Sphingomonas)、norank_f? noorank_o? Vicinamibacterales、norank_f? Vicinamibacterales在SS和PS中廣布,與土壤基質類型無關豐度,但芽孢桿菌屬(Bacilllus)、硫桿菌屬(Thiobacillus)在PS中的相對豐度顯著高于SS.基于FAPROTAX數據庫的功能熱圖分析顯示PS(尤其是P2_1、P3_1)中芳香烴降解功能序列的相對豐度高于SS,結合菌群相對豐度結果推測類諾卡氏菌屬(Nocardioides)、unclassified_f_Nocardioidaceae是該差異產生的關鍵.SS中光養微生物豐度顯著高于PS,尤以卟啉桿菌(Porphyrobacter)、unclassified_f_Rhodobacteraceae、紅細菌(Rhodobacter)為主的不產氧光合細菌的豐度較高,其中紅細菌科(Rhodobacteraceae)是參與SS生物膜形成的重要微生物.研究表明土壤類型對沿黃稻區菌群組成有一定的影響,并驅動了菌群生態功能分異的形成.
關鍵詞:壤菌群結構;生態功能;稻田土壤;砂質土壤
中圖分類號:S158????? 文獻標志碼:A文章編號:1000-2367(2024)03-0139-11
河南沿黃稻區每年經歷濕地田、旱地的兩熟制管理方式,常年的稻麥輪作方式,人為干擾強烈,土壤有機質含量較高[1].黃河灘地為砂質土壤,有機質含量相對較低,人為干擾少,每年7至10月的黃河主汛期,多數灘地被季節性淹沒[2],其他時間河床裸露干燥,呈旱地特征,并著生以莎草科為主的濕生草本植物.黃河灘地與毗鄰稻田具有相似的干濕交替周期,但二者又有截然不同的土地管理方式,主要是黃河灘地取樣點位于近河岸處,受上游來水影響大,且無耕作歷史.因此,上述兩種土樣可為微生物菌群與生態功能研究提供良好的材料.
土壤微生物在生態系統物質循環和能量轉化過程中發揮著重要作用,其中微生物群落結構與土壤性質互為影響.土地利用方式可以改變土壤質量和養分循環,又進一步影響著土壤微生物組成[3].不穩定有機碳是維持土壤微生物群落的重要功能性環境因子,并影響著土壤有機碳變化和貯存[4].河岸土地利用類型的不同也會導致土壤微生物群落組成差異,其中土壤硝酸鹽(NO-3)和水分含量是參與氮循環微生物群落的主要驅動因素[5].農業、非農業用地與原生草地相比,其共存的微生物在群落結構和功能上有所不同[6].植被類型不同,如以小麥、玉米替代向日葵單作也會顯著影響根際微生物群落組成[7].JANGID等[8]研究發現,濕地轉變為農田后引起細菌豐度和種類的顯著變化,并確定土地利用變化是微生物群落組成的主要決定因素.微生
收稿日期:2023-06-02;修回日期:2023-09-08.
基金項目:國家自然科學基金(21906041);河南省科技攻關項目(232102320100,212102310079);河南省高等學校重點科研項目(21A610003);河南工學院博士基金項目(9001/KQ1811).
作者簡介(通信作者):田瑩瑩(1988-),女,河南許昌人,河南工學院講師,博士,研究方向為污染控制與生態修復研究,E-mail:tyy@hait.edu.cn.
引用本文:田瑩瑩,郭琦,陳星儒,等.沿黃稻區土壤菌群結構與生態功能研究[J].河南師范大學學報(自然科學版),2024,52(3):139-149.(Tian Yingying,Guo Qi,Chen Xingru,et al.Soil microbial community structure and eco-function in the rice zone along the Yellow River[J].Journal of Henan Normal University(Natural Science Edition),2024,52(3):139-149.DOI:10.16366/j.cnki.1000-2367.2023.06.02.0007.)
物參與特定的土壤生化反應[9],反過來影響土壤生態系統的多功能性[10-12],包括土壤養分循環、植物生長、溫室氣體產生等方面.研究表明,氨氧化細菌在農業生態系統的硝化過程中起主導作用[5].水稻-蔬菜長期輪作導致土壤微生物組結構均勻化,微生物的硝化和反硝化能力增加,潛在的N2O排放增加[9].研究顯示,微生物多樣性受土地利用類型改變的影響較小,而微生物組成和結構對土地利用類型的響應相對更敏感[6,13].在黃河流域生態保護和高質量發展背景下,從機理上科學認識沿黃稻區土壤微生物群落結構與生態功能有助于更好地理解土壤內部物質循環過程與驅動機制,對于制定科學合理的農田可持續發展模式起著至關重要的作用.
本研究以沿黃流域(原陽段)黃河灘地和稻田土為研究對象,利用高通量測序技術揭示沿黃稻區菌群結構、多樣性和差異物種,并基于BugBase、FAPROTAX數據庫預測菌群表型和功能.研究結果為認識和理解沿黃稻區土壤微生物、功能及元素循環機制提供重要參考.
1? 材料和方法
1.1? 研究區域及土壤樣品的采集
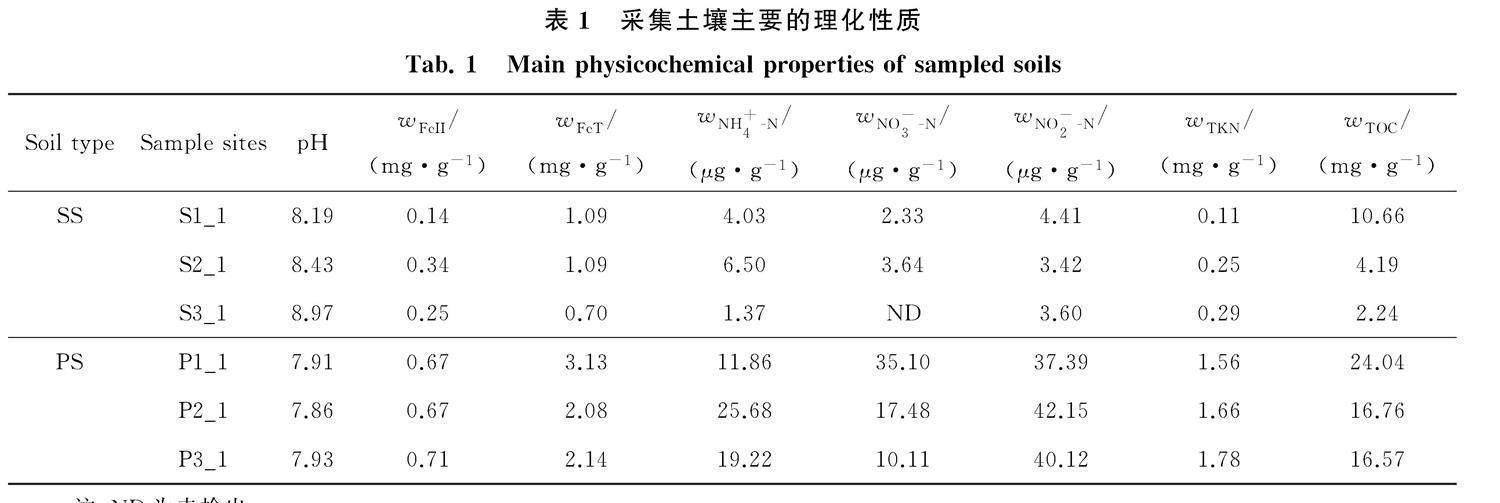
于2021年11月初采用梅花形5點采樣法采集位于河南省原陽縣沿黃稻區表層1 cm的嫩灘砂質土(sand soil,SS; 34°55′1.59″ E,113°40′25.01″ N)和稻田土(paddy soil,PS; 35°01′28.442″ E, 113°39′45.714″ N).每個土壤類型采集3個點,其中SS樣品記為S1_1、S2_1和S3_1,PS樣品記為P1_1、P2_1和P3_1.采樣點S1_1距離河岸約200 m(有植被覆蓋),S2_1距離河岸約50 m(有0.5 cm淤泥層覆蓋),S3_1為近河岸約1 m(受黃河水漲落影響最大).PS采樣點距河岸直線距離約12 km,各點間直線距離100 m.在水稻地上部分收割后采樣,采集時盡量避開植株根系.所有土壤樣品采集后立即放置在冷藏箱中保存,并及時運回實驗室分析,其中用于土壤理化性質分析的土樣置于4 ℃暫存并于48 h內分析完畢,用于高通量測序的樣品在處理前置于-80 ℃冰箱保存.
1.2? 土壤理化性質的測定
取適量風干土樣,采用水土質量比2.5∶1,搖床振蕩30 min,靜置后用便攜式pH計測定土壤pH值.土壤中的二價鐵(FeII)采用鄰菲羅啉比色法測定,總鐵(FeT)利用鹽酸羥胺還原后采用鄰菲羅啉比色法測定.土壤總有機碳(TOC)采用濕式重鉻酸鉀分光光度法測定.土壤銨態氮(NH+4-N)、硝態氮(NO-3-N)、亞硝態氮(NO-2-N)的測定利用2 mol/L KCl溶液浸提,其中NH+4-N采用靛酚藍比色法,NO-3-N采用紫外分光光度法,NO-2-N采用磺胺/鹽酸萘乙二胺分光光度法測定.土壤全氮(TKN)利用凱氏定氮法測定[14].
1.3? DNA的提取,PCR擴增與高通量測序
按E.Z.N.A.soil DNA kit(Omega Bio-tek,Norcross)試劑盒說明書步驟提取基因組DNA,使用NanoDrop 2000超微量蛋白質核酸分析儀(Thermo Fisher Scientific,USA)測定提取出的DNA濃度和純度.將提取好的DNA樣品利用16S rRNA基因V3-V4區擴增引物進行PCR擴增,引物序列為338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3').使用質量分數2%瓊脂糖凝膠回收PCR產物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City)進行回收產物純化.
純化后的產物送至上海美吉生物醫藥科技有限公司,使用Illumina Miseq PE300平臺進行高通量測序和分析.使用NEXTFLEX Rapid DNA-Seq Kit進行建庫.使用Fastq軟件對原始測序序列進行質控,并用Flash軟件進行拼接.使用Qiime2(v2020.2)軟件,利用DADA2算法對序列進行ASV聚類并剔除嵌合體.基于Silva 16S rRNA 數據庫(v138),利用RDP classifier貝葉斯算法對ASV代表序列進行物種分類學注釋(置信度閾值0.7),獲得物種分類學注釋結果.各樣品的16S rRNA基因測序結果上傳至國家微生物科學數據中心(https://nmdc.cn/),登錄號NMDC40024174~NMDC40024179.
1.4? 數據分析
基于細菌群落及土壤理化因子數據利用R語言Psych數據包繪制相關性熱圖.基于美吉云平臺,利用ggplot 2包繪制物種豐度圖,利用Kruskal-Wallis秩和檢驗、多重比較方差分析檢驗菌群的alpha多樣性,利用主坐標分析(PCoA)、Bray-Curtis距離進行beta多樣性分析,與BugBase數據庫比對預測微生物表型;并與FAPROTAX數據庫比對預測優勢菌屬的功能.
2? 結果和分析
2.1? 沿黃灘地和稻田土主要理化性質
對比SS和PS的主要理化性質,發現除pH外,PS中的FeII、FeT、NH+4-N、NO-3-N、NO-2-N、TKN和TOC的含量均顯著高于SS.PS中pH的平均值為7.90,低于SS的8.53.研究表明,土壤有機質含量有隨pH升高而降低的趨勢,二者間呈極顯著的負相關關系(R =-0.530~-0.332,P<0.001).本研究中,TOC與pH顯著負相關(R=-0.881,P=0.02).
2.2? 沿黃灘地和稻田土中菌群結構
將16S rRNA基因測序結果(去除葉綠體和線粒體)按樣本最小序列數抽平,構建ASV集(ASV_all).將相對豐度小于0.01的Genus合并,共有60屬.alpha多樣性指數反應群落內物種數量及其相對豐度,有豐富度指數(如Chao指數)和物種多樣性指數(如Shannon、Simpson指數)等.Chao指數值越高,說明物種數目較多;Shannon指數值越高,說明群落多樣性越高;Simpson指數值越高,則說明群落多樣性越低.分析表明(圖1),SS物種數目較多而多樣性低,但二者的3個指數值均無顯著性差異(P>0.05).對微生物組beta多樣性以主坐標分析(PCoA)進行計算并可視化.SS各點分散,PS各點距離近,表明SS的群落結構差異較大,而PS的菌群組成較為相似,這與SS樣點間生境差異大有關.主成分軸PC1和PC2分別解釋了49.24%和23.06%的結構差異(圖2).
去除至少在4個樣本中相對豐度都小于0.001 7的ASV,得到相對豐度前35的屬,以此繪制相對豐度熱圖(圖3(a)),其中前35屬在總序列中的平均相對豐度為0.439 4±0.030 4.由于S1_1、S2_1、S3_1樣點理化性質(如NH+4-N、TOC、pH等)差異較大,使得SS中組成物種的重現性不如PS高.兩種類型土壤中的優勢細菌在門水平上都分屬于放線菌門(Actinobacteriota)和變形菌門(Proteobacteria),且相對豐度無差異.屬水平上,菌群的相對豐度有所不同.Unclassified_f? Micrococcaceae、鞘氨醇單胞菌屬(Sphingomonas)、norank_f? noorank_o? Vicinamibacterales和norank_f? Vicinamibacterales為土壤中的廣布屬,相對豐度與土壤類型無關.SS中unclassified_f_Planococcaceae、黃桿菌屬(Flavobacterium)、副球菌屬(Paracoccus)、unclassified_f_Comamonadaceae、紅細菌屬(Rhodobacter)、Nodosilinea_PCC_7104相對豐度高于PS;PS中類諾卡氏菌屬(Nocardioides)、unclassified_f_Nocardioidaceae、硫桿菌屬(Thiobacillus)、unclassified_f_Intrasporangiaceae、芽孢桿菌屬(Bacillus)、norank_f_Anaerolineaceae、norank_f_Caldilineaceae、norank_f_norank_o_SJA-15、norank_f_norank_o_norank_c_MB-A2-108、Gaiella、norank_f_Sutterelleaceae相對豐度高于SS(圖3(b)).norank_f_Anaerolineaceae、norank_f_Caldilineaceae、norank_f_norank_o_SJA-15、norank_f_norank_o_norank_c_KD4_96屬綠彎菌門(Chloroflexi),在PP中的豐度顯著高于SS.Chlorolema也為Chloroflexi中的一屬,但僅在S1_1中有較高的相對豐度.此外,Porphyrobacter、Unclassified_f_Rhodobacteraceae、Rhodobacter作為不產氧光合細菌,能通過H2、硫化物、FeII等還原物質提供電子供體還原CO2進行光合自養生長,因而在低有機質的SS中呈現較高的相對豐度.
進一步地用線性判別(LEfSe)分析確定了組間屬水平上豐度差異顯著的21屬(P<0.05).如附錄圖S1,norank_f_Caldilineaceae、norank_f_norank_o_SJA-15、norank_f_Anaerolineaceae、norank_f_norank_o_norank_c_KD4_96、norank_f_Steroidobacteraceae、norank_f_Sutterellaceae、Thiobacillus等的豐度在PS中顯著高于SS,而unclassified_f_Comamonadaceae、norank_f_Rhizobiales_Incertae_Sedis、Porphyrobacter、unclassified_f_Rhodobacteraceae、Paracoccus、微小桿菌屬(Exiguobacterium)、unclassified_f_Planococcaceae、Flavobacterium等的豐度在PS中顯著低于SS.
2.3? 細菌優勢組成物種功能預測分析
BugBase表型預測結果顯示,35個土壤優勢菌屬涵蓋了全部7個類型的微生物群落,除厭氧、生物膜形成外的其他功能菌的比例在SS和PS之間無顯著性差異(圖4(a)).選取與生物膜形成和氧需求相關的類型分析各自組成細菌的貢獻度,如圖4(b-e)).科水平上,土壤優勢菌中的嚴格厭氧菌包括norank_o? Vicinamibacterales、Vicinamibacteraceae,其在PS中相對豐度顯著高于灘地土.鞘脂單胞菌科(Sphingomonadaceae)、類諾卡氏菌科(Nocardioidaceae)、norank_o_norank_c_MB-A2-108、Rhizobiales_Incertae_Sedis為兩種土壤中貢獻度前四的好氧菌.相對優勢兼性厭氧菌包括微桿菌科(Microbacteriaceae)、嗜氫菌科(Hydrogenophilaceae)、紅細菌科(Rhodobacteraceae),其中Hydrogenophilaceae在PS中相對豐度高,Rhodobacteraceae在SS中相對豐度高,并是參與SS生物膜形成的重要類群.
為研究土壤優勢菌屬在生物地球化學循環中的作用,利用FAPROTAX預測確定了12個功能類群(圖5).它們主要參與土壤碳、硫元素的轉化和提供能量,其中化能異養型、需氧化能異養型功能類群占絕對優勢.氧化硫和硫化物的類群在兩種土壤中的比例差異顯著(P<0.01),其他類群無差異.此外,P2_1,P3_1中具PAHs降解功能的細菌比例相對升高.S3_1中光養生物占優勢,包括光合自養和光合異養兩類,分別為能產生氧氣的藍藻(主要是浮絲藻屬)和不產生氧氣的光合細菌(主要是Porphyrobacter、unclassified_f_Rhodobacteraceae、Rhodobacter)貢獻,尤以光合異養功能細菌為主.
3? 討? 論
3.1? 沿黃流域土壤細菌群落結構分析
本研究中SS與PS的土壤類型不同,孕育了某些特定的微生物類群.SS中unclassified_f_Planococcaceae的優勢序列(ASV2)與動球菌屬(Planococcus sp.)相似性高.Planococcus為好氧菌,GAN等[15]從鹽堿土壤中分離得到的Planococcus最適pH為9.0.SS為砂質土,透氣性良好,pH值接近9.0,可能是unclassified_f_Planococcaceae相對豐度高的關鍵.Paracoccus廣泛存在于多種生境,對土壤中多環芳烴(PAHs)、鄰苯二甲酸二甲酯等污染有較好的降解作用[16-17].脫氮副球菌(Paracoccus denitrificans)是Paracoccus的模式種,也是重要的土壤好氧反硝化菌.SS中Paracoccus豐度高于PS,說明SS可能形成獨特的環境,較OMs豐富、N源充足的PS更適宜Paracoccus的生長繁殖.Flavobacterium也是兩種類型土壤中的差異物種.研究發現,Flavobacterium是土壤中魚腥藻屬(Anabaena sp.)PCC7120的重要伴生菌,具有適應寡營養的特性,可能是SS中相對豐度高的原因之一[18].
PS中類諾卡氏菌Nocardioides、Bacillus、Thiobacillus豐度顯著高于SS.土壤中Nocardioides的某些種參與N、S元素循環[19-20].Bacillus是水稻田常見的組成微生物[21-22].枯草芽孢桿菌(Bacillus subtilis)DBM與礦物成分(高嶺石、針鐵礦)形成的復合體提高了礦物本身對銅(Cu)和鉛(Pb)的吸附能力,并保護了DBM免受重金屬毒害[23].Thiobacillus是自然生境中重要的化能自養菌,主要參與氧化硫化物(H2S,S2O2-3)或單質硫為硫酸.本研究中Thiobacillus與pH極顯著負相關(P<0.01),與FeII、FeT正相關(P<0.05),表明偏酸性環境和高含量FeII會更適宜氧化亞鐵硫桿菌(Thiobacillus ferrooxidans)生存,說明T. ferrooxidans可能是Thiobacillus中的優勢種之一.此外,Thiobacillus與NH+4-N顯著正相關,其優勢序列ASV42與環境樣本中一反硝化Thiobacillus(登錄號MG801484.1)相似性(>99%)高,說明ASV42可能具有脫N作用.因此,推測T. ferrooxidans、T. denitrificans是本研究中Thiobacillus的重要組成物種.此外,Bacillus、Thiobacillus是重要的發酵型鐵環原微生物[24],有效改善石灰性土(pH 7.5~8.5)缺鐵狀況[25].土壤中Thiobacillus豐度可直接影響C、N、Fe、S元素轉化.Thiobacillus是PS中的優勢菌,因此在稻田干濕周期中Thiobacillus與土壤元素轉化的關系的研究對稻田的精細化管理具有重要的指導意義.
光養微生物有光合產氧和光合不產氧兩類.與PS相比,SS中光合自養微生物總的相對豐度高,其中又以光合不產氧細菌的豐度占優勢.SS中Symphothece PCC 702、Planthorix為光合產氧細菌,Chloronema、Rhodobacter和unclassified_f_Rhodobacteraceae為厭氧不產氧光合細菌.研究發現,Porphyrobacter屬中也包含有好氧不產氧的光合類群[26].SS中Porphyrobacter、Chloronema、Rhodobacter和unclassified_f_Rhodobacteraceae相對豐度高,主要是因為光輻射作用下,它們能以H2、硫化物、FeII等還原物質提供的電子供體還原CO2光合自養生長,因而在有機質低的灘地環境中較異養代謝微生物呈現出一定的生存優勢.Rhodobacter是稻田土中常見的優勢光合細菌,大多能隨外界氧氣、有機質濃度的改變進行好氧、微需氧或光合厭氧代謝[27].C是植物必需的六種大量元素之首.土壤中的C固存與土壤肥力密切相關.光氧微生物是土壤有機碳的重要生產者.為提高沿黃稻田有機碳含量,結合測序結果,可在沿黃稻田干濕周期分別接種好氧Porphyrobacter和厭氧Chloronema、Rhodobacter實現生物固碳以減少外源有機肥使用量.
3.2? 土壤優勢物種的功能及生物地球化學作用
土壤菌群組成與其環境適應性有關,并影響著生境內元素的生物地球化學循環.基于BugBase表型預測的結果顯示,優勢菌屬包括了全部的7類表型.嚴格厭氧功能菌是PS和SS中的重要差異類群,具體為,norank_o? Vicinamibacterales、Vicinamibacteraceae在PS中相對豐度顯著高于SS.Microbacteriaceae、Hydrogenophilaceae、Rhodobacteraceae是優勢兼性厭氧菌,此外,Rhizobiales_Incertae_Sedis、Rhodobacteraceae與生物膜形成相關,它們在SS中的相對豐度均高于PS.基于FAPROTAX數據庫預測確定了12個功能類群,它們主要參與土壤碳、硫等的轉化和提供能量.化能異養和需氧化能異養型微生物在總微生物類群中占絕對優勢.氧化硫和硫化物的微生物在兩類土壤中的比例有極顯著差異.SS中光養微生物的相對豐度普遍高于PS,尤以S3_1(Porphyrobacter、unclassified_f_Rhodobacteraceae、Rhodobacter構成)為最高.光合自養微生物的存在提高了光能利用率,供給了部分有機碳源,對維持生境內穩定的菌群結構起重要作用.PS中具硫、硫化物氧化和PAHs降解功能的微生物的比例也相對較高.T. ferrooxidans、T. denitrificans為Thiobacillus的重要組成物種,通過代謝硫和硫化物影響體系內Fe、N元素的轉化.微生物降解作用是環境中PAHs去除的主要途徑[28].與焦化廠污染的荒地相比,農田土壤理化特性增加了PAHs降解菌和總細菌群落的多樣性,與低分子量PAHs相關的降解菌主要隸屬于變形桿菌,與高分子PAHs相關的降解菌主要隸屬于放線菌[28].FAPROTAX功能熱圖分析結果顯示,PS(尤其是P2_1、P3_1)中PAHs降解功能微生物的相對豐度高于SS.Sphingomonas生境廣,適應性強,對復雜結構的難降解芳香化合物有特異作用,在生物聚合物的生產方面有優越性.本研究中Sphingomonas豐度在兩種不同利用方式的土壤中無顯著性差異,說明PS中可能有其他的具芳香烴功能的微生物存在.研究發現,農業土壤中Nocardioides也是具降解PAHs功能的微生物的重要類群之一[29].本研究中Nocardioides、unclassified_f_Nocardioidaceae在P2_1、P3_1中的相對豐度顯著高于其他樣點,與PAHs降解功能的熱圖分析結果一致,表明Nocardioides、unclassified_f_Nocardioidaceae可能是促使PAHs降解的關鍵類群.
unclassified_f? Micrococcaceae為兩種類型土壤中的絕對優勢屬.本研究中unclassified_f? Micrococcaceae的優勢代表序列ASV1和ASV3與節桿菌屬(Arthrobacter sp.)相似性達100%.Arthrobacter菌株嚴格好氧,具有高效降解有機污染物和吸附重金屬的能力[30].Arthrobacter sp.ADH-2在10 h內對100 mg/L阿特拉津的降解率為99.9%[31].研究顯示,unclassified_f? Micrococcaceae是健康與發病煙田微生物的主要差異物種之一,在健康煙田土壤中的相對豐度是發病土壤的2倍[32].此外,unclassified_f? Micrococcaceae也是間作甘蔗植株中特有的內生菌之一[33].
生態系統中存在多元素的耦合作用,因此,參與碳、硫等元素代謝的微生物往往也介導了生境內的N轉化過程.Paracoccus denitrificans厭氧條件下以H2作為電子供體,利用CO2、HCO-3等無機碳源,還原硝酸鹽到亞硝酸鹽到氧化氮(NO、N2O)和N2[34].該過程是生物地球化學氮循環中重要的反硝化反應,方程式為:①5H2+2NO-3→N2+4H2O+2OH-;H2+0.35NO-3+0.35H++0.052CO2→0.17N2+1.1H2O+0.010C5H7O2N[34].好氧條件下,P. denitrificans對溶解性硝酸鹽、亞硝酸鹽的去除以同化作用為主,少部分經由反硝化作用去除[35].學者們也發現了同時具有異養硝化-好氧反硝化功能的菌株,為P. denitrificans用于廢水短程脫氮提供參考[36].某些Rhodobacter菌株以NO-3-N為電子受體,有機碳源為電子供體光合異養生長,是沉積物中一種關鍵的反硝化菌[37].研究報道,Rhodobacter是汾河下游水體中nir S型反硝化細菌群落的3個主導菌屬之一,在下游某些采樣點的相對豐度可高于98%,其相對豐度與NO-3-N負相關[38].本研究中Rhodobacter與NO-3-N也顯著負相關,說明所調查區域的Rhodobacter中可能存在反硝化脫氮菌株.T. denitrificans利用元素硫為電子供體從水生環境中去除NO-3,是重要的硫自養反硝化菌.溶解性有機質作為一種微生物光敏劑驅動T. denitrificans發生光電反硝化反應[39].
4? 結? 論
本研究利用高通量測序技術揭示了沿黃稻區SS和PS土樣中的菌群結構、多樣性及差異物種,發現兩種土樣中的菌群豐富度和多樣性指數差異不顯著,但部分菌群相對豐度差異顯著.unclassified_f? Micrococcaceae、Sphingomonas為土壤中的廣布種;Bacilllus、Thiobacillus在PS中的相對豐度顯著高于SS;PS中光合細菌的相對豐度則顯著低于SS.特別地,與硫代謝相關的Thiobacillus,推測主要由T. denitrificans和T. ferrooxidans組成,而Rhodobacteraceae則是土壤優勢菌屬中重要的促生物膜形成微生物.基于BugBase、FAPROTAX數據庫的菌群表型和功能預測結果顯示,SS和PS均包括了7類表型和12類地化循環相關微生物,其中厭氧、氧化硫或硫化物功能的類群在土壤中的相對豐度差異顯著.
但本研究樣本量較少,對SS和PS土壤微生物的差異性認識可能不全面.未來,需要更全面的研究以揭示土壤類型、土地利用方式等影響下的微生物群落結構與功能.
附錄見電子版(DOI:10.16366/j.cnki.1000-2367.2023.06.02.0007).
參? 考? 文? 獻
[1] ??孫建權,胡寧,王書玉,等.水稻旱直播高產栽培技術初探[J].種業導刊,2009(10):22-25.
SUN J Q,HU N,WANG S Y,et al.Preliminary study on high-yield cultivation techniques of dry direct seeding of rice[J].Journal of Seed Industry Guide,2009(10):22-25.
[2]李榮容,王鵬,韋詩濤,等.黃河中下游汛期洪水的分期識別[J].人民黃河,2017,39(11):24-29.
LI R R,WANG P,WEI S T,et al.Flood season staged in middle and lower Yellow River[J].Yellow River,2017,39(11):24-29.
[3]LI Y T,XIE X H,ZHU Z J,et al.Land use driven change in soil organic carbon affects soil microbial community assembly in the riparian of Three Gorges Reservoir Region Applied Soil Ecology,2022,176:104467.
[4]ZHANG H K,FANG Y Y,ZHANG B G,et al.Land-use-driven change in soil labile carbon affects microbial community composition and function[J].Geoderma,2022,426:116056.
[5]MAFA-ATTOYE T G,BASKERVILLE M A,OFOSU E,et al.Riparian land-use systems impact soil microbial communities and nitrous oxide emissions in an agro-ecosystem[J].The Science of the Total Environment,2020,724:138148.
[6]BISSETT A,RICHARDSON A E,BAKER G,et al.Long-term land use effects on soil microbial community structure and function[J].Applied Soil Ecology,2011,51:66-78.
[7]WEN X Y,DUBINSKY E,WU Y,et al.Wheat,maize and sunflower cropping systems selectively influence bacteria community structure and diversity in their and succeeding crop's rhizosphere[J].Journal of Integrative Agriculture,2016,15(8):1892-1902.
[8]JANGID K,WILLIAMS M A,FRANZLUEBBERS A J,et al.Land-use history has a stronger impact on soil microbial community composition than aboveground vegetation and soil properties[J].Soil Biology and Biochemistry,2011,43(10):2184-2193.
[9]SIM J X F,DOOLETTE C L,VASILEIADIS S,et al.Pesticide effects on nitrogen cycle related microbial functions and community composition[J].The Science of the Total Environment,2022,807:150734.
[10]SHEN J E,TAO Q,DONG Q,et al.Long-term conversion from rice-wheat to rice-vegetable rotations drives variation in soil microbial communities and shifts in nitrogen-cycling through soil profiles[J].Geoderma,2021,404:115299.
[11]CHEN W Q,WANG J Y,CHEN X A,et al.Soil microbial network complexity predicts ecosystem function along elevation gradients on the Tibetan Plateau[J].Soil Biology and Biochemistry,2022,172:108766.
[12]TANG Q A,XIA Y Q,TI C P,et al.Partial organic fertilizer substitution promotes soil multifunctionality by increasing microbial community diversity and complexity[J].Pedosphere,2023,33(3):407-420.
[13]張俊,黃煦旸,彭宇琦.“雙碳”目標下黃河流域種植業碳足跡的時空異質效應[J].河南農業大學學報,2023,57(5):884-896.
ZHANG J,HUANG X Y,PENG Y Q.Spatio-temporal heterogeneity of planting carbon footprint in Yellow River Basin under the carbon peaking and carbon neutrality targets[J].Journal of Henan Agricultural University,2023,57(5):884-896.
[14]榮國華,周景云,吳鴻宇,等.流動分析儀與凱氏定氮儀測定土壤全氮含量之比較研究[J].水土保持研究,2023,30(1):204-208.
RONG G H,ZHOU J Y,WU H Y,et al.Comparative study on determination of total nitrogen content in soil by flow analyzer and Kjeldahl nitrogen analyzer[J].Research of Soil and Water Conservation,2023,30(1):204-208.
[15]GAN L Z,ZHANG H M,TIAN J W,et al.Planococcus salinus sp. nov.,a moderately halophilic bacterium isolated from a saline-alkali soil[J].International Journal of Systematic and Evolutionary Microbiology,2018,68(2):589-595.
[16]毛健,駱永明,滕應,等.一株副球菌對污染土壤中多環芳烴的降解研究[J].土壤,2009,41(3):448-453.
MAO J,LUO Y M,TENG Y,et al.Biodegradation of PAHs by Paracoccus aminovorans HPD-2 in contaminated soil[J].Soils,2009,41(3):448-453.
[17]朱曉慧,劉虹,郭茹鑫,等.黑土微生物群落對副球菌屬(Paracoccus sp.)QD15-1修復鄰苯二甲酸二甲酯污染土壤的響應[J].環境污染與防治,2020,42(2):182-186.
ZHU X H,LIU H,GUO R X,et al.Response of microbial community in black soil to remediation of dimethyl phthalate contaminated soil by Paracoccus sp.QD15-1[J].Environmental Pollution & Control,2020,42(2):182-186.
[18]荊瑞勇,王麗艷,孫強,等.東北旱田土壤中Anabaena伴生細菌的分離與鑒定[J].微生物學通報,2020,47(1):130-139.
JING R Y,WANG L Y,SUN Q,et al.Isolation and identification of bacteria associated with Anabaena from upland soils in northeast China[J].Microbiology China,2020,47(1):130-139.
[19]CUI Y S,WOO S G,LEE J,et al.Nocardioides daeguensis sp. nov.,a nitrate-reducing bacterium isolated from activated sludge of an industrial wastewater treatment plant[J].International Journal of Systematic and Evolutionary Microbiology,2013,63(Pt_10):3727-3732.
[20]LACHMAYR K,ODUARAN E.Investigation of Nocardioides sp. metabolic,structural,biochemical properties,and its potential role in the sulfur cycle[J].The FASEB Journal,2015,29(S1):1944-1956.
[21]曹夢雨,桑世飛,王亞男,等.水稻全基因組磷脂酶家族蛋白篩選及其生物信息學分析[J].河南師范大學學報(自然科學版),2022,50(3):143-149.
CAO M Y,SANG S F,WANG Y N,et al.Genome wide screening and bioinformatics analysis of rice phospholipase family proteins[J].Journal of Henan Normal University(Natural Science Edition),2022,50(3):143-149.
[22]DING M J,SHANG N J,XIAO Z X,et al.Bacillus aciditolerans sp. nov.,isolated from paddy soil[J].International Journal of Systematic and Evolutionary Microbiology,2019,69(4):1155-1161.
[23]BAI J,CHAO Y,CHEN Y M,et al.The effect of interaction between Bacillus subtilis DBM and soil minerals on Cu(II)and Pb(II)adsorption[J].Journal of Environmental Sciences,2019,78(4):328-337.
[24]田瑩瑩,王強,趙京,等.黃河灘地和稻田土中鐵還原菌、不產氧光合細菌分布機制[J].微生物學報,2023,63(2):805-820.
TIAN Y Y,WANG Q,ZHAO J,et al.Distribution mechanism of iron-reducing bacteria and oxygen-producing photosynthetic bacteria in Yellow River beach and paddy soil[J].Acta Microbiologica Sinica,2023,63(2):805-820.
[25]GHORBANZADEH N,LAKZIAN A,HAGHNIA G H,et al.Isolation and identification of ferric reducing bacteria and evaluation of their roles in iron availability in two calcareous soils[J].Eurasian Soil Science,2014,47(12):1266-1273.
[26]LI X L,KOBLEK M,FENG F,et al.Whole-genome sequence of a freshwater aerobic anoxygenic phototroph,Porphyrobacter sp. strain AAP82,isolated from the Huguangyan maar lake in southern China[J].Genome Announcement,2013,1(2):e0007213.
[27]ZAVALA N,BAEZA L,GONZALEZ S,et al.The effects of different carbon sources on the growth of Rhodobacter sphaeroides[J].Advances in Microbiology,2019,9(8):737-749.
[28]DU J Q,LIU J X,JIA T,et al.The relationships between soil physicochemical properties,bacterial communities and polycyclic aromatic hydrocarbon concentrations in soils proximal to coking plants[J].Environmental Pollution,2022,298:118823.
[29]LU C,HONG Y,LIU J A,et al.A PAH-degrading bacterial community enriched with contaminated agricultural soil and its utility for microbial bioremediation[J].Environmental Pollution,2019,251:773-782.
[30]李娟,CONSTANTINE UWAREMEW,冷艷,等.節桿菌屬細菌處理有機物和重金屬污染物的研究進展[J].環境科學與技術,2017,40(10):89-97.
LI J,UWAREMWE C,LENG Y,et al.Progress on the study of biodegradation of organic pollutants and adsorption of heavy metals with Arthrobacter strains[J].Environmental Science & Technology,2017,40(10):89-97.
[31]韓鵬,洪青,何麗娟,等.阿特拉津降解菌ADH-2的分離、鑒定及其特性研究[J].農業環境科學學報,2009,28(2):406-410.
HAN P,HONG Q,HE L J,et al.Isolation,identification and characterization of an atrazine-degrading bacteria ADH-2[J].Journal of Agro-Environment Science,2009,28(2):406-410.
[32]陳乾錦,林書震,李紅麗,等.邵武煙田土壤微生物群落結構變化與煙草青枯病發生關系初報[J].中國煙草學報,2019,25(4):64-71.
CHEN Q J,LIN S Z,LI H L,et al.A preliminary report on relationship between variation of microbial community structure in soil and occurrence of tobacco bacterial wilt in tobacco field in Shaowu[J].Acta Tabacaria Sinica,2019,25(4):64-71.
[33]肖健,陳思宇,孫妍,等.甘蔗間作不同豆科作物對甘蔗植株內生細菌多樣性的影響[J].熱帶作物學報,2021,42(11):3188-3198.
XIAO J,CHEN S Y,SUN Y,et al.Effect of intercropping with different legume crops on endophytic bacterial diversity of sugarcanes[J].Chinese Journal of Tropical Crops,2021,42(11):3188-3198.
[34]RICHARDSON D J,SAWERS G,VAN SPANNING R J M.Periplasmic electron-transport systems in bacteria[M].Amsterdam:Elsevier,2013.
[35]劉道玉,范立民,王瓊,等.脫氮副球菌的好氧反硝化特性及對養殖水體中氮素的控制[J].農業環境科學學報,2012,31(11):2249-2255.
LIU D Y,FAN L M,WANG Q,et al.The aerobic denitrification characteristics of Paracoccus denitrificans and its nitrogen control for aquaculture water[J].Journal of Agro-Environment Science,2012,31(11):2249-2255.
[36]李海紅,佟欣宇,宦臣臣,等.高效異養硝化-好氧反硝化菌株TS-1篩選及降解特性[J].應用與環境生物學報,2020,26(4):791-799.
LI H H,TONG X Y,HUAN C C,et al.Characterizing the heterotrophically nitrifying and aerobically denitrifying TS-1 strain[J].Chinese Journal of Applied and Environmental Biology,2020,26(4):791-799.
[37]ZHOU S L,SUN Y E,LI Z X,et al.Characteristics and driving factors of the aerobic denitrifying microbial community in Baiyangdian Lake,Xiong'an new area[J].Microorganisms,2020,8(5):714.
[38]汪銀龍,馮民權,董向前.汾河下游水體nirS型反硝化細菌群落組成與無機氮關系[J].環境科學,2019,40(8):3596-3603.
WANG Y L,FENG M Q,DONG X Q.Community composition of nir S-type denitrifying bacteria in the waters of the lower reaches of the Fenhe River and its relationship with inorganic nitrogen[J].Environmental Science,2019,40(8):3596-3603.
[39]HUANG S F,CHEN M,DIAO Y M,et al.Dissolved organic matter acting as a microbial photosensitizer drives photoelectrotrophic denitrification[J].Environmental Science & Technology,2022,56(7):4632-4641.
Soil microbial community structure and eco-function in the rice zone along the Yellow River
Tian Yingyinga,b, Guo Qia, Chen Xingrua, Sun Xianghuia,b, Zhao Jinga,b
(a. Department of Material Science and Engineering; b. Xinxiang City Engineering Research Center for Wastewater Treatment Energy Saving and Emission Reduction, Henan Institute of Technology, Xinxiang 453003, China)
Abstract: In the present study, samples of riverside sand soil(SS) and adjacent paddy soil(PS) were collected to know the microbial composition of different substrate soils in the rice zone along the Yellow River. The high-throughput sequencing of 16S rRNA gene was used to uncover the soil microbial compositions and to explain microbes' potential eco-function. Alpha diversity analysis showed no significant difference in microbial richness and diversity index between the two soils. Further species analysis showed the ubiquitous distribution of unclassified_f? Micrococcaceae, Sphingomonas, norank_f? noorank_o? Vicinamibacterales and norank_f? Vicinamibacterales, whose abundances were independent of soil types. However, the relative abundances of Bacilllus and Thiobacillus were significantly higher in PS than that in SS. The function heatmap analysis based on FAPROTAX database showed that aromatic compound degrading bacteria in PS(especially P2_1 and P3_1) was higher than that in SS. Combined with the results of bacterial relative abundance, Nocardioides and unclassified_f_Nocardioidaceae might be the key genera contributing to aromatic compound degradation. The phototrophic microbes(PMs) in SS were more abundant than that in PS, which were dominant anoxygenic PMs like Porphyrobacter, unclassified_f_Rhodobacteraceae and Rhodobacter. Moreover, Rhodobacteraceae was likely to participate in biofilm formation in SS. Overall, soil microbial compositions along the Yellow River were to some extent impacted by the soil type, driving the differences of their eco-functions.
Keywords: soil microbial community structure; eco-function; paddy soil; sand soil
[責任編校? 劉洋? 楊浦]
附? 錄

