UV-B不同劑量輻照下生菜生長(zhǎng)和代謝組學(xué)分析
劉淑娟 劉騰云 劉立盤 朱安繁 黃星瑜 歐陽雪靈 周華
摘要:以奶油生菜為研究材料,在植物工廠人工光源中設(shè)置3種紫外線B(UV-B)劑量[0、8.64、17.28 kJ/(m2·d)]處理,利用廣靶代謝組學(xué)技術(shù),分析不同劑量UV-B輻照下生菜葉片中的差異代謝物質(zhì),研究UV-B輻照對(duì)生菜生物量、光合參數(shù)和次生代謝物的影響。結(jié)果表明,與0劑量相比,低劑量UV-B處理對(duì)生菜生物量、光合參數(shù)均未產(chǎn)生顯著影響,代謝組檢測(cè)到30種差異代謝產(chǎn)物,主要為生物堿、酚類、萜類等物質(zhì),其中9種上調(diào)表達(dá),21種下調(diào)表達(dá);高劑量UV-B處理顯著降低了生菜地上部干重、地下部干重、氣孔導(dǎo)度和蒸騰速率,但地上部鮮重、凈光合速率均未呈現(xiàn)顯著差異,共檢測(cè)到35個(gè)差異表達(dá)代謝物,其中21種上調(diào)表達(dá),14種下調(diào)表達(dá),上調(diào)表達(dá)的代謝物主要為黃酮類、單萜等,生菜葉片槲皮素含量在低劑量、高劑量UV-B處理下均顯著增加。研究結(jié)果可為利用UV-B輻照提高設(shè)施生菜營(yíng)養(yǎng)品質(zhì)提供理論依據(jù)和參考。
關(guān)鍵詞:UV-B輻照;生菜;劑量;生長(zhǎng);代謝產(chǎn)物
中圖分類號(hào):S636.204? 文獻(xiàn)標(biāo)志碼:A
文章編號(hào):1002-1302(2024)08-0131-07
收稿日期:2023-04-28
基金項(xiàng)目:國(guó)家自然科學(xué)基金(編號(hào):31960623);江西省科學(xué)院重大產(chǎn)業(yè)技術(shù)攻關(guān)專項(xiàng)(編號(hào):2023YSBG10005)。
作者簡(jiǎn)介:劉淑娟(1982—),女,安徽宿州人,博士,副研究員,主要從事植物遺傳育種研究。E-mail:liushujuan@126.com。
通信作者:周 華,博士,研究員,主要從事設(shè)施園藝研究。E-mail:yuerhua116@126.com。
UV-B(ultraviolet-B)是太陽輻射中波長(zhǎng)為280~315 nm的紫外線,具有高能量日光光譜。隨著人類的發(fā)展和地球臭氧層的減少,到達(dá)地面的UV-B輻射增加,引起了研究人員的關(guān)注[1]。最初的研究認(rèn)為,UV-B是一種環(huán)境脅迫因子,增加的UV-B作用于植物,會(huì)抑制植物的光合作用,減少植株高度、葉片長(zhǎng)度,增加葉片厚度和分枝,影響作物產(chǎn)量、生長(zhǎng)發(fā)育和代謝過程[2]。隨著研究的深入,人們發(fā)現(xiàn)利用作物對(duì)UV-B輻照的適應(yīng)性,可以控制作物的形態(tài)建成,調(diào)控作物生長(zhǎng),生產(chǎn)有利于人類飲食健康的次生代謝產(chǎn)物[3]。研究發(fā)現(xiàn),藥用植物菥蓂在增補(bǔ)UV-B輻射下,通過增加體內(nèi)總黃酮和總酚含量、可溶性蛋白和可溶性糖含量,抵抗UV-B紫外脅迫對(duì)其造成的影響,增強(qiáng)對(duì)逆境環(huán)境的適應(yīng)性[4]。在白光中增加1.14 kJ/(m2·d) UV-B輻照,甜椒中苯丙氨酸解氨酶、查耳酮合成酶基因表達(dá)顯著上調(diào),綠原酸等類黃酮物質(zhì)顯著積累[5]。南非醉茄在溫室環(huán)境[UV-B劑量為 9.6 kJ/(m2·d)] 的基礎(chǔ)上增加3.6 kJ/(m2·d)UV-B輻照劑量,其體內(nèi)尤其是根部的生物堿、花青素、類胡蘿卜素、類黃酮、番茄紅素次生代謝產(chǎn)物含量普遍呈現(xiàn)增加的變化趨勢(shì)[6]。與不能透過紫外線的大棚相比,生長(zhǎng)在可以透過紫外線大棚中的生菜的花青素含量顯著提高[7]。UV-B輻照可以顯著提高水稻、玉米、黃瓜等作物的葉片及水果中的維生素C含量[8]。因此,調(diào)控栽培環(huán)境中的 UV-B 輻照,已經(jīng)成為提高作物營(yíng)養(yǎng)品質(zhì)的一種有效方法[9]。
UV-B對(duì)作物的影響是與波長(zhǎng)、劑量相關(guān)的[10]。例如,當(dāng)用波長(zhǎng)為300~320 nm的UV-B照射蕎麥芽時(shí),可以增加花青素、蕓香苷含量,而當(dāng)用波長(zhǎng)為280~300 nm的UV-B照射時(shí),蕎麥芽會(huì)發(fā)黃或枯萎,不利于芽的生長(zhǎng)[11]。黃瓜在1.44 kJ/(m2·d) UV-B輻照下,植株高度降低,株型更為緊湊,有利于葉片凈光合能力、水分利用效率的提高,而在6.92 kJ/(m2·d) UV-B輻照下,黃瓜地上部、地下部干重顯著下降,根系活力、光合速率和葉綠素含量均受到抑制[12]。24 kJ/(m2·d) UV-B紫外燈處理對(duì)芒果樹體產(chǎn)量、果實(shí)品質(zhì)無顯著影響,而高劑量96 kJ/(m2·d) UV-B會(huì)破壞芒果葉肉光合組織結(jié)構(gòu),抑制葉片光合作用,加厚葉表角質(zhì)層,從而阻礙葉片吸收二氧化碳,抑制蒸騰作用,引起樹體減產(chǎn)[13]。用 1.845 kJ/m2 UV-B輻照2.5 h可以誘導(dǎo)綠豆芽體內(nèi)維生素C、酚類和類黃酮含量的增加,提高其營(yíng)養(yǎng)品質(zhì)[14]。作物在低劑量、高劑量UV-B輻射下會(huì)引發(fā)特異性或非特異性反應(yīng),通過調(diào)控植物光形態(tài)建成、激發(fā)植物抗氧化系統(tǒng)、產(chǎn)生次生代謝產(chǎn)物來應(yīng)對(duì)脅迫[15]。
葉用萵苣(Lactuca sativa L.)俗稱生菜,是國(guó)際上一種重要的蔬菜作物種類,隨著生食蔬菜人口的增加,葉用萵苣以營(yíng)養(yǎng)豐富、生食口感好的特點(diǎn),在近年來市場(chǎng)需求量加大,世界栽培面積也迅速擴(kuò)大。其中LED完全人工光源植物工廠所生產(chǎn)的葉用萵苣可實(shí)現(xiàn)按計(jì)劃生產(chǎn),且無病蟲害或重金屬污染,作物產(chǎn)量高,已經(jīng)成為高端葉用萵苣供應(yīng)的一類重要生產(chǎn)形式[16]。然而,栽培在溫室或植物工廠中的作物由于覆蓋材料、水培方式的影響,營(yíng)養(yǎng)品質(zhì)明顯下降[17]。研究發(fā)現(xiàn),隨著UV-B輻射的增強(qiáng),生菜葉片中類黃酮含量逐漸增加,抗壞血酸、可溶性糖和可溶性蛋白含量則先增加后減小[18]。截至目前,人類對(duì)UV-B輻照劑量對(duì)生菜代謝產(chǎn)物的影響還缺乏全面理解。本研究通過代謝組學(xué)的方法,研究不同劑量UV-B輻照對(duì)生菜生長(zhǎng)、代謝產(chǎn)物的影響,以期為設(shè)施栽培調(diào)控生菜品質(zhì)提供基礎(chǔ)數(shù)據(jù)和技術(shù)支持。
1 材料與方法
1.1 材料
本研究中的生菜品種為奶油生菜,于2022年1月20日生菜的3葉1心期開始在植物工廠中栽培,栽培的基礎(chǔ)光源為紅光-藍(lán)光(光照度之比為 2 ∶1),其中紅光波長(zhǎng)為(660±10) nm,藍(lán)光波長(zhǎng)為(450±10) nm。采用UV-B光源(Phillips TL 100W/01)作為補(bǔ)充光源,植物工廠室內(nèi)設(shè)置:光照度為 200 μmol/(m2·s),每天光照16 h,白天溫度為 22 ℃,晚上溫度為20 ℃,水培營(yíng)養(yǎng)液為Hoagland營(yíng)養(yǎng)液,CO2濃度為400 mg/L。當(dāng)生菜生長(zhǎng)10 d后,開始增加UV-B輻照處理,試驗(yàn)設(shè)置3個(gè)不同劑量的UV-B輻照:0 (CK)、8.64 kJ/(m2·d) (U1)、17.28 kJ/(m2·d) (U2),每個(gè)處理10株,重復(fù)3次,UV-B輻照劑量通過調(diào)整UV-B燈管與植物之間的距離獲得,UV-B劑量采用林上光電科技有限公司的紫外光計(jì)(LS 125 UV)進(jìn)行測(cè)量。
生菜在植物工廠中用不同劑量UV-B照射4 d后,用Li-6400XT光合儀進(jìn)行光合參數(shù)的測(cè)定,選取生菜從上往下第3張葉片進(jìn)行測(cè)定,光合儀葉室參數(shù):流量為500 μmol/s,光合有效輻射為 1 000 μmol/s,CO2濃度為400 μmol/s,相對(duì)濕度為50%~60%,葉溫為25 ℃,重復(fù)測(cè)量3次。同時(shí)進(jìn)行生物量的測(cè)定,從水培系統(tǒng)中取出生菜后,分別稱取地上部、地下部鮮重,隨后在105 ℃烘箱中殺青5 min,再調(diào)節(jié)溫度至70 ℃直到烘干。取中部新鮮葉片,去除葉脈后放入液氮中處理10 min后保存至-80 ℃冰箱中,用于后續(xù)廣靶代謝組學(xué)的測(cè)定和分析。
1.2 樣品的制備及代謝組測(cè)定方法
采用超高效液相色譜-質(zhì)譜系統(tǒng)(UPLC-MS/MS)進(jìn)行代謝組學(xué)的測(cè)定。稱取0.5 g樣品,加入20 mL甲醇-Mcllvaine-Na2EDTA溶液,通過超聲和離心進(jìn)行3次提取,蒸發(fā)至20 mL后過聚苯乙烯-二乙烯基苯(HLB)固相萃取柱,用6 mL甲醇洗脫,收集洗脫液,用氮吹至近干,再用乙腈-水(體積比2 ∶8)混合溶液復(fù)溶,4 ℃、12 000 g離心,收集上清液過濾后,用UPLC-MS/MS進(jìn)行檢測(cè),具體參數(shù)參照陳乾等的研究[19]進(jìn)行設(shè)置。
1.3 數(shù)據(jù)處理
生物量數(shù)據(jù)和光合數(shù)據(jù)用SPSS 20.0進(jìn)行單因素方差分析,采用新復(fù)極差法分析差異。對(duì)質(zhì)譜檢測(cè)的數(shù)據(jù)進(jìn)行定性、相對(duì)定量分析,定性分析參照公共數(shù)據(jù)庫(kù),相對(duì)定量分析采用多反應(yīng)監(jiān)測(cè)模式,得到所有樣本的代謝物定性與相對(duì)定量的結(jié)果。用SIMCA軟件(v16.0.2,Sartorius Stedim Data Analytics AB,Umea,Sweden)對(duì)數(shù)據(jù)進(jìn)行對(duì)數(shù)轉(zhuǎn)換加中心化格式化處理,進(jìn)行主成分模型分析。采用正交偏最小二乘法-判別分析(orthogonal projections to latent structures-discriminant analysis,OPLS-DA)的統(tǒng)計(jì)方法對(duì)結(jié)果進(jìn)行分析。各處理間選取P<0.05的代謝物為差異代謝物,并將差異代謝物比對(duì)到KEGG數(shù)據(jù)庫(kù)中進(jìn)行富集性分析。
2 結(jié)果與分析
2.1 不同劑量UV-B輻照處理對(duì)生菜生長(zhǎng)的影響
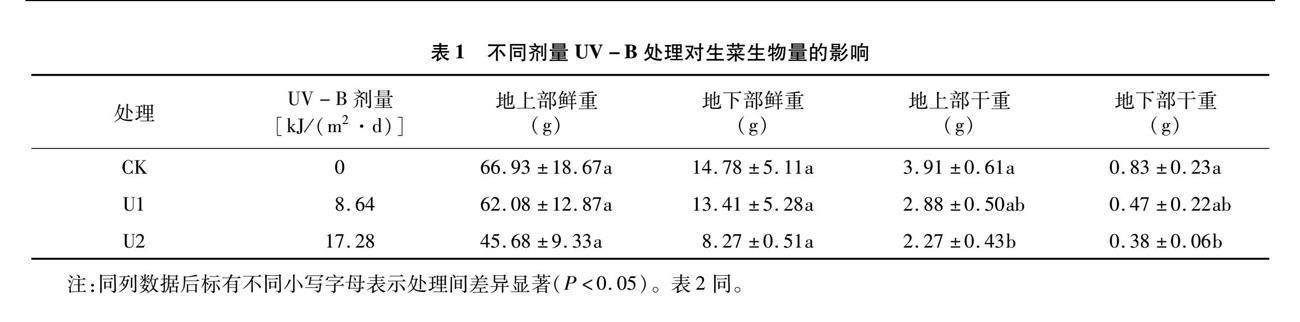
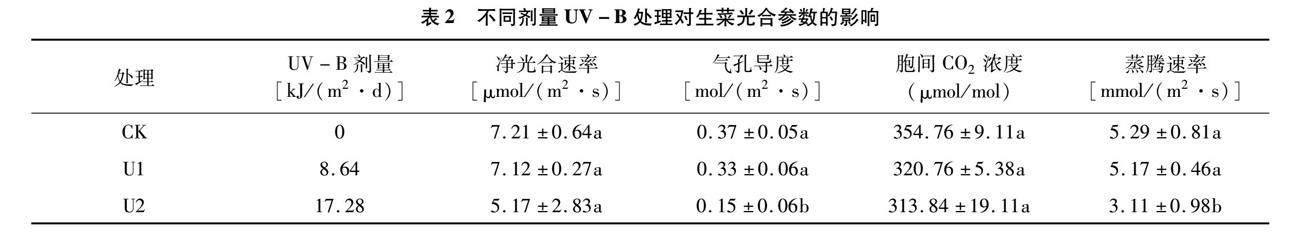
由表1可以看出,與對(duì)照相比,在低劑量UV-B輻照處理下,生菜的地上部鮮重、地下部鮮重、地上部干重和地下部干重逐漸減少,但地上部鮮重、地下部鮮重在3個(gè)處理間未呈現(xiàn)顯著差異。在高劑量UV-B輻照處理下,生菜的地上部干重和地下部干重顯著低于對(duì)照,但在低劑量UV-B輻照處理下,生菜的地上部干重和地下部干重與其他2種處理間無顯著差異。
由表2可以看出,生菜葉片的光合參數(shù)變化趨勢(shì)與生物量基本相同,與對(duì)照相比,生菜葉片的光合參數(shù)隨著UV-B劑量的增加而逐漸下降,其中凈光合速率、胞間CO2濃度在3個(gè)處理間未呈現(xiàn)顯著差異,而氣孔導(dǎo)度、蒸騰速率在高劑量UV-B處理下顯著低于對(duì)照、低劑量處理,而對(duì)照與低劑量處理間無顯著差異。
2.2 代謝組多元統(tǒng)計(jì)分析
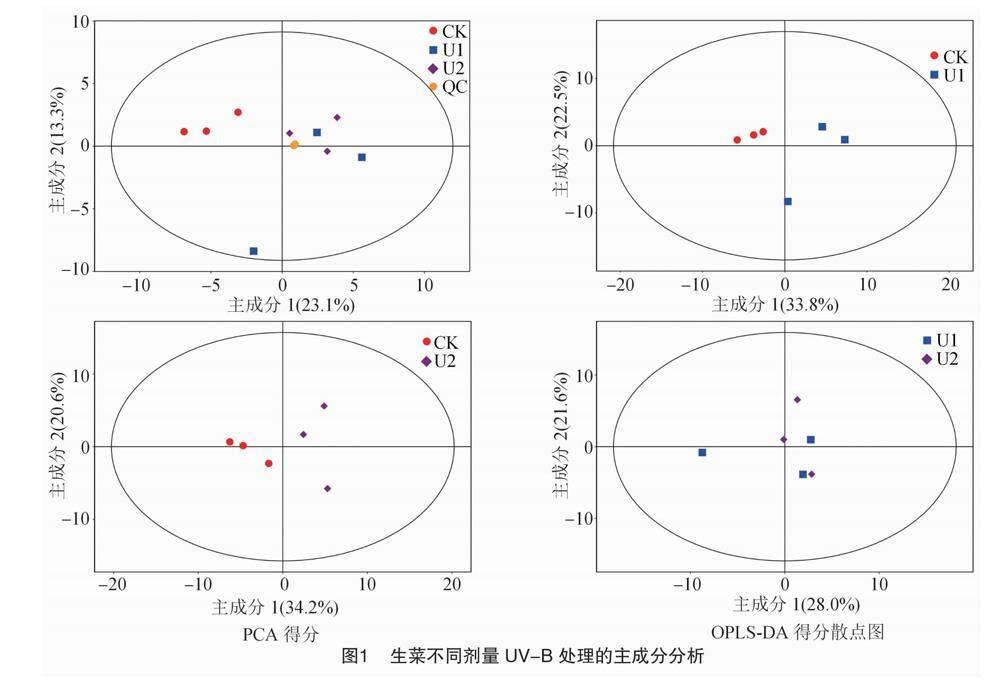
用SIMCA軟件對(duì)數(shù)據(jù)進(jìn)行對(duì)數(shù)(LOG)轉(zhuǎn)換加UV格式化處理,首先對(duì)第1主成分進(jìn)行OPLS-DA建模分析,模型的質(zhì)量用7折交叉驗(yàn)證進(jìn)行檢驗(yàn);用交叉驗(yàn)證后得到的RY(模型對(duì)分類變量Y的可解釋性)和Q(模型的可預(yù)測(cè)性)對(duì)模型的有效性進(jìn)行評(píng)判;最后通過置換檢驗(yàn),隨機(jī)多次改變分類變量Y的排列順序,得到不同的隨機(jī)Q 值,對(duì)模型有效性作進(jìn)一步的檢驗(yàn)。全部樣本(包括QC樣本)的PCA得分散點(diǎn)圖如圖1所示, 可見樣本全部位于95%置
信區(qū)間內(nèi)。樣本間對(duì)比分析的PCA得分散點(diǎn)圖如圖1所示,可見所有樣本的兩兩對(duì)比區(qū)分非常顯著。OPLS-DA模型結(jié)果中的R2Y均為1,Q2分別為0.628、0.632、0.746,表明模型預(yù)測(cè)性良好。置換檢驗(yàn)結(jié)果表明,模型具有良好的穩(wěn)健性,不存在過擬合現(xiàn)象。
2.3 差異代謝物篩選
為了檢測(cè)不同劑量UV-B輻照對(duì)生菜代謝產(chǎn)物的影響,利用廣泛靶標(biāo)代謝組測(cè)定生菜葉片中的代謝產(chǎn)物,每組設(shè)3次生物學(xué)重復(fù),并對(duì)其進(jìn)行定性、定量分析。由表3可知,CK組對(duì)U1組共篩選到30個(gè)差異代謝物,其中屬于生物堿類的有5種,4種在U1中上調(diào)表達(dá),屬于萜類有2種,均在U1 中下調(diào)表達(dá),U1組中共有9種上調(diào)表達(dá)的差異代謝物,分別是1-甲基腺嘌呤、3-羥基-4-甲氧基肉桂酸、別歐前胡素、甜菜堿醛、膽綠素、松柏苷、表雄酮、槲皮素-3-O-新橙皮苷、乙酰托品醇,其中 3-羥基-4-甲氧基肉桂酸、槲皮素-3-O-新橙皮苷上調(diào)表達(dá)達(dá)2倍以上。
CK組對(duì)U2組共篩選到35種差異代謝物,其中黃酮類物質(zhì)占差異代謝物的9/35,均在U2中上調(diào)表達(dá),萜類物質(zhì)有6種,其中單萜在U2中上調(diào)表達(dá),而其余多萜在U2中均下調(diào)表達(dá),生物堿類有3種,在U2組中總共有21種上調(diào)表達(dá)的差異代謝物,其中芹菜苷、甜菜堿醛、去甲氧基茵陳色原酮、維生素A 上調(diào)表達(dá)2倍以上,紫云英苷上調(diào)表達(dá)7倍以上。U1組對(duì)U2組共篩選到26個(gè)差異代謝物,其中萜類物質(zhì)有3種,2種單萜、1種三萜均在U2中上調(diào)表達(dá),3種黃酮類物質(zhì)均在U2中上調(diào)表達(dá),在U2組中總共有16種上調(diào)表達(dá)的差異代謝物。
2.4 差異代謝通路分析
由圖2可知,CK與U1比較,富集在煙酸鹽、煙酰胺代謝通路中共有12個(gè)代謝物,在該通路中的差異代謝物為煙酰胺核糖酸,在泛醌和其他萜類化合物的生物合成通路中共檢測(cè)出23個(gè)代謝物,差異代謝物為維生素E, 油菜素內(nèi)酯生物合成通路中檢測(cè)到25個(gè)代謝物,其中菜油甾醇是差異代謝物,此外,還有卟啉和葉綠素代謝,甘氨酸、絲氨酸和蘇氨酸代謝,類固醇生物合成,嘧啶代謝,精氨酸和脯氨酸代謝和苯丙酸生物合成上均存在差異代謝物,分別為膽綠素、甜菜堿醛、菜油甾醇、脫氧尿苷和n-乙酰-l-谷氨酸5-半醛(圖2)。在CK與U2的比較中,黃酮和黃酮醇的生物合成、類黃酮生物合成、乙醛酸鹽和二羧酸鹽代謝、檸檬酸循環(huán)(TCA循環(huán))、甘氨酸、絲氨酸和蘇氨酸代謝、類胡蘿卜素生物合成和嘧啶代謝是主要的差異代謝通路,其中差異代謝物分別為芹黃素、槲皮素、花青色素、芹黃素、順式烏頭酸、順式烏頭酸、甜菜堿醛、脫落酸、脫氧尿苷。在U1和U2的比較中,代謝通路集中在果糖和甘露糖代謝、乙醛酸鹽和二羧酸鹽代謝、檸檬酸循環(huán)(TCA循環(huán))、泛醌等萜類化合物的生物合成、糖酵解或糖異生、半乳糖代謝、淀粉和蔗糖代謝、半胱氨酸和蛋氨酸代謝、精氨酸和脯氨酸代謝、氨基糖和核苷酸糖代謝、不飽和脂肪酸的生物合成、類黃酮生物合成、苯丙酸生物合成、脂肪酸生物
合成共14個(gè)代謝通路上。
3 結(jié)論與討論
植物為了防御UV-B輻射帶來的傷害,會(huì)改變植物光合作用、基因表達(dá)、酶活性及次生代謝。在本研究中,生菜在高劑量UV-B輻照處理下地上部干重和地下部干重顯著減少,但在低劑量 UV-B 輻照處理下的生物量無顯著差異。在自然條件下,增強(qiáng)UV-B輻射后,山楂葉片、下表皮厚度增加,凈光合速率下降,氣孔導(dǎo)度、蒸騰速度上升,葉片和果實(shí)中的總酚、總黃酮和總花青素含量均出現(xiàn)不同程度的增加[20]。有研究表明,UV-B輻照對(duì)大部分植物的產(chǎn)量、葉面積、胚軸長(zhǎng)度都起到抑制作用[21-22]。也有少數(shù)研究表明,在UV-B輻照下,一些作物(如生菜)的凈光合速率和產(chǎn)量均增加[23-24]。這種差異除了與植物的遺傳特性、地區(qū)適應(yīng)性有關(guān),還與UV-B輻照劑量、植物生長(zhǎng)階段及光合有效輻射強(qiáng)度有關(guān)[10]。在本研究中,在地上部鮮重(產(chǎn)量)方面,3種UV-B處理間并沒有呈現(xiàn)顯著差異,表明UV-B輻照在生菜生產(chǎn)中的應(yīng)用可以不影響產(chǎn)量。
在本研究中,與對(duì)照相比,在2種劑量UV-B輻射處理下,生菜葉片中最主要的差異代謝產(chǎn)物是酚類物質(zhì),尤其是類黃酮類物質(zhì)。在高劑量UV-B輻照下,主要差異代謝物為黃酮類物質(zhì),包括芹菜素、芹菜苷、紫云英苷、矢車菊素、去甲氧基茵陳色原酮、高良姜素、槲皮素、槲皮苷,均在高劑量UV-B輻照處理下顯著上調(diào),在低劑量UV-B輻照處理下, 黃酮類物質(zhì)槲皮素-3-O-新橙皮苷也顯著上調(diào)表達(dá),表明黃酮類物質(zhì)在UV-B輻照處理下顯著積累,且隨著輻照劑量提高而逐漸積累,這與多數(shù)研究結(jié)果一致。如在溫室中比較UV-B、無UV-B處理生菜種苗,類黃酮物質(zhì)呈現(xiàn)顯著差異[25]。UV-B輻射可以顯著提高辣椒葉片中綠原酸、芹菜素8-c-己苷等黃酮類物質(zhì)的含量[5]。在花菜中,隨著UV-B劑量[0、2.2、8.8、16.4 kJ/(m2·d)]的增加,產(chǎn)量逐漸降低,體內(nèi)總酚、金蓮葡糖硫苷含量先增后減,總類黃酮含量逐漸增加[26]。類黃酮類物質(zhì)具有抗氧化和吸收紫外線的功能,在UV-B輻射下高度羥基化,有利于去除植物細(xì)胞中的ROS,從而對(duì)氧化脅迫造成的機(jī)體損傷進(jìn)行有效修復(fù)[27-28]。
除黃酮類外,萜類物質(zhì)也是UV-B輻照下重要的差異代謝物。萜類化合物是指具有(C5H8)n通式、含氧、具有不同飽和程度的衍生物,具有抗腫瘤、抗病毒、抗菌、抗炎等藥理作用。萜類化合物能夠保護(hù)植株避免受到氧化損傷,當(dāng)植株面臨UV-B脅迫時(shí),植物的自我保護(hù)機(jī)制開啟,誘導(dǎo)萜類化合物合成量增加[29]。在本研究中,受到UV-B輻照后,生菜體內(nèi)萜類化合物發(fā)生了顯著變化,與對(duì)照相比,高劑量UV-B輻照處理主要積累單萜2,6-二甲基-7-辛烯-2,3,6-三醇,而倍半萜(脫落酸)、三萜(靈芝酸F、羽扇豆醇)、二萜(12-O-十四烷酰佛波醋酸酯-13)表達(dá)量顯著下調(diào);在低劑量UV-B處理下,生菜的二萜(12-O-十四烷酰佛波醋酸酯-13)、倍半萜(柳杉二醇)顯著下調(diào)表達(dá)。相似的研究結(jié)果也在其他植物中發(fā)現(xiàn),如在UV-B輻射下,神農(nóng)香菊葉片分泌物中的單萜桉樹腦含量隨著輻照時(shí)間不斷增加[30]。相比無UV-B輻照處理,不同強(qiáng)度的UV-B均可以增加葡萄采后桉油精、芳樟醇等單萜的濃度[31]。相對(duì)于正常UV-B較低的環(huán)境,高海拔、較強(qiáng)UV-B環(huán)境下的葡萄漿果中的α-金合歡烯、β-金合歡烯、瓦倫烯、α-人參烯和橙花叔醇等倍半萜含量均增加,但總揮發(fā)性有機(jī)化合物排放量沒有受到明顯影響[32]。上述研究結(jié)果表明,在不同物種中,萜類物質(zhì)對(duì)UV-B脅迫的響應(yīng)機(jī)制不同。
植物產(chǎn)生各種次級(jí)代謝產(chǎn)物是應(yīng)對(duì)UV-B輻射的防御策略之一,這些代謝物不僅涉及對(duì)UV-B影響下的植物提供保護(hù),而且可以對(duì)植物細(xì)胞在UV-B誘導(dǎo)免疫防御系統(tǒng)不充分時(shí)提供保護(hù)[33-34],同時(shí)這些物質(zhì)也是人類可利用的飲食營(yíng)養(yǎng)及藥用物質(zhì),已經(jīng)被用于制藥、營(yíng)養(yǎng)保健并逐漸成為常規(guī)飲食的一部分。槲皮素作為一種天然的黃酮類多酚化合物,具有抗氧化、抗炎、抗腫瘤等作用,在本研究的高、低劑量UV-B輻射處理下,槲皮素表達(dá)量均顯著提升。在高劑量UV-B輻射處理下,香豆素、芹菜苷、紫云英苷、矢車菊素、枸橘苷等黃酮類物質(zhì)表達(dá)量顯著提高,維生素A表達(dá)量顯著提升,但生菜的產(chǎn)量(地上部鮮重)并沒有受到顯著影響。因此可見,較高劑量UV-B輻照可以成為生菜設(shè)施栽培中提高有利于人類健康的營(yíng)養(yǎng)品質(zhì)的一種有效措施[35]。關(guān)于不同UV-B劑量下生菜葉片的轉(zhuǎn)錄組學(xué)研究,尤其是黃酮類、萜類物質(zhì)合成機(jī)制及合成途徑中涉及的關(guān)鍵酶的基因表達(dá)是否發(fā)生上調(diào)還有待進(jìn)一步研究。
本研究開展不同劑量UV-B輻照對(duì)生菜生長(zhǎng)和代謝組學(xué)的影響研究,隨著UV-B劑量增加,生菜地上部鮮重和凈光合速率均呈現(xiàn)下降趨勢(shì),但并未呈現(xiàn)出顯著差異,2種劑量UV-B輻照下生菜葉片中最主要的差異代謝物質(zhì)為黃酮類物質(zhì),其中槲皮素含量在UV-B輻照下均顯著增加,本研究結(jié)果可為利用UV-B輻照提高設(shè)施生菜營(yíng)養(yǎng)品質(zhì)提供技術(shù)支持。
參考文獻(xiàn):
[1]Caldwell M M,Bornman J F,Ballaré C L,et al. Terrestrial ecosystems,increased solar ultraviolet radiation,and interactions with other climate change factors[J]. Photochem Photobiol Sci,2007,6(3):252-266.
[2]Hideg E,Jansen M A K,Strid . UV-B exposure,ROS,and stress:inseparable companions or loosely linked associates?[J]. Trends Plant Sci,2013,18(2):107-115.
[3]王修蘋,李 想,李祖然,等. 植物對(duì)UV-B輻射增強(qiáng)響應(yīng)的跨代可塑性特征及機(jī)制研究進(jìn)展[J]. 植物生理學(xué)報(bào),2022,58(5):797-805.
[4]黃志慧,張一寧,李娜娜,等. 增補(bǔ)UV-B輻射對(duì)菥蓂生理特性及次生代謝產(chǎn)物的影響[J]. 植物研究,2022,42(6):1079-1087.
[5]Rodríguez-Calzada T,Qian M,Strid ,et al. Effect of UV-B radiation on morphology,phenolic compound production,gene expression,and subsequent drought stress responses in chili pepper (Capsicum annuum L.)[J]. Plant Physiology and Biochemistry,2019,134:94-102.
[6]Takshak S,Agrawal S B. Secondary metabolites and phenylpropanoid pathway enzymes as influenced under supplemental ultraviolet-B radiation in Withania somnifera Dunal,an indigenous medicinal plant[J]. J Photoch Photobio B,2014,140:332-343.
[7]Quintero-Arias D G,Acua-Caita J F,Asensio C,et al. Ultraviolet transparency of plastic films determines the quality of lettuce (Lactuca sativa L.) grown in a greenhouse[J]. Agronomy,2021,11(2):358.
[8]Dai Q J,Yan B,Huang S B,et al. Response of oxidative stress defense systems in rice (Oryza sativa) leaves with supplemental UV-B radiation[J]. Physiol Plantarum,1997,101(2):301-308.
[9]Loconsole D,Santamaria P. UV lighting in horticulture:a sustainable tool for improving production quality and food safety[J]. Horticulturae,2021,7(1):9.
[10]Jenkins G I. Signal transduction in responses to UV-B radiation[J]. Annu Rev Plant Biol,2009,60(1):407.
[11]Tsurunaga Y,Takahashi T,Katsube T,et al. Effects of UV-B irradiation on the levels of anthocyanin,rutin and radical scavenging activity of buckwheat sprouts[J]. Food Chemistry,2013,141(1):552-556.
[12]孫令強(qiáng),李召虎,段留生,等. UV-B輻射對(duì)黃瓜幼苗生長(zhǎng)和光合作用的影響[J]. 華北農(nóng)學(xué)報(bào),2006,21(6):79-82.
[13]岳 堃,王 紅,郭鈺柬,等. 增強(qiáng)UV-B輻射對(duì)芒果葉片光合組織結(jié)構(gòu)的損傷[J]. 熱帶生物學(xué)報(bào),2019,10(4):324-330.
[14]Wang H B,Gui M Y,Tian X,et al. Effects of UV-B on vitamin C,phenolics,flavonoids and their related enzyme activities in mung bean sprouts (Vigna radiata)[J]. Int J Food Sci Tech,2017,52(3):827-833.
[15]Lee J H. UV-B signal transduction pathway in Arabidopsis[J]. J Integr Plant Biol,2016,59(3):223-230.
[16]Bergstrand K J,Schüssler H K. Recent progresses on the application of LEDs in the horticultural production[J]. Acta Hortic,2012,927:529-534.
[17]Massot C,Génard M,Stevens R,et al. Fluctuations in sugar content are not determinant in explaining variations in vitamin C in tomato fruit[J]. Plant Physiol Bioch,2010,48(9):751-757.
[18]趙曉莉,胡正華,徐建強(qiáng),等. UV-B輻射與酸雨脅迫對(duì)生菜生理特性及品質(zhì)的影響[J]. 生態(tài)環(huán)境,2006,15(6):1170-1175.
[19]陳 乾,劉 洋,肖麗君,等. 超高效液相色譜串聯(lián)質(zhì)譜法同時(shí)測(cè)定葉菜中13種抗生素[J]. 環(huán)境科學(xué),2020,41(2):952-961.
[20]劉榕晨. UV-B輻射對(duì)‘大金星山楂生理特性及次生代謝產(chǎn)物的影響[D]. 太谷:山西農(nóng)業(yè)大學(xué),2019.
[21]陳慧澤,韓 榕. 植物響應(yīng)UV-B輻射的研究進(jìn)展[J]. 植物學(xué)報(bào),2015,50(6):790-801.
[22]Huché-Thélier L,Crespel L,Le Gourrierec J,et al. Light signaling and plant responses to blue and UV radiations perspectives for applications in horticulture[J]. Environ Exp Bot,2016,121:22-38.
[23]Yao Y,Xuan Z,He Y,et al. Principal component analysis of intraspecific responses of tartary buckwheat to UV-B radiation under field conditions[J]. Environ Exp Bot,2007,61(3):237-245.
[24]Wargent J J,Elfadly E M,Moore J P,et al. Increased exposure to UV-B radiation during early development leads to enhanced photoprotection and improved long-term performance in Lactuca sativa[J]. Plant Cell Environ,2011,34(8):1401-1413.
[25]Wargent J J,Nelson B C,McGhie T K,et al. Acclimation to UV-B radiation and visible light in Lactuca sativa involves up-regulation of photosynthetic performance and orchestration of metabolome-wide responses[J]. Plant Cell Environ,2015,38(5):929-940.
[26]Topcu Y,Dogan A,Sahin-Nadeem H,et al. Morphological and biochemical responses of broccoli florets to supplemental ultraviolet-B illumination[J]. Agr Ecosyst Environ,2018,259:1-10.
[27]Agati G,Tattini M. Multiple functional roles of flavonoids in photoprotection[J]. New Phytol,2010,186(4):786-793.
[28]Agati G,Azzarello E,Pollastri S,et al. Flavonoids as antioxidants in plants:location and functional significance[J]. Plant Sci,2012,196:67-76.
[29]劉佳鈺,王 蓉,張 弛,等. UV-B輻射與植物次級(jí)代謝產(chǎn)物變化的研究進(jìn)展[J]. 基因組學(xué)與應(yīng)用生物學(xué),2017,36(8):3157-3166.
[30]何 淼,王霽佳,高文杰,等. UV-B輻射對(duì)神農(nóng)香菊萜類物質(zhì)合成及其相關(guān)基因表達(dá)的影響[J]. 廣西植物,2019,39(7):933-939.
[31]Eichholz I,Huyskens-Keil S,Keller A,et al. UV-B-induced changes of volatile metabolites and phenolic compounds in blueberries (VacciniumcorymbosumL.)[J].FoodChem,2011,
126(11):60-64.
[32]Gil M,Bottini R,Pontin M,et al. Solar UV-B radiation modifies the proportion of volatile organic compounds in flowers of field-grown grapevine (Vitis vinifera L.) cv. Malbec[J]. Plant Growth Regul,2014,74(2):193-197.
[33]Schreiner M,Martínez-Abaigar J,Glaab J,et al. UV‐B induced secondary plant metabolites:potential benefits for plant and human health[J]. Optik & Photonik,2014,9(2):34-37.
[34]Takshak S,Agrawal S B. Defense potential of secondary metabolites in medicinal plants under UV-B stress[J]. J Photoch Photobio B,2019,193:51-88.
[35]Meyer P,van de Poel B,de Coninck B. UV-B light and its application potential to reduce disease and pest incidence in crops[J]. Hortic Res,2021,8(1):194.

