重金屬汞脅迫下菲律賓蛤仔GPx和GST基因表達(dá)分析
鄭志龍 閆路路 閆喜武 秦艷杰

摘要 為研究重金屬汞脅迫下菲律賓蛤仔谷胱甘肽過(guò)氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽-S-轉(zhuǎn)移酶(glutathione-S-transferase,GST)基因的表達(dá)情況,用汞對(duì)指示生物菲律賓蛤仔(Ruditapes philippinarum)進(jìn)行單一慢性暴露試驗(yàn),分別在0、12、24 h以及2、3、4、5、6、7和8 d時(shí)檢測(cè)菲律賓蛤仔內(nèi)臟團(tuán)和鰓中GPx和GST基因的表達(dá)情況。結(jié)果表明,菲律賓蛤仔內(nèi)臟團(tuán)中GPx和GST基因的表達(dá)量都呈現(xiàn)波動(dòng)變化趨勢(shì),分別在24和12 h時(shí)表達(dá)量最高(P<0.05),6 d時(shí)GPx基因表達(dá)量最低(P>0.05),3 d時(shí)GST基因表達(dá)量最低(P<0.05);GPx基因在鰓中的表達(dá)量在8 d時(shí)最高(P<0.05);鰓中GST基因的表達(dá)量在5 d時(shí)最高(P<0.05)。以上結(jié)果表明汞暴露在短期內(nèi)能夠誘導(dǎo)GPx和GST基因進(jìn)行不同程度的表達(dá),但其隨著時(shí)間的延長(zhǎng)呈明顯的抑制作用。該研究結(jié)果為揭示重金屬汞對(duì)菲律賓蛤仔的毒性機(jī)理提供了理論依據(jù)。
關(guān)鍵詞 重金屬汞;菲律賓蛤仔;谷胱甘肽過(guò)氧化物酶;谷胱甘肽-S-轉(zhuǎn)移酶
中圖分類(lèi)號(hào) S917.4? 文獻(xiàn)標(biāo)識(shí)碼 A? 文章編號(hào) 0517-6611(2024)10-0113-07
doi:10.3969/j.issn.0517-6611.2024.10.024
Expression Analysis of GPx and GST Genes in Ruditapes philippinarum Under Heavy Metal Mercury Stress
ZHENG Zhi-long1,2, YAN Lu-lu1,2, YAN Xi-wu1,2 et al
(1.College of Fisheries and Life Science, Dalian Ocean University, Dalian, Liaoning 116023;2.Liaoning Shellfish Breeding Engineering Technology Center, Dalian,Liaoning 116023)
Abstract In order to study the gene expression of glutathione peroxidase (GPx) and glutathione-S-transferase (GST) in Ruditapes philippinarum under the stress of heavy metal mercury (Hg),? a single chronic exposure experiment on the indicator organism R. philippinarum was carried out. The expression of two genes in visceral mass and gill of? R. philippinarum was detected at 0,12 h,24 h and 2, 3, 4, 5, 6, 7 and 8 d. The results showed that the expression multiples of GPx and GST in the visceral mass showed a fluctuation trend, and the expression multiples reached the highest (P<0.05) at 24 and 12 h, respectively. The expression level was the lowest at 6 d(P>0.05)and 3 d (P<0.05). The expression multiple of GPx in the gill was the highest at 8 d (P< 0.05), and the first peak appeared at 5 d. The expression amount of GST? was the highest at 5 d (P<0.05). It showed that mercury exposure could induce the expression of GPx and GST in different degrees in the short term,but it had obvious inhibitory effect with the extension of time. This study provided the theoretical basis for revealing the toxicity of heavy metal mercury to R. philippinarum.
Key words Heavy metal mercury;R. philippinarum;Glutathione peroxidase;Glutathione-S-transferase
基金項(xiàng)目 山東省重點(diǎn)研發(fā)計(jì)劃項(xiàng)目(2023LZGCQY001);現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系專(zhuān)項(xiàng)(CARS-49);國(guó)家重點(diǎn)研發(fā)計(jì)劃項(xiàng)目(2018YFD0901400)。
作者簡(jiǎn)介 鄭志龍(1999—),男,福建福州人,碩士研究生,研究方向:水產(chǎn)動(dòng)物遺傳育種與繁殖。
*通信作者,教授,博士,從事水產(chǎn)養(yǎng)殖學(xué)研究。
收稿日期 2023-04-21
隨著城市化發(fā)展的不斷加快,大量城市污水和固體廢棄物直接排入水中,致使重金屬污染嚴(yán)重破壞海洋生態(tài)系統(tǒng)平衡,已引起廣泛關(guān)注。重金屬污染物(Hg、Cd、Pb、Cr、Cu、Zn等)流動(dòng)性低、難以降解且難溶于水,但來(lái)源十分廣泛,殘留時(shí)間久并通過(guò)食物鏈被生物富集和傳遞,最終匯入海洋造成不可逆轉(zhuǎn)的傷害,嚴(yán)重危及人體健康[1]。
重金屬汞已成為全球關(guān)注的持續(xù)性污染物,被列為污染物優(yōu)先排查的控制目標(biāo)[2]。重金屬汞進(jìn)入海洋無(wú)法降解,只能通過(guò)顆粒沉降進(jìn)入沉積物才能離開(kāi)海洋,但沉積物中有機(jī)組分礦化及生物擾動(dòng)會(huì)促使汞釋放出來(lái)重新進(jìn)入水體[3]。在此過(guò)程中其對(duì)底棲生物又造成了危害,繼而造成二次污染,危害海洋生物。
金屬的毒性作用已經(jīng)在許多水生生物中被證實(shí)[4]。雙殼貝類(lèi)最具代表性,其金屬中毒的主要后果是氧化應(yīng)激[5]。大量研究表明,金屬中毒促進(jìn)了生物體內(nèi)活性氧(ROS)的生成,進(jìn)而導(dǎo)致細(xì)胞過(guò)氧化損傷、脂質(zhì)過(guò)氧化等[6]。為了減少活性氧對(duì)生物的影響,生物體內(nèi)啟動(dòng)有效的抗氧化防御機(jī)制,主要包括谷胱甘肽過(guò)氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽-S-轉(zhuǎn)移酶(glutathione-S-transferase,GST)[7]。因此,對(duì)抗氧化反應(yīng)和脂質(zhì)過(guò)氧化水平的評(píng)價(jià)常常被應(yīng)用于雙殼貝類(lèi)在重金屬暴露環(huán)境的研究中[8]。谷胱甘肽過(guò)氧化物酶(GPx)通過(guò)將內(nèi)源性活性氧維持在相對(duì)較低水平來(lái)保護(hù)細(xì)胞免受氧自由基的損害,并減輕其應(yīng)激反應(yīng)相關(guān)的損害[9]。谷胱甘肽-S-轉(zhuǎn)移酶(GST)是一種Ⅱ期解毒酶,參與有機(jī)化合物的結(jié)合和解毒,通過(guò)催化谷胱甘肽過(guò)氧化物酶的活性,發(fā)揮抗氧化應(yīng)激的保護(hù)作用[10],因此它被認(rèn)為是監(jiān)測(cè)海洋海岸生態(tài)系統(tǒng)金屬污染的生物標(biāo)記物[11]。
我國(guó)是海水養(yǎng)殖大國(guó),貝類(lèi)是四大海水養(yǎng)殖產(chǎn)品之一。其中,菲律賓蛤仔在水體中分布廣泛,對(duì)多種重金屬(Cd、Zn、Cu、Hg和Cr等)有較高的富集能力,因此菲律賓蛤仔不僅被用于重金屬污染監(jiān)測(cè),而且在海洋毒理學(xué)研究中被廣泛應(yīng)用[12]。針對(duì)重金屬汞的海洋生態(tài)毒理學(xué)研究,一般包括生長(zhǎng)、呼吸、行為、繁殖、濾食和發(fā)育等方面[13]。為了保護(hù)海洋生物免受汞的毒害,要加強(qiáng)對(duì)重金屬汞的防治和控制,明確重金屬汞對(duì)海洋生物的毒性效應(yīng)。筆者選取谷胱甘肽過(guò)氧化物酶(GPx)和谷胱甘肽-S-轉(zhuǎn)移酶(GST)這2個(gè)與谷胱甘肽代謝相關(guān)的關(guān)鍵基因,通過(guò)實(shí)時(shí)熒光定量PCR方法驗(yàn)證和分析這2個(gè)基因
在汞脅迫下菲律賓蛤仔體內(nèi)的表達(dá)情況,旨在為揭示重金屬汞對(duì)菲律賓蛤仔的毒性機(jī)理提供理論依據(jù)。
1 材料與方法
1.1 試驗(yàn)動(dòng)物
試驗(yàn)動(dòng)物為菲律賓蛤仔,購(gòu)于大連長(zhǎng)興市場(chǎng)(進(jìn)貨渠道為大連莊河周邊養(yǎng)殖場(chǎng)),殼長(zhǎng)(3.0±0.5)cm,個(gè)體健壯,生活狀態(tài)良好。
1.2 試驗(yàn)藥品
動(dòng)物組織總RNA提取試劑盒(柱型),購(gòu)自天根生化科技(北京)有限公司;
SYBR Premix Ex TaqTM Ⅱ Kit,購(gòu)自寶生物工程(大連)有限公司;
PrimeScriptTM RT reagent Kit,購(gòu)自寶生物工程(大連)有限公司。
1.3 主要儀器與設(shè)備
核酸蛋白檢測(cè)儀,為德國(guó)Implen NanoPhotometer公司產(chǎn)品;
熒光定量檢測(cè)系統(tǒng)Mx3005p,為美國(guó)Agilent Stratagene公司產(chǎn)品;
梯度PCR儀,為德國(guó)Eppendorf公司產(chǎn)品;
電泳儀,為北京六一儀器廠產(chǎn)品;
生物電泳圖像分析系統(tǒng),為上海天能科技有限公司產(chǎn)品;
高速冷凍離心機(jī),為德國(guó)Hettich公司產(chǎn)品。
1.4 試驗(yàn)方法
1.4.1 汞脅迫下菲律賓蛤仔表達(dá)譜研究。
1.4.1.1
測(cè)序與序列比對(duì)。將經(jīng)0.094 8 mg/L Hg處理的菲律賓蛤仔分別在0、12 h和6 d時(shí)取其鰓和內(nèi)臟團(tuán),并迅速放入液氮中保存。采用Invitrogen公司的Trizol試劑提取RNA;提取RNA后,按照Invitrogen公司的Dynabeads mRNA純化試劑盒進(jìn)行mRNA的純化。將mRNA在fragmentation buffer提供的高鹽理性環(huán)境下,高溫打斷;以打斷的mRNA為模板,用六堿基隨機(jī)引物(random hexamers)合成cDNA第一鏈,加入緩沖液、dNTPs、RNase H和DNA polymerase Ⅰ合成cDNA第二鏈;經(jīng)過(guò)QiaQuick PCR純化試劑盒純化并加入EB緩沖液洗脫,末端修復(fù)、加堿基A后加上測(cè)序接頭,再經(jīng)過(guò)瓊脂糖凝膠電泳回收目的片段大小的核酸序列,進(jìn)行PCR擴(kuò)增,從而完成整個(gè)文庫(kù)制備工作,構(gòu)建的文庫(kù)用Illumina HiSeqTM 2000測(cè)序儀進(jìn)行測(cè)序。測(cè)序儀產(chǎn)生的原始圖像數(shù)據(jù)經(jīng)base calling轉(zhuǎn)化為序列數(shù)據(jù),序列數(shù)據(jù)包含reads的序列及reads的測(cè)序質(zhì)量,原始reads數(shù)據(jù)中帶有含測(cè)序接頭的序列和少量低質(zhì)量序列;最后,利用SOAPaligner/Soap2軟件,將每個(gè)樣品的clean reads分別與菲律賓蛤仔轉(zhuǎn)錄組進(jìn)行比對(duì),最后將比對(duì)得到的基因用于后續(xù)生物信息學(xué)分析。
1.4.1.2 生物信息學(xué)分析。對(duì)clean reads進(jìn)行測(cè)序評(píng)估,并根據(jù)clean reads比對(duì)到參考序列(菲律賓蛤仔轉(zhuǎn)錄組)上的數(shù)量及分布,采用RPKM法(reads per kilobase per million)計(jì)算該基因的表達(dá)量,計(jì)算公式如下:
RPKM(A)=106CNL/103(1)
式中:RPKM(A)為A基因的表達(dá)量;C為唯一比對(duì)到A基因的reads數(shù);N為唯一比對(duì)到參考基因的reads數(shù);L為A基因的堿基數(shù)。
通過(guò)比較不同樣本的數(shù)據(jù),利用概率公式篩選出差異表達(dá)基因。差異表達(dá)基因同時(shí)需要滿足差異檢驗(yàn)FDR≤0.001且基因A與基因B的相對(duì)表達(dá)量絕對(duì)值|log2Ratio(A/B)|≥1。將滿足上述條件的差異表達(dá)基因進(jìn)行以下分析:
(1)基因表達(dá)模式聚類(lèi)分析:表達(dá)模式相似的基因通常具有相似的功能,因此利用差異表達(dá)基因和試驗(yàn)條件同時(shí)進(jìn)行等級(jí)聚類(lèi)分析。
(2)Pathway顯著性富集分析:以KEGG pathway為單位,找出差異表達(dá)基因中顯著性富集的pathway。
為進(jìn)一步了解差異表達(dá)基因的生物學(xué)功能,以KEGG pathway為單位,找出與整個(gè)轉(zhuǎn)錄組相比差異表達(dá)基因顯著富集的KEGG pathway。按照以下計(jì)算公式,計(jì)算P值:
P=1-m-1i=0MiN-Mn-iNn
(2)
式中,N為轉(zhuǎn)錄組中具有pathway注釋的基因數(shù)目,n為具有pathway注釋的差異表達(dá)基因數(shù),
M為轉(zhuǎn)錄組中注釋為某特定pathway條目的基因數(shù)目,
m為注釋為某特定pathway條目的差異表達(dá)基因數(shù)。
設(shè)定Q值≤0.05的KEGG pathway為顯著性富集,由此確定重金屬脅迫下菲律賓蛤仔差異表達(dá)基因參與的主要生化代謝途徑和信號(hào)轉(zhuǎn)導(dǎo)途徑。
1.4.2 GPx和GST基因?qū)崟r(shí)熒光定量PCR分析。
1.4.2.1 前期處理和取樣。
菲律賓蛤仔暫養(yǎng)7 d后,用96 h半致死濃度(0.094 8 mg/L)的Hg處理菲律賓蛤仔,分別在0、12、24 h以及2、3、4、5、6、7、8 d取其鰓和內(nèi)臟團(tuán),迅速冷凍在液氮中,保存于-80 ℃冰箱中。
1.4.2.2 總RNA的提取。
按照天根生化科技(北京)有限公司提供的動(dòng)物組織總RNA提取試劑盒說(shuō)明書(shū)提取樣品總RNA。
1.4.2.3
RNA純度及濃度檢測(cè)。
總RNA經(jīng)過(guò)1%的瓊脂糖凝膠電泳檢測(cè)其完整性,電泳液為0.5×TBE,電泳時(shí)間為30 min,電泳后在凝膠成像儀下觀察RNA條帶。將沒(méi)有彌散且條帶清晰的總RNA在核酸蛋白檢測(cè)儀上檢測(cè)RNA純度和濃度,選擇純度1.9~2.1、濃度≥61.5 ng/μL的RNA樣品用于后續(xù)試驗(yàn),將不合格樣品重新提取總RNA,直到滿足條件為止。
1.4.2.4 cDNA第一鏈的合成。
將檢測(cè)合格的RNA樣品,分別取800 ng總RNA進(jìn)行反轉(zhuǎn)錄,按照反轉(zhuǎn)錄試劑盒說(shuō)明書(shū)進(jìn)行,整個(gè)試驗(yàn)操作在冰上進(jìn)行,反轉(zhuǎn)錄體系如下:5×PrimeScriptTM buffer 4 μL、
PrimeScriptTM RT enzyme Mix I 1 μL、
Oligo dT Primer(50 μmol/L)1 μL、
Random 6 mers(100 μmol/L)1 μL、
Total RNA 900 ng,
用RNase Free H2O補(bǔ)足20 μL。反應(yīng)條件:37 ℃,15 min;85 ℃,5 s;
4 ℃下分裝并保存于-80 ℃冰箱中備用。
1.4.2.5 qRT-PCR引物設(shè)計(jì)。
根據(jù)引物設(shè)計(jì)原則,設(shè)計(jì)內(nèi)參基因和目的基因引物。內(nèi)參基因Tubulin,目的基因GPx和GST序列均來(lái)自菲律賓蛤仔轉(zhuǎn)錄組序列。引物設(shè)計(jì)完成后,委托生工生物工程(上海)股份有限公司進(jìn)行引物合成,經(jīng)過(guò)引物篩選,設(shè)計(jì)引物序列如下:
Tubulin-F為AAGCGTCTATGATTCTGG,Tubulin-R為GGTAAGGGCAAAGGTAT;
GPx-F為GAATGTAGCATCCCTCTG,
GPx-R為T(mén)CTCCTGGTGTCCAAACT;
GST-F為T(mén)GCTTCAGGCTCTTGCT;
GST-R為T(mén)ATCTTGACGAAACTACCC。
1.4.2.6 GPx和GST基因?qū)崟r(shí)熒光定量PCR。
將反轉(zhuǎn)錄得到的所有cDNA各取1 μL,混合后作為cDNA的混合模板,按照2×50、2×51、2×52、2×53、2×54倍數(shù)進(jìn)行稀釋?zhuān)糜跇?biāo)準(zhǔn)曲線的制備。確定標(biāo)準(zhǔn)曲線后,對(duì)內(nèi)參基因、GST和GPx基因進(jìn)行實(shí)時(shí)熒光定量PCR,反應(yīng)體系如下:
2×SYBR Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)10.0 μL,
PCR Forward Primer(0.4 μmol/L)0.8 μL,
PCR Reverse Primer(0.4 μmol/L)0.8 μL,
ROX Reference Dye Ⅱ(50×)0.4 μL,
cDNA(≤100 ng)2.0 μL,用ddH2O補(bǔ)足20 μL。qRT-PCR反應(yīng)程序:95 ℃30 s;95 ℃10 s,56 ℃25 s,72 ℃25 s,40個(gè)循環(huán)。
2 結(jié)果與分析
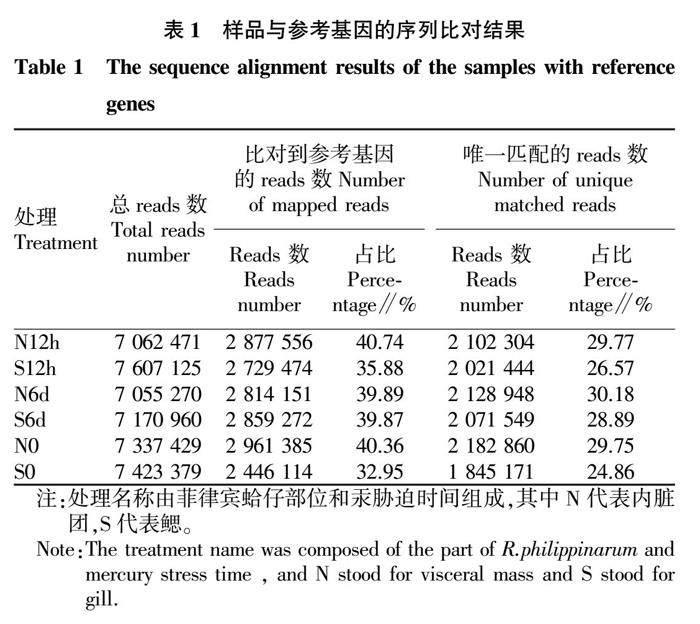
2.1 序列比對(duì)結(jié)果
將6個(gè)樣品分別與參考基因進(jìn)行序列比對(duì),得到所測(cè)樣品總reads數(shù)、比對(duì)到參考序列的reads數(shù)和唯一比對(duì)到參考序列的reads數(shù),結(jié)果見(jiàn)表1。
2.2 差異基因表達(dá)篩選
差異表達(dá)基因篩選原則:
①差異檢驗(yàn)中陽(yáng)性發(fā)現(xiàn)錯(cuò)誤率(false discovery rate,F(xiàn)DR)≤0.001;
②差異倍數(shù)在2倍及以上,即|log2Ratio| ≥1。
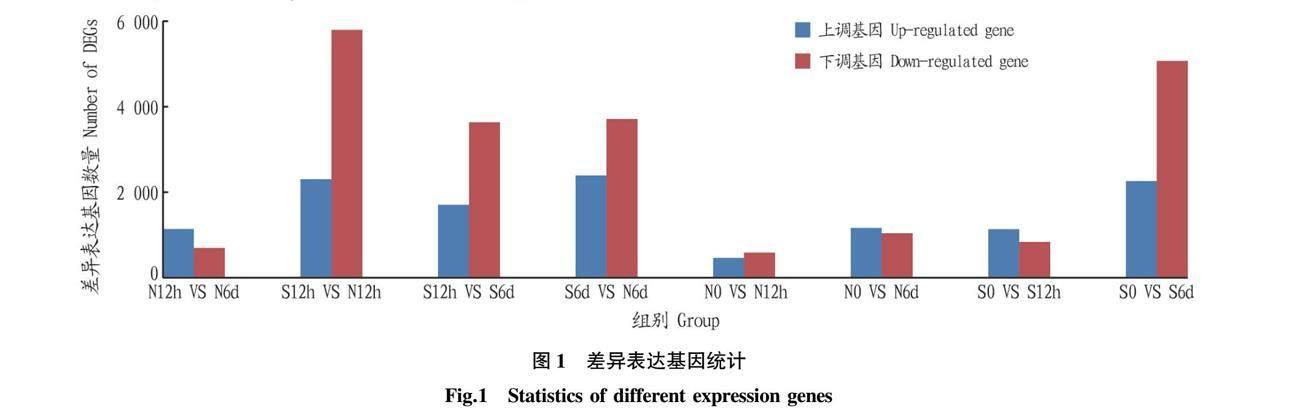
試驗(yàn)以單變量為比對(duì)原則,將樣品進(jìn)行兩兩比對(duì),并得到差異表達(dá)基因統(tǒng)計(jì)圖(圖1)。從圖1可以看出,S0 VS S6d有2 251個(gè)上調(diào)基因和5 051個(gè)下調(diào)基因。
2.3 KEGG Pathway顯著性富集分析 通過(guò)KEGG通路顯著性富集分析,得到KEGG中顯著性富集的通路,同時(shí)確定差異表達(dá)基因參與的主要生化代謝途徑和信號(hào)轉(zhuǎn)導(dǎo)途徑,具體結(jié)果見(jiàn)圖2。由圖2可知,鰓在脅迫12 h時(shí)顯著基因主
要富集
在丙氨酸、天冬氨酸和谷氨酸代謝,脂肪酸生物合成,氮代謝,牛磺酸和亞牛磺酸代謝,精氨酸和脯氨酸代謝等代謝通路(P<0.05);鰓在脅迫6 d時(shí)顯著基因主要富集于谷胱甘肽代謝、苯丙氨酸代謝、半胱氨酸和蛋氨酸代謝等代謝通路(P<0.05)。內(nèi)臟團(tuán)在脅迫12 h時(shí)顯著基因主要富集于氨酰-tRNA生物合成、氰基氨基酸代謝、牛磺酸和亞牛磺酸代謝以及丙氨酸、天冬氨酸和谷氨酸代謝等代謝通路(P<0.05);內(nèi)臟團(tuán)在脅迫6 d時(shí)顯著基因主要富集于氨酰-tRNA生物合成、內(nèi)質(zhì)網(wǎng)中的蛋白質(zhì)加工以及氨基糖和核苷酸糖代謝等代謝通路(P<0.05)。
2.4 汞脅迫下蛤仔GPx和GST基因的表達(dá)
以Tubulin作為內(nèi)參基因,以篩選好的引物為熒光定量引物,采用相對(duì)定量的方法檢測(cè)目的基因(GPx和GST基因)在菲律賓蛤仔鰓和內(nèi)臟團(tuán)中的表達(dá)情況。從圖3~6可以看出,在Hg脅迫菲律賓蛤仔試驗(yàn)中,內(nèi)臟團(tuán)中GPx基因在24 h時(shí)表達(dá)量最高(P<0.05),在6 d時(shí)表達(dá)量最低(P>0.05);鰓中GPx基因在8 d 時(shí)表達(dá)量最高(P<0.05),在24 h時(shí)表達(dá)量最低(P<0.05);內(nèi)臟團(tuán)中GST基因在12 h時(shí)表達(dá)量最高(P<0.05),在3 d時(shí)表達(dá)量最低(P<0.05);鰓中GST基因在5 d時(shí)表達(dá)量最高(P<0.05)。
2.5 qRT-PCR與表達(dá)譜分析結(jié)果的比較
以各組GPx和GST基因與對(duì)照組的相對(duì)表達(dá)量為研究指標(biāo),分析發(fā)現(xiàn)目的基因上下調(diào)一致率達(dá)到87.5%,僅有1組數(shù)據(jù)不一致(圖7)。
3 討論
3.1 貝類(lèi)GPx和GST基因的防御作用
該研究在篩選大量差異表達(dá)基因的基礎(chǔ)上,用Hg對(duì)菲律賓蛤仔進(jìn)行脅迫,通過(guò)熒光定量PCR方法進(jìn)一步研究基因表達(dá)情況。結(jié)果發(fā)現(xiàn),谷胱甘肽代謝通路中的大多數(shù)酶基因在汞脅迫后的菲律賓蛤仔體內(nèi)表現(xiàn)出顯著的表達(dá)變化。其中,谷胱甘肽過(guò)氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽-S-轉(zhuǎn)移酶(glutathione-S-transferase,GST)是谷胱甘肽代謝通路中的關(guān)鍵酶,在解毒系統(tǒng)和抗氧化系統(tǒng)中均起到非常重要的作
用[14-15],
因此研究這2個(gè)酶基因在重金屬脅迫菲律賓蛤仔中的表達(dá)情況意義重大。目前已有學(xué)者研究了文蛤(Meretrix meretrix)[16]、蝦夷扇貝(Mizuhopectenyessoensis)[17]、太平洋長(zhǎng)牡蠣(Crassostrea gigas)[18]、菲律賓蛤仔(Ruditapes philippinarum)[19]、三角帆蚌(Hyriopsis cumingi)[20]、厚殼貽貝(Mytilus coruscus)[21]等貝類(lèi)的GPx和GST基因表達(dá)情況。Wang等[22]研究Nrf2-Keap1信號(hào)通路對(duì)多環(huán)芳烴暴露下菲律賓蛤仔抗氧化防御系統(tǒng)及氧化損傷的影響,檢測(cè)了注射dsRNA-Nrf2后的菲律賓蛤仔中CAT、GPx和GST mRNA的表達(dá)情況,暴露前12 h CAT和GPx的mRNA表達(dá)量顯著高于暴露第0天(P<0.05);RpNrf2-dsRNA組4、5 d時(shí)檢測(cè)到GPx和GST-pi mRNA的表達(dá)量顯著升高(P<0.05);RpNrf2-dsRNA組GST-pi活性在4、5 d時(shí)顯著低于GFP-dsRNA和PBS組,抑制作用在3 d時(shí)達(dá)到峰值。Wang等[23]在櫛孔扇貝Nrf2-Keap1信號(hào)通路在BaP誘導(dǎo)的抗氧化防御反應(yīng)中的分子機(jī)制研究中發(fā)現(xiàn),注射Bap后第1天Cfkeap1-dsRNA組櫛孔扇貝消化腺和鰓中的GPx mRNA表達(dá)量與對(duì)照組相比沒(méi)有明顯差異(P>0.05),而2 d時(shí)GPx的mRNA表達(dá)量高于對(duì)照組,與該試驗(yàn)結(jié)果相符。Vidal-Lin等[24]研究發(fā)現(xiàn)紫貽貝暴露于最高濃度的PCB 7 d后GST活性受到顯著抑制,不同濃度的PCB對(duì)GPx活性都有顯著誘導(dǎo)作用。以上報(bào)道結(jié)果和該試驗(yàn)結(jié)果均表明在毒物刺激下雙殼貝類(lèi)中GPx和GST基因表達(dá)量均發(fā)生不同程度的變化,在免疫防御中起重要作用。
3.2 重金屬脅迫下GPx和GST基因表達(dá)分析
鰓是雙殼類(lèi)軟體動(dòng)物的濾食器官和呼吸器官[25],在Hg脅迫下抗氧化系統(tǒng)和解毒系統(tǒng)中關(guān)鍵酶基因GPx和GST基因分別表現(xiàn)出各自的表達(dá)譜。該研究結(jié)果表明Hg脅迫下菲律賓蛤仔鰓中GPx基因在5 d時(shí)達(dá)到第1個(gè)峰值(4.5倍左右,P<0.05),在8 d 時(shí)達(dá)到最高。蔣國(guó)萍[26]研究了Hg脅迫下斧文蛤體內(nèi)GPx、SOD以及CAT基因的表達(dá)情況,結(jié)果顯示GPx、SOD和CAT基因的表達(dá)量都呈先上升后下降的趨勢(shì),SOD、CAT以及GPx基因的表達(dá)量分別在3、1和2 d達(dá)到最大。以上結(jié)果表明,Hg脅迫下斧文蛤體內(nèi)抗氧化酶在清除和轉(zhuǎn)運(yùn)活性氧過(guò)程中起到至關(guān)重要的作用。暴露于Hg脅迫環(huán)境下的菲律賓蛤仔和斧文蛤GPx基因表達(dá)量均發(fā)生變化,推測(cè)在Hg脅迫下雙殼貝類(lèi)鰓組織中GPx基因的表達(dá)對(duì)雙殼貝類(lèi)起到一定的機(jī)體調(diào)節(jié)和保護(hù)作用。該研究結(jié)果表明Hg脅迫下菲律賓蛤仔鰓中GST基因的表達(dá)量在5 d達(dá)到最大(82倍左右,P<0.05)。Jiang等[27]研究了菲律賓蛤仔在汞(Hg2+,2和10 μg/L)、苯并[a]芘單一和聯(lián)合脅迫下GSTs基因表達(dá)量的變化,發(fā)現(xiàn)Hg2+和BaP處理顯著誘導(dǎo)了菲律賓蛤仔肝胰腺中的GSTs。
雙殼貝類(lèi)的內(nèi)臟團(tuán)是消化系統(tǒng)的重要組成部分,能夠富集重金屬,從而對(duì)生物體造成危害[28]。該研究結(jié)果表明在Hg脅迫下菲律賓蛤仔內(nèi)臟團(tuán)中GPx和GST基因分別在24和12 h時(shí)表達(dá)量最高,分別為4倍左右(P<0.05)和2.7倍左右(P<0.05)。隨著Hg暴露時(shí)間的延長(zhǎng),GPx和GST基因分別在6和3 d時(shí)表達(dá)量最低,分別為0.5左右(P>0.05)和0.2左右(P<0.05)。陳琳琳等[29]研究了汞、硒暴露對(duì)紫貽貝(Mytilus edulis)抗氧化酶系統(tǒng)的影響,結(jié)果表明汞暴露條件下GPx基因表達(dá)量隨著暴露時(shí)間的延長(zhǎng)呈先升高后降低的變化,2 d時(shí)表達(dá)量最大。該研究進(jìn)一步推測(cè)出Hg對(duì)菲律賓蛤仔內(nèi)臟團(tuán)中GST基因的抑制程度要高于GPx基因,汞入侵引起了菲律賓蛤仔的應(yīng)激反應(yīng),產(chǎn)生大量的GPx和GST來(lái)清除機(jī)體產(chǎn)生的活性氧自由基。
3.3 qRT-PCR與表達(dá)譜分析結(jié)果的比較 以各組GPx和GST基因與對(duì)照組的相對(duì)表達(dá)量為研究指標(biāo),分析發(fā)現(xiàn)目的基因上下調(diào)一致率達(dá)到87.5%,還有1組試驗(yàn)數(shù)據(jù)不一致。這可能與取樣批次、養(yǎng)殖環(huán)境和個(gè)體差異有關(guān)。綜合來(lái)看,熒光定量PCR試驗(yàn)結(jié)果與表達(dá)譜分析結(jié)果相似度高,可見(jiàn)表達(dá)譜分析結(jié)果準(zhǔn)確性高,可直接用于基因表達(dá)的分析中,與鱸魚(yú)[30]、斑馬魚(yú)[31]等表達(dá)譜分析結(jié)果基本一致,即表達(dá)譜分析試驗(yàn)結(jié)果準(zhǔn)確,可為后續(xù)基因表達(dá)分析提供理論依據(jù)和參考。
4 結(jié)論
綜上所述,汞暴露短期內(nèi)能夠誘導(dǎo)菲律賓蛤仔體內(nèi)抗氧化防御系統(tǒng)來(lái)清除氧自由基。隨著暴露時(shí)間的延長(zhǎng),表現(xiàn)出明顯的抑制作用。因此,重金屬汞慢性脅迫下菲律賓蛤仔體內(nèi)GPx和GST基因表達(dá)量分析揭示了重金屬汞在菲律賓蛤仔體內(nèi)的作用規(guī)律,為深入研究重金屬汞在菲律賓蛤仔體內(nèi)重金屬毒性作用提供理論基礎(chǔ)。
參考文獻(xiàn)
[1] YU B J,WANG X L,DONG K F,et al.Heavy metal concentrations in aquatic organisms(fishes,shrimp and crabs)and health risk assessment in China[J].Marine pollution bulletin,2020,159:1-13.
[2] 楊東方,王磊磊,高振會(huì),等.膠州灣水體重金屬HgⅡ.分布和污染源[J].海洋環(huán)境科學(xué),2009,28(5):501-505.
[3] 魏愛(ài)泓,矯新明,毛成責(zé),等.重金屬汞對(duì)海洋底棲動(dòng)物毛蚶和紫貽貝毒性效應(yīng)研究[J].生態(tài)毒理學(xué)報(bào),2018,13(6):352-359.
[4] WANG W X,MENG J,WENG N Y.Trace metals in oysters:Molecular and cellular mechanisms and ecotoxicological impacts[J].Environmental science:Processes & impacts,2018,20(6):892-912.
[5] MENG J,WANG W X,LI L,et al.Tissue-specific molecular and cellular toxicity of Pb in the oyster(Crassostrea gigas):mRNA expression and physiological studies[J].Aquatic toxicology,2018,198:257-268.
[6] CHAN C Y,WANG W X.A lipidomic approach to understand copper resilience in oyster Crassostrea hongkongensis[J].Aquatic toxicology,2018,204:160-170.
[7] FERREIRA C P,LIMA D,PAIVA R,et al.Metal bioaccumulation,oxidative stress and antioxidant responses in oysters Crassostrea gasar transplanted to an estuary in southern Brazil[J].Science of the total environment,2019,685:332-344.
[8] COMPANY R,SERAFIM A,BEBIANNO M J,et al.Effect of cadmium,copper and mercury on antioxidant enzyme activities and lipid peroxidation in the gills of the hydrothermal vent mussel Bathymodiolus azoricus[J].Marine environmental research,2004,58(2/3/4/5):377-381.
[9] LIVINGSTONE D R.Cytochrome P-450 and oxidative metabolism in invertebrates[J].Biochemical society transactions,1990,18(1):15-19.
[10] SHEEHAN D,MEADE G,F(xiàn)OLEY V M,et al.Structure,function and evolution of glutathione transferases:Implications for classification of non-mammalian members of an ancient enzyme superfamily[J].Biochemical journal,2001,360(1):1-16.
[11] VIDAL-LIN L,BELLAS J,CAMPILLO J A,et al.Integrated use of antioxidant enzymes in mussels,Mytilus galloprovincialis,for monitoring pollution in highly productive coastal areas of Galicia(NW Spain)[J].Chemosphere,2010,78(3):265-272.
[12] 孫珊,趙玉庭,王立明,等.山東省主要貝類(lèi)養(yǎng)殖區(qū)重金屬環(huán)境狀況及貝類(lèi)安全風(fēng)險(xiǎn)分析[J].漁業(yè)科學(xué)進(jìn)展,2017,38(4):118-125.
[13] ZHANG Q F,LI Y W,LIU Z H,et al.Exposure to mercuric chloride induces developmental damage,oxidative stress and immunotoxicity in zebrafish embryos-larvae[J].Aquatic toxicology,2016,181:76-85.
[14] ZHANG L B,LIU X L,CHEN L L,et al.Transcriptional regulation of selenium-dependent glutathione peroxidase from Venerupis philippinarum in response to pathogen and contaminants challenge[J].Fish & shellfish immunology,2011,31(6):831-837.
[15] SALAZAR-MEDINA A J,GARCA-RICO L,GARCA-OROZCO K D,et al.Inhibition by Cu2+ and Cd2+ of a mu-class glutathione S-transferase from shrimp Litopenaeus vannamei[J].Journal of biochemical and molecular toxicology,2010,24(4):218-222.
[16] 王超.文蛤(Meretrix meretrix)選擇群體生長(zhǎng)、抗性差異的初步解析[D].北京:中國(guó)科學(xué)院研究生院(海洋研究所),2011.
[17] 單忠國(guó).蝦夷扇貝MyGPx基因的啟動(dòng)子克隆及表達(dá)[D].大連:遼寧師范大學(xué),2011.
[18] GAO C,ZHANG X X,LI X M,et al.Toxic effects of heavy metal Cu2+ on the pacific oyster Crassostrea gigas[J].IOP conference series:Earth and environmental science,2017,64:1-11.
[19] JI C L,CAO L L,LI F.Toxicological evaluation of two pedigrees of clam Ruditapes philippinarum as bioindicators of heavy metal contaminants using metabolomics[J].Environmental toxicology and pharmacology,2015,39(2):545-554.
[20] LIU Y M,YANG M,ZHENG L,et al.Antioxidant responses of triangle sail mussel Hyriopsis cumingii exposed to toxic Microcystis aeruginosa and thermal stress[J].Science of the total environment,2020,743:1-9.
[21] QI P Z,TANG Z R.The Nrf2 molecule trigger antioxidant defense against acute benzo(a)pyrene exposure in the thick shell mussel Mytilus coruscus[J].Aquatic toxicology,2020,226:1-10.
[22] WANG H D,PAN L Q,SI L J,et al.Effects of Nrf2-Keap1 signaling pathway on antioxidant defense system and oxidative damage in the clams Ruditapes philippinarum exposure to PAHs[J].Environmental science and pollution research,2021,28:33060-33071.
[23] WANG H P,PAN L Q,XU R Y,et al.The molecular mechanism of Nrf2-Keap1 signaling pathway in the antioxidant defense response induced by BaP in the scallop Chlamys farreri[J].Fish & shellfish immunology,2019,92:489-499.
[24] VIDAL-LIN L,BELLAS J,SORIANO J A,et al.Bioaccumulation of PCB-153 and effects on molecular biomarkers acetylcholinesterase,glutathione-S-transferase and glutathione peroxidase in Mytilus galloprovincialis mussels[J].Environmental pollution,2016,214:885-891.
[25] 孫振興,張晾,郝麗紅,等.菲律賓蛤仔鰓組織的原代培養(yǎng)[J].水產(chǎn)科學(xué),2004,23(2):12-14.
[26] 蔣國(guó)萍.海洋酸化條件下重金屬Cd2+、Hg2+對(duì)斧文蛤生態(tài)毒理效應(yīng)研究[D].上海:上海海洋大學(xué),2016.
[27] JIANG W W,F(xiàn)ANG J G,GAO Y P,et al.Biomarkers responses in Manila clam,Ruditapes philippinarum after single and combined exposure to mercury and benzo [a] pyrene[J].Comparative biochemistry and physiology part C:Toxicology & pharmacology,2019,220:1-8.
[28] RUELAS-INZUNZA J,SOTO L A,PEZ-OSUNA F.Heavy-metal accumulation in the hydrothermal vent clam Vesicomya gigas from Guaymas basin,Gulf of California[J].Deep sea research part I:Oceanographic research papers,2003,50(6):757-761.
[29] 陳琳琳,張高生,陳靜,等.汞、硒暴露對(duì)紫貽貝(Mytilus edulis)抗氧化酶系統(tǒng)的影響[J].生態(tài)毒理學(xué)報(bào),2011,6(4):383-388.
[30] XIANG L X,HE D,DONG W R,et al.Deep sequencing-based transcriptome profiling analysis of bacteria-challenged Lateolabrax japonicus reveals insight into the immune-relevant genes in marine fish[J].BMC genomics,2010,11(1):1-21.
[31] WANG L K,F(xiàn)ENG Z X,WANG X,et al.DEGseq:An R package for identifying differentially expressed genes from RNA-seq data[J].Bioinformatics,2010,26(1):136-138.

