氟苯尼考/二甲基-β-環糊精包合物的制備及評價
程曉敬 陳怡健 李智斌 梁勁康 胡巧紅

摘要:目的 以2,6-二甲基-β-環糊精(DM-β-CD)為包合材料制備氟苯尼考(florfenicol,FF)包合物FF/DM-β-CD,以改善FF的溶解度和溶出速度,提高其生物利用度。 方法 在應用分子對接結合相溶解度法篩選合適的環糊精(CD)后,采用加熱攪拌法制備FF/DM-β-CD,并使用DSC、PXRD、FT-IR對包合物進行物相鑒別,對其溶解性、溶液穩定性和體外溶出進行考察,同時進行了FF/DM-β-CD在雞體內的藥動學研究。結果 FF與 HP-β-CD、DM-β-CD和SBE-β-CD對接后的模型較穩定,DM-β-CD改善FF溶解度的效果最好。選擇DM-β-CD作為包合材料,加熱攪拌法制備了FF/DM-β-CD,DSC、PXRD和FT-IR結果證實FF/DM-β-CD的形成。FF/DM-β-CD可顯著增加FF的溶解度,在標準硬水、自來水、去離子水和純化水中的溶解度均大于FF的55.0倍。FF/DM-β-CD溶液在25 ℃放置1 d后,自來水中無析出,標準硬水、純化水和去離子水中有微量析出;隨著時間增加,析出逐漸增多,7 d后,以自來水中析出最少;FF含量無明顯變化。FF/DM-β-CD在不同水質水中的溶出無明顯差異,25 ℃、5 min時均已完全溶出,為FF原料藥的17.09倍。與FF相比,FF/DM-β-CD能明顯提高FF在雞體內的生物利用度(Fr=165.24%)。結論 以DM-β-CD為包合材料制備FF/DM-β-CD,可顯著提高FF的溶解度、溶出度和生物利用度。
關鍵詞:氟苯尼考;DM-β-CD;包合物;溶解度;體外溶出;體內藥動學
中圖分類號:R978文獻標志碼:A
Preparation and evaluation of florfenicol/dimethyl-β-cyclodextrin
inclusion compound
Cheng Xiaojing1, Chen Yijian1, Li Zhibin2, Liang Jingkang3, and Hu Qiaohong1,4
( 1 School of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006; ?2 Guangzhou Health Science College, Guangzhou 510450; 3 Guangdong Wens Dahuanong Biotechnologianl Co. Ltd., Yunfu 527400; 4 Guangdong Provincial Key Laboratory of
Advanced Drug Delivery Systems and Guangdong Provincial Engineering Center of Topical Precise Drug Delivery
System, Guangdong Pharmaceutical University, Guangzhou 510006)
Abstract Objective To improve the solubility, dissolution rate and bioavailability of florfenicol (FF), a FF/dimethyl-β-cyclodextrin (DM-β-CD) inclusion complex (FF/DM-β-CD) was prepared and evaluated. Methods The binding free energies of FF with 6 cyclodextrins (CDs) were calculated by molecular docking, and then the phase solubility of FF in 4 cyclodextrin solutions was determined to screen for a proper CD. FF/DM-β-CD was prepared by stirring under the heating method and characterized by differential scanning calorimetry (DSC), powder X-ray diffractometry (PXRD), and Fourier transform infrared spectrometry (FT-IR). The solubility, solution stability, in vitro dissolution and in vivo pharmacokinetics of FF/DM-β-CD were investigated. Results The results of molecular docking and phase solubility determination showed that the docking model of FF with hydroxypropyl-β-cyclodextrin (HP-β-CD), DM-β-CD and sulfobutyl-β-cyclodextrin (SBE-β-CD) was stable, and DM-β-CD exhibited the best enhancing effect on the solubility of FF. Using DM-β-CD as inclusion material, FF/DM-β-CD was prepared successfully by stirring under the heating method. DSC, PXRD and FT-IR results confirmed the formation of FF/DM-β-CD. FF/DM-β-CD could significantly increase the solubility of FF in standard hard water, tap water, deionized water, and purified water, which were at least 55.0 times higher than that of FF. When stored at 25 ℃, the FF/DM-β-CD solution was still clear in tap water after 1 day, while a small amount of precipitate occurred in standard hard water, pure water and deionized water. The amount of precipitate gradually increased with time and was the least in tap water after 7 days. There were no significant differences between the in vitro dissolution of FF/DM-β-CD in standard hard water, tap water, deionized water and purified water. At 5 min, the cumulative dissolution percentage of FF/DM-β-CD reached 100% at 25 ℃, which was 17.09 times that of FF raw material. Compared with FF, the bioavailability of FF/DM-β-CD in chickens increased with Fr=165.24%. Conclusion FF/DM-β-CD prepared with DM-β-CD as inclusion material could significantly improve the solubility, dissolution and bioavailability of FF.
Key words Florfenicol; Dimethyl-β-cyclodextrin; Inclusion complex; Solubility; In vitro dissolution; In vivo pharmacokinetics
氟苯尼考(florfenicol,FF)是一種動物專用的酰胺醇類廣譜抗生素[1],對絕大多數的革蘭陰性菌和革蘭陽性菌均有很強的殺菌作用,如大腸埃希菌、金黃色葡萄球菌、多殺性巴氏桿菌、傷寒桿菌、鏈球菌等[2],廣泛用于臨床。然而,FF的水溶性較差,極大地限制了其臨床應用。FF屬于BCS II類藥物[3],溶出是其吸收的限速步驟,因此,在FF新制劑的開發中,應重點考慮如何提高其溶解度和溶出度。
目前,改善FF溶解度的方法主要有固體分散體、納米晶、超微粉、微晶、微乳和包合物等[4-5]。固體分散體在儲存過程中不穩定,可能會由于尺寸增大、重結晶等出現老化問題[6];納米晶通常會由于粒徑減小導致體系不穩定,出現Ostawald熟化現象[7];超微粉具有較大的表面積,易出現氧化和吸濕等現象[8];微晶在制備過程中可能會由于溶液中局部過飽和度不一致使產品粒度不均一,造成團聚[9]。微乳中表面活性劑占比較大,對胃腸道的刺激等副作用增加[10]。包合物可通過主、客分子間的疏水作用、靜電引力、范德華力和氫鍵的相互作用包載FF,增加FF的溶解度和穩定性,且制備工藝簡單,給藥方便[11]。
包合材料是決定包合物增溶效果的重要因素之一,目前包合材料的篩選通常仍采用傳統的實驗方法,不僅耗時且費用較高。隨著計算機技術的飛速發展,計算藥劑學在藥物制劑研發中展現出巨大的潛力。其中,分子對接是一種通過受體特征以及受體和藥物分子間的相互作用方式,研究分子間(如配體和受體)相互作用,并預測其結合模式和親合力的一種理論模擬方法,近年來已成為計算機輔助藥物研究領域的一項重要技術。將該技術應用于包合物,通過預測小分子配體與大分子受體的結合模式和包合物的微觀結構[12],以及最低結合能,篩選出合適的包合材料,可提高實驗的準確性和可靠性。
目前研究最多的FF包合物的包合材料為β-環糊精(β-cyclodextrin, β-CD)[13-15],此外,還有羥丙基-β-環糊精(hydroxypropyl-β-cyclodextrin, HP-β-CD)、γ-環糊精(γ-cyclodextrin, γ-CD)、羥丙基-γ-環糊精(hydroxypropyl-γ-cyclodextrin, HP-γ-CD)等[16]。盡管這些包合材料可在一定程度上增加FF溶解度,但其效果均不甚理想。因此,本文選擇6種CDs,通過分子對接預測,結合相溶解度測定,篩選出增溶效果最好的2,6-二甲基-β-環糊精(2,6-dimethyl-β-cyclodextrin, DM-β-CD)作為包合材料,制備FF/DM-β-CD,旨在提高FF的溶解度、溶出度和生物利用度,更好地滿足用藥要求。
1 材料與動物
1.1 儀器
FA2004B 電子天平(上海精科天美科學儀器有限公司);DF-101S 集熱式恒溫加熱磁力攪拌器(鞏義市予華儀器責任有限公司);RE-2000A旋轉蒸發器(上海亞榮生化儀器廠);SHA-B恒溫振蕩器(上海力辰邦西儀器科技有限公司);ZRS-8GD智能溶出儀(天津天大天發科技有限公司);Spectrum100傅里葉紅外光譜儀、DSC-4000差示掃描量熱儀(美國PerkinElmer儀器有限公司);X射線粉末衍射儀(日本理學Rigaku ULTIMA IV);DGJ-56T10NDP冷凍干燥機(北京賽歐華創科技有限公司);1200高效液相色譜儀(美國Agilent公司);3-30K高速冷凍離心機(德國Sigma公司)
1.2 藥品與試劑
FF原料藥(批號:200634)購自湖北龍翔藥業科技股份有限公司;FF對照品(批號:wkq22060603;含量≥98%)購自四川省維克奇生物科技有限公司;氯霉素(CAP)對照品(含量為99.8%,批號:201704)購自中國獸醫藥品監察所;DM-β-CD、α-環糊精(α-cyclodextrin, α-CD)、γ-環糊精(γ-CD)、羥丙基-β-環糊精(HP-β-CD)、磺丁基-β-環糊精(SBE-β-cyclodextrin, SBE-β-CD)購自山東濱州智源生物科技有限公司;β-CD購自安徽山河藥用輔料有限公司;色譜用甲醇、乙腈為色譜純;其他試劑均為分析純。
1.3 實驗動物
(12±1)月齡健康三黃雞12只,體重為(2.0±
0.3) kg,常規飼養,自由飲水和采食,飼料為不含抗菌藥物的全價日糧。給藥前12 h開始至給藥后4 h禁食,自由飲水。
2 方法
2.1 環糊精的篩選
(1) FF與CDs的分子對接 ?從PubChem數據庫下載FF、α-CD、β-CD和γ-CD的3D模型(CID編號為114811、444913、444041和5287407),用MarvinSketch軟件打開去水后的β-CD模型,用相應取代基將葡萄糖單元中對應位置進行取代,得到β-CD衍生物模型并進行幾何優化;采用AutoDockTools 1.5.7軟件處理受體(α-CD、β-CD、γ-CD、HP-β-CD、2,6-DM-β-CD、SBE-β-CD)與配體(FF),并保存為pdbqt格式[17]。在分子對接過程中,將合適尺寸的反應約束盒子中心置于受體幾何中心。能量差值設定為10,對接的細致程度設定為20,最多生成30000個模型,其他參數取默認值;對接方法采用半柔性對接。
(2) 相溶解度的測定 ?根據分子對接結果,選取最佳結合能較小的若干CDs,測定FF在不同CDs中的相溶解度。將過量 FF 加入到10 mL不同濃度的CDs溶液中,在30 ℃、200 r/min下恒溫震蕩72 h,4000 r/min離心5 min,取上清液過濾,濾液適當稀釋后用HPLC進行分析[18]。以FF的摩爾濃度對CD的摩爾濃度進行線性擬合,求出回歸方程,按下式計算包合常數K以及吉布斯自由能△G。
式中,S0表示FF在水中的溶解度,Slope表示相溶解度曲線的斜率,T表示溫度。
2.2 FF/DM-β-CD的制備
取處方量FF,用適量無水乙醇溶解。另取處方量DM-β-CD,置于50 mL燒杯中,加純化水10 mL,在50 ℃、650 r/min下,攪拌溶解,緩緩滴加上述 FF醇溶液,待反應液呈均相后,密閉繼續攪拌5 h,停止加熱,旋蒸除乙醇,過濾,濾液冷凍干燥即得包合物。
2.3 FF/DM-β-CD的物相鑒別
(1) DSC分析 ? 取FF、DM-β-CD、FF與DM-β-CD簡單物理混合物(FF-PM)、FF/DM-β-CD適量,進行DSC測定。測定條件:N2流速20 mL/min,溫度范圍30~250 ℃,升溫速率10 ℃/min。
(2) PXRD分析 ? 取FF、DM-β-CD、FF-PM、FF/DM-β-CD適量,進行PXRD分析。測定條件:Cu靶Ka射線,電壓40 kV,電流40 mA,發散狹縫1/32°,防散射狹縫1/16°,防散射狹縫7.5 mm,2θ角度范圍5°~90°,步長0.02°,每步停留時間40 s,掃描速度10°/min。
(3) FT-IR分析 ? 取FF、DM-β-CD、FF-PM、FF/DM-β-CD適量,進行FT-IR分析。采用KBr壓片。掃描范圍4000~400 cm?1,分辨率4 cm?1。
2.4 FF/DM-β-CD的溶解性考察
(1) FF的溶解度 ? 分別將過量FF加入10 mL標準硬水、純化水、自來水和去離子水中,在25 ℃、150 r/min條件下振蕩72 h后取出,于5000 r/min離心5 min,上清液用0.45 μm的微孔濾膜過濾,取濾液適當稀釋后,用HPLC進行分析[18],計算FF溶解度。
(2) FF/DM-β-CD的溶解性 ? 分別精密稱取包合物1.2 g(相當于FF 142.32 mg),置于2 mL容量瓶,加標準硬水、自來水、純化水和去離子水溶解并定容,適當稀釋后用HPLC測定FF濃度[18]。
2.5 FF/DM-β-CD溶液穩定性考察
精密稱取包合物1.25 g,分別用標準硬水、自來水、純化水和去離子水溶解并定容至5 mL,在25 ℃下放置,于0、1、2、3、4、5、6和7 d觀察其外觀性狀,并取樣適量稀釋后,用HPLC測定FF濃度[18]。
2.6 FF/DM-β-CD的體外溶出考察
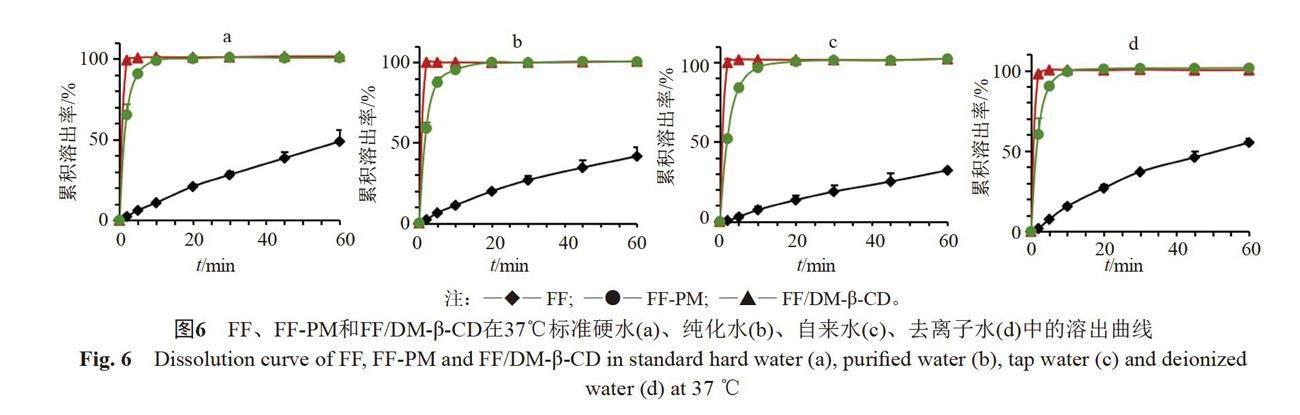
按《中國獸藥典》(2020年版Ⅰ卷)第160條規定的方法(槳法)測定,溫度分別為25 ℃和37 ℃,溶出介質為標準硬水、自來水、純化水和去離子水,溶出介質體積為900 mL,轉速為50 r/min。取FF、FF-PM或FF/DM-β-CD(均相當于200 mg的FF)進行測定,在預定的時間點取樣5 mL,同時補加等溫等體積的新鮮溶出介質。樣品過0.45 μm微孔濾膜,濾液用HPLC進行分析[18],計算FF的累積溶出率,并繪制溶出曲線。
2.7 FF/DM-β-CD的體內藥動學
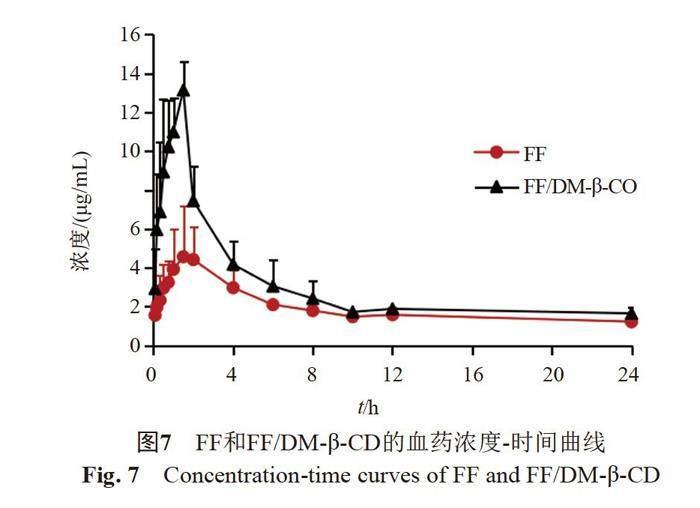
12只三黃雞隨機分為A、B兩組,A組灌服FF混懸液,B組灌服FF/DM-β-CD溶液,劑量為20 mg/kg;在給藥前及給藥后0.083、0.16、0.333、0.5、0.75、1、1.5、2、4、6、8、10、12和24 h,從翅靜脈采血2 mL,置于肝素鈉抗凝的離心管中,5000 r/min離心10 min,收集血漿,置-20 ℃冰箱保存。血漿樣品用HPLC進行分析[1]。
3 結果
3.1 環糊精的篩選
(1) FF與CDs的分子對接 對FF與不同CDs可能的結合模式進行篩選,每種CD從30000次構象搜索中選出能量最低的結合方式,此能量為最佳結合能(ΔG),FF與α-CD、β-CD、γ-CD、HP-β-CD、DM-β-CD和SBE-β-CD之間的ΔG分別為-4.3、-4.9、 -4.5、-5.7、-5.1和-5.1,說明反應均可自發進行,ΔG的絕對值為HP-β-CD>DM-β-CD=SBE-β-CD>β-CD>γ-CD>α-CD,說明FF與HP-β-CD、DM-β-CD和SBE-β-CD形成的構象相對較穩定。
(2) 相溶解度 根據對接結果,選擇HP-β-CD、DM-β-CD、SBE-β-CD和常用的β-CD,測定FF在4種CDs中的相溶解度,結果見圖1。FF的溶解度隨著CDs濃度的增大而增大。FF在HP-β-CD中的相溶解度曲線呈AL型,隨HP-β-CD濃度增加,FF溶解度呈線性增加;FF在β-CD、SBE-β-CD中的相溶解度曲線呈AN型,隨β-CD (或SBE-β-CD)濃度增加,FF溶解度增加的速率變慢;FF在DM-β-CD中的相溶解度曲線呈AP型,隨DM-β-CD濃度增加,FF溶解度增加的速率變快。
根據公式計算求得包合物的K值以及相應的ΔG,結果見表1。K值大小順序為DM-β-CD>β-CD>SBE-β-CD>HP-β-CD,說明FF與DM-β-CD形成包合物的過程最穩定;ΔG均小于0,表明包合過程自發進行,且ΔG的絕對值為DM-β-CD>β-CD>SBE-β-CD>HP-β-CD,表明DM-β-CD反應自發進行的程度最高。因此,選擇DM-β-CD為包合材料制備FF/DM-β-CD。
3.2 FF/DM-β-CD的制備
因FF水溶性較差,制備包合物時將FF先溶于無水乙醇中,再滴加到DM-β-CD水溶液中,整個過程中,體系均為澄清溶液,無藥物析出,旋蒸去除乙醇后,仍為澄清溶液,冷凍干燥后得到白色粉末狀的包合物。
3.3 FF/DM-β-CD的物相鑒別
(1) DSC分析 DSC結果見圖2,FF在159 ℃處有熔融吸熱峰,而DM-β-CD無明顯的吸熱峰。FF-PM中的FF熔點峰在146 ℃左右,較FF有所降低,且強度減弱。這可能是由于升溫過程中,當溫度較高時FF與DM-β-CD間發生了相互作用,有部分已經形成包合物,使熔點降低;且物理混合物樣品中含有的FF量較FF原料藥樣品少,使峰強度減弱。而FF/DM-β-CD中,FF的吸熱峰消失,表明FF已經嵌入DM-β-CD空穴中,沒有藥物結晶,證明包合物確已形成。
(2) PXRD分析 PXRD結果見圖3,FF在8.22°、16.22°、21.16°、23.64°、24.44°、26.88°、31.92°、41.42°和43.52°處有較強的衍射峰,表明FF具有特定晶型結構。DM-β-CD沒有明顯的衍射峰。FF-PM出現與FF同樣的衍射峰,但峰強度較FF原料藥小,可能是由于物理混合物樣品中含有FF的量較FF原料藥樣品少,使衍射峰強度減弱。FF/DM-β-CD中FF的特征吸收峰完全消失,表明形成了包合物。
(3) FT-IR分析 FT-IR結果見圖4,FF在3448 cm-1處有-OH伸縮振動吸收峰,在1681 cm-1處有-C=O伸縮振動吸收峰,在1535 cm-1處有-NH的彎曲振動和-CN的伸縮振動吸收峰,在1270 cm-1處有-CN的彎曲振動和-NH的伸縮振動吸收峰。DM-β-CD在3401 cm-1有-OH伸縮振動吸收峰,1644 cm-1處有C-O-C伸縮振動吸收峰。FF-PM紅外圖譜中,由于DM-β-CD的存在使FF的-OH伸縮振動吸收峰偏移至3437 cm-1,其他峰位置不變,表明FF與DM-β-CD未發生相互作用。FF/DM-β-CD在3402 cm-1有-OH伸縮振動吸收峰,與DM-β-CD一致,而FF的特征峰消失或發生偏移,說明FF與DM-β-CD之間發生了氫鍵的作用,形成了包合物,與文獻[19]基本一致。
3.4 FF/DM-β-CD的溶解性
溶解性考察結果見表2。25 ℃時,FF在標準硬水、自來水、純化水和去離子水中的溶解度沒有明顯差異;FF/DM-β-CD在4種水質水中的溶解度分別是FF的55.74、57.68、55.0和55.57倍以上,對FF的增溶效果遠大于文獻報道[14-15]。
3.5 FF/DM-β-CD溶液穩定性
FF/DM-β-CD溶液穩定性結果見表3。25 ℃下放置7 d,24 h后,在自來水中無析出,在去離子水、純化水和標準硬水中有微量析出,隨著放置時間延長,析出增加,尤以去離子水中析出明顯,其后依次為純化水、標準硬水、自來水,表明在自來水中的物理穩定性最佳;此外,放置過程中FF含量也沒有明顯下降,表明FF/DM-β-CD溶液的化學穩定性較好。
3.6 FF/DM-β-CD的體外溶出
體外溶出結果見圖5~6。在不同水質水中,FF、FF-PM和FF/DM-β-CD在37 ℃的溶出速率均比25 ℃快,升高溫度有助于藥物的溶出。FF/DM-β-CD在不同水質水中的溶出無明顯差異。在25 ℃、2 min時,FF/DM-β-CD在標準硬水、純化水、自來水和去離子水中的累積溶出率分別為98.60%、99.36%、97.70%和98.67%;FF-PM的累積溶出率分別為54.98%、46.12%、37.28%和59.84%,明顯低于FF/DM-β-CD;而FF的累積溶出率分別為1.63%、1.43%、0.61%和1.38%,遠低于FF/DM-β-CD和FF-PM。這是因為與FF原料藥(粒徑約為15.60 μm)相比,FF/DM-β-CD不僅顯著增加了FF的溶解度,而且使FF以分子狀態分散,比表面積顯著增加,根據Noyes-Whitney方程,溶解度越大,藥物粒徑越小,比表面積越大,溶出速率越快。包合物在5 min均可完全溶出,是FF的17.09倍以上,表明FF/DM-β-CD可顯著加快FF的溶出。
3.7 FF/DM-β-CD的體內藥動學
FF和FF/DM-β-CD的平均血藥濃度-時間曲線見圖7,藥動學參數見表4。FF/DM-β-CD的Cmax和AUC(0-t)均顯著大于FF(P<0.01),AUC(0-∞) 明顯大于FF(P<0.05),Tmax、MRT(0-t)、MRT(0-∞)、t1/2z、CLz/F、Vz/F、Zeta與FF無顯著性差異(P>0.05)。表明制成FF/DM-β-CD可明顯提高FF的生物利用度(Fr=165.24%)。
4 討論
藥物與CD的相溶解度圖可分為A型和B型,其中A型表示生成可溶性包合物,可進一步分為AL、AN和AP型,FF與DM-β-CD的相溶解度曲線呈AP型,隨DM-β-CD濃度增加,對FF的增溶效果越好。FF與SBE-β-CD和β-CD的相溶解度曲線呈AN型,可能是由于FF與SBE-β-CD和β-CD之間的作用力不及FF與DM-β-CD之間的作用力或者是高濃度的CD分子間存在著聚合作用[20]。K值是衡量包合物穩定性的重要參數,K值越大,對藥物穩定作用越強[21]。ΔG是判斷反應是否可以自發進行以及自發進行難易程度的重要指標,通常ΔG為負值反應自發進行,且值越小,反應自發進行的程度越高。本實驗中,分子模擬預測的結果與相溶解度結果略有差異,可能是由于分子對接采用的是半柔性對接,CDs為剛性結構,對接過程中受到限制,而實際過程中FF和CDs之間可能發生更為復雜的相互作用。因此,本文在分子對接基礎上通過相溶解度測定后,選用增溶效果最好的DM-β-CD作為包合材料。
FF/DM-β-CD制備中,應用單因素試驗考察了藥載比、水浴溫度、攪拌時間、攪拌速度對包封率和載藥量的影響,結果發現,藥載比影響較大,藥載比1:2時包封率最高,溫度、攪拌時間和攪拌速度的影響均無明顯差異,因此確定包合物制備處方工藝為藥載比1:2、水浴溫度50 ℃、攪拌時間5 h、攪拌速度650 r/min。
鑒于FF在臨床上常采用飲水給藥,本文考察了FF/DM-β-CD在不同水質水中的溶解性。實驗過程中曾嘗試用平衡溶解度測定法測定FF/DM-β-CD溶解度,發現1.2 g FF/DM-β-CD均可以溶于2 mL不同水質水中,且溶液黏度合適;當用量增加到2 g時,溶液黏度過大,無法順利取樣測定,因此,僅考察了溶解性。結果表明,FF/DM-β-CD能明顯增加FF的溶解度。臨床上,飲水給藥時,首先配成濃溶液,稀釋后作為飲水給予動物,在此過程中,必須確保藥物始終完全溶解且不發生降解,因此本文考察了FF/DM-β-CD溶液的穩定性。結果表明,25 ℃放置1 d,FF/DM-β-CD在自來水中物理穩定性最好;連續放置7 d,去離子水、純化水中析出相對較多,可能是因為在缺少離子的條件下,FF更易從包合物中脫離,而標準硬水、自來水中析出較少,其中自來水中析出最少,原因可能是DM-β-CD與水中金屬離子發生絡合作用,使體系更穩定,FF不易從包合物中脫離;FF濃度未發生明顯下降,說明溶液的化學穩定性較好,為FF/DM-β-CD的臨床應用奠定了基礎。
溶出度測定不僅可以反映藥物的溶出特性,還可作為包合物鑒別的輔助方法。FF因水溶性較差,導致其溶出緩慢[22]。FF/DM-β-CD的溶出速率明顯高于FF,也證明成功制得FF/DM-β-CD。FF-PM的溶出速率較FF有明顯提高,這是因為一方面DM-β-CD的存在增加了FF的分散程度和可潤濕性,另一方面,在攪拌條件下,可能有部分FF與DM-β-CD發生相互作用形成包合物。
Cmax和AUC(0-∞)是評價藥物吸收程度的重要藥動學參數,也是評價藥品質量的重要指標之一。FF/DM-β-CD組的Cmax和AUC(0-∞)顯著高于FF組,表明包合物可明顯增加FF溶解度和溶出速率,從而增加藥物吸收。Tmax可反映藥物吸收速度,FF/DM-β-CD的Tmax與FF無顯著差異,這可能是因為包合物和DM-β-CD僅影響FF的溶解度和溶出速率,不能影響藥物的透膜轉運,從而不能加快藥物的吸收。
5 結論
本文通過分子對接結合相溶解度法篩選出DM-β-CD作為包合材料后,應用加熱攪拌法制備FF/DM-β-CD,并通過DSC、PXRD和FT-IR證明成功制備了FF/DM-β-CD。DM-β-CD為包合材料制備的包合物,可提高FF的溶解度、溶出速率和生物利用度,為后續FF新制劑的開發提供必要的實驗依據。
參 考 文 獻
張雨晴, 劉連超, 高建亭, 等. 氟苯尼考固體分散體的制備、優化及體內外釋藥評價[J]. 中國獸醫雜志, 2023, 59(8): 41-47.
李亮. 畜牧生產中常用的抗生素種類及科學使用[J]. 畜禽業, 2022, 33(9): 24-26.
Li B, Hu Y, Guo Y, et al. Coamorphous system of florfenicol-oxymatrine for improving the solubility and dissolution rate of florfenicol: preparation, characterization and molecular dynamics simulation[J]. J Pharm Sci, 2021, 110(6): 2544-2554.
劉連超, 李雪嬌, 李金輝, 等. 氟苯尼考固體形態增溶技術研究進展[J]. 動物醫學進展, 2021, 42(4): 104-108.
張炳順, 方秋華, 魏海濤, 等. 氟苯尼考增溶技術的研究進展[J]. 北方牧業, 2023(17): 19.
胡洋, 楊奕, 林霞, 等. 固體分散體制備工藝對其物理穩定性的影響[J]. 沈陽藥科大學學報, 2022, 39(1): 98-104.
Tuomela A, Hirvonen J, Peltonen L. Stabilizing agents for drug nanocrystals: Effection bioavailability[J]. Pharmaceutics, 2016, 8(2): 16.
Gao W, Chen F, Wang X, et al. Recent advances in processing food powders by using superfine grinding techniques: A review[J]. Compr Rev Food Sci Food Saf, 2020, 19(4): 2222-2255.
李玉秀, 張子怡, 李丙東, 等. 藥物增溶技術研究進展[J]. 山東化工, 2021, 50(10): 70-71.
Callender S P, Mathews J A, Kobernyk K, et al. Microemulsion utility in pharmaceuticals: Implications for multi-drug delivery[J]. Int J Pharm, 2017, 526(1-2): 425-442.
黃健榕, 楊鳳, 仲雨葉, 等. 環糊精包合物的研究進展[J]. 廣東化工, 2015, 42(19): 87-88.
Liu J, Zhang S, Zhao X, et al. Molecular simulation and experimental study on the inclusion of rutin with β-cyclodextrin and its derivative[J]. J Mol Struct, 2022, 1254: 132359.
馬可, 張勇軍, 鄧樺, 等. 氟苯尼考-β-環糊精包合物的制備與結構表征[J]. 中國抗生素雜志, 2018, 43(2): 223-227.
羅娟, 陳彪, 鄭珊, 等. 氟苯尼考β-環糊精包合物的制備[J]. 中獸醫醫藥雜志, 2015, 34(1): 58-62.
馬素英, 尚校軍, 閆福林. 氟苯尼考β-環糊精包合物的制備與表征研究[J]. 湖北農業科學, 2011, 50(4): 802-806.
Ma S, Shi Y, Wang J, et al. Preparation and characterization of florfenicol inclusion complexes with three cyclodextrins[J]. World J Pharm Res, 2014, 3(9): 38-48.
姚培培, 樊金玲, 李德鋒, 等. 光甘草定/環糊精固體包合物的制備和性質[J]. 食品科學, 2022, 43(16): 9-18.
萬進, 牛志強, 徐瑞華, 等. 兩種氟苯尼考制劑產品比較藥動學研究[J]. 中國動物保健, 2017, 19(5): 82-85.
楊寶亭, 王庚南, 黃康東, 等. 氟苯尼考-羥丙基-β-環糊精包合物的研制[J]. 中國畜牧獸醫, 2017, 44(6): 1854-1860.
艾鳳偉, 張加偉, 錢楠, 等. 蘆丁-二甲基-β-環糊精包合物的制備、物理化學表征及體外溶出研究[J]. 藥學研究, 2015, 34(11): 650-653.
Ding X, Zheng M, Lu J, et al. Preparation and evaluation of binary and ternary inclusion complexes of fenofibrate/hydroxypropyl-β-cyclodextrin[J]. J Incl Phenom Macrocycl Chem, 2018, 91: 17-24.
Bharathi Balakrishnan S, Veerakanellore G B, Stalin T. In-vitro dissolution rate and molecular docking studies of cabergoline drug with β-cyclodextrin[J]. J Mol Struct, 2018, 1160: 1-8.

