席夫堿改性MCM-41分子篩的制備及其對鉛離子的吸附性能




關鍵詞MCM-41分子篩;席夫堿;改性;吸附;鉛離子
鉛是地球上最豐富的重金屬元素之一, 廣泛存在于空氣、土壤和水等環境體系中。然而, 鉛離子(Pb2+)具有很強的毒性,能夠通過食物或呼吸進入人體,并在人體內富集,導致人發生多種疾病,如貧血、基因毒性和癌癥等[1-2]。特別是隨著工業的迅速發展,大量含鉛工業污染物被排放到水中,造成水體污染。因此,迫切需要建立一種高效和經濟的方法去除水中的Pb2+。
近年來,研究者提出多種消除重金屬離子對環境危害的方法,如吸附法[3]]、氧化還原法[4]、電化學法[5]、生物絮凝法[6]和生物修復法[7]等。在這些方法中,吸附法因具有成本低、環境友好和操作簡單等優點而被認為是最具應用前景的水處理技術。吸附材料的選擇會直接影響重金屬離子的吸附效果。常見的吸附材料有活性炭[8]、海藻酸鈉[9]、氧化石墨烯[10]、樹脂[11]和分子篩[12]等。然而,上述吸附材料未經處理時,對重金屬離子的吸附能力遠不能滿足實際需求,通常需要采用一些化學方法將有機官能團接枝到其表面,使其能夠與溶液中的重金屬離子發生配位螯合作用,實現對重金屬離子的有效去除。因此,尋找合適的有機官能團是提高吸附材料對重金屬離子吸附性能的關鍵。
席夫堿是一種結構中含有亞胺或者甲亞胺特性基團(—RC=N—)的有機化合物,可作為電子給予體,與重金屬離子形成穩定的配合物。利用席夫堿官能團與重金屬離子的配位螯合能力,可將其接枝到吸附材料表面,有助于提高其吸附性能,這為制備重金屬離子吸附劑提供了一條行之有效的技術路線[13]。Zhang 等[14]利用席夫堿反應將水楊醛接枝到SBA-15 介孔分子篩表面,制備了功能化二氧化硅材料,能夠有效吸附廢水中的Pb2+。Liang 等[15]以4-甲基噻唑為席夫堿配體修飾SBA-15 介孔分子篩,獲得了對Pb2+吸附性能優異的吸附劑。但是, SBA-15 介孔分子篩的制備成本較高,制約了其在水處理中的實際應用。MCM-41 分子篩作為一種價格低廉的介孔硅材料,因其具有較大的孔徑、比表面積和良好的化學穩定性和熱穩定性等特性而被廣泛應用于吸附分離等領域[16]。然而,利用席夫堿改性MCM-41 介孔分子篩去除Pb2+的研究鮮有報道。
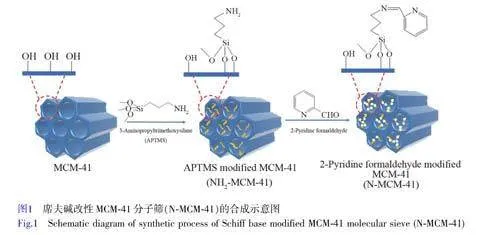
本研究利用席夫堿反應將2-吡啶甲醛接枝到MCM-41 介孔分子篩上,制備了一種新型席夫堿改性MCM-41 分子篩(N-MCM-41),利用其表面席夫堿結構中—RC=N—和吡啶中的氮原子協同配位作用,實現了對Pb2+的有效吸附。采用多種表征手段系統研究了N-MCM-41 的形貌結構、元素分布和表面官能團,并詳細分析了N-MCM-41 對水溶液中Pb2+的吸附行為。
1 實驗部分
1.1 儀器與試劑
DF-101S 集熱式磁力攪拌器(鞏義市予華儀器有限責任公司);BSA124S 電子天平(賽多利斯科學儀器(北京)有限公司);101-00B 電熱鼓風干燥箱(浙江紹興市蘇珀儀器有限公司);SHZ-D(Ⅲ)循環水真空泵(上海力辰邦西儀器科技有限公司);SRJX-3-12 馬弗爐(沈陽通用電爐制造有限公司)。
正硅酸乙酯(TEOS)、十六烷基三甲基溴化銨(CTAB)、NaOH、無水乙醇、HCl 和Pb(NO3)2(分析純,天津市科密歐化學試劑有限公司);2-吡啶甲醛(分析純,河北百靈威超精細材料有限公司);3-氨丙基三甲氧基硅烷(APTMS)和冰醋酸(分析純,國藥集團化學試劑有限公司)。
1.2 實驗方法
1.2.1 2-吡啶甲醛改性MCM-41吸附劑的制備
2-吡啶甲醛改性MCM-41 吸附劑的制備路線見圖1。稱取2.4 g CTAB 加入到120 mL 超純水中,攪拌至溶液澄清后,再加入10.25 mL 氨水(25%, m/V),攪拌10 min;然后,將10 mL TEOS 滴加到上述混合溶液中,攪拌過夜。將得到的白色溶液裝入到不銹鋼合成釜中,于110 ℃烘箱中晶化24 h。將得到的樣品在馬弗爐中500 ℃下煅燒6 h,最終得到MCM-41 介孔分子篩。將2.5 g MCM-41 分子篩分散到盛有150 mL 無水乙醇的燒瓶中,攪拌10 min;再移取2.5 mL APTMS 溶液加入到上述燒瓶中,在N2 氛圍下回流反應24 h。反應結束后,冷卻至室溫,經無水乙醇反復洗滌、抽濾、干燥,得到氨基改性MCM-41 分子篩,記為NH2-MCM-41。稱取1.0 g NH2-MCM-41,分散到60 mL 無水乙醇中,并加入1.0 mL 2-吡啶甲醛,攪拌混合均勻后,滴加3~4 滴冰醋酸;在N2 氛圍下回流反應24 h。反應結束后,用無水乙醇對產物進行反復洗滌、抽濾和干燥,得到2-吡啶甲醛改性MCM-41 分子篩,記為N-MCM-41。
1.2.2 樣品表征
利用Hitachi S-4800 型掃描電子顯微鏡(FESEM, Hitachi 公司)分析樣品的表面形貌;利用JEM 2010型透射電子顯微鏡(TEM, JEOL 公司)觀察樣品的微觀結構;采用VERTEX 70 型紅外光譜儀(FT-IR,Bruker 公司)測定樣品表面的官能團;采用STA449C 型熱重分析儀(TGA, Netzsch 公司)測定樣品的穩定性;利用ESCALAB-250Xi 型X 射線光電子能譜儀(XPS, Thermo Scientific 公司)分析樣品的表面元素的結合能;采用D/Max2400 型X 射線衍射儀(XRD, Rigaku 公司)分析樣品的晶體結構;利用ASAP2460型氣體吸附儀(BET, Micromeritic 公司)測定樣品的比表面積。
1.2.3 吸附實驗
移取50 mL 一定濃度的Pb(NO3)2 溶液至100 mL 錐形瓶中,加入15 mg N-MCM-41 吸附劑,恒溫水浴攪拌吸附一定時間后,離心,取上層清液,采用240DUO 原子吸收光譜儀(美國Agilent 公司)測定上層清液中的Pb2+濃度。按照公式(1)計算吸附容量。
其中, q(mg/g)為Pb2+的吸附容量, V(mL)為Pb2+溶液的體積, C0(mg/L)為吸附前Pb2+ 質量濃度, C(mg/L)為吸附后Pb2+質量濃度, m(g)為吸附劑質量。
2 結果與討論
2.1 吸附劑的表征
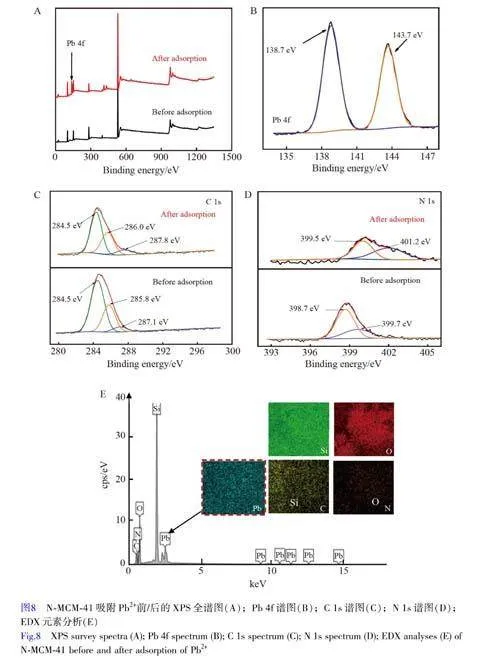
圖2A 和2C 分別為MCM-41 分子篩和N-MCM-41 的SEM 圖。由圖2A 可見,所合成的MCM-41 分子篩呈球狀和棒狀堆積形貌,這是典型的MCM-41 分子篩的特征形貌[17]。經2-吡啶甲醛修飾后, N-MCM-41的形貌無明顯變化(圖2C)。由TEM 圖(圖2B 和2D)可知, N-MCM-41 分子篩仍然保持著典型MCM-41的二維六方孔道結構[18],并且孔道結構規則有序。通過EDX 元素分析(圖2E)可知, N-MCM-41 表面不僅含有C、O 和Si 元素,而且存在N 元素,初步印證了2-吡啶甲醛被引入到N-MCM-41 上。
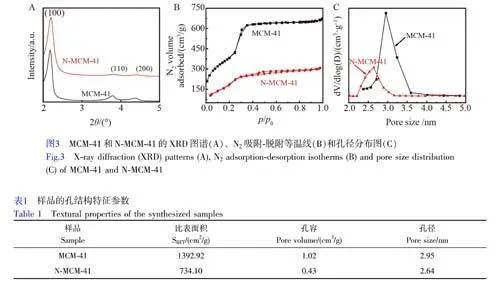
采用XRD 分析了改性前后MCM-41 分子篩的晶體結構。由圖3A 可知, N-MCM-41 分別在2θ為2.20°、3.79°和4.39°處出現了明顯的衍射峰,對應于(100)、(110)和(200)晶面,說明樣品孔道的有序度較高,這與MCM-41 分子篩典型的二維六方結構(p6mm)一致[19]。上述形貌和結構分析說明通過席夫堿反應在MCM-41 上引入2-吡啶甲醛的過程未影響MCM-41 分子篩固有的形貌和介孔結構。
圖3B和3C分別為樣品的N2 吸附-脫附等溫線圖和孔徑分布圖。由圖3B可見, MCM-41和N-MCM-41均表現出介孔材料特有的IV 型等溫線和H1 型滯后環[20],這與XRD 分析結果一致。采用BJH 模型模擬計算獲得MCM-41 分子篩的比表面積、孔容和平均孔徑分別為1392.92 cm2/g、1.02 cm3/g 和2.95 nm。與MCM-41 相比較, N-MCM-41 的N2 吸附量明顯減少,并且N-MCM-41 的比表面積、孔容和平均孔徑均降低,分別為734.10 cm2/g、0.43 cm3/g 和2.64 nm(表1)。上述結果主要歸因于2-吡啶甲醛被接枝到N-MCM-41 孔內,占據了其孔道,影響了N2 的吸附-脫附過程。
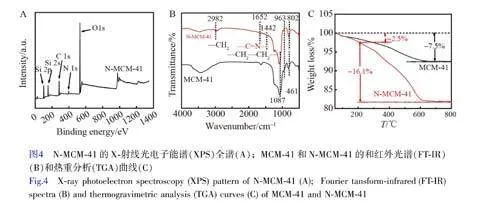
由N-MCM-41 的XPS全譜(圖4A)可見,在結合能為153.5、102.0、284.5、533.0和399.5 eV處分別出現了Si 2s、Si 2p、C 1s、O 1s 和N 1s 的特征峰,說明N-MCM-41 材料表面含有N 元素,這與EDX 分析結果(圖2E)一致。由MCM-41 和N-MCM-41 的FT-IR 譜圖(圖4A)可見, N-MCM-41 和MCM-41 存在一部分相同的特征峰,其中, 802 和1087 cm–1 處的特征峰分別對應Si—O—Si 的對稱[21]和不對稱伸縮振動峰[22],461 cm–1 處的特征峰對應O—Si—O 的彎曲振動峰[23], 963 cm–1 處的特征峰對應Si—OH 的伸縮振動峰。經2-吡啶甲醛改性后, N-MCM-41 出現了新的特征峰,在1442、2982 和1652 cm–1 處的特征峰分別歸屬于—CH2—CH2—的剪式振動吸收峰、—CH2 的不對稱伸縮振動峰[24]和—C=N—的特征振動峰[25]。
由MCM-41 和N-MCM-41 的TGA 曲線(圖4C)可知,在50~800 ℃范圍內, MCM-41 分子篩的失重為7.5%,這是由于MCM-41 表面和孔道內的水分脫附和分子篩表面硅羥基縮合成Si—O—Si 所導致[26]。與MCM-41 相比, N-MCM-41 損失的重量明顯增加,為18.6%。其中,在50~200 ℃范圍內,重量損失2.5%,這歸因于樣品表面和孔道內水分子的蒸發;在200~800 ℃范圍內,樣品重量損失16.1%,這主要是由于N-MCM-41 表面接枝的有機官能團隨著溫度升高而發生熱分解。上述XPS、FT-IR 和TGA 結果說明2-吡啶甲醛通過席夫堿反應成功接枝到MCM-41 分子篩上。
2.2 N-MCM-41的吸附性能
2.2.1 吸附等溫線
為了研究N-MCM-41 與Pb2+之間的相互作用,采用Langmuir(公式(2))和Freundlich(公式(3))等溫模型分析所得到的吸附數據。
其中, Ce(mg/L)為平衡時溶液濃度, qe(mg/g)為平衡時Pb2+吸附容量, qm(mg/g)為最大Pb2+吸附容量,KL(L/mg)是Langmuir 模型的吸附平衡常數, KF(L/g)是Freundlich 模型的吸附平衡常數, n 為與吸附強度有關的常數。
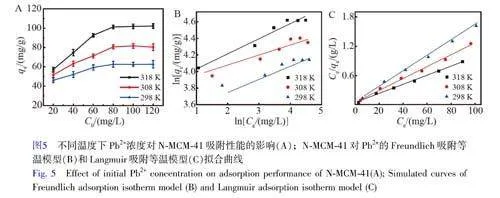
不同溫度下Pb2+初始濃度對N-MCM-41 吸附性能的影響見圖5A。其中, N-MCM-41 吸附劑加入量為15 mg, 溶液pH 值為5.5, 溶液體積為50 mL, 吸附時間為240 min。由圖5A 可知, N-MCM-41 對Pb2+的吸附容量隨著溫度和Pb2+溶液濃度的升高而增大,說明升高溫度有利于吸附Pb2+。當Pb2+溶液濃度增至80 mg/L 時,吸附達到平衡。
圖5B 和5C 分別為N-MCM-41 在不同溫度下的Freundlich 吸附等溫模型和Langmuir 吸附等溫模型擬合曲線,其相關擬合參數見表2。對比分析可知,在溫度為293、303 和318 K 時,采用Langmuir 吸附等溫模型擬合曲線的相關系數(R2)分別為0.998、0.992 和0.995,明顯高于相同溫度下Freundlich 模型擬合曲線的相關系數(R2=0.936、0.922、0.947)。而且, Langmuir 吸附等溫模型擬合得到的理論吸附容量qm與實驗值相近。上述結果表明, N-MCM-41 對Pb2+的吸附符合Langmuir 吸附等溫模型,吸附過程以單分子層為主[27]。本研究中KL 值均小于1,說明N-MCM-41 對Pb2+的吸附過程屬于易吸附過程[28]。
2.2.2 吸附動力學
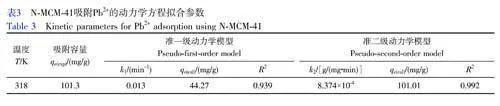
圖6A 為N-MCM-41 對Pb2+的吸附容量隨時間的變化曲線,其中, N-MCM-41 的用量為15 mg, Pb2+濃度為80 mg/L, 吸附溫度為318 K, 溶液pH 為5.5。由圖6A 可見,在10~240 min 內,隨著吸附時間延長,N-MCM-41 對Pb2+的吸附容量逐漸增大,這是由于在反應初期, N-MCM-41 表面吸附位點數量多,溶液中Pb2+濃度高,具有較高的吸附驅動力,此時N-MCM-41 表面活性位點能與Pb2+進行快速配位。當吸附時間達到180 min 時,吸附容量基本不再增加,此時吸附容量達到101.3 mg/g。這是因為隨著吸附時間延長,溶液中Pb2+濃度降低,吸附驅動力減小,并且N-MCM-41 表面大量活性位點被Pb2+占據,吸附達到平衡狀態。為了進一步研究N-MCM-41 對Pb2+的吸附行為和速率控制步驟,采用準一級動力學模型(式(4))和準二級動力學模型(式(5))對實驗數據進行分析。
式中, qt(mg/g)和qe(mg/g)分別為t(min)時和平衡態時的吸附量, k1(min–1)為準一級模型的平衡速率常數, k2(g/(mg·min))為準二級模型的平衡速率常數。
圖6B 和6C 分別為準一級動力學模型和準二級動力學模型,相關擬合結果見表3。通過對比分析可知,準二級動力學模型擬合曲線的相關系數(R2=0.992)遠高于準一級動力學模型擬合曲線的相關系數(R2=0.939),并且準二級動力學模型得到的理論吸附容量(101.01 mg/g)與實驗值(101.3 mg/g)更接近。因此, N-MCM-41 吸附Pb2+的過程符合準二級動力學模型,主要為化學吸附[29],說明N-MCM-41 表面官能團與水溶液中Pb2+的相互作用是實現有效吸附的關鍵。
2.2.3 吸附熱力學
通過計算吸附過程的吉布斯自由能變化(ΔG, kJ/mol)、焓變化(ΔH, kJ/mol)和熵變化(ΔS,J/(mol·K)),研究了在溶液pH = 5.5、N-MCM-41 用量為15 mg、吸附時間為180 min、Pb2+濃度為80 mg/L 的條件下,不同溫度(298~318 K)對吸附過程的影響,相關熱力學計算公式(6)~(9)如下:
式中, Kc 為分配系數, T(K)是絕對溫度, R 是理想氣體常數(8.314 J/(mol·K))。
圖7 為N-MCM-41 吸附Pb2+的熱力學模型擬合曲線,相關熱力學參數見表4。由計算結果可知,在N-MCM-41 吸附Pb2+的過程中, ΔG 均小于0,并且ΔG 隨著溫度升高而降低,說明該此吸附過程為自發過程,溫度升高有利于N-MCM-41 對Pb2+的吸附,這與前述吸附等溫模型分析結果一致。而且, ΔH 和ΔS 均大于0,表明N-MCM-41 對Pb2+的吸附是吸熱和熵增的過程[30]。
2.2.4 吸附性能對比
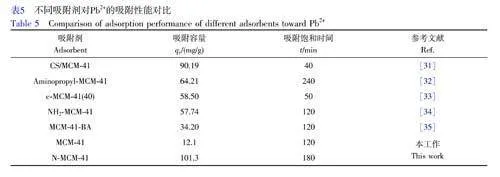
未經改性的MCM-41 和N-MCM-41 對Pb2+的吸附性能的對比見表5。MCM-41 對Pb2+的吸附容量僅為12.1 mg/g, 這是由于MCM-41 直接吸附Pb2+的過程主要是利用其本身的孔道結構所起的物理吸附作用。經2-吡啶甲醛修飾后, N-MCM-41 對于Pb2+的吸附容量顯著提高,達到101.3 mg/g, 這充分說明了本研究中的席夫堿改性過程能夠賦予MCM-41 更高效的吸附活性位點。對比近年來文獻報道的不同改性MCM-41 吸附劑對Pb2+的吸附容量(表5)可知, N-MCM-41 對Pb2+具有較高的吸附能力,說明N-MCM-41吸附劑在處理含鉛廢水方面具有良好的應用前景。
2.2.5 吸附機理
為了進一步闡明N-MCM-41 與Pb2+之間的相互作用機理,利用XPS 研究了N-MCM-41 吸附Pb2+前后的表面化學狀態。圖8A 為N-MCM-41 吸附Pb2+前后的XPS 全譜,當N-MCM-41 吸附Pb2+后,在138.7 和143.7 eV 處出現了Pb 的譜峰(圖8B),分別對應Pb 4f7/2 和Pb 4f5/2 特征峰[36],表明N-MCM-41 成功吸附了Pb2+,這與EDX 分析結果(圖8E)一致。圖8C 為N-MCM-41 吸附Pb2+前/后的C 1s 譜圖,未吸附Pb2+時,N-MCM-41 在284.5 eV(C—C/C=C)、285.8 eV(C—N)和287.1 eV(C=N)處出現3 個譜峰[37];吸附Pb2+后, C—N 與C=N 峰的結合能分別移動至286.0 和287.8 eV。圖8D 為N-MCM-41 吸附Pb2+前/后的N 1s 譜圖,吸附Pb2+后, N 1s 結合能升高,由398.7 eV(C—C=N/—C—N)和399.7 eV(—NH2)[38]分別移動至399.5 和401.2 eV。這是由于N 原子提供的孤對電子進入到Pb 原子提供的空軌道中,與Pb2+配位后,N 原子的電子云密度降低,導致結合能升高。上述XPS 表征結果充分說明在吸附Pb2+的過程中,N-MCM-41 的表面官能團與Pb2+發生了螯合配位作用。
2.2.6 吸附劑的再生性和吸附選擇性
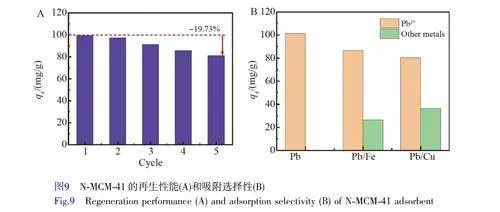
將吸附Pb2+的樣品置于0.1 mol/L HCl 溶液中,室溫下攪拌3 h 后,經離心和干燥后再進行吸附實驗,結果如圖9A 所示。N-MCM-41 重復使用5 次后,其吸附容量有所下降。這主要是由于經過多次吸附-再生后, N-MCM-41 孔內壁上仍然會吸附一定的Pb2+,占據了孔道內的吸附位點,導致吸附性能下降,與孔結構分析結果(表6)一致。但吸附容量僅下降19.73%,說明N-MCM-41 具有良好的可重復再生性。為了研究N-MCM-41 在雙金屬溶液體系內的吸附選擇性,分別測試了N-MCM-41 對Pb2+/Fe2+和Pb2+/Cu2+的吸附性能,其中Pb2+濃度和其它金屬離子濃度均為80 mg/L(圖9B)。結果表明,在Fe2+和Cu2+存在下,盡管N-MCM-41的吸附性能有所下降,但仍然保持對Pb2+較高的吸附能力(gt; 80 mg/g), 說明N-MCM-41 對Pd2+具有較好的吸附選擇性。
3 結論
采用席夫堿反應成功地將2-吡啶甲醛接枝到MCM-41分子篩上,獲得了一種新型席夫堿改性MCM-41分子篩(N-MCM-41),研究了N-MCM-41 對Pb2+的吸附性能。N-MCM-41 對Pb2+的吸附容量為101.3 mg/g,吸附過程符合Langmuir 吸附等溫模型和準二級動力學模型,屬于自發、熵增的吸熱過程。此吸附劑具有良好的再生性能,經過5 次吸附-脫附實驗后,吸附容量僅下降19.73%;此吸附劑還具有良好的吸附選擇性。XPS 分析結果表明, N-MCM-41 表面的官能團與Pb2+之間發生了螯合配位作用,使得N-MCM-41對Pb2+具有良好的吸附性能。本研究為開發高效經濟的重金屬離子吸附劑提供了參考。

