蘆筍SSR-PCR反應體系的優化及驗證



摘" " 要:以蘆筍幼葉為材料,采用單因素與L16(43)正交試驗相結合的方法,對影響蘆筍SSR-PCR反應的3個因素(2×Taq Master Mix,模板DNA,引物)進行優化,并以此為基礎通過退火溫度和循環次數試驗篩選引物最佳退火溫度和循環次數。結果表明,蘆筍基因組DNA的SSR-PCR最優反應體系為:10 μL反應體系中,50 ng·μL-1 DNA模板0.125 μL,10 μmol·L-1 上下游引物各0.5 μL,2×Taq PCR Mix 3 μL,滅菌ddH2O 5.875 μL。PCR擴增程序為:94 ℃預變性4 min;94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸35 s,循環25次;72 ℃延伸10 min,4 ℃保存。經5對引物組合和5個不同蘆筍品種DNA擴增驗證,該體系穩定可靠,可用于蘆筍遺傳多樣性分析、種子純度鑒定、分子標記輔助育種及重要農藝性狀的圖位克隆等工作。
關鍵詞:蘆筍;SSR-PCR反應體系;正交設計
中圖分類號:S644.6 文獻標志碼:A 文章編號:1673-2871(2024)07-100-07
Optimization and validation of SSR-PCR reaction system for Asparagus officinalis L.
BAI Yang, YI Zehui
(College of Horticulture, Shanxi Agricultual University, Taiyuan 030031, Shanxi, China)
Abstract: Based on DNA of asparagus young leaves, a single factor screening test combined with a L16(43) orthogonal design method was employed to optimize the factors of 2×Taq Master Mix, template DNA, and primer combination applied for SSR-PCR and followed by gradient annealing temperature test and gradient cycle times test to screening the optimum annealing temperature and cycle numbers. The results showed that the optimal SSR-PCR system for asparagus included 50 ng·μL-1 DNA template 0.125 μL, 10 μmol·L-1 primers 0.5 μL, 2×Taq PCR Mix 3 μL, sterilized ddH2O 5.875 μL, with a total reaction volume of 10 μL. The PCR amplification procedure for asparagus was: 94 ℃ pre-denaturation for 4 min, 94 ℃ denaturation for 30 s, 60 ℃ annealing 30 s, 72 ℃ renaturation for 35 s, 25 cycles, 72 ℃ extension for 10 min, 4 ℃ for storage. This reaction system was proved to be stable and reliable by PCR amplification with 5 pairs of primer combinations and DNA templates of five different asparagus cultivars. The optimized SSR-PCR reaction system could be satisfactorily used for genetic diversity analysis, seed purity identification, marker-assisted breeding and map-based cloning of important agronomic traits of asparagus.
Key words: Asparagus officinalis; SSR-PCR reaction system; Orthogonal design
蘆筍又名石刁柏,為天門冬科天門冬屬多年生草本植物,富含礦物質、多糖、皂苷、氨基酸、維生素和蘆丁等多種營養成分,具有抗氧化、降血糖、降血脂、提高免疫力等多種藥理功能,深受國內外關注,被譽為“蔬菜之王”[1-4]。目前,我國已成為世界第一大蘆筍生產國和出口國,經濟效益顯著。然而,我國蘆筍育種起步較晚,技術滯后,缺乏擁有自主知識產權的優良品種,生產上仍以國外品種為主,如阿波羅、格蘭德、紫色激情等,已成為影響我國蘆筍產業發展的主要因素之一[5]。
分子標記是對DNA進行檢測,實現了對基因型的直接選擇,具有多態性豐富、鑒定方法簡捷、準確性高等優點,已廣泛應用于作物的分子生物學和遺傳育種研究[6-7]。簡單重復序列(simple sequence repeats,SSR)是由1~6個核苷酸組成的基序,經多次重復形成的DNA片段[8]。與RAPD、SRAP等分子標記相比,SSR標記具有分布廣泛、多態性高、重復性好、共顯性和操作簡便等優點[9],已廣泛應用于遺傳多樣性分析[10]、分子標記輔助育種[11-12]及重要農藝性狀定位[13-14]等領域。SSR標記屬于PCR標記類型,檢測結果易受Taq聚合酶、引物、模板、Mg2+和dNTPs等諸多因素影響。因此,開展蘆筍SSR-PCR反應體系優化至關重要,可為SSR分子標記應用于蘆筍種質資源遺傳多樣性分析、分子標記輔助育種和重要農藝性狀的圖位克隆奠定基礎,對加速蘆筍新品種選育和優異基因挖掘具有重要意義。目前,前人已經對多個物種開展了SSR-PCR反應體系的優化研究,如木麻黃[15]、云南草果[16]、白及[17]、短絲木犀[18]等,發現不同物種的最優反應體系各異,具有一定的物種特異性。然而,SSR分子標記在蘆筍中的應用研究進展緩慢,僅有部分基于EST序列和基因組序列的SSR標記開發的報道[1,19-20],且彼此間反應體系存在較大差異,尚未見關于蘆筍SSR反應體系優化的研究報道,尤其是現今廣為應用的PCR Mix。
鑒于上述背景,筆者以PCR Mix為基礎,采用正交設計對SSR-PCR反應體系中的PCR Mix、引物和模板進行優化,并以此為基礎對擴增程序中的退火溫度和循環次數進行進一步優化,以期獲得適用于蘆筍的穩定性高、重復性好的反應體系,為SSR標記應用于蘆筍的遺傳育種研究奠定基礎。
1 材料與方法
1.1 材料
以冠軍、TC、京綠蘆1號、特立龍和新科2030共5個蘆筍品種為試驗材料,其中冠軍和TC來自山東省濰坊市農業科學院,京綠蘆1號來自北京市農林科學院蔬菜研究所,特利龍和新科2030來自美國沃克兄弟公司。試驗于2020年6月30日開始,種子經3% NaClO溶液消毒后,采用40 ℃溫水浸種48 h后催芽,待大部分種子露白時,采用32孔穴盤育苗,基質配比為V椰糠∶V草炭∶V蛭石∶V珍珠巖=2∶1∶1∶1。幼苗期每個品種隨機選擇5株采集健康、新鮮幼葉,液氮速凍,保存于-80 ℃冰箱備用。試驗用Ezup柱式植物基因組DNA抽提試劑盒和SanTaq Plus PCR Mix預混液均購自上海生工生物工程有限公司。
1.2 蘆筍基因組提取與檢測
參照Ezup柱式植物基因組DNA抽提試劑盒說明提取蘆筍DNA,經微量紫外分光光度計檢測,其質量濃度范圍為452.3~625.8 ng·μL-1,OD260/OD280比值在1.82~2.02;經1.0%瓊脂糖凝膠電泳檢測,DNA條帶清晰明亮、無彌散,可用于后續PCR擴增。采用ddH2O將DNA質量濃度稀釋至50 ng·μL-1,保存于-20 ℃冰箱備用。
1.3 SSR引物來源及篩選
以3個蘆筍品種冠軍、TC、京綠蘆1號DNA為模板,隨機挑選馬振川[1]開發的蘆筍EST-SSR引物5對(表1),委托上海生工生物工程有限公司合成。參照胡一凡等[16]PCR反應體系并略作修改,10 μL體系具體包括:50 ng·μL-1 DNA模板0.5 μL,10 μmol·L-1上下游引物各0.5 μL,2×Taq PCR Mix 4 μL,滅菌ddH2O 4.5 μL。PCR擴增程序參照馬振川[1]的報道并略作修改,具體為:94 ℃預變性4 min,94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸35 s,循環35次,72 ℃延伸10 min。擴增產物采用1.0%瓊脂糖凝膠電泳檢測。
1.4 蘆筍SSR-PCR反應體系優化
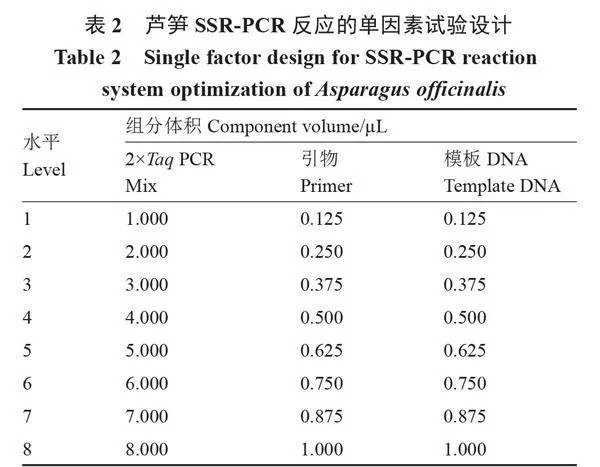
1.4.1 單因素試驗 在初篩試驗基礎上,以條帶明亮、雜帶較少的冠軍品種DNA為模板、LS6組合為引物,對影響PCR反應的3個主要因素(2×Taq PCR Mix、引物和模板)進行單因素優化,其中引物濃度10 μmol·L-1,DNA質量濃度50 ng·μL-1。以初篩試驗的PCR體系為基礎組成,設置8個梯度的單因素試驗(表2),用ddH2O補齊10 μL,分別篩選2×Taq PCR Mix、引物和模板的最適用量。擴增程序同1.3,設3次重復。采用6%非變性聚丙烯酰胺凝膠檢測擴增產物,分別用0.2% AgNO3和1.5% NaOH溶液進行染色和顯色。
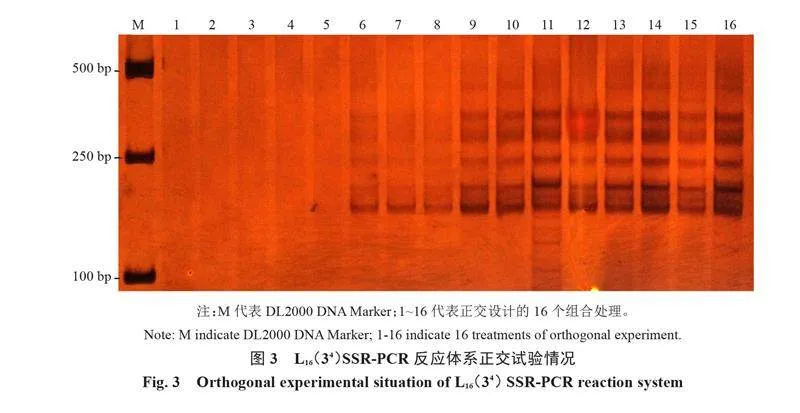
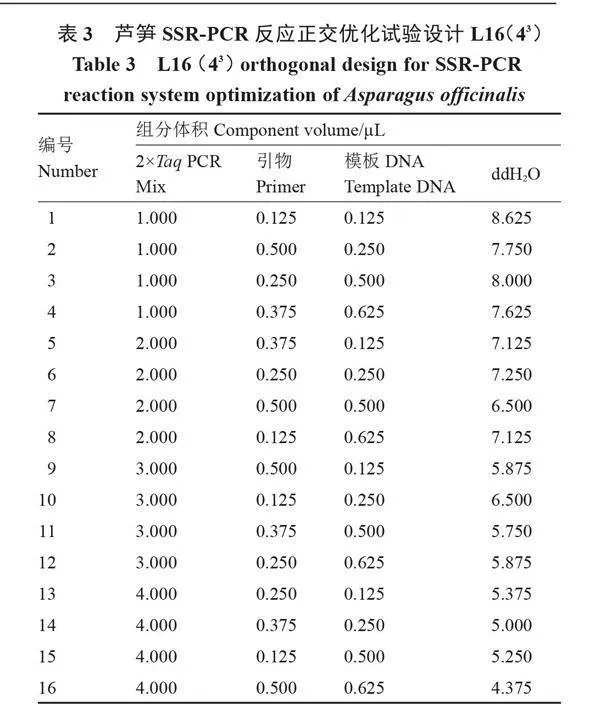
1.4.2 正交優化試驗 經單因素試驗,分別選取3個影響因素中擴增效果較好的4個水平,即2×Taq PCR Mix為1.000、2.000、3.000和4.000 μL;50 ng·μL-1 DNA模板為0.125、0.250、0.500和0.625 μL;10 μmol·L-1引物為0.125、0.250、0.375和0.500 μL。采用L16(43)設計3因素4水平正交試驗(表3),篩選最優組合,每個組合3次重復。擴增產物檢測方法同1.4.1。
1.5 蘆筍SSR-PCR退火溫度和循環次數的優化
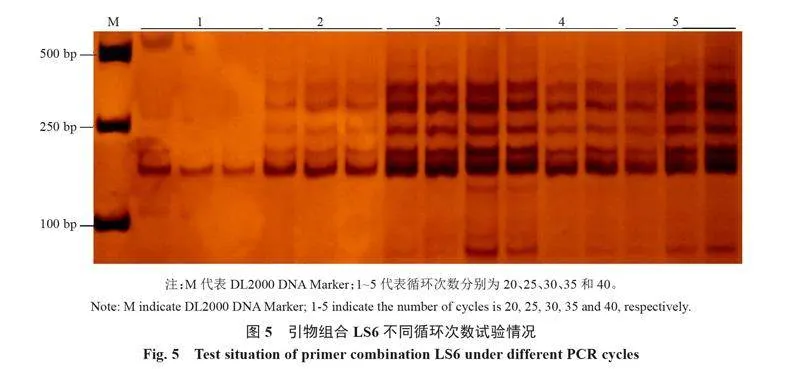
以最優PCR體系為基礎,優化LS6引物組合的PCR擴增程序,設置退火溫度和循環次數的單因素試驗,篩選最適退火溫度和循環次數。設置54、56、58、60和62 ℃共5個退火溫度,選取目標條帶清晰、雜帶較少的為最適退火溫度。采用最適退火溫度,設置20、25、30、35和40次循環,選擇條帶清晰、雜帶較少的最少循環次數為最適循環次數。
1.6 蘆筍SSR-PCR最佳反應體系的驗證
基于優化后的SSR-PCR反應體系和擴增程序,用5對SSR引物組合對5個蘆筍品種DNA模板進行擴增,以檢測最佳反應體系的穩定性和通用性。
2 結果與分析
2.1 引物及模板初步篩選
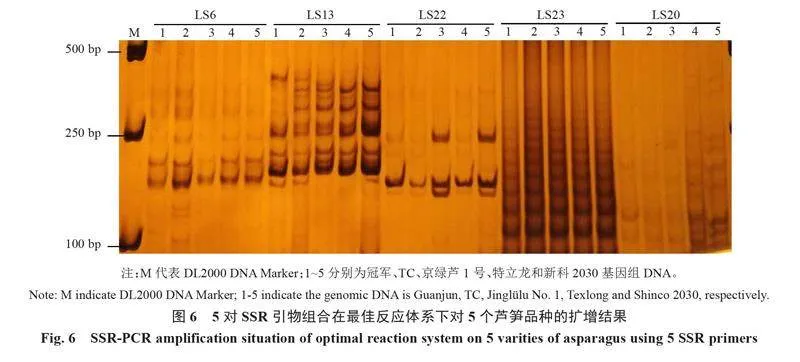
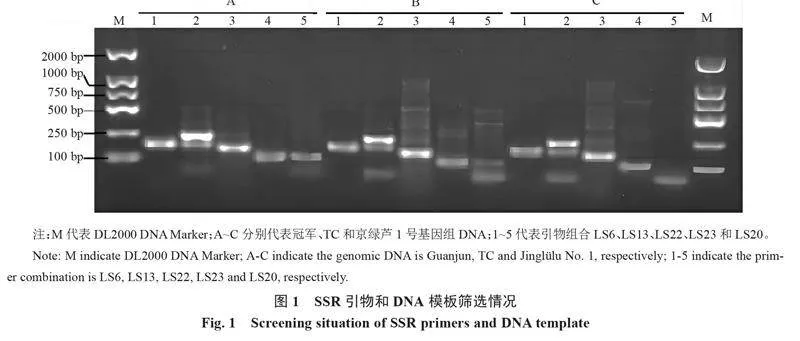
由圖1可知,引物組合LS23和LS20擴增條帶亮度和清晰度較低,且存在部分模板未擴增出目標條帶的現象;引物組合LS13和LS22擴增條帶亮度和清晰度最高,但是均存在不同程度的雜帶;引物組合LS6條帶較為清晰,未發現明顯雜帶,且以冠軍DNA為模板的條帶亮度和清晰度明顯優于京綠蘆1號和特立龍。因此,選擇冠軍DNA和LS6引物組合進行后續PCR反應體系優化試驗。
2.2 蘆筍SSR-PCR反應體系的單因素試驗
由圖2可知,2×Taq PCR Mix、引物和模板用量均會對蘆筍SSR-PCR擴增效果產生明顯影響。在2×Taq PCR Mix單因素試驗中,1~4水平初始用量的反應體系均可明顯擴增出目標條帶,其中,1/2倍用量條帶清晰且雜帶較3/4和1倍體系少。因此,10 μL PCR反應體系中2×Taq PCR Mix最佳用量為2 μL;引物單因素試驗中,8個引物用量的體系均可擴增出目的條帶,其中2~4水平用量體系的目標條帶最為清晰。考慮引物用量的經濟適用性,以0.25 μL為引物最佳用量;模板DNA單因素試驗中,8個用量的反應體系均可清晰擴增出目標條帶,1~3、5~6、8水平初始用量的反應體系條帶清晰度基本一致,明顯優于4和7水平用量,且1和2水平用量的雜帶較少。基于經濟節約原則,10 μL PCR反應體系中DNA最佳用量為0.125 μL。綜上可知,10 μL PCR反應體系中2×Taq PCR Mix、10 μmol·L-1引物和50 ng·μL-1 模板的最適用量分別為2、0.25和0.125 μL。
2.3 蘆筍SSR-PCR反應體系的正交試驗
由圖3可知,16個正交組合處理的擴增結果具有較大差異。組合1~5沒有擴增出目標條帶,組合6、7、8、11、13和15目標條帶清晰度偏低,組合9、10、12、14和16目標條帶較為清晰。就目標條帶清晰度而言,組合9、14和16的清晰度相似,明顯高于組合10、12。同時,組合9的雜帶明顯弱于組合14和16。因此,選擇組合9為蘆筍SSR擴增的最優體系,即10 μL反應體系組成為:50 ng·μL-1 DNA模板0.125 μL,10 μmol·L-1上下游引物各0.5 μL,2×Taq PCR Mix 3 μL,滅菌ddH2O 5.875 μL。
2.4 蘆筍SSR-PCR退火溫度試驗
由圖4可知,退火溫度對引物組合LS6的PCR擴增結果具有一定影響。退火溫度為54~60 ℃時,PCR擴增的目標條帶較為清晰,且均具有一定雜帶,但不影響主帶識別;退火溫度為62 ℃時,目標條帶清晰度大幅降低。因此,基于相同擴增效果選擇較高退火溫度的原則,選擇60 ℃為LS6引物組合的最適退火溫度。
2.5 蘆筍SSR-PCR循環次數試驗
由圖5可知,循環次數可明顯影響引物組合LS6的PCR擴增結果。循環次數為30、35和40次時,PCR擴增的目標條帶較為清晰,但雜帶較多,影響擴增結果識別;循環次數為20次時,雜帶明顯消失,但目標條帶清晰度也隨之大幅下降;循環次數為25次時,PCR擴增的目標條帶較為清晰,同時雜帶清晰度也明顯低于30、35和40次循環。因此,選擇25次為引物組合LS6的最適循環次數。
2.6 蘆筍SSR-PCR最佳反應體系的驗證
依據優化試驗獲得的最適體系(50 ng·μL-1 DNA模板0.125 μL,10 μmol·L-1上下游引物各0.5 μL,2×Taq PCR Mix 3 μL,滅菌ddH2O 5.875 μL)擴增程序(94 ℃預變性4 min,94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸35 s,循環25次,72 ℃延伸10 min),采用LS6、LS13、LS20、LS22和LS23引物組合對5個蘆筍品種的基因組DNA進行擴增。結果表明(圖6),引物組合LS6、LS13、LS22和LS23均可在5個蘆筍品種中擴增出相應目標條帶,且條帶清晰、易辨;引物組合LS20在5個模板中沒有擴增出目標條帶,僅有部分非特異性條帶被擴增,可能是由于引物特異性不高所致。綜上所述,篩選出的反應體系及擴增程序具有較高的穩定性和較好的重現性,可用于蘆筍及近緣物種的SSR-PCR擴增反應。
3 討論與結論
與RAPD、SRAP等傳統分子標記相比,SSR標記具有操作簡便、多態性豐富、穩定性好、共顯性等優勢,已在植物遺傳育種研究中發揮重要作用[6-7]。SSR標記以PCR技術為基礎,鑒定結果易受PCR反應體系及擴增程序影響,且不同物種對PCR反應體系的要求各異[15-18]。因此,通過優化試驗獲取蘆筍最優反應體系是利用SSR分子標記開展分子育種研究的前提和基礎。
Taq聚合酶、引物、模板、Mg2+和dNTPs是影響PCR擴增效果的主要因素[15]。2×Taq PCR Mix包含了PCR反應體系所需的Taq聚合酶、Mg2+、dNTPs和Buffer緩沖液,極大簡化了試驗程序,縮短試驗操作時間,在大規模的分子標記鑒定中具有廣闊的應用前景[17]。因此,筆者選擇2×Taq PCR Mix、模板DNA和引物為3個設計因素。單因素試驗結果表明,2×Taq PCR Mix對PCR反應的影響最為明顯,其次為DNA和引物濃度,本試驗結果與徐德林等[17]的研究結果一致,而與錢慧蓉等[18]和蔣小剛等[21]的研究結果不太一致。這說明不同物種對PCR因素的靈敏度不同,對不同物種進行SSR-PCR反應體系優化至關重要。目前,SSR-PCR體系優化的方法主要有完全組合、正交設計和響應面法。筆者在單因素試驗的基礎上,又通過正交試驗設計并利用直觀分析方法對影響蘆筍SSR-PCR反應的3個因素進行了優化,確定了最優反應體系。而徐德林等[17]則利用響應面法對白及SSR-PCR反應體系進行了優化,獲得了擬合方程模型及最優體系。正交設計法具有試驗組數少、簡便高效、布點均衡等優點,但精準度不及響應面法,較適用于對精度要求不太高的試驗;響應面法則需要通過更多試驗組合的得分情況對方程模型進行擬合及響應值預測,工作量較大[22]。采用正交設計法即可完全滿足SSR-PCR反應體系優化試驗需求。首先,對各試驗組的評價以人工識別擴增條帶為主,未涉及到具體數值測量;其次,優化的反應體系穩定性好,條帶明亮,清晰易辨。
退火溫度和循環次數對PCR擴增產物均具有明顯影響,其中,退火溫度決定了PCR產物的產量和特異性,循環次數決定了PCR產物的產量和擴增時間。退火溫度過高容易影響引物與模板DNA的緊密結合;溫度過低則易發生引物與模板DNA錯配從而導致非特異性擴增,影響目標條帶識別[23]。在本研究中,退火溫度為54~60 ℃條件下,擴增效果基本相同,選擇60 ℃為LS6引物組合的最佳退火溫度。因此,有必要對每條引物的最佳退火溫度進行篩選,尤其是特異性低的引物組合。PCR擴增的循環次數與產物產量和擴增時間成正比。在本研究中,循環次數為25次時的擴增條帶清晰易辨,且雜帶較少,在一定程度上節約了PCR擴增時間。
筆者優化獲得了適用于蘆筍基因組DNA的SSR-PCR最優反應體系,10 μL反應體系具體包括50 ng·μL-1 DNA模板0.125 μL,10 μmol·L-1上下游引物各0.5 μL,2×Taq PCR Mix 3 μL,滅菌ddH2O 5.875 μL。PCR擴增程序為:94 ℃預變性4 min,94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸35 s,循環25次,72 ℃延伸10 min。該體系經隨機選擇的不同引物和不同模板DNA驗證,除LS20引物特異性不明顯外,其他均可擴增出重復性好、清晰易辨的條帶,表明該體系穩定、可靠。可為今后SSR標記應用于蘆筍遺傳多樣性分析、種子純度鑒定、分子標記輔助育種及重要農藝性狀的圖位克隆等工作奠定基礎。
參考文獻
[1] 馬振川.蘆筍種質資源營養成分及EST-SSR遺傳多樣性分析[D].黑龍江大慶:黑龍江八一農墾大學,2017.
[2] TIWARI N,GUPTA V K,PANDEY P,et al.Adjuvant effect of Asparagus racemosus Willd.derived saponins in antibody production,allergic response and pro-inflammatory cytokine modulation[J].Biomedicine amp; Pharmacotherapy,2017,86:555-561.
[3] 謝啟鑫,尹玉玲,張岳平,等.人工海水脅迫下蘆筍品種耐鹽性評價的多元統計分析[J].植物遺傳資源學報,2015,16(2):411-416.
[4] GUO Q B,WANG N F,LIU H H,et al.The bioactive compounds and biological functions of Asparagus officinalis L.-A review[J].Journal of Functional Foods,2020,65:103727.
[5] 厲廣輝,于繼慶,李書華,等.我國蘆筍育種研究進展及展望[J].核農學報,2016,30(10):1934-1940.
[6] 張羽,張先平,李小鵬,等.分子標記在小麥抗條銹病遺傳育種中的應用研究進展[J].分子植物育種,2018,16(18):6032-6045.
[7] 董志剛,劉政海,李曉梅,等.SSR標記技術在葡萄品種鑒別及遺傳育種上的應用[J].生物技術進展,2016,6(2):137-140.
[8] SAEED A F,WANG R Z,WANG S H.Microsatellites in pursuit of microbial genome evolution[J].Frontiers in Microbiology,2016,6:1462.
[9] TAHERI S,ABDULLAH T L,YUSOP M R,et al.Mining and development of novel SSR markers using next generation sequencing(NGS)data in plants[J].Molecules,2018,23(2):399.
[10] WONG Q N,TANZI A S,HO W K,et al.Development of gene-based SSR markers in winged bean (Psophocarpus tetragonolobus (L.) DC.) for diversity assessment[J].Genes,2017,8(3):100.
[11] GAUTAM T,DHILLON G S,SINGH G,et al.Marker-assisted pyramiding of genes/QTL for grain quality and rust resistance in wheat (Triticum aestivum L.)[J].Molecular Breeding,2020,40(5):49.
[12] ZHU X,ZHAO J F,ABBAS H M K,et al.Pyramiding of nine transgenes in maize generates high-level resistance against necrotrophic maize pathogens[J].Theoretical and Applied Genetics,2018,131(10):2145-2156.
[13] WU M,LIU Y N,ZHANG C,et al.Molecular mapping of the gene(s) conferring resistance to Soybean mosaic virus and Bean common mosaic virus in the soybean cultivar raiden[J].Theoretical and Applied Genetics,2019,132(11):3101-3114.
[14] RONG F X,CHEN F F,HUANG L,et al.A mutation in class III homeodomain-leucine zipper (HD-ZIP III) transcription factor results in curly leaf (cul) in cucumber (Cucumis sativus L.)[J].Theoretical and Applied Genetics,2019,132(1):113-123.
[15] 李振,仲崇祿,張勇,等.木麻黃SSR-PCR反應體系的建立與優化[J].植物研究,2021,41(2):312-320.
[16] 胡一凡,狄義寧,張雪梅,等.云南草果SSR-PCR反應體系的優化及引物的篩選[J].分子植物育種,2019,17(1):195-200.
[17] 徐德林,陳紅波,馬激,等.白及SSR-PCR擴增體系的優化[J].中成藥,2018,40(12):2672-2676.
[18] 錢慧蓉,陳林,楊國棟,等.短絲木犀SSR-PCR反應體系優化及基于DNA混合池的引物快速篩選[J].分子植物育種,2019,17(2):525-530.
[19] 盛文濤,鄧建蘭,饒友生,等.基于NCBI數據庫蘆筍EST-SSR標記的開發[J].分子植物育種,2019,17(13):4307-4313.
[20] LI S F,ZHANG G J,LI X,et al.Genome-wide identification and validation of simple sequence repeats (SSRs) from Asparagus officinalis[J].Molecular and Cellular Probes,2016,30(3):153-160.
[21] 蔣小剛,王華,郭坤元,等.湖北道地藥材貝母ISSR反應體系優化及多態性引物篩選[J].福建農業學報,2021,36(6):642-650.
[22] 張明會,樊亮,高婷婷.響應面法與正交設計提取天麻素工藝比較[J].甘肅農業大學學報,2014,49(3):60-65.
[23] 徐顯異,陸婷,田嘉,等.橡膠草及其近緣種ISSR反應體系及擴增程序的優化[J].分子植物育種,2019,17(12):4007-4015.
收稿日期:2023-02-16;修回日期:2024-02-24
基金項目:山西省高校科技創新項目(2022L104);山西省農業科學院農業科技創新研究課題(YCX2020YQ07)
作者簡介:白" " 揚,女,助理研究員,研究方向為蔬菜育種及生物技術。E-mail:baiy5502@163.com
通信作者:儀澤會,男,助理研究員,研究方向為蔬菜育種及生物技術。E-mail:yizehui2008bj@163.com

