熱馴化對高山倭蛙體內氧化應激和抗氧化防御系統的影響

摘 要:以青藏高原特有兩棲動物高山倭蛙(Nanorana parkeri)為研究對象,通過實驗室內熱馴化處理(26 ℃,以16 ℃為對照;2周),探究長期熱馴化對其體內氧化應激水平和抗氧化防御系統的影響。結果顯示:熱馴化導致高山倭蛙骨骼肌中氧化型谷胱甘肽含量顯著升高(t=1. 4,df=10,plt;0. 001),肝臟和骨骼肌中氧化型與還原型谷胱甘肽比值顯著上升,表明其體內氧化應激水平升高;組織中超氧化物歧化酶、過氧化氫酶、谷胱甘肽過氧化物酶和谷胱甘肽轉移酶活性發生了特異性增加;肝臟丙二醛含量明顯下降,骨骼肌丙二醛含量沒有明顯變化,表明熱馴化并未導致氧化損傷指標增加,這得益于體內完善的抗氧化防御系統。研究結果有助于闡明全球氣候變暖對青藏高原兩棲動物的影響。
關鍵詞:高山倭蛙;氧化應激;抗氧化防御系統;熱馴化
中圖分類號:Q494
文獻標識碼:A
文章編號:2310 - 1490(2024)- 03 - 0588 - 08
DOI:10.12375/ysdwxb.20240315
全球氣候變暖已是不爭的事實,嚴重威脅全球生物安全和生物多樣性[1]。據預測,到21世紀末,全球平均氣溫將上升4 ℃,極端天氣事件將加劇,如更強烈、更頻繁的熱浪和干旱[2]。變溫動物的體溫隨外界環境變化而變化,缺乏生理性體溫調節能力,因此熱脅迫是未來變溫脊椎動物面臨的巨大挑戰之一[3?4]。近年來,大量的研究已經證實兩棲動物在目前的氣候危機中會有很高的生存風險,大規模的氣候變暖導致兩棲動物減少甚至滅絕[5?6],可能的原因是氣候變暖會干擾兩棲動物的代謝過程,從而加速其衰老和死亡[7?8]。青藏高原作為地球上一個獨特的地理單元,被譽為“世界屋脊”和“第三極”[9],是全球氣候變化的敏感區和關鍵區[10]。由于全球氣候變化的影響,導致青藏高原地區的物種組成和分布發生了顯著變化,如棲息地退化和生境喪失、物種分布區減小、物候期提前、種群繁殖速率和生存力下降、生物種間關系變化等[11]。因此,快速的升溫模式必將對世居高原的變溫脊椎動物的生存和繁殖等產生嚴重影響,那么這些物種的命運將何去何從?這是當前動物生理生態學研究的重要科學問題之一。
對于變溫脊椎動物,其體內氧化還原穩態會受到各種內部或外部因素的顯著影響,如缺氧、冰凍、低溫、高溫、脫水、冬眠以及從休眠中蘇醒等[12?17]。氧化應激是與溫度變化有關的各種生理和生化反應中的一個常見結果。許多研究報道稱,熱應激可以顯著增加變溫脊椎動物的活性氧生成,如棘胸蛙(Quasipaa spinosa)[12]、暗紋東方鲀(Takifugu obscu?rus)[18]、密點麻蜥(Eremias multiocellata)[19]和中亞側褶蛙(Pelophylax terentievi)[17]。為了減緩或防止活性氧造成的氧化損傷,生物體進化出了一套完整的抗氧化防御系統,該系統主要由低分子質量的抗氧化劑[還原型谷胱甘肽(GSH)、抗壞血酸(Vc)、維生素E 和尿酸等]和抗氧化酶[超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GPX)、谷胱甘肽-S-轉移酶(GST)、谷胱甘肽還原酶(GR)等]兩部分組成。不同抗氧化劑之間形成了互補、協同的關系,從而保證了整個抗氧化系統的穩定性和有效性[20]。通過清除活性氧,抗氧化酶在保護生物體免受熱應激方面發揮了重要作用,如棘胸蛙肝臟中SOD和GPX的活性明顯提高,以消除熱應激(30 ℃)誘發產生的大量活性氧[12]。目前,這類研究更多地關注低海拔分布的變溫脊椎動物,而關于熱脅迫對高海拔兩棲動物的氧化應激水平和抗氧化防御系統的影響研究鮮有報道。
高山倭蛙(Nanorana parkeri)隸屬于叉舌蛙科(Dicroglossidae)倭蛙屬(Nanorana),廣泛分布于(海拔2 850~5 100 m)青藏高原南部,被認為是世界上迄今所知海拔分布最高的兩棲動物[21]。目前,對該物種的研究主要集中在系統發生關系[22]、生活史[23]、高海拔適應[24]、冬眠生理生態學[25]等方面。近年來,Niu等[15]對高山倭蛙冬眠生理生態學進行了系統的研究,發現冷凍處理導致高山倭蛙的抗氧化防御系統發生了組織特異性變化,激活抗氧化防御系統是高山倭蛙耐受結冰的生存策略之一;此外,高山倭蛙能夠耐受短暫的身體結冰[26];與夏季相比,越冬的高山倭蛙采用季節性的代謝抑制策略,主要表現在動物整體水平、器官水平和亞細胞水平的代謝速率顯著降低[26?27]。目前,全球氣候變暖對青藏高原特有物種高山倭蛙的影響是未知的,本研究旨在探究熱馴化對該物種體內氧化應激和抗氧化防御系統的影響,從生理生化層面揭示高山倭蛙對熱馴化的響應,有助于揭示全球氣候變暖對青藏高原兩棲動物的影響,對保護青藏高原的生物多樣性具有重要意義。
1 材料與方法
1. 1 動物采集和熱馴化試驗
高山倭蛙采自西藏自治區拉薩市當雄縣(30. 28° N,91. 05° E;海拔4 280 m),采樣時間為2021年7月中旬,共采集雄性成體高山倭蛙20只。將采集的高山倭蛙裝于30 cm ×20 cm ×20 cm的收納箱中,并采用在收納箱外側放置冰袋的方式將運輸溫度控制在15~20 ℃,帶至德州學院后,置于人工氣候培養箱(RGD-500C3;合肥右科儀器設備有限公司)中飼養2周(培養箱參數:溫度16 ℃,相對濕度90%,光照強度6 000 lx,12 h光照/12 h黑暗),每天08:00投喂20條小面包蟲,18:00挑出剩余面包蟲。然后,隨機取出10只高山倭蛙置于另一人工氣候培養箱中進行熱馴化處理2 周(培養箱參數:溫度26 ℃,相對濕度90%,光照強度6 000 lx,12 h 光照/12 h黑暗)。以16 ℃條件為對照組,26 ℃為熱馴化組。熱馴化過程也為高山倭蛙提供同對照組的喂食。馴化結束后,對高山倭蛙進行毀髓處死,解剖、快速提取完整的心臟、肝臟、腦和骨骼肌,分別裝入凍存管,速凍于液氮中,最后轉至超低溫冰箱中-80 ℃保存,用于氧化應激指標和抗氧化保護指標的測定。動物實驗經德州學院動物實驗倫理委員會批準(批準號:DZXY2021003)。
1. 2 樣本處理
組織預處理:稱取存放于冰箱中?80 ℃的組織樣品0. 02~0. 04 g,分別置于2 mL研磨管中,按質量(g)∶體積(mL)=1∶9的比例加入預冷的0. 6%生理鹽水,使用冷凍樣品研磨儀進行勻漿處理,儀器參數:?20 ℃,60 Hz,40 s,間隔20 s,循環5次。研磨充分后,離心(4 ℃,4 000 r/min,10 min),將上清液轉至1. 5 mL離心管中并置于冰上待測。吸取20 μL上清液,使用考馬斯亮藍法(Bradford法)測定蛋白濃度。
1. 3 生理生化指標的測定
使用購自南京建成生物工程研究所的生化試劑盒測定氧化應激和抗氧化防御指標,包括谷胱甘肽[GSH和氧化型谷胱甘肽(GSSG)]、SOD、CAT、GPX、GST、總抗氧化能力(T-AOC)、Vc和丙二醛(MDA),所有操作過程按照說明書進行。
1. 4 數據處理
使用IBM SPSS Statistics 26 軟件對數據進行統計分析,對每組數據進行方差齊性和正態分布檢驗,使用獨立樣本t 檢驗比較兩組之間的差異,plt;0. 05表示統計學上具有顯著差異,在剔除異常值后,每組保留6個有效數據用于統計分析,所有數據均使用平均值±標準誤表示。使用Origin 2022軟件(Origin‐Lab Corporation)繪圖。
2 結果
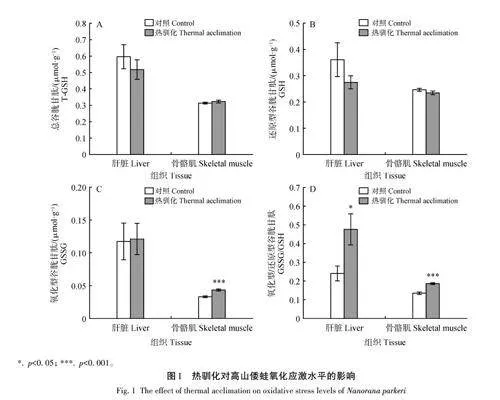
2. 1 熱馴化對高山倭蛙谷胱甘肽水平的影響
與對照組相比,熱馴化并未對肝臟和骨骼肌組織的總谷胱甘肽和GSH含量產生顯著影響(圖1A、B)。盡管肝臟組織中的GSSG 含量未發生明顯變化,但熱馴化導致骨骼肌組織中GSSG含量顯著升高(t=1. 4,df=10,plt;0. 001)(圖1C)。此外,熱馴化導致肝臟和骨骼肌組織中GSSG/GSH明顯升高(圖1D)。
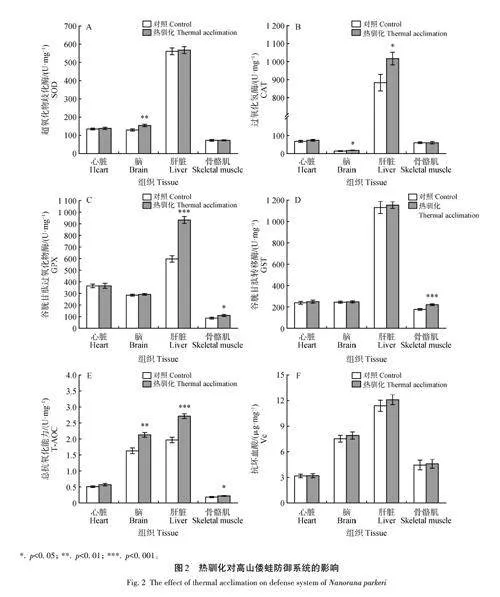
2. 2 熱馴化對高山倭蛙抗氧化酶的影響
與對照組相比,熱馴化導致腦組織中SOD活性上升約19%(t=?0. 398,df=10,plt;0. 01),但其他組織中SOD活性未見明顯變化(pgt;0. 05)(圖2A)。熱馴化并未導致心臟和骨骼肌組織中的CAT活性發生明顯變化(pgt;0. 05),但在腦組織中CAT 活性上升約27%(t=?3. 526,df=6. 741,plt;0. 05),肝臟組織的CAT活性上升約15%(t=?2. 317,df=10,plt;0. 05)(圖2B)。熱馴化導致骨骼肌組織中GPX活性上升約23%(t=?2. 446,df=10,plt;0. 05),肝臟組織中GPX活性上升約56%(t=?8. 468,df=10,plt;0. 001),但心臟和腦組織中的GPX活性未發生明顯變化(pgt;0. 05)(圖2C)。熱馴化導致骨骼肌組織中GST 活性上升26%(t=6. 175,df=10,plt;0. 001),但心臟、腦、肝臟組織中的GST活性未發生明顯變化(pgt;0. 05)(圖2D)。熱馴化誘導骨骼肌組織中T-AOC 活性上升約22%(t=?2. 750,df=10,plt;0. 05),腦組織中T-AOC活性上升約31%(t=?4. 561,df=10,plt;0. 01),肝臟組織中T-AOC活性上升約38%(t=?6. 766,df=10,plt;0. 001),心臟組織中T-AOC未發生明顯變化(pgt;0. 05)(圖2E)。此外,熱馴化并未導致心臟、腦、肝臟和骨骼肌組織中Vc含量發生明顯變化(pgt;0. 05)(圖2F)。
2. 3 熱馴化對高山倭蛙MDA 質量摩爾濃度的影響
與對照組相比,熱馴化誘導肝臟組織中MDA質量摩爾濃度下降約42%(t=5. 434,df=10,plt;0. 001),骨骼肌組織中MDA質量摩爾濃度未發生明顯變化(pgt;0. 05)。
3 討論
本研究以高山倭蛙為研究對象,探究了熱馴化對其氧化應激水平和抗氧化防御系統的影響,結果顯示不同組織中各指標對熱馴化處理呈現不同的反應,這與以往的研究結果[28?29]相吻合,即動物對熱刺激的響應呈現組織特異性和物種特異性。
3. 1 熱馴化對高山倭蛙氧化應激水平的影響
作為外溫脊椎動物,兩棲動物對環境溫度的變化極其敏感,被認為是生物多樣性觀測和環境監測的指示物種[30]。GSSG/GSH比值是體現細胞氧化還原狀態的一項重要指標[31],另外GSH是一種重要的解毒劑和小分子抗氧化劑[32]。GSH/GSSG 比值越大,表明機體抗氧化能力越強,反之,GSSG/GSH比值越大,代表生物體遭受氧化脅迫越強。在本研究中,熱馴化導致肝臟和骨骼肌組織中GSSG/GSH比值顯著升高,表明熱馴化誘導高山倭蛙機體處于氧化應激狀態,這可能是熱馴化誘導其代謝水平升高,從而伴隨著活性氧的急劇增加。以前的研究已經證實,活性氧的生成與機體的代謝水平成正比。此外,急性的熱處理也能誘導機體氧化應激水平升高,如冬眠的高山倭蛙(4 ℃)被急性熱刺激(10 ℃,12 h)后,肝臟和骨骼肌組織中GSSG 含量及GSSG/GSH 比值顯著升高[33]。
3. 2 熱馴化對高山倭蛙抗氧化防御系統的影響
急性熱應激可以導致變溫動物抗氧化防御系統上調[34],而且熱馴化對抗氧化防御系統的影響依賴于物種、組織和暴露條件(時間和溫度)。本研究發現,熱馴化導致腦組織中的SOD活性顯著增加,而其他組織中SOD 活性沒有發生明顯變化。SOD 作為一種重要的抗氧化保護酶,其發揮的作用是抗氧化防御的第一步,即將O2·-轉化生成H2O2、羥自由基(·OH)[35]。腦組織中SOD活性上升是高山倭蛙對熱馴化的一種保護性策略,能夠有效地降低高溫條件下活性氧激增帶來的負面影響。顧重建等[36]對紅耳滑龜(Trachemys scripta elegans)幼龜的研究也發現,熱馴化導致肝臟和肌肉組織中SOD活性顯著升高;另外,熱刺激(30 ℃,48 h)導致棘胸蛙肝臟中SOD酶活性顯著升高[12]。抗氧化保護酶發揮作用的第二步是CAT清除體內的H2O2[37]。本研究發現,熱馴化導致高山倭蛙腦和肝臟組織中CAT 活性顯著增加。GPX作為一種重要的抗氧化酶,能夠將GSH氧化成GSSG,同時將H2O2 還原為H2O,從而能夠有效地保護生物膜的結構和功能[38]。GST是生物體中一種主要的解毒酶,能夠催化GSH和親電底物結合,增加有毒物質的水溶性,消除生物體因受到脅迫而產生的活性氧[39]。在本研究中,熱馴化導致肝臟組織中GPX活性和骨骼肌組織中GST活性均顯著增加。在三刺魚(Gasterosteus aculeatus)的研究中發現,熱條件會使其肌肉組織中GPX活性顯著增加[40];在金頭鯛(Sparus aurata)中也發現了類似的結果,熱刺激導致肝臟和肌肉中的CAT 和GST 活性均顯著增加[28]。T-AOC 是反映體內抗氧化防御能力的一個重要指標,可以綜合評價整個身體的抗氧化水平,克服單一抗氧化防御指標的片面性[41]。本研究發現,熱馴化導致高山倭蛙腦、肝臟和骨骼肌中T-AOC均顯著增高,而心臟組織中無明顯變化。不同組織對活性氧的敏感程度和抗氧化保護酶的表達等不同,例如,肝臟是體內最活躍的代謝器官,也是產生活性氧的主要場所,通常肝臟具有更強的抗氧化保護酶活性。此外,肌肉和腦組織中含有大量不飽和脂肪酸,這是活性氧攻擊的主要對象,因此這兩種組織很容易遭受氧化損傷[42],提高這些組織中T-AOC有助于及時清除活性氧造成的損傷。此外,已有大量的研究證實抗氧化保護酶在應對脅迫時表現出組織特異性變化[29]。活性氧可以激活一些轉錄因子,如FoxO、Nrf2、HIF-1、NF-κB 和p53,從而提高抗氧化酶的表達[43],而且翻譯后修飾也參與調控抗氧化酶的活性[44]。這些調節作用對高山倭蛙抗氧化酶的影響還需要進一步驗證。
為了抵抗活性氧的攻擊,維持機體氧化還原穩態,小分子抗氧化劑也發揮了重要作用,其中典型的代表就是Vc[45]。Vc具有很強的還原性,在體內起著平衡自由基的產生和清除的作用。本研究發現,熱馴化對心臟、腦、肝臟和骨骼肌組織中Vc含量無影響,表明機體并未動用Vc 參與活性氧的清除過程。
3. 3 熱馴化對高山倭蛙MDA 的影響
MDA含量常常可反映體內脂質過氧化的程度,間接反映出細胞損傷程度[46]。在本研究中,熱馴化后肝臟組織中MDA含量顯著降低,而且肌肉中MDA含量未發生變化,表明熱馴化并未導致這些組織出現氧化損傷,這主要是由于熱馴化導致抗氧化防御能力顯著增強并快速清除急劇增加的活性氧。然而,在密點麻蜥中發現,肝臟組織中MDA含量在熱馴化后顯著升高,但是SOD 活性并未發生明顯變化[19]。總之,熱馴化對不同動物的氧化損傷的影響存在種間差異。
4 結論
綜上所述,高山倭蛙肝臟和骨骼肌組織中GSSG/GSH比值顯著增加,表明熱馴化導致高山倭蛙體內氧化應激水平升高;抗氧化防御系統發生了組織特性的變化,尤其肝臟中CAT、GPX和T-AOC活性顯著上升,但MDA含量明顯下降,表明高山倭蛙體內有著完善的抗氧化防御系統,能夠及時有效地抵御熱馴化導致的氧化應激水平升高,本研究對于理解全球變暖對世居高原的兩棲動物的影響具有重要意義。
參考文獻:
[1] MORITZ C, AGUDO R. The future of species under climate
change: resilience or decline?[J]. Science, 2013, 341(6145):
504-508.
[2] STOCKER T F, QIN D H, PLATTNER G K, et al. Climate
change 2013 the physical science basis: working group Ⅰ contribution
to the fifth assessment report of the intergovernmental panel
on climate change[R]. Cambridge: Cambridge University Press,
2013: 1054.
[3] HUEY R B, KEARNEY M R, KROCKENBERGER A, et al.
Predicting organismal vulnerability to climate warming: roles of
behaviour, physiology and adaptation[J]. Philosophical Transactions
of the Royal Society B, 2012, 367(1596): 1665-1679.
[4] KINGSOLVER J G, DIAMOND S E, BUCKLEY L B. Heat stress
and the fitness consequences of climate change for terrestrial ectotherms
[J]. Functional Ecology, 2013, 27(6): 1415-1423.
[5] CAREY C, ALEXANDER M A. Climate change and amphibian
declines: Is there a link?[J]. Diversity and Distributions, 2003,
9(2): 111-121.
[6] LI Y M, COHEN J M, ROHR J R. Review and synthesis of the effects
of climate change on amphibians[J]. Integrative Zoology,
2013, 8(2): 145-161.
[7] POUNDS A J, BUSTAMANTE M R, COLOMA L A, et al. Widespread
amphibian extinctions from epidemic disease driven by
global warming[J]. Nature, 2006, 439(7073): 161-167.
[8] BLAUSTEIN A R, WALLS S C, BANCROFT B A, et al. Direct
and indirect effects of climate change on amphibian populations
[J]. Diversity, 2010, 2(2): 281-313.
[9] 姚檀棟, 陳發虎, 崔鵬, 等. 從青藏高原到第三極和泛第三極
[J]. 中國科學院院刊, 2017, 32(9): 924-931.
YAO T D, CHEN F H, CUI P, et al. From Tibetan Plateau to
Third Pole and Pan-Third Pole[J]. Bulletin of Chinese Academy
of Sciences, 2017, 32(9):924-931.
[10] 李菲, 郜永祺, 萬欣, 等. 全球變暖與地球“ 三極” 氣候變化
[J]. 大氣科學學報, 2021, 44(1): 1-11.
LI F, GAO Y Q, WAN X, et al. Earth’s“ three-poles” climate
change under global warming[J]. Transactions of Atmospheric
Sciences, 2021, 44(1):1-11.
[11] 馬瑞俊, 蔣志剛. 全球氣候變化對野生動物的影響[J]. 生態
學報, 2005, 25(11): 3061-3066.
MA R J, JIANG Z G. Impact of global climate change on wildlife
[J]. Acta Ecologica Sinica, 2005, 25(11): 3061-3066.
[12] LIU Z P, GU W B, TU D D, et al. Effects of both cold and heat
stress on the liver of the giant spiny frog (Quasipaa spinosa):
stress response and histological changes[J]. Journal of Experimental
Biology, 2018, 221(21): jeb186379.
[13] ZHANG X J, NIU Y G, ZHANG H Y, et al. The effect of longterm
cold acclimation on redox state and antioxidant defense in
the high-altitude frog, Nanorana pleskei[J]. Journal of Thermal
Biology, 2021, 99: 103008.
[14] NIU Y G, CAO W J, STOREY K B, et al. Metabolic characteristics
of overwintering by the high-altitude dwelling Xizang Plateau
frog, Nanorana parkeri[J]. Journal of Comparative Physiology
B, 2020, 190(4): 433-444.
[15] NIU Y G, ZHANG X J, ZHANG H Y, et al. Antioxidant and
non-specific immune defenses in partially freeze-tolerant Xizang
Plateau frogs, Nanorana parkeri[J]. Journal of Thermal Biology,
2021, 102: 103132.
[16] MALIK A I, STOREY K B. Activation of antioxidant defense
during dehydration stress in the African clawed frog[J]. Gene,
2009, 442(1/2): 99-107.
[17] BAGNYUKOVA T V, STOREY K B, LUSHCHAK V I. Induction
of oxidative stress in Rana ridibunda during recovery from
winter hibernation[J]. Journal of Thermal Biology, 2003, 28
(1): 21-28.
[18] CHENG C H, YANG F F, LIAO S A, et al. High temperature
induces apoptosis and oxidative stress in pufferfish (Takifugu ob?
scurus) blood cells[J]. Journal of Thermal Biology, 2015, 53:
172-179.
[19] HAN X Z, HAO X, WANG Y, et al. Experimental warming induces
oxidative stress and immunosuppression in a viviparous lizard,
Eremias multiocellata[J]. Journal of Thermal Biology,
2020, 90: 102595.
[20] SIES H. Oxidative stress: oxidants and antioxidants[J]. Experimental
Physiology, 1997, 82(2): 291-295.
[21] ZHANG L X, MA X Y, JIANG J P, et al. Stronger condition dependence
in female size explains altitudinal variation in sexual
size dimorphism of a Tibetan frog[J]. Biological Journal of the
Linnean Society, 2012, 107(3): 558-565.
[22] LIU J, WANG C M, FU D L, et al. Phylogeography of
Nanorana parkeri (Anura: Ranidae) and multiple refugia on the
Tibetan Plateau revealed by mitochondrial and nuclear DNA[J].
Scientific Reports, 2015, 5: 9857.
[23] LU X, MA X Y, FAN L Q, et al. Reproductive ecology of a Tibetan
frog Nanorana parkeri (Anura: Ranidae)[J]. Journal of
Natural History, 2016, 50(43/44): 2769-2782.
[24] NIU Y G, ZHANG X J, XU T S, et al. Physiological and biochemical
adaptations to high altitude in Tibetan frogs, Nanorana
parkeri[J]. Frontiers in Physiology, 2022, 13: 942037.
[25] NIU Y G, CHEN Q, STOREY K B, et al. Physiological ecology
of winter hibernation by the high-altitude frog Nanorana parkeri
[J]. Physiological and Biochemical Zoology, 2022, 95(3):
201-211.
[26] 牛永剛. 高山倭蛙冬眠的生理生化特征及分子機制[D]. 蘭
州:蘭州大學,2019.
NIU Y G. Physiological and biochemical characteristics and underlying
molecular mechanisms of hibernation in Nanorana
parkeri[D]. Lanzhou: Lanzhou University, 2019.
[27] NIU Y G, ZHANG X J, ZHANG H Y, et al. Metabolic responses
of plasma to extreme environments in overwintering Tibetan
frogs Nanorana parkeri: a metabolome integrated analysis
[J]. Frontiers in Zoology, 2021, 18(1): 41.
[28] MADEIRA D, VINAGRE C, DINIZ M S. Are fish in hot water?
Effects of warming on oxidative stress metabolism in the
commercial species Sparus aurata[J]. Ecological Indicators,
2016, 63: 324-331.
[29] VINAGRE C, MADEIRA D, MENDON?A V, et al. Effect of increasing
temperature in the differential activity of oxidative stress
biomarkers in various tissues of the rock goby, Gobius paganellus
[J]. Marine Environmental Research, 2014, 97: 10-14.
[30] 吳軍, 高逖, 徐海根, 等. 兩棲動物監測方法和國外監測計
劃研究[J]. 生態與農村環境學報, 2013, 29(6): 784-788.
WU J, GAO T, XU H G, et al. Methods for monitoring of amphibians
and monitoring programmes in foreign countries[J].
Journal of Ecology and Rural Environment, 2013, 29(6):
784-788.
[31] ASENSI M, SASTRE J, PALLARDO F V, et al. Ratio of reduced
to oxidized glutathione as indicator of oxidative stress status
and DNA damage[J]. Methods in Enzymology, 1999, 299:
267-276.
[32] CAREY H V, RHOADS C A, AW T Y. Hibernation induces
glutathione redox imbalance in ground squirrel intestine[J].
Journal of Comparative Physiology B, 2003, 173(4): 269-276.
[33] ZHANG H Y, ZHANG X J, XU T S, et al. Effects of acute heat
exposure on oxidative stress and antioxidant defenses in overwintering
frogs, Nanorana parkeri[J]. Journal of Thermal Biology,
2022, 110: 103355.
[34] LUSHCHAK V I, BAGNYUKOVA T V. Temperature increase
results in oxidative stress in goldfish tissues: 1. Indices of oxidative
stress[J]. Comparative Biochemistry and Physiology Part C,
2006, 143(1): 30-35.
[35] GOPAL R K, ELUMALAI S. Industrial production of superoxide
dismutase (SOD): a mini review[J]. Journal of Probiotics
Health, 2017, 5:3.
[36] 顧重建, 金建鈺, 上官福根, 等. 溫度馴化對紅耳滑龜幼龜
選擇體溫、熱耐受性和抗氧化酶活性的影響[J]. 生態學報,
2016, 36(6):1737-1745.
GU C J, JIN J Y, SHANGGUAN F G, et al. Influence of temperature
acclimation on selected body temperature, thermal tolerance,
and antioxidant enzyme activity of juvenile red-eared
slider turtles (Trachemys scripta elegans)[J]. Acta Ecologica Sinica,
2016, 36(6):1737-1745.
[37] LOUGHLAND I, SEEBACHER F. Differences in oxidative status
explain variation in thermal acclimation capacity between individual
mosquitofish (Gambusia holbrooki)[J]. Functional
Ecology, 2020, 34(7): 1380-1390.
[38] CHEN J, BHANDAR B, KAVDIA M. Interaction of ROS and
RNS with GSH and GSH/GPX systems[J]. The FASEB Journal,
2015, 29(Suppl. 1): 636. 7.
[39] 呂敏,劉惠霞,吳文君. 谷胱甘肽S-轉移酶與昆蟲抗藥性的關
系[J]. 昆蟲知識,2003,40(3):204-207;228.
Lü M, LIU H X, WU W J. The relationship between of glutathione
S-transferases and insect resistance[J]. Entomological
Knowledge,2003,40(3):204-207;228.
[40] KIM S Y, NOGUERA J C, VELANDO A. Carry-over effects of
early thermal conditions on somatic and germline oxidative damages
are mediated by compensatory growth in sticklebacks[J].
Journal of Animal Ecology, 2019, 88(3): 473-483.
[41] 孔祥會, 王桂忠, 艾春香, 等. 鋸緣青蟹不同器官組織中總
抗氧化能力和SOD活性的比較研究[J]. 臺灣海峽, 2003, 22
(4): 469-474.
KONG X H, WANG G Z, AI C X, et al. Comparative study on
total antioxidative capability and SOD activity in different organs
and tissues of mud crab Scylla serrata[J]. Journal of Oceanography
in Taiwan Strait, 2003, 22(4): 469-474.
[42] CROCKETT E L. The cold but not hard fats in ectotherms: consequences
of lipid restructuring on susceptibility of biological
membranes to peroxidation, a review[J]. Journal of Comparative
Physiology B, 2008, 178(7): 795-809.
[43] HERMES-LIMA M, MOREIRA D C, RIVERA-INGRAHAM G
A, et al. Preparation for oxidative stress under hypoxia and metabolic
depression: revisiting the proposal two decades later[J].
Free Radical Biology and Medicine, 2015, 89: 1122-1143.
[44] DAWSON N J, KATZENBACK B A, STOREY K B. Freeradical
first responders: the characterization of CuZnSOD and
MnSOD regulation during freezing of the freeze-tolerant North
American wood frog, Rana sylvatica[J]. Biochimica et Biophysica
Acta, 2015, 1850(1): 97-106.
[45] G?GOTEK A, SKRZYDLEWSKA E. Ascorbic acid as antioxidan
[t J]. Vitamins and Hormones, 2023, 121: 247-270.
[46] MOORE K, ROBERTS L J. Measurement of lipid peroxidation
[J]. Free Radical Research, 1998, 28(6): 659-671.

