負載型三維電極處理甲基橙廢水的動力學和降解機理研究





摘 要:采用化學共沉淀法制備負載型Fe3O4-MnO2/GAC粒子電極,通過三維電極系統處理甲基橙廢水,探討甲基橙和COD降解的反應動力學,并運用紫外-可見光光譜分析甲基橙的降解機理。結果表明:降解甲基橙和COD反應均為一級反應,粒子投加量為50g·L-1,溶液pH為7,溶液溫度為45℃時反應速率常數最大,降解甲基橙和COD的反應活化能分別為3.4442×104J·mol-1和1.5299×104J·mol-1。此外,根據紫外-可見光光譜推測甲基橙降解機理為偶氮式降解,強氧化物與甲基橙接觸首先破壞發色基團,并且破壞偶氮鍵分解為多種芳香類物質;接著·OH進一步攻擊苯環大π鍵,生成苯酚、對苯二酚等中間產物,最終被礦化為CO2和H2O。
關 鍵 詞:三維電極;甲基橙;COD;動力學
中圖分類號:X791;TQ613.1 文獻標志碼: A 文章編號: 1004-0935(2024)08-1173-08
印染廢水具有水量大、色度高、組分復雜、水質變化大等特征,在排放前必須進行工程預處理[1]。此外,印染廢水具有色澤深的特征,對受納水體外觀也造成了不良的影響[2]。甲基橙是一種廣泛應用于印染紡織的偶氮活性染料,傳統的物理法、化學法、生物法均難以對偶氮廢水進行有效處理。三維電極作為一種電催化氧化技術具有氧化性能好、操作靈活、占地面積小等優點,被認為是一種具有良好應用前景的處理高濃度有機廢水的方法。該技術是將粒子電極利用電場作用成為復極性粒子,粒子與粒子之間形成許多的微電解池,通過在粒子電極表面直接氧化分解以及利用生成的強氧化劑間接將有機污染物分解礦化[3]。然而,傳統的粒子電極在重復使用效果不理想、能耗高以及選擇性小[4],成為阻礙三維電極應用的關鍵問題。徐斌[5]等制備了Fe3O4負載的氧化石墨烯粒子電極降解甲基橙。研究發現,在初始pH=5,粒子電極投加量3g·L-1,反應時間90min,電流密度30mA·cm-2,外加電壓 7V 的反應條件下,SGF 粒子電極體系的甲基橙色度和 COD 去除率分別是98.8%和87.5%。張添淇[6]采用浸漬焙燒法制備負載SnO2的氧化鋁粒子電極,對甲基橙廢水處理,實驗結果表明在電解時間60min,電解電壓6V,pH=7.2,電解質投加量為1g·L-1,粒子電極投加量120g,曝氣量200mL·min-1的條件下,甲基橙和COD去除率分別可以達到最高值,甲基橙去除率為82.27%,COD去除率為61.77%。莫再勇[7]等人制備鉻、鐵二元修飾的活性炭粒子電極處理甲基橙廢水,研究表明在工作電壓15V、空氣流量0.2 L·min-1、pH為5、處理時間為30min時,脫色率可達到94.31%。
前言目前對于三維電極處理甲基橙廢水的動力學和降解機理研究較少,本研究采用化學共沉淀法制備Fe3O4-MnO2/GAC粒子電極,應用于三維電極體系處理甲基橙廢水,分析甲基橙和COD降解的動力學規律,推測降解機理與歷程,為三維電極的實際應用提供初步理論依據。
1 實驗部分
1.1 材料、試劑與儀器
活性炭由河南平頂山綠之原活性炭有限公司生產。
實驗藥劑:甲基橙、鄰苯二甲酸氫鉀、鉬酸銨、無水Na2SO4、AgSO4、HgSO4、Fecl3·6H2O、Fecl2·4H2O、KMnO4、NaOH均為分析純;H2SO4、K2Cr2O7均為優級純;H2O2質量分數為25%。
實驗儀器:UV-1810紫外可見分光光度計:上海佑科儀器儀表有限公司;FA1204B電子天平:上海佑科儀器儀表有限公司;101-1鼓風干燥箱:紹興市上虞區誠尚儀器有限公司;JJ-1型電動攪拌器:常州市江南實驗儀表廠;LZB-3WB轉子流量計:常州科德精密機械制造有限公司;ACO-001電磁式空氣泵:深圳市興日生實業有限公司;PHS-2FpH計:上海儀電科學儀器股份有限公司。
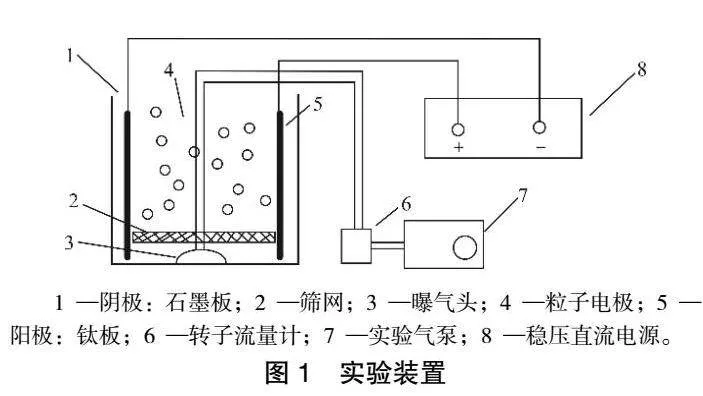
1.2 實驗裝置
實驗裝置由陰極、陽極、穩壓直流電源、曝氣頭、轉子流量計、實驗氣泵等組成,如圖1所示。
裝置采用立方體反應器155mm×125mm×155mm(長×寬×高),有效容積1000mL,材質為有機玻璃,水樣以及藥劑可以從上部投加,陰極采用石墨板,陽極采用Ti,規格均為150mm×120mm×
3mm。反應器底部有曝氣裝置,利用轉子流量計控制曝氣量,用以調節反應內部的曝氣,并起到充分攪拌的作用,從而使甲基橙廢水得到充分處理。
1.3 粒子電極制備
正文粒子電極制備運用化學共沉淀法將Fe3O4-MnO2負載于顆粒狀活性炭。
首先將3mm柱狀活性炭顆粒用去離子水清洗數次后依次用稀酸、稀堿溶液浸泡30min,過濾后用去離子水洗至中性,然后將活性炭置于超聲水浴鍋中處理30min,于105℃下干燥12h備用。
稱取89.55gFeCl2·4H2O溶解于100mL蒸餾水中完全溶解,后加入0.18L濃度為5mol·L-1的氫氧化鈉(NaOH),放入50℃水浴鍋中,持續機械攪拌,使生成的藍色絮狀物分布均勻,然后緩慢加入0.3L濃度為0.5mol·L-1的KMnO4持續機械攪拌,加入9.375mL濃度為8mol·L-1的H2O2,當燒杯中的液體物質全部轉化成黑色混合液時,加入15.95g預處理的活性炭顆粒,持續機械攪拌2h,靜置沉淀后除去上清液,將剩下的混合液放入鼓風干燥箱中烘干,溫度調節為105℃,烘干12h,取出烘干后的材料反復洗滌,最終達到上清液為中性為止,除去上清液,繼續烘干后放入瓶內密封保存即可。
1.4分析方法
1.4.1 甲基橙測定方法
采用紫外-可見分光光度法[8]在甲基橙pH為1的狀態下可見光最大吸收波長為460nm,計算得到其不同時間的濃度。
1.4.2COD測定方法
COD的測定采用快速密閉催化消解法。當COD大于50mg·L-1,將波長為600nm的吸光度值代入標準曲線可計算得到COD質量濃度。當COD大于50mg·L-1,將波長為440nm的吸光度值代入標準曲線可計算得到COD質量濃度。
2 結果與分析
2.1 動力學方程擬合
在甲基橙溶液濃度100mg·L-1,極板間距為6cm,外加電壓為10.12V、曝氣量為313mL·min-1、電解質投加量為3.195g·L-1,初始pH為7,粒子電極投加量50g·L-1,溶液溫度為25℃,進行實驗。一次實驗連續進行2h,每20min取一次樣。
2.1.1 降解甲基橙動力學擬合
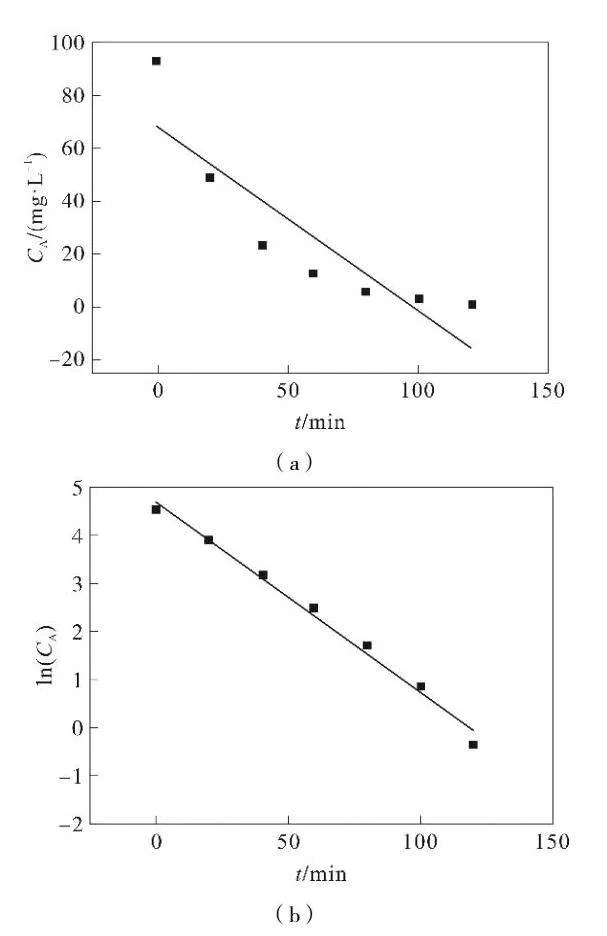
根據化學反應動力學理論。假定Fe3O4-MnO2/GAC對甲基橙的降解反應屬于零級反應,則CA-t呈直線關系(圖2(a)),回歸方程為y=-0.6997x+68.797,R2=0.7876。
假定Fe3O4-MnO2/GAC對甲基橙的降解反應屬于一級反應,則ln(CA)-t呈直線關系(圖2(b)),回歸方程為y=-0.0398x+4.7159,R2=0.9887。
假定Fe3O4-MnO2/GAC對甲基橙的降解反應屬于二級反應,則1/(CA)-t呈直線關系(圖2(c)),回歸方程為y=0.009 4x-0.247 6,R2=0.611 3。
2.1.2 降解COD動力學擬合
根據化學反應動力學理論。假定Fe3O4-MnO2/GAC對COD的降解反應屬于零級反應,則CA-t呈直線關系(圖3(a)),回歸方程為y=-0.681x+85.73,R2=0.8691。
假定Fe3O4-MnO2/GAC對COD的降解反應屬于一級反應,則ln(CA)-t呈直線關系(圖3(b)),回歸方程為y=-0.0156x+4.5384,R2=0.9875。
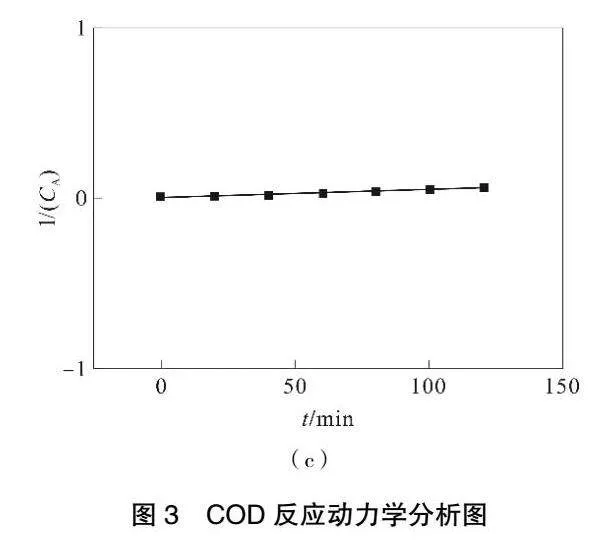
假定Fe3O4-MnO2/GAC對甲基橙的降解反應屬于二級反應,則1/(CA)-t呈直線關系(圖3(c)),回歸方程為y=0.000 4x+0.005 7,R2=0.976。
甲基橙降解零級反應相關系數為0.7876,一級反應相關系數為0.9887,二級反應相關系數為0.6113;COD降解零級反應相關系數為0.8691,一級反應相關系數為0.9875,二級反應相關系數為0.976。以及反應相關系數最大。
在三維電極降解甲基橙過程中,主要是利用電芬頓反應生成強氧化物質·OH。因此在動力學研究方面,可忽略直接氧化[9]。甲基橙(R)被強氧化物質·OH氧化,獲得氧化產物(P):
R+·OH→P
反應速率方程為:
式中:c(R)—甲基橙的濃度;
c(·OH)—·OH的濃度;
c(P)—氧化產物的濃度;
k—反應的速率常數;
t—反應時間。
在一定的電化學體系里如果認為·OH達到了穩定濃度,則認為·OH濃度為一常數[10]。
在整個反應過程中反應條件保持不變,即排除其他條件對反應速率的影響,Fe3O4-MnO2/GAC粒子電極對甲基橙和COD的降解反應為一級反應。
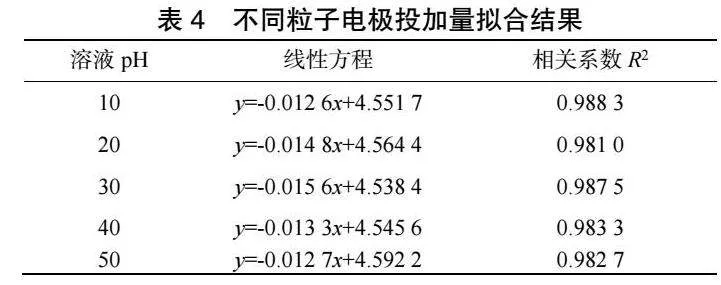
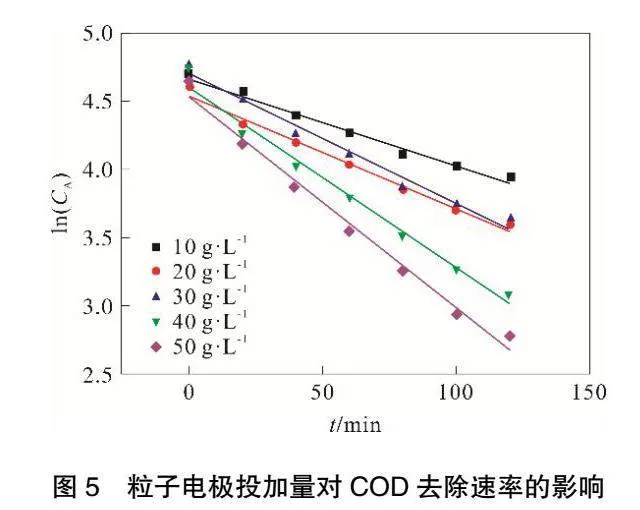
2.2 粒子電極投加量
在甲基橙溶液質量濃度100mg·L-1,極板間距為6cm,外加電壓為10.12V、曝氣量為313mL·min-1、電解質投加量為3.195g·L-1,初始pH為7,溶液溫度為25℃,改變粒子電極投加量,進行實驗。一次實驗連續進行2h,每20min取一次樣。
2.2.1 甲基橙降解反應速率
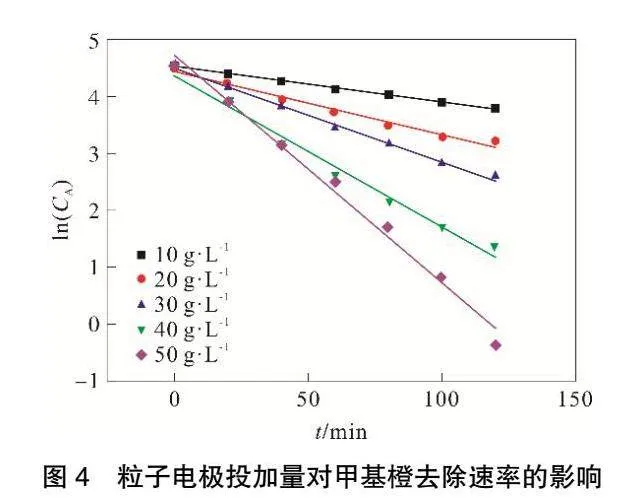
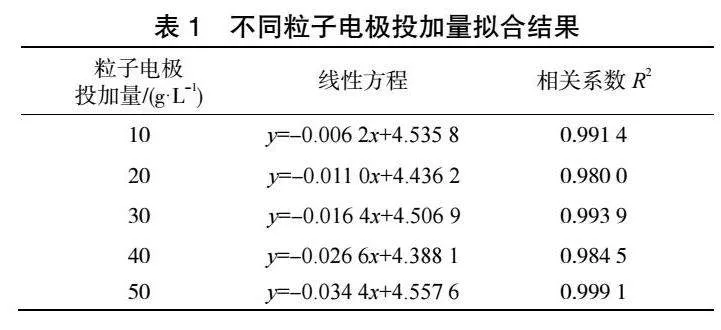
由圖4和表1可見,ln(CA)與t存在良好線性關系,相關系數R2可以達到0.98以上。隨著粒子電極投加量的增加,甲基橙降解反應速率常數k不斷增大,當粒子電極投加量達到50g·L-1,反應速率常數k最大可達到0.0344。
2.2.2 COD降解反應速率
由圖5和表2可見,ln(CA)與t存在良好線性關系,相關系數R2可以達到0.97以上。
隨著粒子電極投加量的增加,COD降解反應速率常數k不斷增大,當粒子電極投加量達到50 g·L-1,反應速率常數k最大可達到0.015 6。
粒子電極作為三維電極中最重要的部分,合適的粒子電極投加量可以增加污染物質與電極的接觸面積[11],從而提高反應效率。隨著粒子電極投加量增大,反應過程中處置距離減小,從而使得傳質效率升高[12]。并且隨著粒子電極投加量增大鐵、錳金屬氧化物增多,從而促進電芬頓反應進行,使得甲基橙和COD降解反應速率增大。
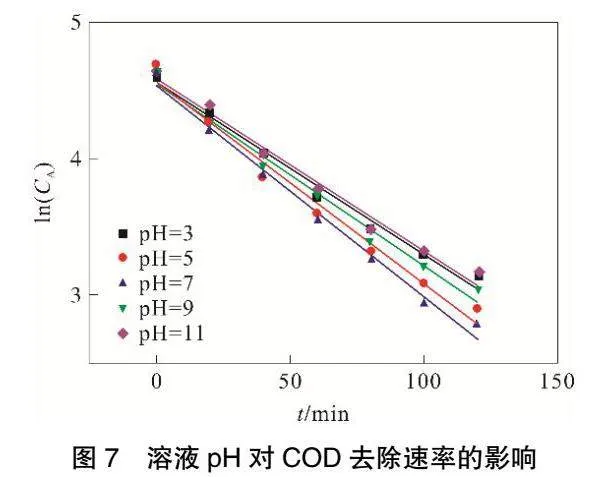
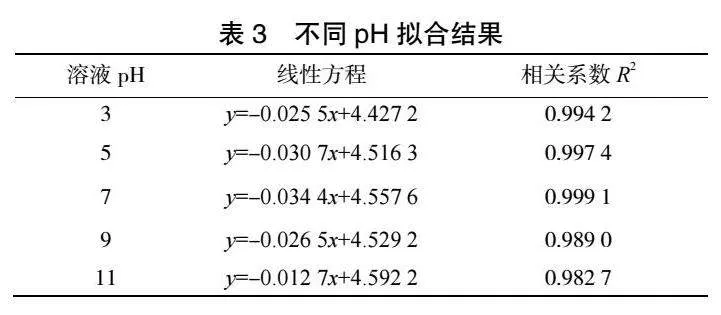
2.3 溶液pH對反應速率的影響
在甲基橙溶液濃度100mg·L-1,極板間距為6cm,外加電壓為10.12V、曝氣量為313mL·min-1、電解質投加量為3.195g·L-1,溶液溫度為25℃,粒子電極投加量為50g·L-1,改變甲基橙溶液pH,進行實驗。一次實驗連續進行2h,每20min取一次樣。
2.3.1 甲基橙降解反應速率
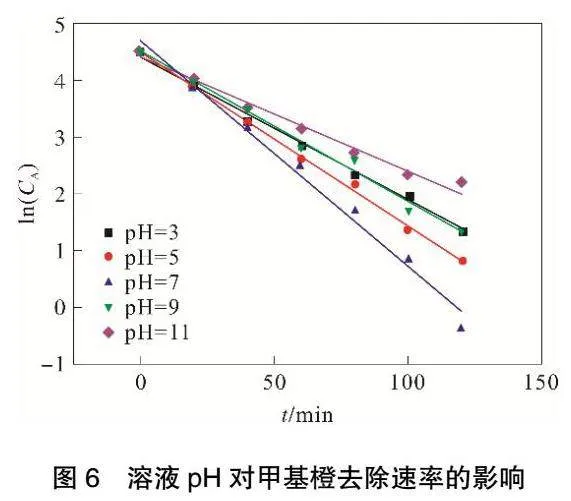
由圖6和表3可見,ln(CA)與t存在良好線性關系,相關系數R2可以達到0.98以上。隨著溶液pH的增加,甲基橙降解反應速率常數k呈現出先增大后減小的趨勢,當甲基橙溶液pH達到7,反應速率常數k最大可達到0.0344。
2.3.2 COD降解反應速率
由圖7和表4可見,ln(CA)與t存在良好線性關系,相關系數R2可以達到0.98以上。隨著溶液pH的增加,COD解反應速率常數k呈現出先增大后減小的趨勢,當甲基橙溶液pH達到7,反應速率常數k最大可達到0.0156。
在所有的電化學體系中,污染物在酸性條件下帶正電荷,在堿性條件下污染物帶負電荷[13],并且pH也影響顆粒電極物質的吸附能力[14]。大部分研究表明,三維電極系統處于弱酸性環境,有機污染物有較好的去除效果[7,15-17],這是因為O2+2H++2e-=H2O2,H+在溶液中含量高有利于H2O2的生成。由于本實驗的粒子電極中有MnO2存在,根據Wang[18]等人的研究,由于MnO2的存在,在極化粒子電極的陽極側發生H2O和OH-的放電反應,產生吸附的羥基自由基:MnO2+H2O→MnO2(·OH )+H++e-。這樣,即使在中性環境中,溶液依然能夠產生大量H+,從而生成H2O2和·OH,有效去除甲基橙和COD。
當溶液pH過低時,其中含有大量H+,這會導致電解槽中發生析氫副反應:2H++2e-=H2。該反應的發生會降低H2O2生成的活性,抑制了H2O2的生成,從而導致甲基橙和COD降解速率較低。當溶液pH大于7時,隨著pH增大,溶液中存在大量OH-,OH-與Fe2+或者Fe3+反應會產生絮凝沉淀,覆蓋在離子電極表面,影響粒子電極的復極性,從而無法生成·OH,進而導致甲基橙和COD降解速率下降。因此,將甲基橙溶液初始pH控制在中性環境中最有利于甲基橙與COD的去除。
2.4 溶液溫度對反應速率的影響
在極板間距為6cm,外加電壓為10.12V、曝氣量為313mL·min-1、電解質投加量為3.195g·L-1,初始pH為7,甲基橙濃度為100mg·L-1,粒子電極投加量為50g·L-1,改變溶液溫度,進行實驗。一次實驗連續進行2h,每20min取一次樣。
2.4.1 甲基橙降解反應速率
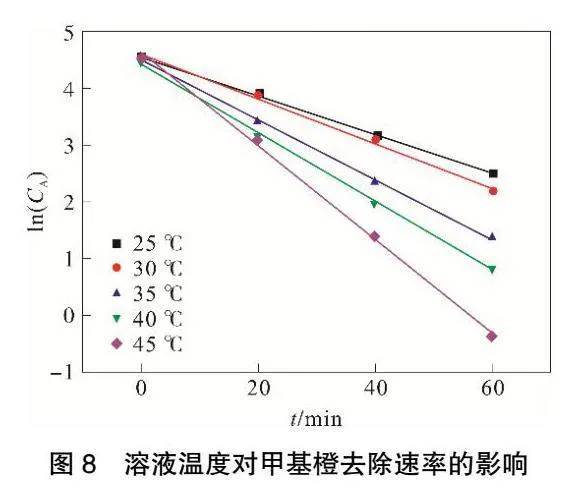
隨著溫度升高甲基橙降解速率變快,為保證統一,選取第1h的實驗樣本。
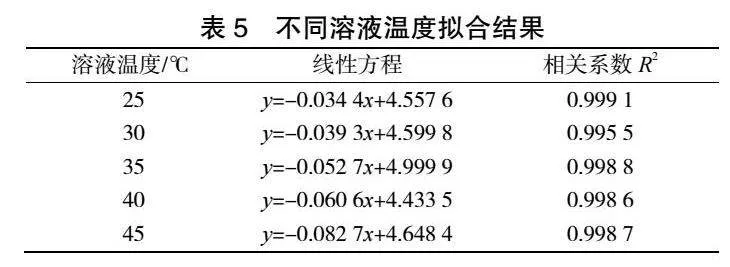
由圖8和表5可見,ln(CA)與t存在良好線性關系,相關系數R2可以達到0.99以上。隨著體系反應溫度升高,底物活度增加,使其參與反應的機會增多,進而促進反應速率明顯提高。當溶液溫度達到45℃,反應速率常數k最大可達到0.0827。
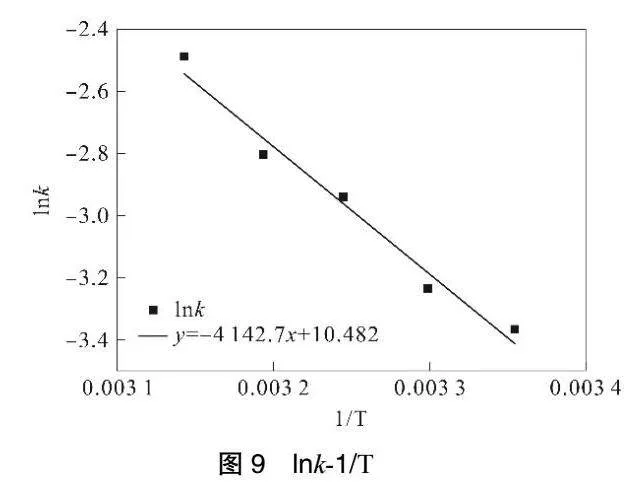
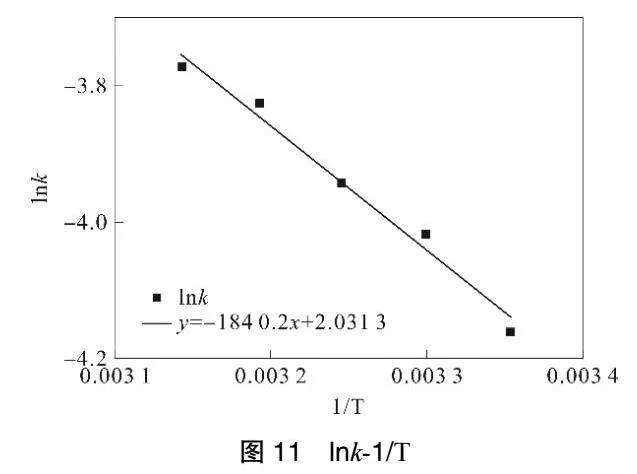
由圖9可知,lnk與1/T擬合的相關系數R2為0.9787,lnk與1/T有良好的線性關系,說明反應速率常數與絕對溫度的關系符合阿倫烏尼斯方程[19]:
式中:k—反應速率常數,min-1;
k0—頻率因子常數,min-1;
Ea—反應活化能,J·mol-1;
R—氣體常數,8.314 J·mol-1·K-1;
T—絕對溫度,K。
對(1)式取對數得:![]()
將實驗數據帶入(2)式,解得反應活化能Ea=3.4442×104J·mol-1,k0=3.5667×104min-1,進而得到溫度與甲基橙降解反應速率方程為:
2.4.2 COD降解反應速率
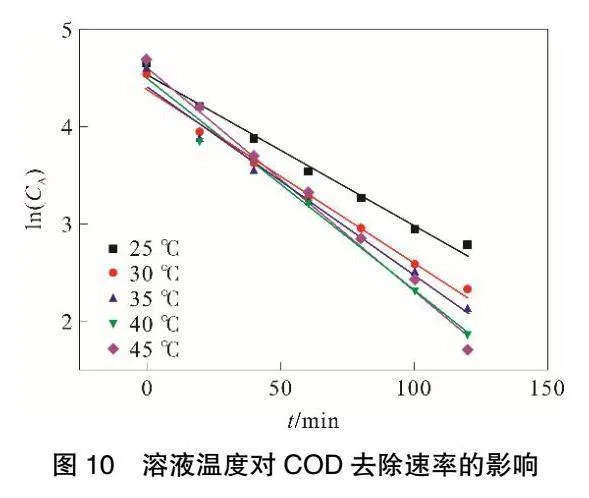
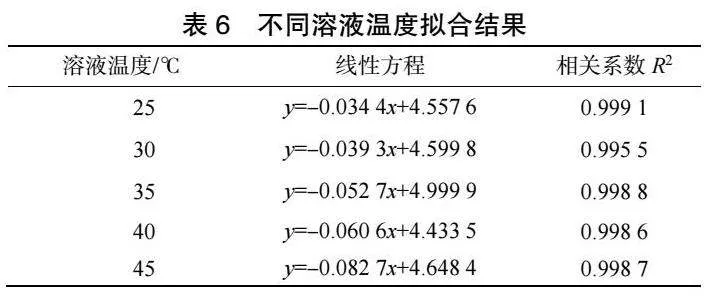
由圖10和表6可見,ln(CA)與t存在良好線性關系,相關系數R2可以達到0.98以上。
隨著體系反應溫度升高,底物活度增加,使其參與反應的機會增多,進而促進反應速率明顯提高。當溶液溫度達到45℃,反應速率常數k最大可達到0.023。
由圖11可知,lnk與1/T擬合的相關系數R2為0.9832,lnk與1/T有良好的線性關系,說明反應速率常數與絕對溫度的關系符合阿倫烏尼斯方程,同理將實驗數據帶入(2)式,解得反應活化能Ea=1.5299×104J·mol-1,k0=7.62min-1,進而得到溫度與COD降解反應速率方程為:
3 降解機理初探
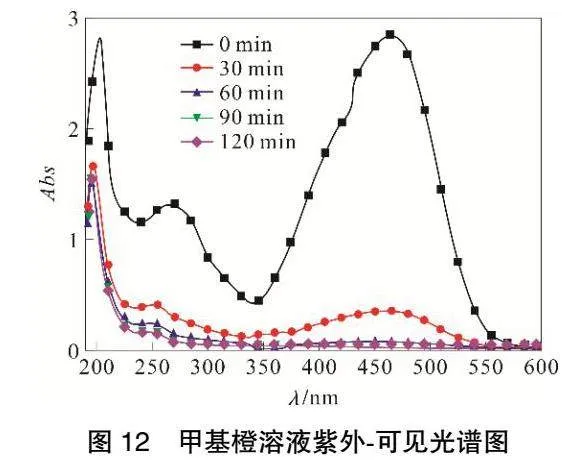
在極板間距為6cm,外加電壓為10.12V、曝氣量為313mL·min-1、電解質投加量為3.195g·L-1,初始pH為7,甲基橙質量濃度為100mg·L-1,粒子電極投加量為50g·L-1,溶液溫度為45℃,進行實驗。一次實驗連續進行2 h,每30min取一次樣。借助紫外-可見分光光度計在190~600nm 范圍內進行掃描。
由圖12可知,在0min時,463nm處出現強吸收峰,這是甲基橙分子中偶氮結構的n-π*躍遷引起的,屬于甲基橙的偶氮鍵特征吸收峰[20];275nm處的吸收峰是由苯環共軛體系的π-π*躍遷引起的,屬于甲基橙分子中苯環的特征吸收峰;203nm處吸收峰由π-π*躍遷和苯環共振重疊引起的E2吸收帶。隨著降解反應進行,463nm處吸收峰迅速降低,最后波峰消失,此時甲基橙溶液顏色從橙色,變為黃色,最終變為無色,表明甲基橙分子結構中的偶氮鍵被氧化破壞,甲基橙分子中-SO3Na 和-N(CH3)2發色基團也脫落,使n-π*的躍遷逐漸消失[21]。30min時,463nm處吸收峰很小,說明甲基橙剩余較少;275nm的吸收峰向前推移至250nm處,說明苯系物苯環上的支鏈在逐漸斷裂。30min之后,463nm處吸收峰幾乎消失,203nm處吸收峰降低幅度很小,60min后基本保持不變,這是由于前期氧化形成中間產物苯環結構較多且穩定,很難被氧化降解[22-23]。
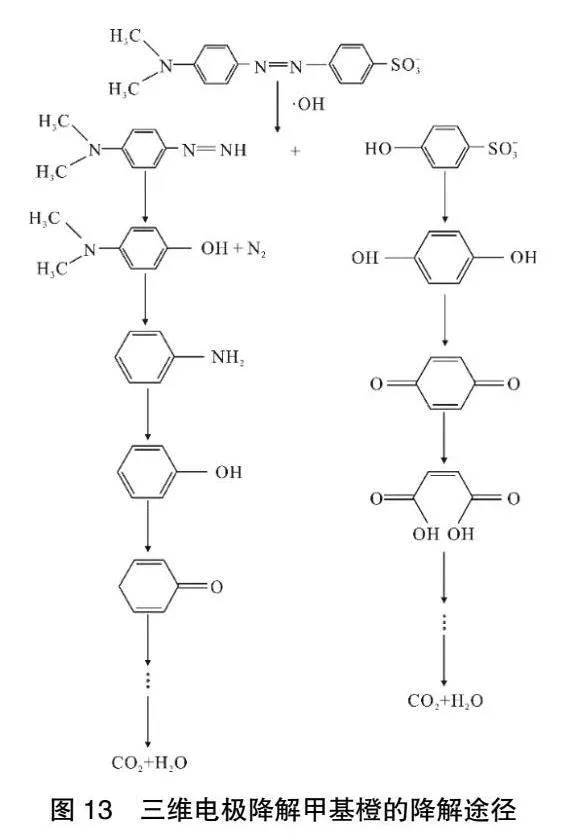
初步推測甲基橙降解途徑如圖13所示。
該三維電極系統為中性,則甲基橙為偶氮式結構。由Fenton反應產生的強氧化性物質·OH,強氧化物與甲基橙接觸首先破環發色基團,生成偶氮苯和硫酸基苯,并且通過攻擊甲基橙分子中的偶氮鍵。強氧化物攻擊偶氮鍵導致偶氮苯分子從中間斷開,分解為多種芳香類物質;接著·OH進一步攻擊苯環大π鍵,生成苯酚、對苯二酚、鄰苯二酚;然后對苯二酚繼續反應生成苯醌[24]。苯醌會在強氧化物質攻擊下,環被打開降解為乙二酸、丁二酸等物質,最終被礦化為CO2和H2O。
4 結 論
1)對負載型三維電極降解甲基橙和COD進行動力學分析。結果表明,甲基橙和COD降解符合一級反應動力學。粒子投加量為50g·L-1,溶液pH為7,溶液溫度為45℃時反應速率常數最大。溫度與甲基橙降解反應速率方程為:k=3.5667×104exp(-3.4442×104/(RT));溫度與甲基橙降解反應速率方程為:k=7.62exp(-1.5299×104/(RT))。
2)通過紫外-可見光譜圖可以看出:463nm處吸收峰迅速降低,最后波峰消失,表明甲基橙分子結構中的偶氮鍵被氧化破壞;275nm的吸收峰向前推移至250nm處,說明苯系物苯環上的支鏈在逐漸斷裂;203nm處吸收峰下降幅度很小,60min后基本保持不變,這是由于前期氧化形成中間產物苯環結構較多且穩定。
3)初步推測反應機理:甲基橙降解為偶氮式降解,強氧化物與甲基橙接觸首先破環發色基團,并且通過攻擊甲基橙分子中的偶氮鍵導致偶氮苯分子從中間斷開,分解為多種芳香類物質;接著·OH進一步攻擊苯環大π鍵,生成苯酚、對苯二酚、鄰苯二酚、苯醌等中間產物,最終被礦化為CO2和H2O。
參考文獻:
[1]許青枝,王翔,鄭瑩瑩. 印染廢水水質特征及處理技術探討[J]. 能源與節能, 2022, 2: 90-91.
[2]王開花. 印染廢水處理技術現狀及發展趨勢[J]. 資源節約與環保, 2020, 12: 79-80.
[3]MA J, GAO M, SHI H, et al. Progress in research and development of particle electrodes for three-dimensional electrochemical treatment of wastewater: a review[J].EnvironSciPollutRes Int. 2021,28(35):47800-47824.
[4]時曉寧, 王培京, 王茂, 等.粒子電極在廢水處理中的應用研究進展[J].四川環境, 2020, 39(5):179-185.
[5]徐斌, 張書陵, 高月香, 等. 石墨烯三維電極-電Fenton 系統降解甲基橙[J]. 中國環境科學, 2020, 40(10):4385-4394.
[6]張添淇. 三維電極電催化降解甲基橙模擬廢水的研究[D]. 沈陽:沈陽建筑大學,2022.
[7]莫再勇, 李香源, 曾玉鳳. 鉻、鐵二元修飾的高效碳基催化劑及其三維電極催化降解甲基橙模擬廢水[J]. 玉林師范學院學報(自然科學), 2019, 40(5):71-76.
[8]李雪, 馮巖, 于衍真. 三維電極體系在廢水處理中的應用[J]. 中國資源綜合利用,2016,34(4):29-33.
[9]WANG CT, HU JL, CHOU WL, et al.Removal of color from real dyeing wastewater by Electro-Fenton technology using a three-dimensional graphite cathode[J].Journal of Hazardous Materials, 2008, 152(2):601-606.
[10]宋衛鋒,林美強,倪亞明. DSA 類電極催化降解硝基苯動力學及機理的研究[J]. 環境科學研究,2002(5):10-13+21.
[11]蘇博. 三維電極降解偶氮廢水的研究[D]. 沈陽:沈陽建筑大學,2020.
[12]白忠騰. 三維電-Fenton粒子電極制備及其處理焦化廢水研究[D]. 鞍山:遼寧科技大學,2021.
[13] TANGWZ, HUANGC. Effect of chlorine content of chlorinated phenols on their oxidationkinetics by Fenton’s reagent[J].Chemosphere,1996,33(8):1621-1635
[14] ZHOU M, LEIL. Electrochemical regeneration of activated carbon loaded with p-nitrophenolin a fluidized electrochemical reactor[J].ElectrochimActa, 2006,51(21):4489-4496
[15]李沅知. 活性炭粒子電極改性及其三維電極反應器處理廢水的研究[D]. 長沙:中南大學, 2014.
[16]張程蕾,滕厚開,韓恩山, 等. Fe3O4-MnO2/Gh的制備及其對氯乙酸的降解研究[J]. 工業水處理, 2021, 41(1):43-48.
[17]張顯峰. SnO2/Fe3O4粒子電極的制備及三維電極體系電催化性能研究[D]. 中國石油大學, 2017.
[18]WANGZY, LIJF, HEXL, et al. Organic Pollutants Removal Performance and Enhanced Mechanism Investigation of Surface-Modified Steel Slag Particle Electrode [J].En8c9fe22a9e8b87fbfbf4674744cdd06f7fd6cec1c85529d4a56e77f4aeaec885vironmental Progress & Sustainable Energy, 2018, 58(1): 1-7.
[19] SUN S P, ZENG X, LEMLEYA T. kinetics and mechanism of carbamazepine degradation by a modified Fenton-like reaction with ferric-nitrilotriacetatecomplexes[J].Journal of Hazardous Materials, 2013,(252/253):155-165.
[20] ZHAO WT, HUANG X, LEEDJ. Enhanced treatment of coke plant wastewater using an anaerobic anoxic oxicmembrane bioreactor system[J].Separation & Purification Technology,2009,66(2):279-286.
[21]吳正雷,彭文博,董凱,等. Ni 基催化劑處理甲基橙廢水動力學及機理研究[J]. 當代化工,2020,49(5):850-853.
[22]孫宏, 張澤, 潘珊珊. 負載型納米Mn-Fe 雙金屬配合物的制備及催化性能[J]. 化學工程, 2016, 44(9): 6-10.
[23]孫宏, 張澤, 于祥輝. ZnFe2O4/ZnO復合材料光催化氧化水中甲基橙[J]. 印染助劑, 2018, 35(9): 44-47.
[24]湯茜,王艷華,遲赫. 電Fenton法降解甲基橙的機理研究[J]. 安全與環境工程, 2011,18(5):37-41.

