低溫脅迫下工業大麻中大麻二酚含量和差異表達基因分析

摘要:為研究低溫脅迫條件下龍大麻6號大麻二酚(CBD)積累的變化規律和合成途徑分子調控機制,以不同低溫脅迫和常溫條件處理大麻葉片為材料,測定CBD含量,同時對上述材料進行轉錄組測序。通過對不同低溫脅迫和常溫條件處理大麻葉片CBD含量變化,發現0 ℃處理組(T1)CBD含量最高,其他低溫處理組5 ℃處理組(T2)、15 ℃處理組(T3)、20 ℃處理組(T4)大麻葉中CBD含量比常溫組(CK)CBD含量低。轉錄組數據中CBD合成途徑關鍵基因差異表達分析顯示,0 ℃處理組CBD合成途徑中大部分關鍵基因表達量都顯著上調,同時其他溫度脅迫條件下CBD合成途徑中大部分關鍵基因表達量也都有變化。0 ℃能夠顯著提高龍大麻6號CBD的合成,提高植株體內CBD合成途徑中關鍵基因表達量,從而使其更好地適應低溫環境。
關鍵詞:大麻;大麻二酚;低溫脅迫;差異表達基因
中圖分類號:S563.301 文獻標志碼:A
文章編號:1002-1302(2024)15-0072-13
收稿日期:2023-11-17
基金項目:黑龍江省省屬科研院所科研業務費項目(編號:CZKYF2023-1-B007)。
作者簡介:王文重(1979—),女,博士,副研究員,主要從事工業大麻遺傳育種研究。E-mail:wenwen0331@163.com。
通信作者:張利國,博士,研究員,主要從事麻類遺傳基礎研究。E-mail:zlg86@aliyun.com。
大麻(Cannabis sativa L.)是一種高附加值的多用途經濟作物,屬于桑科大麻屬,廣泛分布于世界各地,在我國有著悠久的栽培歷史[1-3]。目前國內已審定或認定或登記的大麻品種,都是工業大麻,不含或含有極低神經成癮性物質,不具毒品利用價值[4]。工業大麻中存在多種大麻素,主要在大麻葉和花中,大麻二酚(cannabidiol,CBD)是其中已被聯合國世界衛生組織認可的健康成分,研究表明,CBD無致幻成癮性,且具有抗驚厥痙攣、癲癇、鎮痛、焦慮、抗菌抗炎、抗麻醉和神經系統保護等藥理功效,廣泛應用于醫藥和化妝品領域[5-7]。在CBD產業帶領下,工業大麻產業有望在未來幾年實現強勁增長,到2025年CBD產業預計將達到千億美元級別[8]。低溫是影響植物正常生長的主要障礙之一,大多數植物對低溫較為敏感,一旦遭遇低溫脅迫,將導致生長受限,產量下降影響植物的生長發育和次生代謝產物的合成[9]。溫度是調控植物生長發育和代謝物質積累的重要條件,國內外關于溫度對工業大麻生長和CBD積累研究的相關報道較少。黑龍江省地處我國北方,春季播種時間溫度較低,對大麻的生長和CBD含量會造成一定的影響。因此需要開展大麻對低溫脅迫響應方面的研究,了解大麻在CBD含量變化規律和合成途徑分子機制。目前,黑龍江省工業大麻原料來源多樣,溫度與CBD含量、原料產率存在密切的關系,掌握溫度與大麻CBD有效成分含量之間的關系,也為今后利用植物基因工程技術提高工業大麻的品質奠定研究基礎,將有效提升花葉用工業大麻產業的市場競爭力與經濟效益。
1 材料與方法
1.1 植物材料與處理
試驗大麻品種為龍大麻6號,由黑龍江省農業科學院經濟作物研究所提供。CK代表常溫(25 ℃)處理組;T1代表0 ℃(處理1)處理組;T2代表5 ℃(處理2)處理組;T3代表15 ℃(處理3)處理組;T4代表20 ℃(處理4)處理組。
試驗材料2021年種植于黑龍江省農業科學院經濟作物研究所實驗室人工氣候溫箱內,培養條件設定為相對濕度80%、光—暗周期14 h—10 h,全程充分供水。分別在0 ℃(處理1)、5 ℃(處理2)、15 ℃(處理3)、20 ℃(處理4)、CK(25 ℃)下進行培養。待植株長大至花期進行取樣,為了消除個體差異,選擇植株長勢、外觀表型、部位盡量一致的大麻葉取樣,每株大麻取5~8張葉片,3次生物學重復,用錫箔紙包好后于-80 ℃保存備用。
1.2 大麻二酚(CBD)含量測定
分別取不同環境下培養后的鮮大麻葉經85 ℃烘3 h并粉碎后的大麻葉0.200 g,加入甲醇4 mL,采用常溫超聲提取,提取時間為10 min,靜置1 h。4 000 r/min 離心5 min,取上清液轉移至10 mL容量瓶中進行定容。使用2 mL注射器裝樣過 0.45 μm 有機濾膜注射至液相進樣瓶,采用HPLC色譜條件分析CBD含量。
1.3 RNA的提取及cDNA文庫的合成
使用全式金生物技術有公司試劑盒分別提取處理組和對照組總RNA,并用Bioanalyzer 2100及Agilent RNA6000 Nano Kit對總RNA的完整性和純度進行分析。
測序由哈爾濱博泰生物科技有限公司完成,使用Illumina HiSeqTM X TEN測序儀進行測序。使用HISAT2將clean reads比對到參考基因組(https://gofile-3663784363.cn4.quickconnect.cn/fsdownload/QZM0L6zNu/Cannatonic.genome.fasta.gz)。篩選差異表達基因條件為:表達差異倍數 |log2FoldChange|>1,顯著性P<0.01。
1.4 qRT-PCR驗證
使用全式金生物技術有公司試劑盒提取總RNA后反轉錄為cDNA,利用Primer 5軟件設計引物,采用Actin為內參基因(表1)。
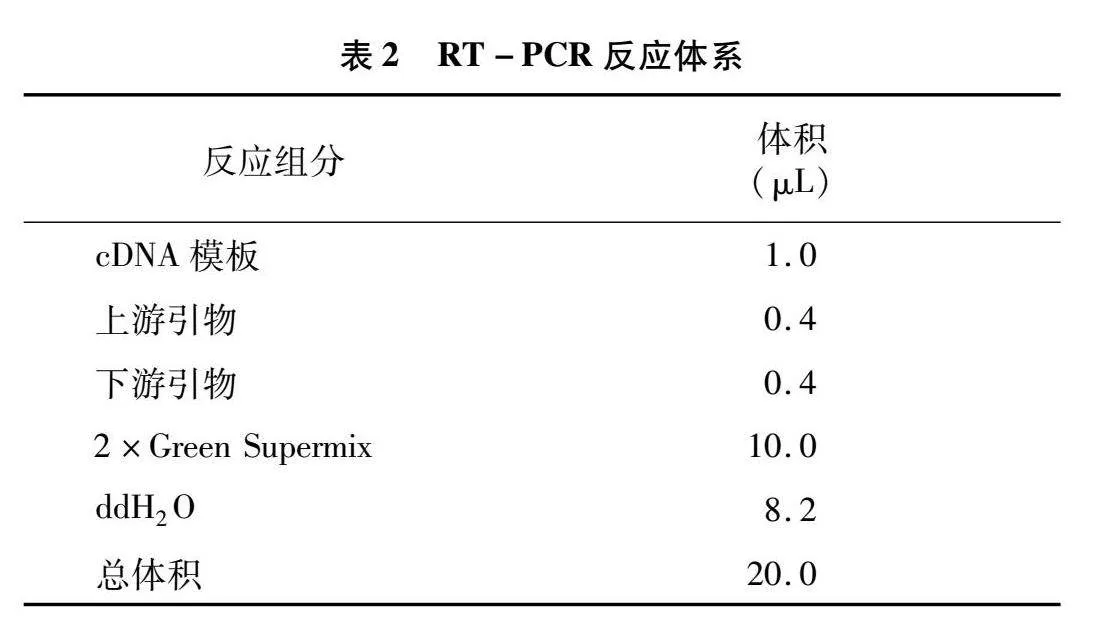
應用全式金公司熒光定量試劑盒進行熒光定量試驗,反應體系見表2。反應程序為:94 ℃ 30 s;94 ℃ 5 s,57 ℃ 15 s,72 ℃ 10 s,40個循環。應用2-ΔΔCT方法計算相對定量結果。相關基因qRT-PCR引物如表1所示。對篩選的關鍵基因進行 qRT-PCR,測定相對表達量,比熒光定量試驗結果與轉錄組數據趨勢是否一致。
1.5 數據分析
每組試驗重復3次,使用Excel軟件處理數據及對結果作圖,SPSS 25.0軟件對數據進行顯著性分析(α=0.05)。
2 結果與分析
2.1 不同溫度處理大麻二酚(CBD)含量變化
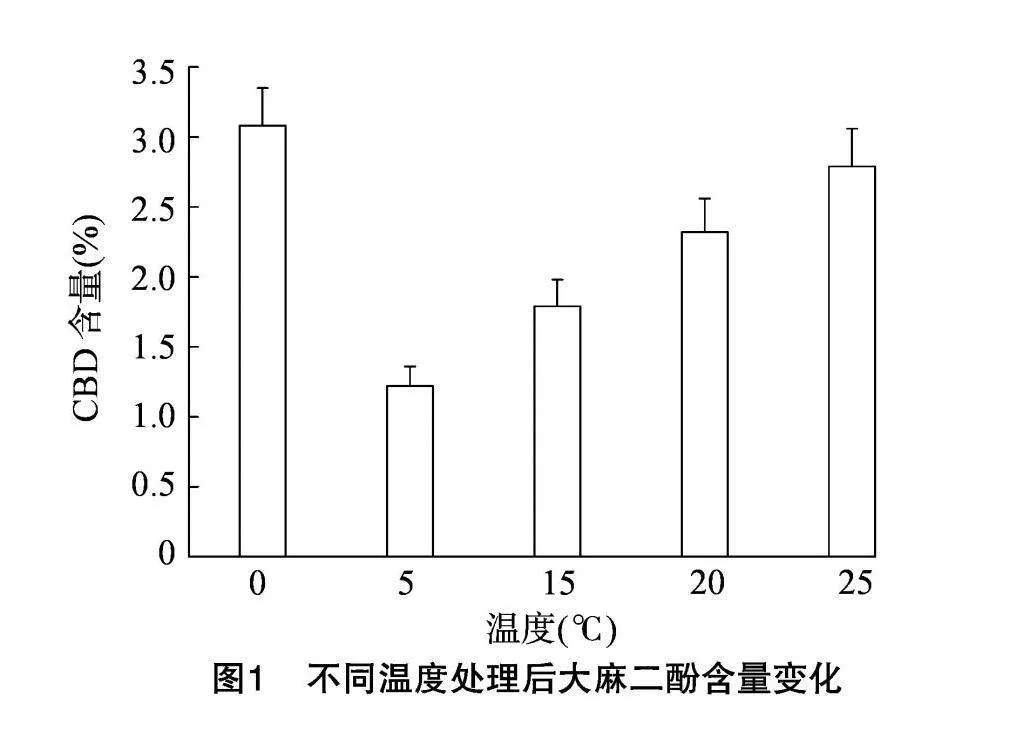
由圖1可知,0 ℃處理后CBD含量最高,5 ℃處理后含量最低。處理溫度從5 ℃開始,隨著處理溫度升高,CBD含量逐漸增加,但15℃和20℃處理后,CBD含量差異不顯著。
2.2 轉錄組分析
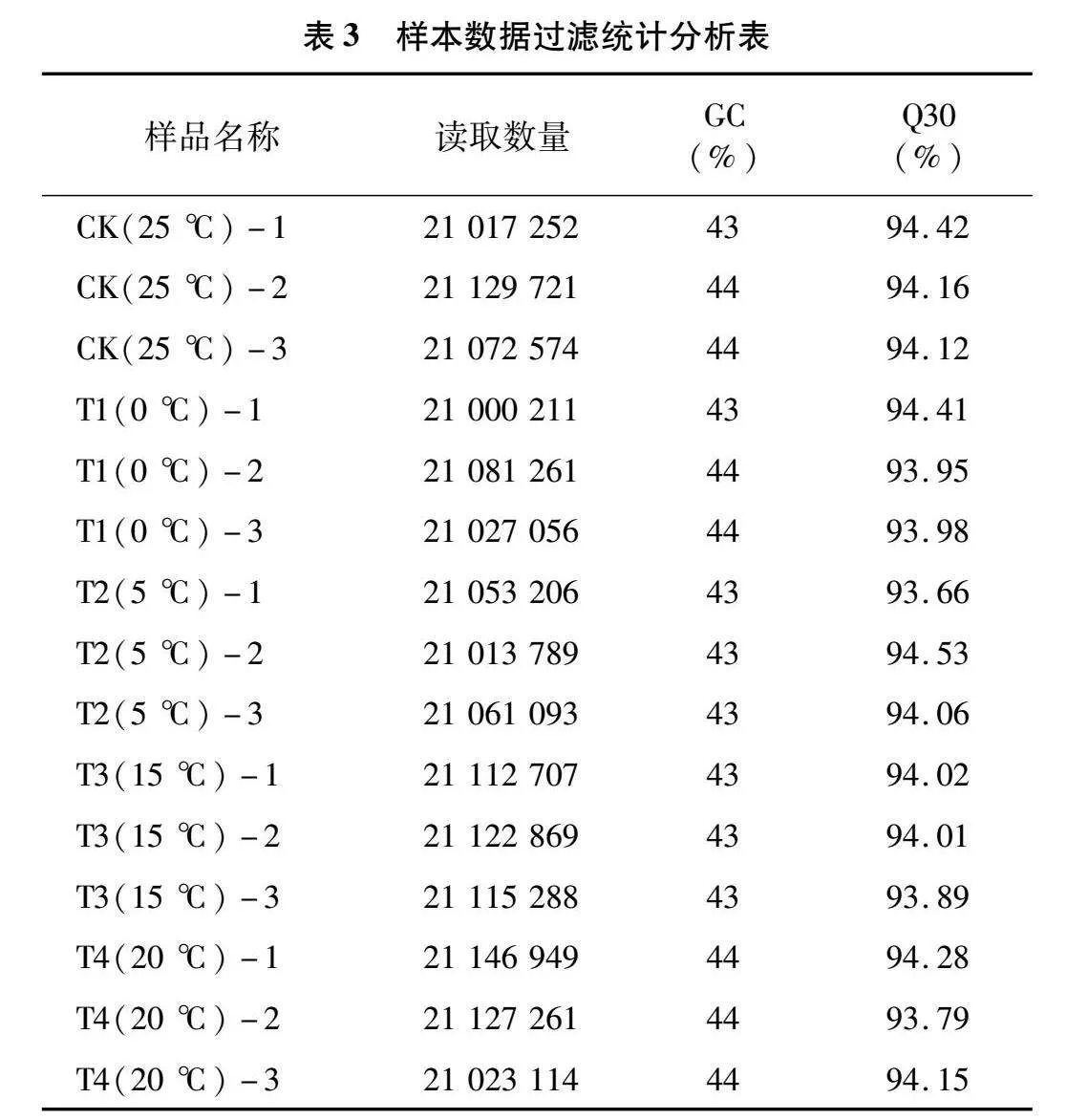
2.2.1 數據整理 工業大麻植株經過不同溫度處理之后,進行相應的轉錄組測序分析。對每個樣品的下機數據(Raw Data)分別進行統計,包括Q30(%)、模糊堿基和GC(%)。統計結果如表3所示,Q30均在90%以上,說明轉錄組測序數據質量較好,可用于進一步分析。
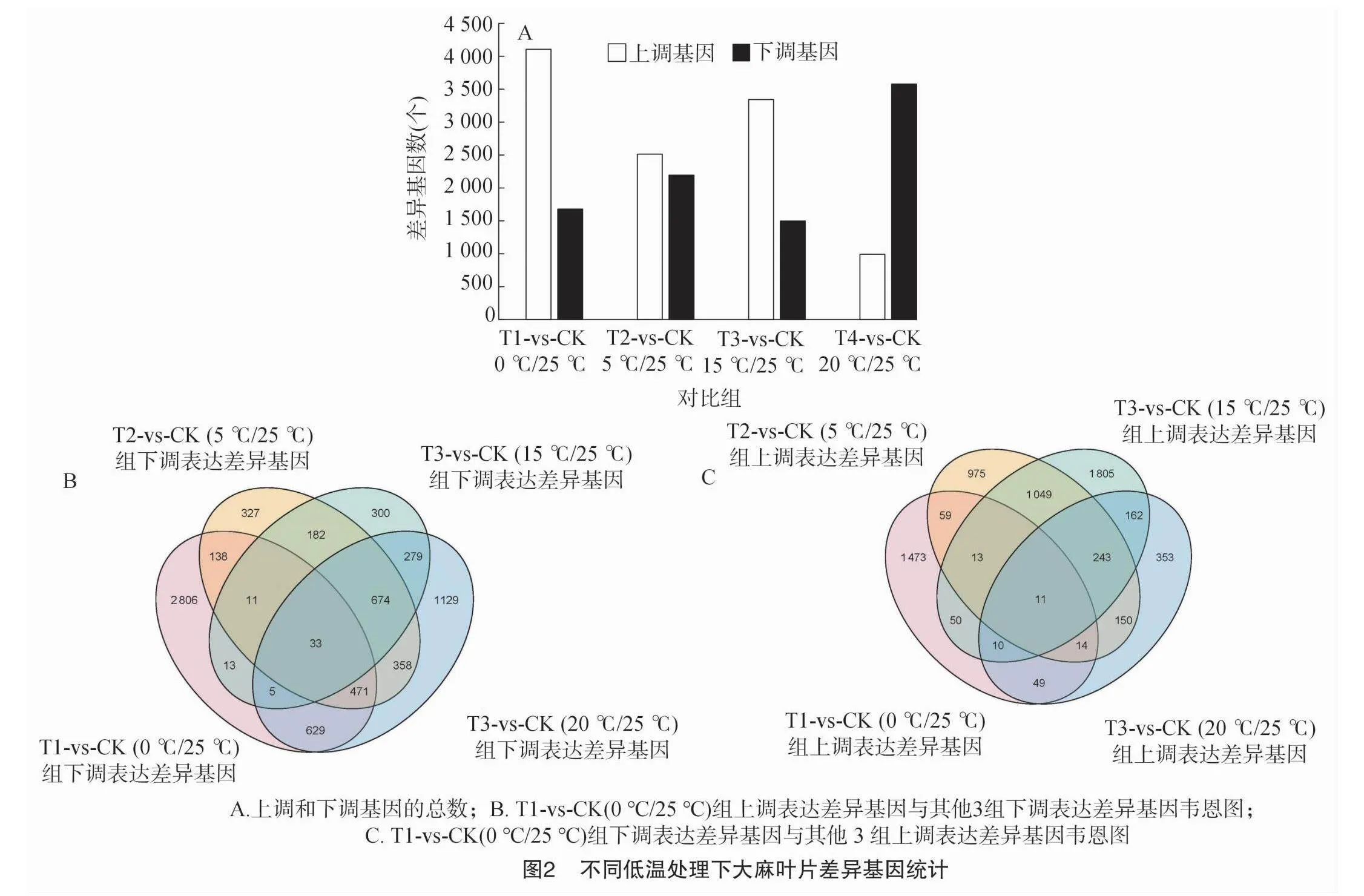
2.2.2 差異基因表達及富集分析 edgeR以count計數為起始數據,經過TMM標準化后,進行差異表達分析,結果如圖2所示。T1與對照組(CK)之間共有5 785個差異基因,其中4 106個上調基因,1 679 個下調基因;T2與對照組(CK)之間共有 4 707 個差異基因,其中2 513個上調基因,2 194個下調基因;T3與對照組(CK)之間共有48 440個差異基因,其中3 343個上調基因,1 497個下調基因;T4與對照組(CK)之間共有4 570個差異基因,其中992個上調基因,3 578個下調基因(圖2-A)。結果顯示,不同低溫處理后,T1-vs-CK(0 ℃/25 ℃)、T2-vs-CK(5 ℃/25 ℃)和T3-vs-CK(15 ℃/25 ℃)上調差異表達基因數大于下調差異表達基因數。T4-vs-CK(20 ℃/25 ℃)下調差異表達基因數遠遠大于上調差異表達基因數(圖2-A)。整體看,處理溫度從0 ℃逐漸升高至20 ℃,不同處理組與對照組相比上調基因數逐漸減少,下調基因數逐漸增加,其中T4-vs-CK(20 ℃/25 ℃)組下調基因數是上調基因數的3.6倍。在4個比較組中,T1-vs-CK(0 ℃/25 ℃)組上調表達差異基因,與T2-vs-CK(5 ℃/25 ℃)、T3-vs-CK(15 ℃/25 ℃)和T4-vs-CK(20 ℃/25 ℃)組下調基因進行比較,結果顯示33個基因為共有的顯著差異基因(圖2-B)。T1-vs-CK(0 ℃/25 ℃)組下調表達差異基因,與T2-vs-CK(5 ℃/25 ℃)、T3-vs-CK(15 ℃/25 ℃)和T4-vs-CK(20 ℃/25 ℃)組上調基因進行比較,結果顯示11個基因為共有的顯著差異基因(圖2-C)。這些結果表明,工業大麻在應對不同的低溫脅迫時,可以觸發相似的反應,同時處理1可能還存在獨特的反應和機制。
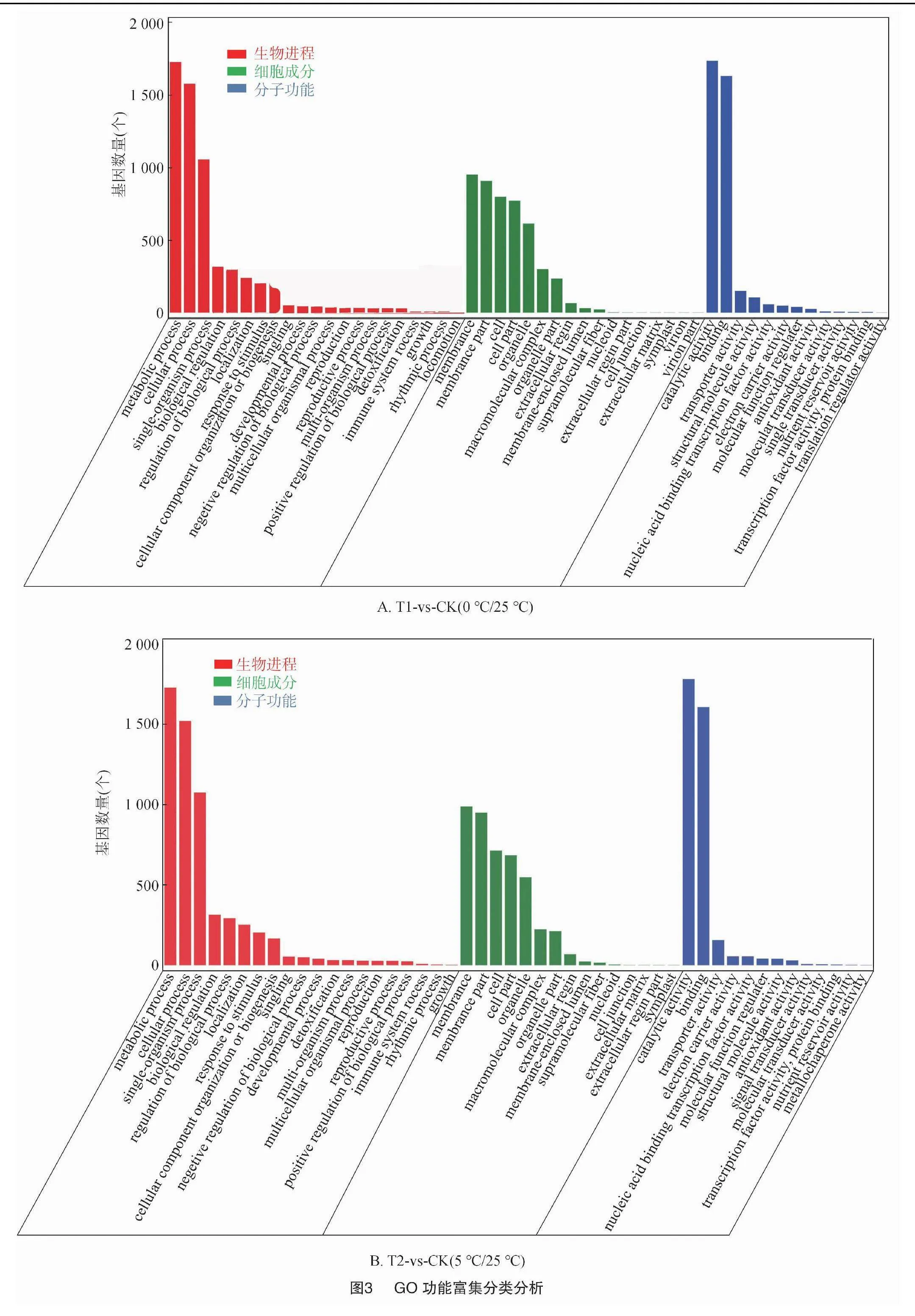
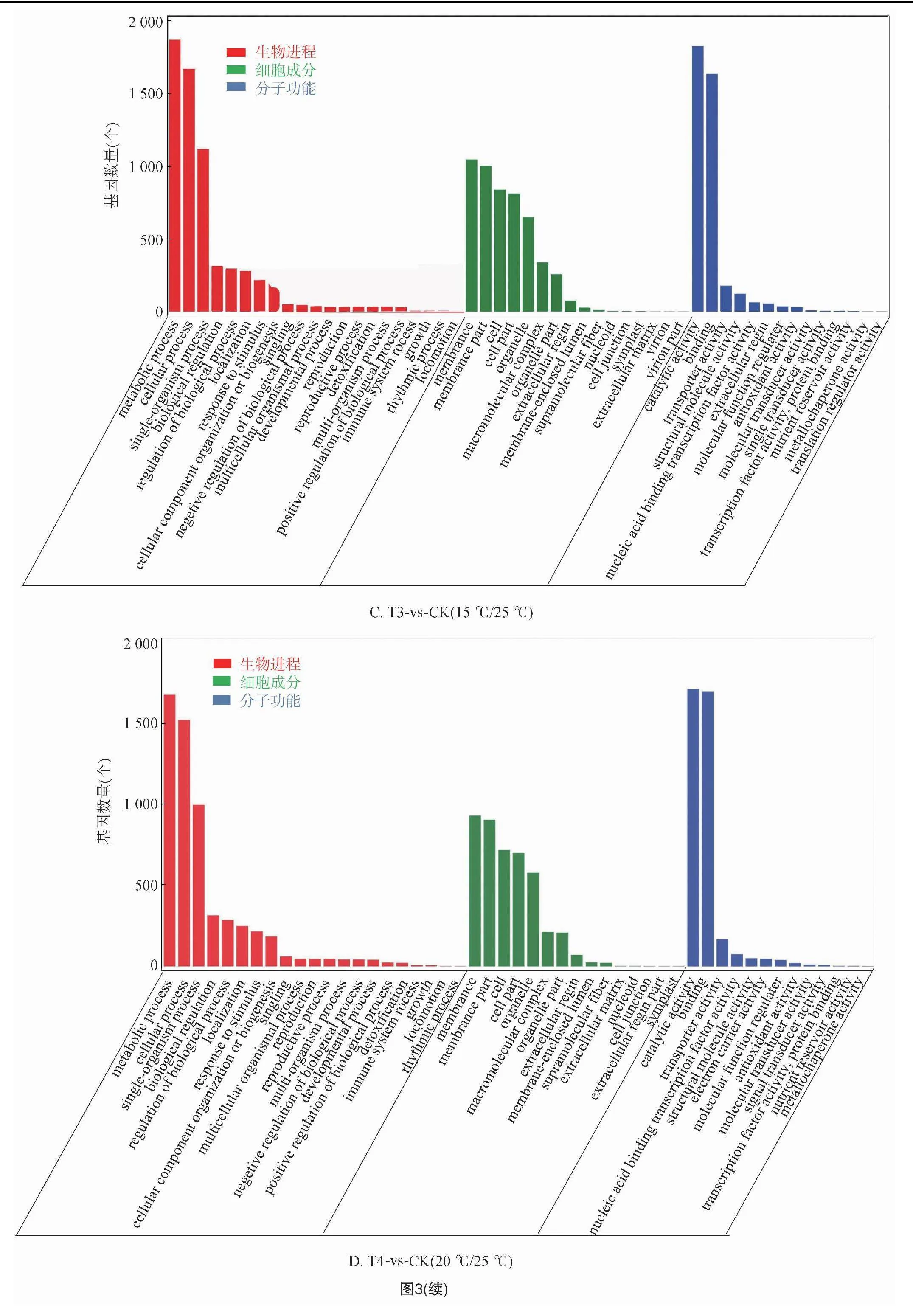
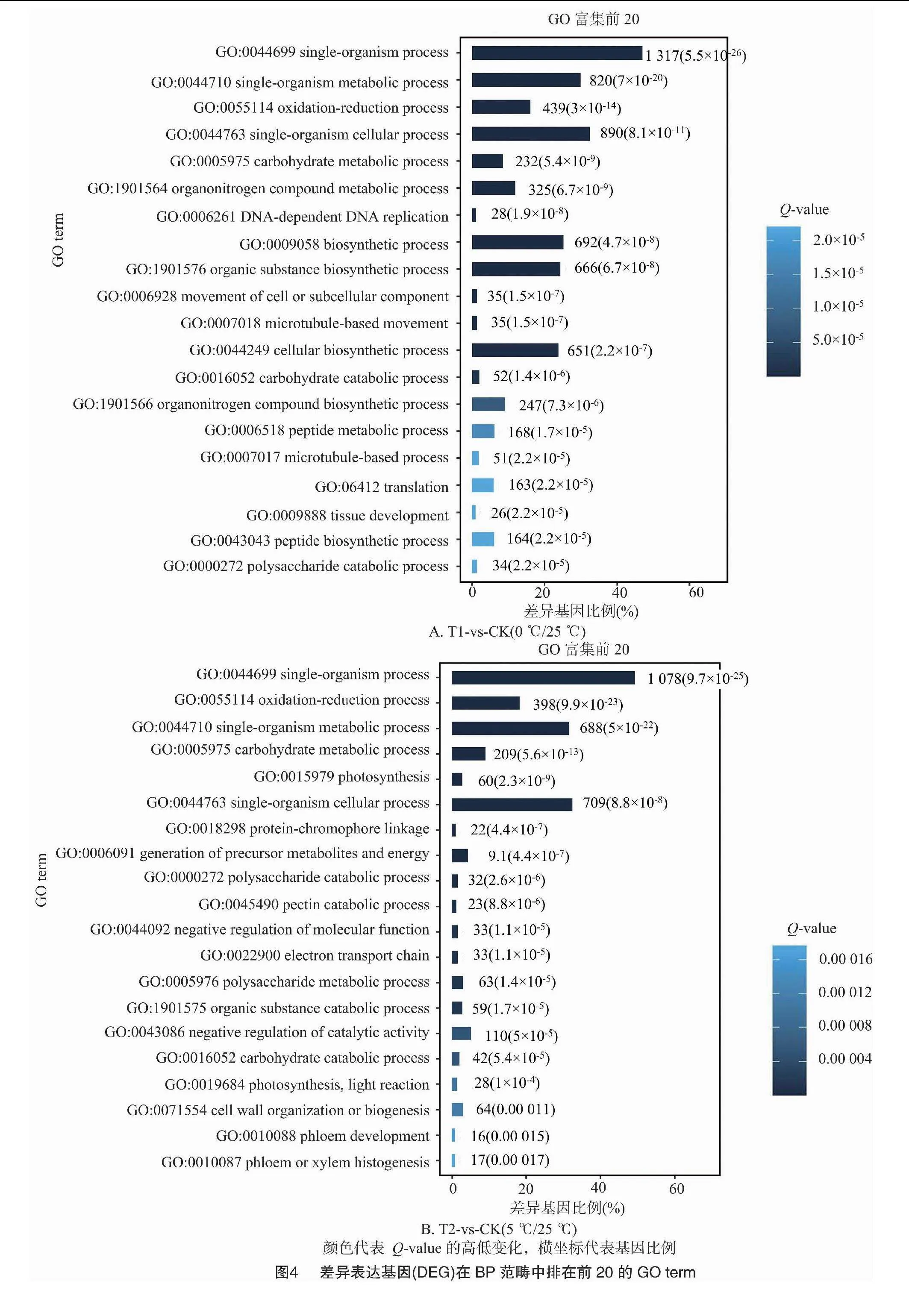
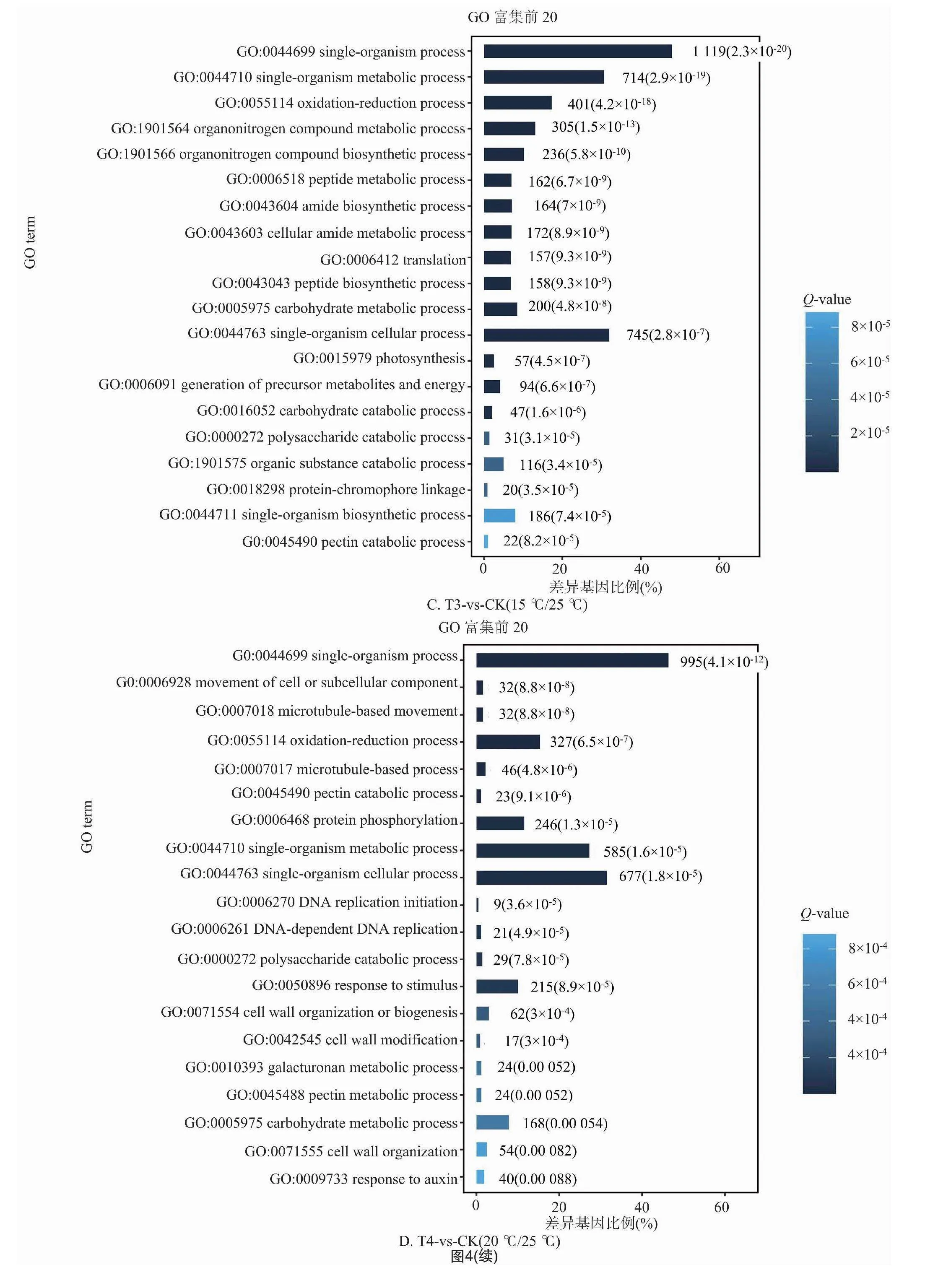
2.2.3 差異基因的GO富集分析 對不同溫度處理工業大麻差異表達基因所具有的功能進行GO功能富集分析,結果發現4組間的差異表達基因分別富集55、48、51、49條GO terms中,這些GO terms屬于三大功能類別:細胞成分(CC)、分子功能(MF)、生物進程(BP)。4組分析獲得的GO terms很相似。CC中最豐富的成分被歸類為膜(GO:0016020,membrane)、細胞膜組分(GO:0044425,membrane part)以及細胞(GO:0005623,cell)。在MF中富集最多的2條GO terms是催化活性(GO:0003824,catalytic activity)和結合(GO:0005488,binding)。在BP中富集最多的3條GO terms是代謝過程(GO:0008152,metabolic process)、細胞進程(GO:0009987,cellular process)和單一有機體過程(GO:0044699,single-organism process)(圖3)。
在工業大麻葉片相應溫度脅迫處理的基因功能富集中,在BP分類中排在前20的GO terms中主要與合成和代謝相關,包括單一生物過程(GO:0044699,single-organism process)、單生物代謝過程(GO:0044710,single-organism metabolic process)、氧化還原過程(GO:0055114,oxidation-reduction process),此外還有單生物細胞過程(GO:0044763,single-organism cellular process)、細胞或亞細胞成分的運動(GO:0006928 movement of cell or subcellular component)、有機氮化合物代謝過程(GO:1901564,organonitrogen compound metabolic process)、碳水化合物代謝過程(GO:0005975,carbohydrate metabolic process)、果膠分解代謝過程(GO:0045490,pectin catabolic process)(圖4)。
2.2.4 差異共表達基因的GO分析
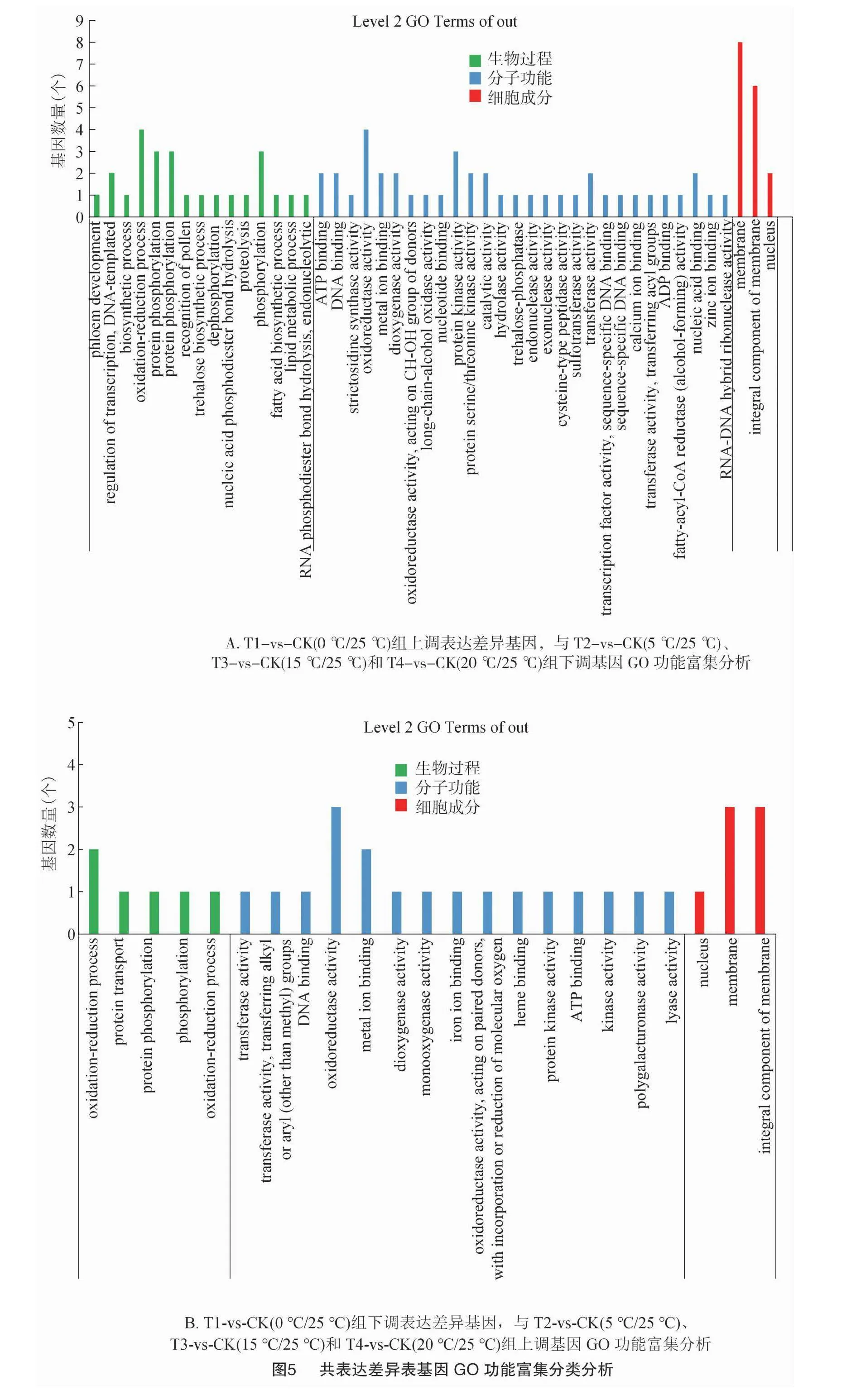
T1-vs-CK(0 ℃/25 ℃)組上調表達差異基因,與T2-vs-CK(5 ℃/25 ℃)、T3-vs-CK(15 ℃/25 ℃)和 T4-vs-CK(20 ℃/25 ℃)組下調基因共表達的33個基因進行GO分析發現,CC中最豐富的成分被歸類為膜(GO:0016020,membrane),在MF中是氧化還原酶活性(GO:0016491,oxidoreductaseactivity),在BP中富集最多的是氧化還原過程(GO:0055114,oxidation-reduction process)(圖5-A)。T1-vs-CK(0 ℃/25 ℃)組下調表達差異基因,與T2-vs-CK(5 ℃/25 ℃)、T3-vs-CK(15 ℃/25 ℃)和T4-vs-CK(20 ℃/25 ℃)組上調基因共表達的11個基因進行GO分析發現,CC中最豐富最多的2條GO terms是膜(GO:0016020,membrane)和細胞膜組成成分(GO:0016021,integral component of membrane),在MF中是氧化還原酶活性(GO:0016491,oxidoreductase activity),在BP中富集最多的是氧化還原過程(GO:0055114,oxidation-reduction process)(圖5-B)。
2.2.5 差異基因的KEGG富集分析
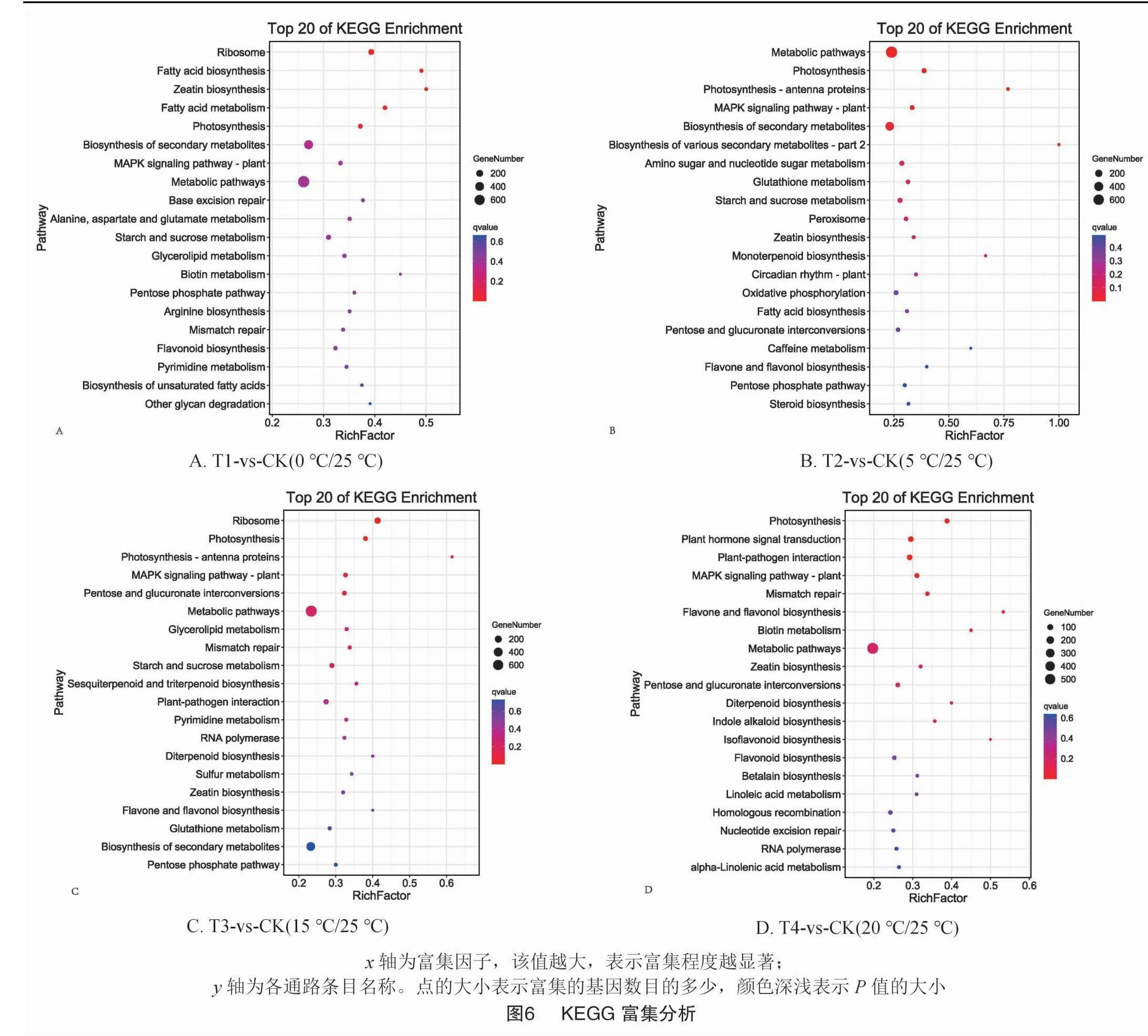
根據差異表達基因的KEGG富集分析結果,分別有139、136、134、127個代謝途徑參與了T1-vs-CK(0 ℃/25 ℃)、T2-vs-CK(5 ℃/25 ℃),T3-vs-CK(15 ℃/25 ℃)和T4-vs-CK(20 ℃/25 ℃)組。主要包括玉米素生物合成(zeatin biosynthesis)、光合作用(photosynthesis)、植物MAPK信號通路(MAPK signaling pathway-plant)、代謝通路(metabolic pathways),還有次級代謝物的生物合成(biosynthesis of secondary metabolites)、淀粉和蔗糖代謝(starch and sucrose metabolism)、黃酮和黃酮醇生物合成(flavone and flavonol biosynthesis)、戊糖磷酸途徑(pentose phosphate pathway),戊糖和葡萄糖酸鹽相互轉化(pentose and glucuronate interconversions)和錯配修復(mismatch repair)。本研究中由不同溫度處理后調控的排在前20的代謝途徑如圖6所示。這些結果表明,在不同溫度處理下,工業大麻的葉片會積極調整自身代謝以增加環境適應的能力。
2.2.6 CBD合成途徑基因響應不同溫度脅迫
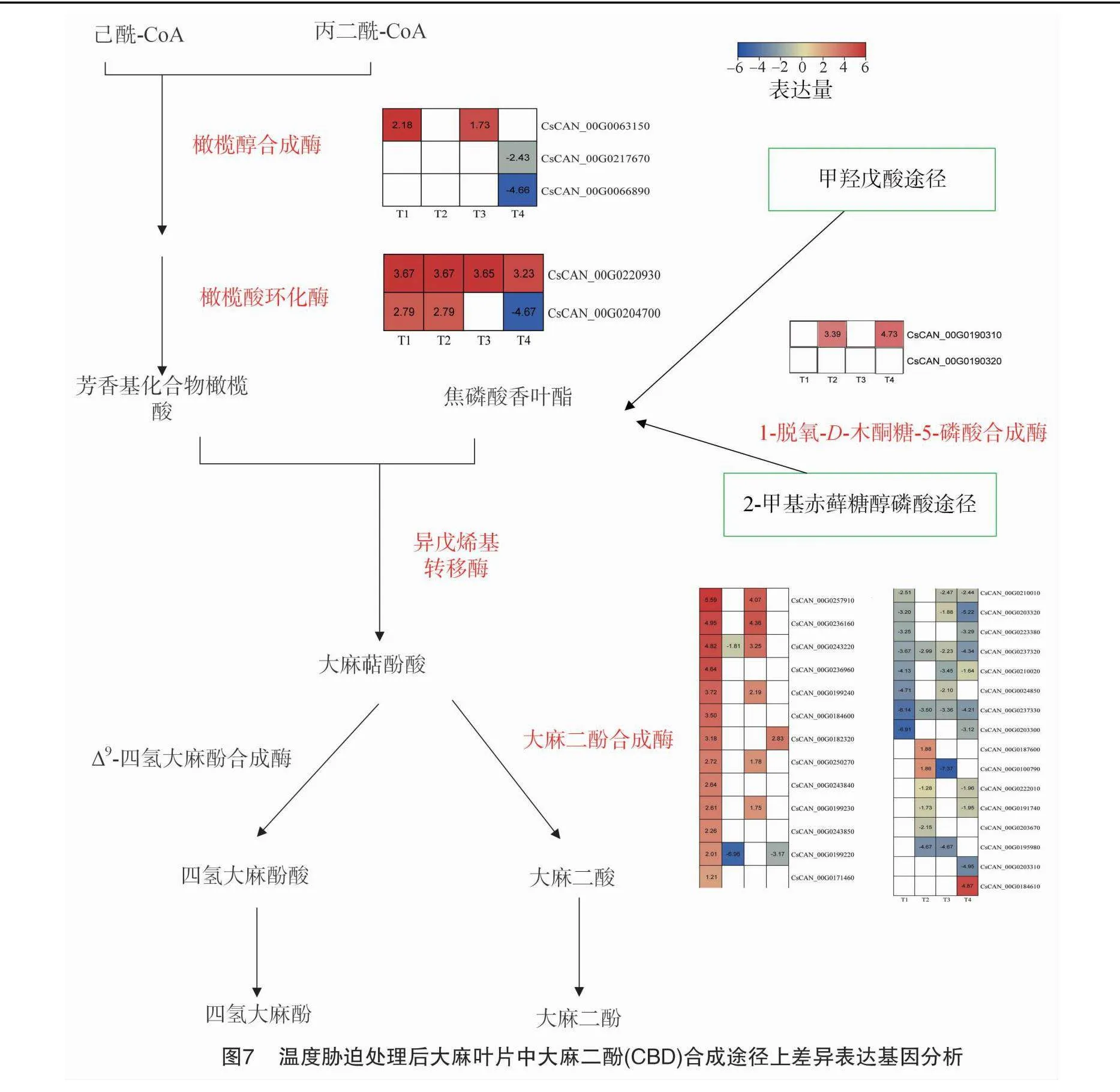
植物大麻素生物合成途徑分為3個催化步驟:(1)聚酮合成(polyketide formation);(2)異戊烯化(prenylation);(3)氧化環化(oxidative cyclization)。本研究中發現低溫脅迫也能夠誘導CBD合成途徑相關基因表達。橄欖醇合成酶(olivetol synthase,OLS)和橄欖酸環化酶(olivetolic acid cyclase,OAC)是聚酮合成途徑中的關鍵酶。在所有的顯著差異表達基因中,有3個基因被注釋為OLS,為T1-vs-CK(0 ℃/25 ℃)組和T3-vs-CK(15 ℃/25 ℃)組共有的差異基因CsCAN_00G0063150,低溫脅迫后顯著上調表達。基因CsCAN_00G0217670和CsCAN_00G0066890在受到低溫脅迫時下調表達(圖7)。基因CsCAN_00G0063150,CsCAN_00G0066890和CsCAN_00G0217670 GO富集為BP條目生物合成的過程(GO:0009058,biosynthetic process)。基因CsCAN_00G0063150還參與查爾酮生物合成過程(GO:0009715,chalcone biosynthetic process)和大麻素生物合成過程(GO:1901696,cannabinoid biosynthetic process)。
在所有的顯著差異表達基因中,1個OAC(CsCAN_00G0220930)為4個溫度處理共有的差異基因,還有另外1個OAC(CsCAN_00G0204700)為T1-vs-CK(0 ℃/25 ℃)組和T2-vs-CK(5 ℃/25 ℃)組共有的差異基因,上述基因在受到低溫脅迫之后均顯著上調表達。
大麻戊烯基轉移酶1(cannabis sativa prenyltransferase 1,CsPT1)和烯戊烯基轉移酶4(cannabis sativa prenyltransferase 4,CsPT4)已被證明在大麻素生物合成途徑中催化產生大麻二酚酸(cannabigerolic acid,CBGA)的步驟,CBGA是產生大麻二酸(CBDA)和四氫大麻酚酸(THCA)的終點酶的底物。在所有的顯著差異表達基因中,有8個基因被注釋為PT,這些基因中沒有響應4個脅迫所共有的差異基因。在T1-vs-CK(0 ℃/25 ℃)組和T3-vs-CK(15 ℃/25 ℃)組溫度脅迫處理下,有5個PT共有的差異基因,除CsCAN_00G0027410之外其他均顯著上調表達(圖7)。T4-vs-CK(20 ℃/25 ℃)溫度脅迫處理下,2個PT均下調表達。其中CsCAN_00G0202190屬于葉綠素生物合成過程(GO:0015995,chlorophyll biosynthetic process)。
大麻二酚合成酶(cannabidiolic acid synthase,CBDAS)催化CBGA單萜部分氧化環化,分別轉化為大麻二酸(cannabidiolicacid,CBDA)。在所有的顯著差異表達基因中,有29個基因被注釋為CBDAS。其中21個CBDAS響應T1-vs-CK(0 ℃/25 ℃)組溫度脅迫處理,10個CBDAS響應T2-vs-CK(5 ℃/25 ℃)組溫度脅迫,14個CBDAS響應T3-vs-CK(15 ℃/25 ℃)組溫度脅迫,13個CBDAS響應T4-vs-CK(20 ℃/25 ℃)組溫度脅迫。除CsCAN_00G0100790之外,其他28個基因GO富集為BP條目氧化還原過程(GO:0055114//oxidation-reduction process)。
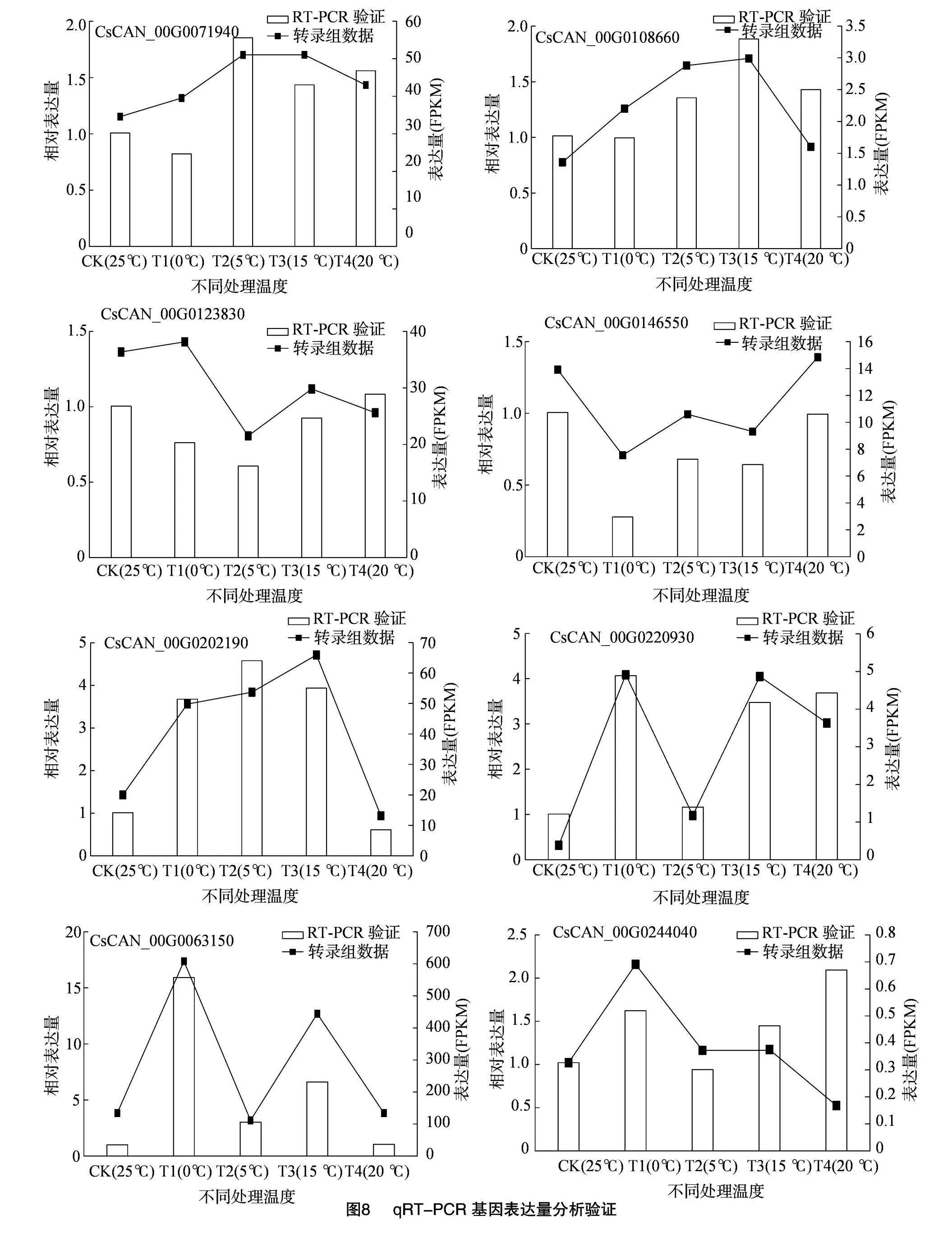
2.2.7 差異基因的qRT-PCR驗證
為了驗證由RNA-seq測序獲得的基因表達模式的準確性,通過qRT-PCR檢測了CBD生物合成途徑中10個DEG的表達模式(圖8)。比較了用qRT-PCR檢測的基因的表達量在T1(0 ℃/25 ℃)、T2(5 ℃/25 ℃)、T3(15 ℃/25 ℃)和T4(20 ℃/25 ℃)4個比較組之間的相對表達情況。所選基因的qRT-PCR檢測的相對表達趨勢與RNA-seq檢測的表達趨勢一致,說明RNA-seq數據是可靠的,重復性好。
3 討論
首先,本研究探討了不同溫度處理下工業大麻植株CBD積累的規律,結果表明:與對照(25 ℃)相比,T1組(0 ℃)處理后CBD含量最高,表明0 ℃對大麻CBD含量有一定的影響。T2組(5 ℃)、T3組(15 ℃)和T4組(20 ℃)與對照常溫組(25 ℃)相比CBD含量均有所下降,其中T2組(5 ℃)CBD含量最低。隨著處理溫度的升高,從5 ℃到20 ℃,CBD含量緩慢上升,但始終低于常溫對照組。由此可見,0 ℃短時處理后會提高大麻CBD含量,但短時 5~20 ℃之間,短時處理會減低大麻CBD含量。可能與植物體對溫度的適應機制有關,在5~20 ℃這個溫度范圍內,持續較低溫度使得工業大麻生長變慢,低溫抑制地上部生長,使得干物質積累量減少[10-11]。
其次,試驗研究了低溫脅迫對工業大麻CBD含量的調控作用,通過不同溫度處理后對大麻葉片進行轉錄組分析,發現在T1-vs-CK組(0 ℃/25 ℃)上調基因數量最多,且差異表達基因上調數遠多于下調數。另外對于差異共表達基因進行GO分析發現,三大功能類別中膜(GO:0016020,membrane)、氧化還原酶活性(GO:0016491,oxidoreductase activity)和氧化還原過程(GO:0055114,oxidation-reduction process)富集最多。由于植物受到低溫脅迫時會促進細胞內活性氧的產生,推測溫度處理可能影響了大麻細胞內的氧化還原反應。植物次生代謝物的合成不僅是一類有用的天然產物,而且是植物抵抗環境脅迫防御系統的重要組成。轉錄組測序檢測到的DEG相關功能主要集中在膜系統結構、碳水化合物(蔗糖和淀粉)代謝、次生代謝產物合成等代謝通路。本研究對KEGG富集分析發現,植物MAPK信號通路(MAPK signaling pathway -plant)、次級代謝物的生物合成(biosynthesis of secondary metabolites)、代謝通路(metabolic pathways)等通路顯著富集,表明溫度處理影響了次生代謝。Shan等的研究表明,結縷草在低溫脅迫下(4 ℃)能夠激活植物體內氧化應急反應、MAPK信號通路、類黃酮和異黃酮生物合成和萜類主干物質生物合成等次生代謝產物通路富集顯著。
大麻素的前體實際上起源于2種不同的生物合成途徑:聚酮合成(polyketide formation)途徑和非甲羥戊酸途徑(MEP pathway)[12]。橄欖醇合成酶(OLS)和橄欖酸環化酶(OAC)是聚酮合成途徑中的關鍵酶,在它們的作用下產生橄欖酸(olivetolic acid,OLA)。脫氧-D-木酮糖-5-磷酸合成酶(DXS)是MEP途徑中的第一個酶,在植物激素調控、逆境抗性和病原體防御等生理過程中發揮著重要作用[13],MEP途徑最終合成焦磷酸香葉酯(geranyl diphosphate,GPP)。轉錄組數據分析發現有3個差異表達基因被注釋為OLS基因,2個差異表達基因被注釋為OAC基因,2個差異表達基因被注釋為DXS基因,上述7個差異表達基因在T1-vs-CK組(0 ℃ /25 ℃)均上調表達,且在4個處理組中表達量最高。由此可見,T1組(0 ℃)處理促進提高OLS、OAC和DXS基因的表達,進而提高CBD含量。大麻異戊烯轉移酶4(CsPT4)和1(CsPT1)是大麻素生物合成的限速酶,催化GPP和OLA產生大麻二酚酸(CBGA)[14]。轉錄組數據共有8個差異表達基因被注釋為PT基因,6個差異表達基因在 T1-vs-CK組(0 ℃/25 ℃)上調表達,上調表達的基因數量明顯高于其他處理組。大麻二酚合成酶(CBDAS)催化CBGA單萜部分氧化環化,轉化為大麻二酸(CBDA)。本研究數據中共有29個差異表達基因被注釋為CBDAS基因,13個差異表達基因在T1-vs-CK組(0 ℃/25 ℃)上調表達,上調表達的基因數量明顯高于其他處理組。
4 結論
溫度與植物生長發育、有機物產量的積累密切相關,不同溫度處理后對大麻CBD的含量和調控通路產生了不同影響。本研究中,0 ℃能顯著增加工業大麻葉中CBD含量,其機理可能是通過影響合成通路中OLS、OAC、PT、DXS和CSDAS關鍵酶基因的表達進而提高CBD含量。
參考文獻:
[1]王殿奎,關鳳芝. 黑龍江省大麻生產現狀及發展對策[J]. 中國麻業,2005,27(2):98-101.
[2]胡學禮,郭鴻彥,劉旭云,等. 云南工業大麻品種在黑龍江大興安嶺地區的適應性研究[J]. 西南農業學報,2012,25(3):838-841.
[3]郭 麗,王明澤,王殿奎,等. 工業大麻綜合利用研究進展與前景展望[J]. 黑龍江農業科學,2014,8(3):132-134.
[4]王東凱,宮海楠. 工業大麻的發展脈絡及在醫療領域的應用動態[J]. 黑龍江農業科學,2022,13(22):124-127.
[5]Perez J,Ribera M V. Managing neuropathic pain with Sativex:a review of its pros and cons[J]. Expert Opin Pharmacothe,2008,9(7):1189-1195.
[6]MacCallum C A,Russo E B. Practical considerations in medical cannabis administration and dosing[J]. European Journal of Internal Medicine,2018,49:12-19.
[7]Franco V,Perucca E. Pharmacological and therapeutic properties of cannabidiol for epilepsy[J]. Drugs,2019,79(13):1435-1454.
[8]Seifalian A,Kenyon J,Khullar V. Dysmenorrhoea:can medicinal Cannabis bring new hope for a collective group of women suffering in Pain,Globally[J]. International Journal of Molecular Sciences,2022,23(24):16201.
[9]張 健,唐 露,冉啟凡,等. 植物響應低溫脅迫轉錄組測序研究進展[J]. 分子植物育種,2020,18(6):1849-1866.
[10]Chandra S,Lata H,Khan I A,et al. Temperature response of photosynthesis in different drug and fiber varieties of Cannabis sativa L.[J]. Physiology and Molecular Biology of Plants,2011,17(3):297-303.
[11]王雅妮,曾糧斌,汪洪鷹,等. 溫度對工業大麻生長及大麻二酚含量的影響[J]. 湖南農業科學,2021(10):27-31.
[12]高 萍,陳宇嫻,柯 崇,等. 新型靶向化合物:植物大麻素的生物合成途徑及研究進展[J]. 生物工程學報,2021,37(6):1968-1985.
[13]Tian S,Wang D,Yang L,et al. A systematic review of 1-deoxy-D-xylulose-5-phosphate synthase in terpenoid biosynthesis in plants[J]. Plant Growth Regulation,2022,96:221-235.
[14]Sands L B,Haiden S R,Ma Y,et al. Hormonal control of promoter activities of Cannabis sativa prenyl transferase 1 and 4 and salicylic acid mediated regulation of cannabinoid biosynthesis[J]. Scientific Reports,2023,13(1):8620.

