脫氧雪腐鐮刀菌烯醇合成及降解研究進展

摘 要:脫氧雪腐鐮刀菌烯醇(Deoxynivalenol,DON)是一種主要污染小麥等禾谷類作物的霉菌毒素,具有較強的毒性,可通過食物鏈的富集作用對人和動物健康構成嚴重威脅。本文詳細探討了DON的分子結構、化學性質以及生物合成過程,分析了DON合成的影響因素和降解方法,并針對不同產品的DON污染問題提出相應的解決策略,旨在為有效預防和控制糧食中的DON污染提供理論支撐。
關鍵詞:脫氧雪腐鐮刀菌烯醇;真菌毒素;生物合成;降解
Research Progress on Biosynthesis and Degradation of Deoxynivalenol
ZHAO Li, ZHANG Hao*
(Product Quality Inspection and Testing Center of Luoyang, Luoyang 471000, China)
Abstract: Deoxynivalenol (DON) is a fungal toxin that mainly contaminates cereal crops such as wheat. It has strong toxicity and can pose a serious threat to human and animal health through its enrichment in the food chain. This article explores in detail the molecular structure, chemical properties, and biosynthesis process of DON, analyzes the influencing factors and degradation methods of DON synthesis, and proposes corresponding solutions for DON pollution in different products, aiming to provide theoretical support for effective prevention and control of DON pollution in food.
Keywords: deoxynivalenol; mycotoxin; biosynthesis; degradation
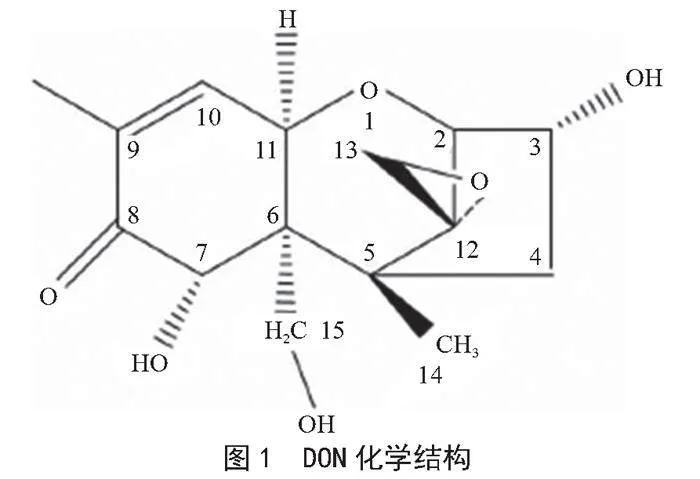
脫氧雪腐鐮刀菌烯醇(Deoxynivalenol, DON)的主要產毒菌株是黃色鐮刀菌(F. culmorum)以及禾谷鐮刀菌(F. gramineaum)。20世紀70年代,日本學者在感染了赤霉病的大麥中發現了DON,并成功將其分離。DON化學結構見圖1[1]。
DON結構復雜,具有很強的耐儲藏能力,研究發現受DON污染的谷物在儲存4年后仍保留有DON的毒性[2]。此外,DON毒素具有耐高溫特性,能夠耐受170~350 ℃的高溫,這使得它在面包等食品的常規加工過程中難以被消除,從而在食品中殘留量較高。同時,相關研究發現DON在鐮刀菌素中的污染率和污染水平最高,其對糧食產業構成了嚴重威脅[3-4]。目前,DON的合成和降解機制是科研領域的熱點,本文對現有的DON降解方法進行綜述,旨在為今后有效防治糧食和飼料中DON的研究提供理論支撐。
1 DON合成的影響因素
在禾谷鐮刀菌(F. gramineaum)的基因組中,有12~16個單端孢霉烯族毒素合酶基因參與了DON的生物合成酶促過程。其中,TRI5基因編碼的單端孢霉烯合酶是這一合成途徑的起始關鍵酶,其他相關基因圍繞TRI5合酶基因聚集,形成一個25 kb的基因簇(詳見圖2)。DON的生物合成涉及一個復雜的代謝網絡,需要相應的TRI基因編碼的酶來實現,通過基因鑒定結合DON的化學結構和基因的遺傳特性來分析單端孢霉烯族的生物合成過程,對于研究其生物降解機制和開發控制策略具有重要意義。
1.1 溫度和濕度對DON合成的影響
在鐮刀菌類真菌產生DON的過程中,環境因素尤其是溫度和濕度對F. graminearum的感染和產毒量起著決定性的調控作用。研究發現F. graminearum在12 ℃時能繁殖并產生代謝毒素,而25 ℃為其最適生長和產毒溫度,當環境溫度高于37 ℃時,F. graminearum會停止合成DON[5]。在田間作物生長條件下,10~32 ℃被認為是F. graminearum生長和產毒的最適溫度[6]。此外,不同來源的F. graminearum受濕度的影響不同,菌體生長的最適濕度在90.0%~99.5%[7]。
1.2 化學因素對DON合成的影響
化學因子對鐮刀菌類真菌的生長以及產毒作用影響較大。例如,pH值、氮源、碳源、基質緩沖劑、殺菌劑以及無機鹽離子、過氧化氫等,都可以通過真菌體內的信號通路調節DON的合成。蔗糖是F. graminearum唯一能夠利用的碳源,因此在培養基中適量添加蔗糖可以促進菌體產生更多的DON。GARDINER等[8]發現F. graminearum以胺類物質作為氮源時,會誘導單端孢霉烯族毒素TRI合成基因的表達,硫酸胺會刺激DON的合成;而硝酸鹽類物質則抑制DON的生物合成。此外,偏酸性的培養基質有利于F. graminearum合成DON[9];Mg2+能夠顯著抑制DON的生物合成[10]。這些化學因子的作用機制和調控效果對于控制和預防真菌毒素的產生具有重要的應用價值。
1.3 生物大分子對DON合成的影響
DON的生物合成由一系列TRI基因編碼的生物酶有序催化完成。研究發現,核心基因簇TRI5區域包含了大部分主要的TRI基因,TRI5是DON合成的正調控因子,但在禾谷鐮刀菌內存在與TRI5基因的靶RNA具有互補序列的反義RNA,可以抑制DON合成[11]。除了直接參與生物合成的酶,DON的合成過程還受到蛋白激酶和轉錄因子的間接調控。例如,生物體內參與絲裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)信號途徑的3個激酶(FgOs4、FgOs5和FgOs2)的突變可以干擾TRI4和TRI6基因的轉錄,從而降低毒素產量;F. graminearum的轉錄輔助因子Swi6敲除突變體在精氨酸濃度為5.0 mmol·L-1時,未檢測到DON物質的積累,而野生型菌株則可以檢測到DON的存在,這一發現進一步證實了Swi6在DON的生物合成過程中發揮著重要的調控功能[12]。
2 DON毒素降解方法
2.1 DON物理降解方法
DON毒素的物理降解方法包括熱處理、研磨去殼、電子輻射和無機吸附等。這些物理降解方法操作簡單,且成本相對較低,在生產加工中被廣泛應用。
2.1.1 熱處理法
熱處理法在降解DON毒素時,溫度與降解效果呈正相關。不同溫度的熱處理對食物中DON含量的降低程度不同[13]。DON的結構和性質較為穩定,加熱120 ℃不能破壞其結構,180 ℃時表現為中度穩定,但當溫度升至210 ℃并持續加熱30~40 min時,DON可以被完全降解。例如,在面包烤制過程中,面粉中的DON含量可下降24%~71%[14]。此外,炒、煎、烤和煨等熱處理方式均可使DON部分降解。
2.1.2 研磨去殼法
濕磨法可以使農作物中的DON毒素溶解于浸液中,而不產生其他副產物,從而降低食物中DON含量。研究發現,通過清洗或漂洗被污染的小麥,可使其DON含量降低5.5%~19%[15]。此外,水解酶作用下的鐮刀霉菌,能夠穿透種皮并深入細胞直至胚乳,導致作物外殼受到嚴重污染[16]。對于感染了鐮刀霉菌的大麥,去殼后的DON含量可減少30%,而去除35%的谷物組織后,DON含量可降低55%[17]。因此,對于帶殼谷物,去殼法在去除DON方面比研磨法更為有效。
2.1.3 電子輻射法
使用低能或高能電子束射線輻照含有DON的溶液可以顯著降低其濃度,不同濃度的DON在相同電子束射線劑量下,其降解效果存在差異。其中,高濃度DON在1~10 kGy輻照劑量下降解效果較好,而低濃度DON在10~20 kGy輻照劑量下降解效果更好[18]。國外在農業領域應用電子束輻照技術已有多年歷史,技術已經十分成熟。相比之下,國內電子束輻照技術仍處于起步階段,尚未完全成熟。
2.1.4 無機吸附法
無機吸附是一種常用的物理學方法,其中活性炭表現出較強的吸附能力,如1 g活性炭可吸附高達35.1 μmol的DON。且經過特定修飾處理后,吸附劑的吸附能力還可以得到顯著提升[19]。然而,無機吸附法并不能徹底清除DON,尤其是高濃度DON,需要結合高溫才能有效清除,但高溫同時也會破壞食品中的營養成分。因此,在處理高濃度DON樣品時,需要權衡無機吸附可能造成的營養流失、大量使用無機吸附劑所導致的能源消耗,以及可能引發的環境的二次污染問題。
2.1.5 光催化法
通過使用TiO2、BiVO4等比表面積較大的納米光子晶體材料吸附目標物質,并在紫外光照射下進行催化,可以高效地降解DON。光催化不僅是一種環境友好型的方法,而且對農作物的營養成分幾乎沒有影響。
2.2 DON化學降解方法
2.2.1 氧化法
DON的生物活性可以通過氧化作用發生變化。例如,在常溫下,NaClO能將DON降解為無毒的單一產物;在22 ℃下,2%的抗壞血酸處理小麥1 d能使小麥中DON含量減少50%。此外,利用化學試劑NaHSO4處理小麥制成的面粉時,1%的Na2S2O5飽和蒸汽處理15 min,可以使霉變小麥中的DON含量下降96%;DON在NaHSO3和Na2S2O5的作用下轉化為DON的磺酸鹽,其毒性弱于DON,但仍具有一定的毒害作用[20]。盡管化學試劑氧化法能使DON降解,但其降解產物仍具有毒性,且會增加處理成本,減少企業收益,因此在生產中不推薦使用這種方法。
2.2.2 糖基化法
參照植物的自然解毒機制,利用葡萄糖基轉移酶將DON的C3位上的羥基糖基化,形成DON-葡萄糖苷(DON-3-glucoside),可以有效降低其毒性。MA等[21]通過農桿菌轉化法將UDP-葡萄糖基轉移酶基因片段導入擬南芥植株,成功提高了植株對DON的耐受性。研究發現,當270 μmol·L-1的DON和糖苷共同侵染細胞時,細胞未表現出任何毒性反應,這表明糖基化法是降解DON的一種安全有效的方法。
2.2.3 臭氧氧化法
DON毒素結構中的C9和C10位雙鍵在光催化作用下易與臭氧結合,被氧化為酸、醛、酮等小分子。該反應受pH值的影響顯著。例如,pH值為4~6時,降解效果最佳;pH值為7~8時,降解效果依賴于DON分子C8位的氧化狀態;而當pH值高于9時,DON幾乎不降解[10]。相較于干燥的臭氧氣體,液態臭氧對DON的降解效果更好。但臭氧降解方法存在處理過程復雜、廢氣收集困難等問題,因此在生產實踐中應用較少[22]。
2.2.4 其他化學降解法
關于堿液處理法,相關實驗結果表明,pH值與DON的化學結構穩定性呈負相關。HUWIG等[19]通過使用NaHSO3處理DON發現,在特定條件下,DON可以轉化成磺酸鹽,而這種產物對豬無毒。此外,ClO2法是指二氧化氯水溶液在濃度為40 mg·L-1時,可明顯抑制食品中禾谷鐮刀菌的生長,從而有效減少DON含量。
2.3 DON生物降解方法
生物降解方法能夠在溫和的條件下有效降解DON毒素,同時對食品及其原料的外觀和特性影響較小。目前,常用的DON生物降解技術包括微生物菌體吸附法和生物酶降解法。
2.3.1 微生物菌體吸附法
生產加工過程中,微生物菌體吸附是一種常用的去除產品中殘留DON毒素的方法。細菌細胞壁具有特殊結構,通過非共價鍵的疏水作用能夠使DON吸附在細菌細胞壁表面的碳原子上,實現微生物菌體對DON的有效吸附[23]。例如,深紅類酵母(Rhodotorula rubra)、膠紅類酵母(Rhodotorula mucilaginosa)、發酵地霉酵母(Geotrzchum fermentans)和美極梅奇酵母(Metschnikowia pulcherima)對DON的吸附率在44%~84.6%[24]。研究還發現,嗜熱鏈球菌和腸球菌屬對DON的吸附效果顯著,其中嗜熱鏈球菌的吸附率達到33%。
2.3.2 生物酶降解法
生物酶降解主要是通過酶分子破壞DON分子結構,降低其穩定性,并將其轉化為低毒或無毒物質。這種方法具有操作條件溫和以及高度專一性的特點,不會破壞產品的營養成分。研究發現,使用保加利亞乳桿菌和馬克思克魯維酵母發酵生產的木聚糖酶,可使酒糟中的DON降解率達到45%[25]。此外,兩種芽孢桿菌菌株(枯草芽孢桿菌和地衣芽孢桿菌)也有清除DON的作用,其有效成分主要來自發酵過程中的上清液,推測是這兩種菌株的次生代謝產物,且在75 ℃以上時具有熱敏性[26]。相關研究還發現魚內臟中的微生物能將真菌毒素轉化為毒性較小的化合物。然而,由于生物酶產量低、易變性、難以提取和應用條件苛刻等因素,目前霉菌毒素解毒酶的應用還不成熟。
3 結語
在生產過程中降解DON毒素時,需要綜合考慮原材料的特性、產品加工的要求,以及DON的結構和性質,以選擇最合適的降解方法。電子輻射處理降解法在處理過程中不會產生劇烈的溫度和濕度變化,因此適用于大多數產品;當原料中目標產物含量較高,且加熱過程對原料性質和微量元素造成的損失對最終喂養對象的影響不大時,可使用熱處理方法;無機吸附降解方法適合DON含量不高的原料;臭氧氧化降解對pH值的酸堿敏感性較高,在pH值為4~6的條件下降解DON的效果最佳;微生物菌體吸附雖然在DON的降解效果上不如物理化學降解方法顯著,但微生物菌體吸附專一性和溫和性使其適合于多種產品的添加;生物酶降解法適合于加工要求精細或需要提取微量元素的產品。
在工業生產中,降解DON毒素通常選用單一的方法。然而,結合物理、化學和生物3種方法的綜合使用,可能會顯著提高降解效果。因此,建議在未來的生產實踐中,針對不同產品對象的DON污染情況,選用多種方法的組合來降解DON。
除了上述提到的解決方案,還可以根據微生物菌體對DON的吸附原理,研究并確定菌體表面對DON吸附起作用的結構。通過人工合成的方法,對菌體細胞壁中的有效成分進行大量合成來提高吸附率,這可能成為降解DON的一種新方法。在生產應用中,應根據具體問題具體分析,選擇最適合的降解方法,以便高效率地降解產品中的DON,同時保證降解過程的安全性。
參考文獻
[1]TANAKA K,SAGO Y,ZHENG Y.Mycotoxins in rice[J].International Journal of Food Microbiology,2007,119(1/2):59-66.
[2]SHIN S.TOMES-ACOSTA J A,HEINEN S J,et al.Transgenic Arabidopsis thaliana expressing a barley UDP-glucosyltransferase exhibit resistance to the mycotoxin deoxynivalenol[J].Journal of Experimental Botany,2012,63(13):4731-4740.
[3]李國林,薛華麗,畢陽,等.脫氧雪腐鐮刀菌烯醇的毒性及脫毒研究進展[J].食品工業科技,2013,34(24):380-384.
[4]尹杰,伍力,彭智興,等.脫氧雪腐鐮刀菌烯醇的毒性作用及其機理[J].動物營養學報,2012,24(1):48-54.
[5]MCCORMICK S P,STANLEY A M,STOVER N A,et al.Trichothecenes: from simple to complex mycotoxins[J].Toxin,2011,3(7):802-814.
[6]李萌萌.赤霉病小麥中脫氧雪腐鐮刀菌烯醇降解技術研究[D].鄭州:河南工業大學,2013.
[7]MAGAN N,MEDINA N,ALDERED D.Possible climate-change effects on mycotoxin contamination of food crops pre-and postharvest[J].Plant Pathology,2011,60(1):150-163.
[8]GARDINER D M,KAZAN K,MANNERS J M.Nutrient profiling reveals potent inducers of trichothecene biosynthesis in Fusarium graminearum[J].Fungal Genetics & Biology,2009,46(8):604-613.
[9]MERHEJ J, RICHARD-FORGET F, BARREAU C.The pH regulatory factor Pacl regulates Tri gene expression and trichothecene production in Fusarium graminearum[J].Fungal Genetics and Biology,2011,48(3):275-284.
[10]PINSON-GADAIS L,RICHARD-FORGET F,FRASSE P,et al.Magnesium represses trichothecene biosynthesis and modulates Tri5, Tri6, and Tri12 genes expression in Fusarium graminearum[J].Mycopathologia,2008,165(1):51-59.
[11]謝茂昌,王明祖.用化學方法脫除赤霉病麥毒素的研究[J].糧食儲藏,1999(6):37-41.
[12]OCHIAI N,TOKAI T,NISHIUCHI T,et al.Involvement of the osmosensor histidine kinase and osmotic stress-activated protein kinases in the regulation of secondary metabolism in Fusarium graminearum[J].Biochemical and Biophysical Research Communications,2007,363(3):639-644.
[13]SAMAR M,RESNIK S L,GONZáLEZ H H L,et al.Deoxynivalenol reduction during the frying process of turnover pie covers[J].Food Control,2007,18(10):1295-1299.
[14]鄒忠義,黃斐,李洪軍.紫外光輻照對脫氧雪腐鐮刀菌烯醇和T-2毒素的去除作用[J].食品科學,2015,36(19):7-11.
[15]BULLERMAN L B,BIANCHINI A.Stability of mycotoxins during food processing[J].International Journal of Food Microbiology,2007,119(1/2):140-146.
[16]SKADSEN R W,HOHN T M.Use of Fusarium graminearum transformed with gfp to follow infection patterns in barley and Arabidopsis[J].Physiological and Molecular Plant Pathology,2004,64(1):45-53.
[17]RIOS G,PINSON-GADAIS L,ABéCASSIS J,et al.Assessment of dehulling efficiency to reduce deoxynivalenol and Fusarium level in durum wheat grains[J].Journal of Cereal Science,2009,49(3):387-392.
[18]PONTS N,PINSON-GADAIS L,BARREAU C,et al.Exogenous H2O2 and catalase treatments interfere with Tri genes expression in liquid cultures of Fusarium graminearum[J].Febs Letters,2007,581(3):443-447.
[19]HUWIG A,FREIMUND S,K?PPELI O,et al.Mycotoxin detoxification of animal feed by different adsorbents[J].Toxicol Lett,2001,122(2):179-188.
[20]JOUANY J P.Methods for preventing, decontamination and mininizing the toxicity of mycotoxins in feeds[J].Animal Feed Science and Technology,2007,137(3/4):342-362.
[21]MA L L,SHANG Y,CAO A Z, et al.Molecular cloning and characterization of an up-regulated UDP-glucosyltransferase gene induced by DON from Triticum aestivum L. cv. Wangshuibai[J].Molecular Biology Reports,2010,37:785-795.
[22]朱佳廷,馮敏,王玲等.60Co γ射線對谷物中3種真菌毒素含量的控制[J].江蘇農業學報,2012,28(5):1152-1156.
[23]BAKUTIS B,BALIUKONIEN? V,PA?KEVI?IUS A.Use of biological method for detoxification of mycotoxins[J].Botanica Lithuanica,2005,7:123-129.
[24]JOUANY J P.Methods for preventing, decontamination and mininizing the toxicity of mycotoxins in feeds[J].Animal Feed Science and Technology,2007,137(3/4):342-362.
[25]張昆,卞科,關二旗,等.電子束輻照降解脫氧雪腐鐮刀菌烯醇的研究[J].糧食與飼料工業,2014(2):13-16.
[26]YOUNG J C,BLACKWELL B A,APSIMON J W.Alkaline degradation of the mycotoxin 4-deoxynivalenol[J].Tetrahedron Letters,1986,27(9):1019-1022.
作者簡介:趙莉(1983—),女,河南周口人,碩士,畜牧師。研究方向:畜產品、獸藥、飼料產品的檢驗檢測。
通信作者:張昊(1996—),男,山西忻州人,本科,助理畜牧師。研究方向:獸藥飼料、畜產品檢測。E-mail: 2448576064@qq.com。

