基于三腳架DNA 探針的電化學發光生物傳感器檢測外泌體
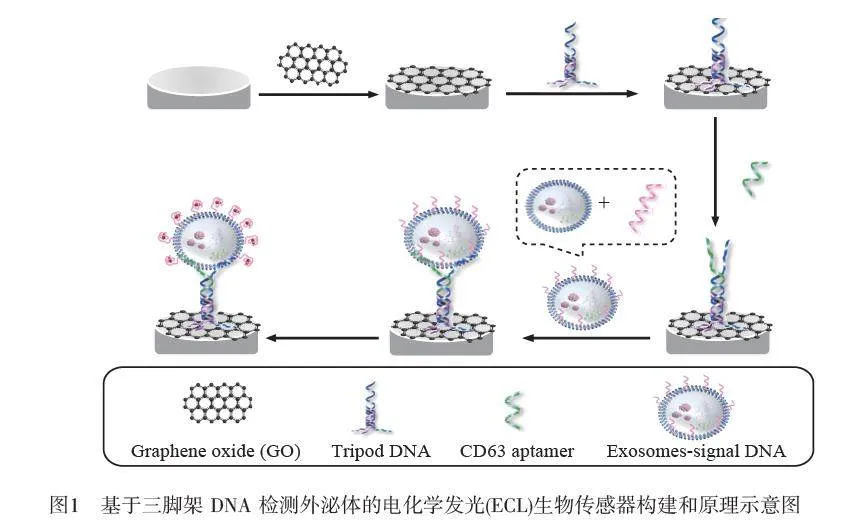

摘要 外泌體(Exosome)的分析檢測對于疾病的早期診斷和治療具有重要意義。本研究利用堿基與石墨烯的π-π 相互作用將三螺旋結構DNA(tsDNA)組裝在電化學還原氧化石墨烯(ERGO)的表面,制備了三腳架(Tripod)DNA探針,并通過懸于探針頂端的膜蛋白(CD63)適配體(apt)序列特異性捕獲外泌體,同時引入血紅素增強魯米諾(Luminol)-過氧化氫(H2O2)電化學發光(ECL)體系的信號強度。此生物傳感器的ECL強度與外泌體濃度在70~1.4×106 particles/μL范圍內呈良好的線性關系,檢出限低至30 particles/μL (S/N=3)。這種三腳架結構的DNA較雙鏈或單鏈DNA具有大的探針間距,使其更有利于較大目標物的捕獲和檢測,有望應用于臨床樣品的分析測定。
關鍵詞 外泌體;三腳架DNA;適配體;生物傳感器;電化學發光
外泌體(Exosome)是由真核細胞(包括各種腫瘤細胞和正常細胞)通過溶酶體途徑主動分泌的一種納米級細胞外囊泡,直徑約為30~150 nm[1],存在于多種體液(血漿、唾液、尿液、腹水和腦脊液等)中[2],在細胞間通訊和免疫反應等生理過程中發揮了重要作用[3]。研究表明,腫瘤細胞分泌的外泌體通過釋放相關的信號分子促進腫瘤發展,并且腫瘤細胞產生的外泌體量通常高于正常細胞[4-5],這些獨特的功能使外泌體可以作為生物標志物用于癌癥的早期診斷和治療。
目前,外泌體的分析檢測方法包括流式細胞術[6]、酶聯免疫吸附分析法[7]、熒光法[8]和比色法[9]等。外泌體的形態特征可通過透射電子顯微鏡(Transmission electron microscope, TEM)[10]、掃描電子顯微鏡(Scanning electron microscope, SEM)[11]、原子力顯微鏡(Atomic force microscope, AFM)[12]等表征獲得。但是,以上方法尚存在不足和局限性,如分析過程復雜、操作耗時以及靈敏度難以滿足低濃度外泌體的檢測要求[13]。電化學發光(Electrochemiluminescence, ECL)生物傳感器具有檢測靈敏度高、響應速度快、便攜性好以及樣品需求量少等優勢[14-17]。適配體(Aptamer, apt)是通過指數富集技術經體外篩選得到的與目標物具有高親和力、高特異性的單鏈DNA或RNA序列,其靶標物質包括多肽、蛋白質、金屬離子甚至細胞或細菌,因此得到了廣泛應用[18]。Qiao等[19]構建了Eu3+摻雜CdS納米晶體的ECL適配體傳感器,用于檢測外泌體時顯示出較高的穩定性和靈敏度。
控制探針的界面密度和取向是構建以DNA為識別元件的電化學生物傳感器的關鍵[20]。為了防止在電極表面的非特異性吸附和鏈間纏結,研究者將DNA 探針從簡單的單鏈DNA(Single-stranded DNA,ssDNA)擴展到多種具有不同空間構型的高級DNA結構[21]。Travascio 等[22]提出了一種特殊拓撲構象的核酸結構G-四聯體,可與血紅素(Hemin)復合形成一種功能性DNA復合物,具有類過氧化物酶活性,可高效催化基于過氧化氫(H2O2)的氧化反應。單鏈寡核苷酸鏈與DNA雙鏈可通過Hoogsteen氫鍵形成三鏈DNA(Triple-stranded DNA, tsDNA)[23]。Tian等[24] 基于特異性核酸酶設計了一種環狀tsDNA納米開關探針,用于靈敏檢測microRNA Let-7a。本研究組的前期研究[25]表明, tsDNA探針的穩定性和直立性優于雙鏈和單鏈DNA探針,并且tsDNA的電荷轉移速率(約為3~5 s–1)也明顯高于單鏈和雙鏈DNA。
本研究基于tsDNA結構的探針構建了ECL 生物傳感器用于靈敏檢測外泌體。三腳架(Tripod)結構的識別探針可以有效避免傳感界面上探針之間的纏結和潛在的空間位阻效應。此傳感器采用電催化策略增強魯米諾–H2O2 體系的EC信號。如圖1所示,三鏈探針包括3個部分:首先,底部的單鏈DNA通過π-π 堆積作用使探針結合到電化學還原氧化石墨烯(Electrochemically reduced graphene oxide, ERGO)[26]表面,中間的tsDNA 由于不與石墨烯作用而直立在電極界面[27],從而形成三腳架形狀;其次,三腳架探針的頂端是特異性識別外泌體膜蛋白CD63 適配體的互補序列,可以有效捕獲外泌體;最后,通過將G-四聯體DNA 與外泌體結合形成外泌體-DNA復合物,當適配體探針捕獲到外泌體復合物后,通過引入Hemin 與G-四聯體DNA 形成具有類過氧化物酶活性的復合物,催化基于H2O2 的氧化反應,從而實現外泌體的靈敏檢測。
1 實驗部分
1.1 儀器與試劑
CHI 660A電化學分析儀(上海辰華儀器有限公司);KQ-400KDE超聲波清洗器(昆山市超聲儀器有限公司);DYY-10C 凝膠成像分析系統(北京六一儀器廠);H-7650 透射電鏡(日本Hitachi 公司);Zetaview 粒徑分析儀和Eppendorf 5427R高速冷凍離心機(德國Wiggens公司);T100 PCR熱循環儀(美國Bio-Rad 公司);MPI-E 電化學分析儀(西安瑞邁電子科技有限公司);Dimenson ICON 原子力顯微鏡(美國Bruker公司)。采用三電極系統:玻碳電極(Glassy carbon electrode, GCE, d=3 mm)為工作電極,Ag/AgCl(飽和KCl)電極為參比電極,鉑絲電極為對電極。
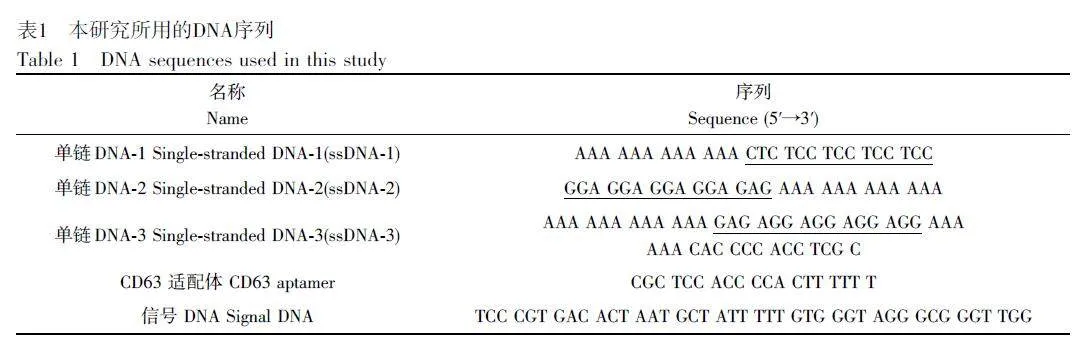
K3[Fe(CN)6]、K4[Fe(CN)6]·3H2O、KCl、HCl、NaH2PO4·2H2O和Na2HPO4·12H2O(分析純,天津市福晨化學試劑廠);青霉素和鏈霉素(分析純,上海碧云天生物技術有限公司);精胺、血紅素(Hemin)、98% 魯米諾(Luminol)、30% H2O2 和杜氏改良Eagle培養基-高葡萄糖(DMEM)(美國Sigma-Aldrich 公司);胎牛血清、MgCl2、1×TE 緩沖溶液(10 mmol/L Tris-HCl,1 mmol/L EDTA, pH=8.0)和1×Tris-HCl緩沖溶液(10 mmol/L Tris-HCl, pH=8.0)(上海生工生物科技有限公司);氧化石墨烯(GO)分散液(1 mg/mL, 南京先豐納米有限公司);無血清培養基和總外泌體分離試劑(賽默飛世爾科技有限公司)。本實驗所用細胞由中國醫學科學院基礎醫學研究所(北京)提供;所有化學品均為分析純。實驗用水為Milli-Q純水系統純化的超純水(18.2 MΩ·cm)。實驗所用DNA序列均由生工生物工程(上海)股份有限公司合成(高效液相色譜純化),具體序列信息見表1。
1.2 實驗方法
1.2.1 外泌體的分離及提取
在5% CO2、37 ℃ 條件下,在含有10% 胎牛血清和1% 青霉素-鏈霉素的DMEM 培養基中培養肺腺癌細胞(A549細胞)。當細胞覆蓋率達到80% 后,使用無血清培養基培養72 h;在4 ℃ 以2000 r/min離心30 min, 以分離漂浮的細胞和細胞碎片;吸取上清液,采用商用外泌體分離試劑盒處理,并在2~8 ℃下孵育過夜;在2~8 ℃ 條件下,將樣品以10000 r/min離心1 h, 棄去上清液,加入100 μL 1×PBS緩沖液將沉淀重懸,于–80 ℃ 保存,備用。采用1×PBS緩沖液稀釋外泌體母液,制備不同濃度的外泌體溶液。
1.2.2 TsDNA 的合成以及外泌體-signal DNA 復合物的制備
分別移取3 μL 100 μmol/L的單鏈DNA(ssDNA-1、ssDNA-2和ssDNA-3)至60 μL緩沖液(10 mmol/LTris-HCl, pH=6.8)中,并加入一定濃度的精胺,在37 ℃ 下培養24 h, 得到5 μmol/L tsDNA溶液,于?20 ℃下冷凍儲存,備用。移取5 μL 100 μmol/L信號DNA(signal DNA)與95 μL 1.4×106 particles/μL外泌體溶液,在室溫下混合孵育60 min, 得到外泌體-signal DNA復合物,于?20 ℃ 冷凍儲存,備用。
1.2.3 ECL 生物傳感界面的構建
首先在拋光絨布上將GCE用0.05 μm Al2O3 懸濁液打磨成鏡面,依次用水、乙醇和水超聲清洗處理3 min 后,用氮氣吹干,備用。將預處理過的GCE 置于1 mg/mL GO 水分散液中,以100 mV/s 的掃速在0.5~ ?1.5 V的電壓范圍內循環伏安掃描10圈,在電極表面得到ERGO,將此電極命名為ERGO/GCE,掃描過程中始終保持氮氣的氛圍。在ERGO/GCE表面滴加5 μL合成的tsDNA,在室溫下孵育1 h后, tsDNA通過π-π 堆積作用被錨定在ERGO 上,形成直立的Tripod DNA,獲得Tripod DNA/ERGO/GCE。以水和Tris-HCl緩沖液依次清洗電極表面,氮氣吹干,備用。
1.2.4 外泌體的檢測
在修飾電極Tripod DNA/ERGO/GCE表面滴加5 μL CD63 aptamer溶液, 孵育45 min, 得到修飾電極apt/Tripod DNA/ERGO/GCE;滴加10 μL 預先制備的外泌體-signal DNA 復合物溶液,孵育2 h, 得到exo-DNA/apt/Tripod DNA/ERGO/GCE;滴加10 μL Hemin, 孵育1 h, 得到修飾電極hemin/exo-DNA/apt/Tripod DNA/ERGO/GCE。將此修飾電極浸入含有0.5 mmol/L Luminol和0.08 mol/L H2O2 的0.1 mol/L PBS(pH=7.5)中,進ECL測試,電壓掃描范圍為0~0.8 V, 掃描速率為100 mV/s。
1.2.5 原子力顯微鏡成像
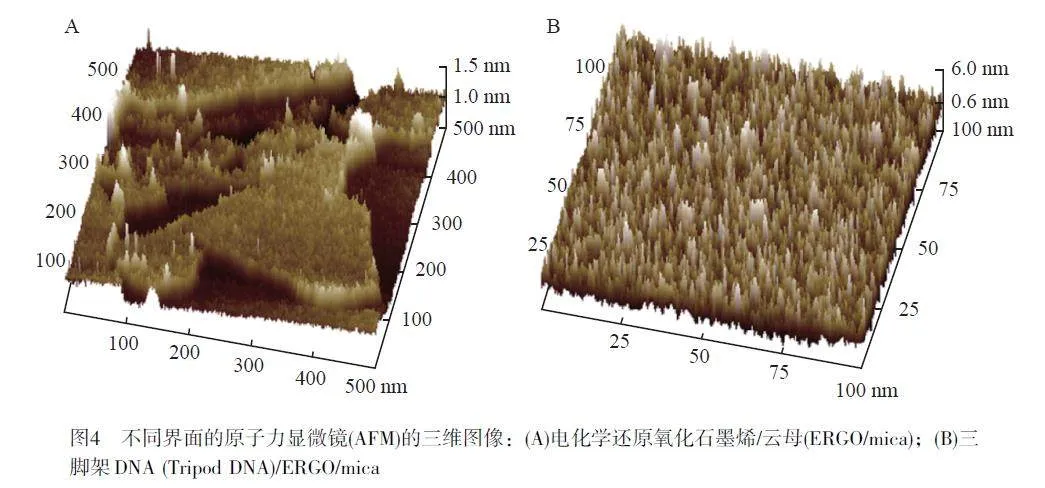
將0.1 mg/mL GO分散液滴涂到新剝落的云母(Mica)表面,在室溫下干燥,得到GO/mica界面。在GO修飾的云母表面滴加5 μL 500 nmol/L的tsDNA溶液,在濕潤的環境下孵育30 min, 然后用Tris-HCl緩沖液小心潤洗多次,在氮氣中干燥,得到Tripod DNA/GO/mica界面。將得到的樣品在輕敲模式下進行原子力顯微鏡掃描成像。
2 結果與討論
2.1 tsDNA 探針的合成與表征
為降低DNA鏈的磷酸骨架的負電荷之間的靜電排斥力,需要在體系中添加二價陽離子或多胺(如精胺或亞精胺)進行電荷中和,以形成穩定的tsDNA[28]。圖2為ssDNA、dsDNA和tsDNA的凝膠電泳圖,其中,泳道1~9 為不同濃度精胺條件下合成的tsDNA,泳道10 為單鏈DNA(ssDNA-1),泳道11 為ssDNA-1和ssDNA-3合成的dsDNA。由圖2可見,當精胺濃度低于0.3 mmol/L(泳道1、2)或高于2.5 mmol/L(泳道8、9)時,只觀察到1條單鏈對應的條帶,與泳道10一致,說明此條件下未形成穩定的tsDNA;泳道3~7在遷移位移最小時出現1條明顯條帶,并且泳道7已無明顯的單鏈條帶,表明精胺濃度為2.5 mmol/L時合成的tsDNA合成效率最高。因此,本研究選擇在精胺濃度為2.5 mmol/L的條件下合成tsDNA。
2.2 外泌體的提取和表征
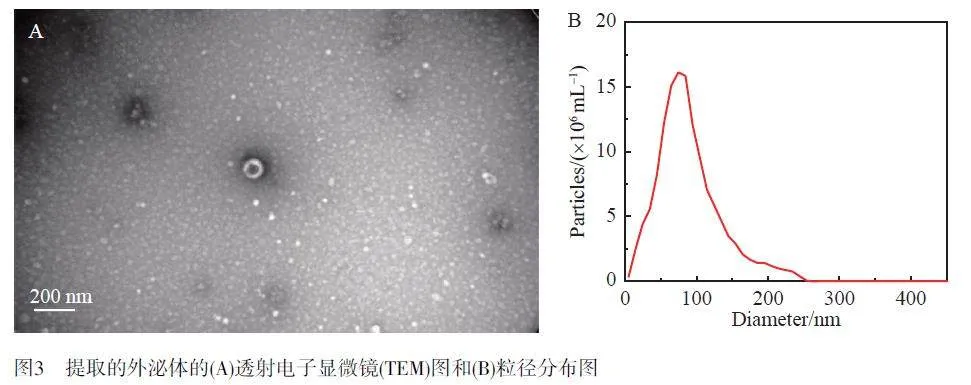
由透射電子顯微鏡(TEM)圖(圖3A)可見,從A549細胞中提取的外泌體具有明顯的雙層膜結構,呈典型的茶杯狀,直徑約為100 nm。利用NTA進一步分析外泌體的粒徑分布及其濃度(圖3B),可見外泌體濃度約為1.4×1010 particles/mL,粒徑分布集中在80~120 nm之間,平均直徑為91 nm。外泌體的理論直徑為50~200 nm[8],提取的外泌體大小在此特征直徑范圍內,表明已成功提取和純化得到A549細胞外泌體。
2.3 ECL 生物傳感界面的表征
利用原子力顯微鏡表征ERGO/mica和Tripod DNA/ERGO/mica的界面形貌(圖4A),可以看到沉積的ERGO厚度為(1.0±0.5) nm, 這與其單層的特性一致[28]。如圖4B所示,富含A堿基的tsDNA通過強π-π 堆積吸附在ERGO上形成了Tripod DNA,此層的厚度也相應增加到(6.0±1.0) nm。由于Tripod DNA的三螺旋互補序列為15個堿基,理論高度為5.1 nm, 與圖像結果近似,表明Tipod DNA鏈在基底表面呈直立狀態。
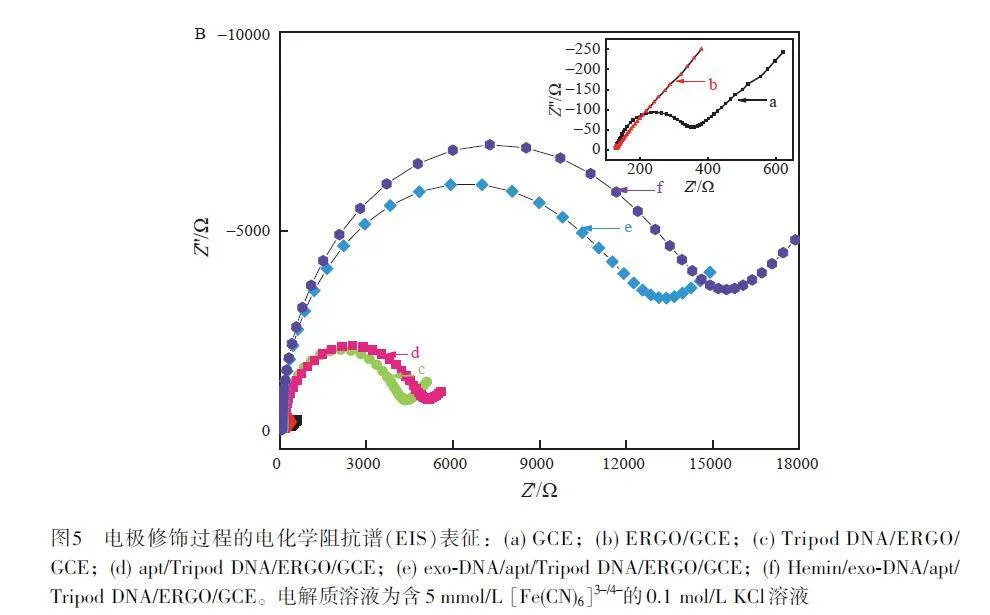
電化學阻抗譜(Electrochemical impedance spectroscopy, EIS)常用于表征電極界面的電荷轉移性能,其高頻區的半圓直徑大小對應電極的電子轉移電阻(Resistance of electron-transfer, Rct),低頻區的線性部分代表擴散過程。如圖5 所示,在GCE 表面電化學還原GO 后,表面的含氧基團減少, Rct 明顯減小(插圖中曲線b);而組裝三腳架DNA探針后(曲線c)以及與CD63 aptamer雜交后(曲線d), Rct 均逐步增大,這是因為帶負電荷的DNA 磷酸骨架排斥負電性的電化學探針[Fe(CN)6]3?/4?。捕獲外泌體-SignalDNA復合物后(曲線e和f),電極界面的導電性進一步減弱,使得Rct 進一步增大。
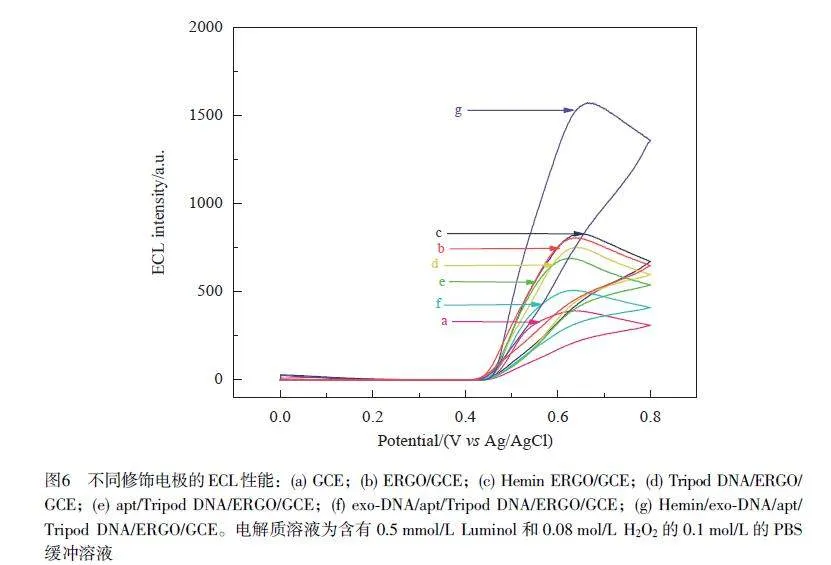
圖6 顯示了不同修飾電極在含有0.5 mmol/L Luminol、0.08 mol/L H2O2 的0.1 mol/L PBS 溶液中的ECL響應曲線,其中, Luminol為發光體, H2O2 為共反應劑。當電極修飾ERGO 后, ECL強度增大,這歸因于ERGO的高導電性提高了電極表面的電子轉移速率(曲線b);繼續組裝探針和捕獲外泌體后, ECL強度逐步降低(曲線d、e 和f),其原因是電極表面被導電性不佳的物質覆蓋,電子傳遞能力降低。在體系中加入Hemin后,其與外泌體上的信號探針形成具有類過氧化物酶活性的Hemin/G-四聯體DNA復合物,催化H2O2 的氧化反應,ECL信號顯著增強(曲線g)。曲線c為對照實驗,是Hemin直接修飾到ERGO/GCE電極表面的ECL曲線,無H2O2 時, Hemin不能增強Luminol體系的ECL信號。
2.4 實驗條件的優化
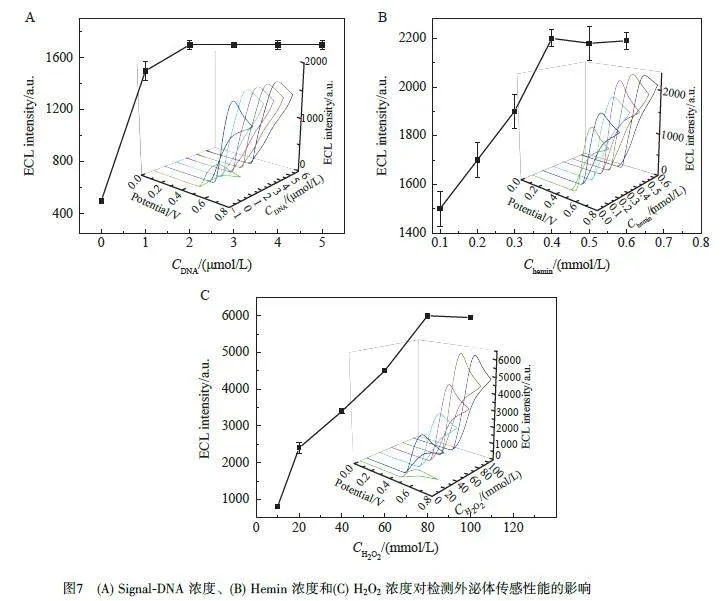
2.4.1 Signal-DNA 濃度的優化
預組裝在外泌體上的Signal-DNA 的量與體系的ECL 強度直接相關,圖7A 顯示了不同濃度(0、1、2、3、4 和5 μmol/L)的Signal-DNA與1.4×106 particles/μL外泌體形成復合物時體系ECL響應強度的變化。隨著Signal-DNA 濃度增大,結合到電極表面的Signal-DNA 增多,ECL 響應依次增強。當Signal-DNA 的濃度達到2 μmol/L 后, ECL 信號不再增加并達到平臺,說明此時已飽和。因此,選擇Signal-DNA濃度為2 μmol/L。
2.4.2 Hemin 濃度的優化
圖7B 為不同濃度Hemin 對體系的ECL 響應強度的影響。保持信號探針的濃度不變,在0.1~0.4 mmol/L范圍內,隨著Hemin濃度增加, ECL信號增強。當Hemin濃度大于0.4 mmol/L時, ECL信號不再發生明顯變化,達到飽和。因此,選擇0.4 mmol/L作為最佳Hemin濃度。
2.4.3 H2O2 濃度的優化
考察了Luminol ECL 體系的共反應劑H2O2 濃度的影響。圖7C 為不同濃度H2O2 的條件下,含0.5 mmol/L Luminol 的0.1 mol/L PBS 溶液體系的ECL 響應強度。隨著H2O2 濃度從10 mmol/L 增大至80 mmol/L, ECL信號顯著增強;進一步增大H2O2 濃度, ECL信號增強不顯著。因此,選擇H2O2 的最佳濃度為80 mmol/L。
2.5 外泌體的檢測
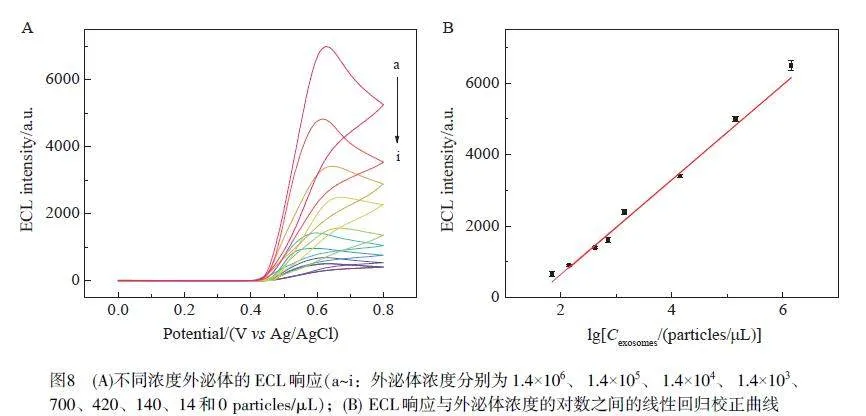
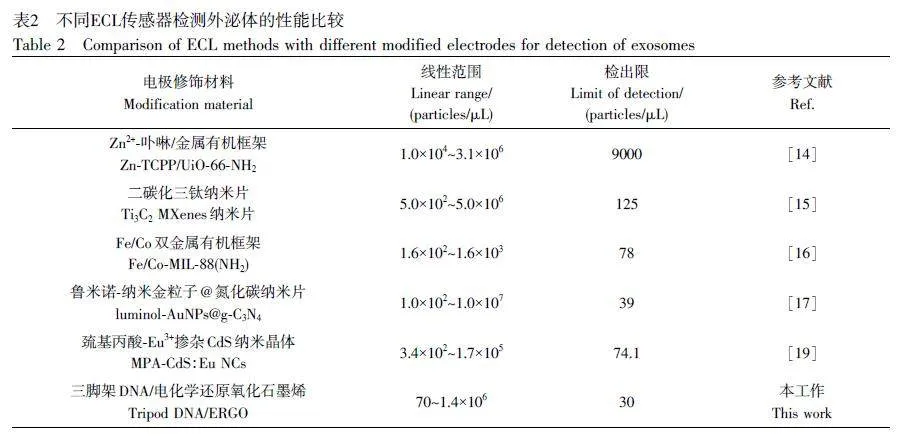
在最優實驗條件(Sginal-DNA 濃度為2 μmol/L, Hemin 濃度為0.4 mmol/L, 電解質溶液為含有0.5 mmol/L Luminol和0.08 mol/L H2O2 的0.1 mol/L PBS溶液)下,檢測傳感器對不同濃度外泌體的ECL響應(圖8A)。當不存在外泌體時, Sginal-DNA不能結合至電極表面,無催化信號,未觀察到明顯的ECL發光信號(曲線i);隨著外泌體濃度增大,ECL 信號逐漸增強,體系ECL 強度與外泌體濃度的對數值在70~1.4×106 particles/μL 范圍內呈良好的線性關系(圖8B),線性回歸方程為y=1278.5x–1797.5(R2=0.996),檢出限為30 particles/μL (S/N=3)。與其它檢測外泌體的ECL方法相比,本方法具有較低的檢出限和較寬的線性檢測范圍(表2),表明本研究設計的三腳架DNA 探針結合具有催化放大作用的Hemin/G-四聯體DNA復合物有效提高了檢測外泌體的靈敏度和準確性。
為了考察生物傳感器的重現性,在相同條件下制備3 支修飾電極,測量其對1.4×106 particles/μL外泌體溶液的ECL響應,結果表明, 3支電極測定結果的相對標準偏差(RSD)為1.08%,說明其具有良好的重現性。ECL 生物傳感器的穩定性是評價其性能的另一個重要指標。采用此ECL 生物傳感器檢測1.4×104 particles/μL的外泌體,連續11個周期循環檢測的ECL響應信號非常穩定, RSD為1.0%,表明此生物傳感器具有優異的穩定性。
3 結論
構建了基于三腳架DNA探針的ECL生物傳感器,利用可特異性識別外泌體的適配體和Hemin/G-四聯體的高效催化性能實現了外泌體的靈敏檢測。采用的tsDNA的尾部寡核苷酸片段含有12個腺嘌呤堿基,其與ERGO通過π-π 堆積作用使探針呈現直立狀態的三腳架結構,并且12個腺嘌呤堿基使探針間距滿足捕獲尺寸較大的外泌體的要求,提高了精準性。本研究結果表明,這種基于探針間距尺寸可控的傳感器在選擇性分析不同尺寸目標物中具有良好的應用前景。
References
[1] SUNG B H, VON LERSNER A, GUERRERO J, KRYSTOFIAK E S, INMAN D, PELLETIER R, ZIJLSTRA A, PONIK S M, WEAVER A M. Nat. Commun. , 2020, 11(1): 2092.
[2] XU H, YE B C. TrAC, Trends Anal. Chem. , 2020, 123: 115773.
[3] TKACH M, THéRY C. Cell, 2016, 164(6): 1226-1232.
[4] MAKLER A, ASGHAR W. Expert Rev. Mol. Diagn. , 2020, 20(4): 387-400.
[5] EL ANDALOUSSI S, M?GER I, BREAKEFIELD X O, WOOD M J A. Nat. Rev. Drug Discov. , 2013, 12(5): 347-357.
[6] MASTORIDIS S, BERTOLINO G M, WHITEHOUSE G, DAZZI F, SANCHEZ-FUEYO A, MARTINEZ-LLORDELLA M.Front. Immunol. , 2018, 9: 1583-1590.
[7] LOGOZZI M, DI RAIMO R, MIZZONI D, FAIS S. Method. Enzymol. , 2020, 645: 155-180.
[8] CHEN X, LAN J, LIU Y, LI L, YAN L, XIA Y, WU F, LI C, LI S, CHEN J. Biosens. Bioelectron. , 2018, 102: 582-588.
[9] ZHAO V X T, WONG T I, ZHENG X T, TAN Y N, ZHOU X. Mater. Sci. Energy Technol. , 2020, 3: 237-249.
[10] SHAO H, IM H, CASTRO C M, BREAKEFIELD X, WEISSLEDER R, LEE H. Chem. Rev. , 2018, 118(4): 1917-1950.
[11] SOKOLOVA V, LUDWIG A K, HORNUNG S, ROTAN O, HORN P A, EPPLE M, GIEBEL B. Colloids Surf., B, 2011, 87(1):146-150.
[12] SHARMA S, RASOOL H I, PALANISAMY V, MATHISEN C, SCHMIDT M, WONG D T, GIMZEWSKI J K. ACS Nano,2010, 4(4): 1921-1926.
[13] RANI K, RASTOGI S, VISHWAKARMA P, BHARTI P S, SHARMA V, RENU K, MODI G P, VISHNU V Y,CHATTERJEE P, DEY A B, NIKOLAJEFF F, KUMAR S. J. Neurosci. Methods, 2021, 347: 108980.
[14] WANG Y, SHU J, LYU A, WANG M, HU C, CUI H. ACS Appl. Nano Mater. , 2023, 6(6): 4214-4223.
[15] ZHANG H, WANG Z, ZHANG Q, WANG F, LIU Y. Biosens. Bioelectron. , 2019, 124-125: 184-190.
[16] JIANG Q, XIAO Y, HONG A N, GAO Z, SHEN Y, FAN Q, FENG P, ZHONG W. ACS Appl. Mater. Interfaces, 2022, 14(37):41800-41808.
[17] LIU X, WANG Q, CHEN J, CHEN X, YANG W. Talanta, 2021, 221: 121379.
[18] JI C, WEI J, ZHANG L, HOU X, TAN J, YUAN Q, TAN W. Chem. Rev. , 2023, 123(22): 12471-12506.
[19] QIAO B, GUO Q, JIANG J, QI Y, ZHANG H, HE B, CAI C, SHEN J. Analyst, 2019, 144(11): 3668-3675.
[20] DIAO W, TANG M, DING S, LI X, CHENG W, MO F, YAN X, MA H, YAN Y. Biosens. Bioelectron. , 2018, 100: 228-234.
[21] DONG Y, YAO C, ZHU Y, YANG L, LUO D, YANG D. Chem. Rev. , 2020, 120(17): 9420-9481.
[22] TRAVASCIO P, LI Y, SEN D. Chem. Biol. , 1998, 5(9): 505-517.
[23] XU Z, LEI X, TU Y, TAN Z J, SONG B, FANG H. Chem. Eur. J. , 2017, 23(53): 13100-13104.
[24] TIAN J, CHU H, ZHU L, XU W. Anal. Bioanal. Chem. , 2020, 412(19): 4477-4482.
[25] JIN X, LU L, WANG X. Talanta, 2021, 234: 122670.
[26] CHANDLER S P, FOX K R. Biochemistry, 1996, 35(47): 15038-15048.
[27] THOMAS T, THOMAS T J. Biochemistry, 1993, 32(50): 14068-14074.
[28] ZHANG H, JIA S, LV M, SHI J, ZUO X, SU S, WANG L, HUANG W, FAN C, HUANG Q. Anal. Chem. , 2014, 86(8):4047-4051.
國家自然科學基金項目(Nos. 22276005,21876005)和北京市卓越青年科學家計劃項目(No. BJJWZYJH01201910005017)資助。

