外源脫落酸(ABA)對桑樹抗旱生理及生長的影響


摘 要 為了解廣西用于種植桑樹的土地灌溉條件較差、干旱缺水對桑蠶業(yè)穩(wěn)定發(fā)展的影響,對桑樹苗噴施不同濃度的脫落酸并對其進(jìn)行干旱脅迫,測定桑樹葉片的相對含水量、葉綠素、可溶性蛋白、可溶性糖、過氧化氫酶(CAT)、超氧化物歧化酶(SOD)等生理生化指標(biāo)及生長指標(biāo)。結(jié)果表明:施用30 μmol·L-1外源脫落酸能對桑樹苗抗旱生理及生長具有較好的調(diào)控作用,在一定程度上提高了桑樹苗的抗旱性。
關(guān)鍵詞 桑樹;脫落酸;抗旱性
中圖分類號:S888.2 文獻(xiàn)標(biāo)志碼:A DOI:10.19415/j.cnki.1673-890x.2024.17.019
桑樹在我國廣泛種植,是養(yǎng)蠶的直接原料來源,其果實桑葚也因富含花青素深受人們的喜愛。廣西是目前我國最大的桑樹種植基地,近年來種桑養(yǎng)蠶已經(jīng)成為促進(jìn)農(nóng)民增收致富的重要產(chǎn)業(yè),但因廣西桑蠶業(yè)受制于其地理環(huán)境的特殊性,桑樹大多種植于缺乏灌溉條件的旱坡地上,一旦發(fā)生干旱氣候,將嚴(yán)重影響桑樹的正常生長,從而制約著廣西桑蠶業(yè)的穩(wěn)定發(fā)展。
當(dāng)植物受到干旱威脅時,會發(fā)生一系列生理生化變化來適應(yīng)干旱環(huán)境,以維持正常的生長和發(fā)育[1]。過氧化氫酶(CAT)、過氧化物酶(POD)、超氧化物歧化酶(SOD)等抗氧化酶在植物體內(nèi)協(xié)同作用,共同保護(hù)植物,使其免受活性氧的損害[2-3]。在干旱條件下,植物還會通過積累一些滲透調(diào)節(jié)物質(zhì),調(diào)節(jié)氣孔開放、水分吸收及光合作用等,來幫助維持細(xì)胞的水分平衡,減少干旱帶來的損傷[4-5]。植物體內(nèi)有許多重要的滲透調(diào)節(jié)物質(zhì),如脯氨酸、可溶性糖、可溶性蛋白等。干旱同時會引起植物體內(nèi)源激素的變化,以應(yīng)答逆境帶來的脅迫,它作為化學(xué)信號參與了植物代謝的調(diào)控進(jìn)程[6]。
脫落酸(ABA)是一種重要的植物內(nèi)源激素,它在植物的發(fā)育和響應(yīng)逆境脅迫中起重要作用。ABA除了調(diào)節(jié)植物的生長發(fā)育,還對植物抵御外界不良環(huán)境起到了關(guān)鍵作用,是植物受到干旱脅迫時調(diào)節(jié)其適應(yīng)性的重要應(yīng)激激素。研究顯示,當(dāng)面臨滲透脅迫時,植物根系會大量合成某種物質(zhì),這些物質(zhì)會順著木質(zhì)部導(dǎo)管被運(yùn)輸?shù)饺~片的保衛(wèi)細(xì)胞,引發(fā)氣孔關(guān)閉,從而減少水分蒸騰流失[7]。ABA即使含量發(fā)生微小的改變,也能推動反應(yīng)的進(jìn)行,隨著干旱脅迫的加劇,后續(xù)的大量合成會導(dǎo)致氣孔持續(xù)閉合,進(jìn)而增強(qiáng)植物對脅迫的抵抗力[8]。李長寧研究表明,隨著干旱脅迫程度的加深,受ABA處理的甘蔗葉片體內(nèi)的ABA 含量顯著高于干旱處理組,由此可見,外源ABA可以通過刺激甘蔗體內(nèi)ABA的合成,以提高ABA含量,進(jìn)而加強(qiáng)抵御干旱的能力[9]。本試驗針對百色桑樹地常年受水分脅迫對桑蠶產(chǎn)業(yè)產(chǎn)生的嚴(yán)重影響,以增強(qiáng)百色桑樹的抗旱性為研究主旨,通過施用外源ABA,探討其對桑樹抗旱生理生化的影響,為深入探究ABA如何增強(qiáng)桑樹幼苗抗旱能力的生理機(jī)制及為提高桑樹的抗旱栽培技術(shù)及育種進(jìn)程提供理論依據(jù)。
1" 材料與方法
1.1" 試驗材料
試驗于百色學(xué)院校內(nèi)試驗地進(jìn)行,挑選長勢一致、無病蟲害的健康桂桑12號桑樹苗進(jìn)行盆栽,每盆栽種3棵,做好日常管理栽培。
1.2" 試驗方法
1.2.1" 處理方法
將桑樹幼苗培養(yǎng)至60 cm左右,挑選24盆長勢較好且大小一致的苗進(jìn)行試驗,設(shè)置4組(每組6盆)。1組為對照(CK),不進(jìn)行干旱脅迫處理且不噴施脫落酸溶液,另外3組分別對葉面噴施0(即清水)、15、30 μmol·L-1的脫落酸并進(jìn)行干旱處理,每個處理均在干旱脅迫前(0 d)和干旱脅迫后(2、4 d)分別對桑樹葉片進(jìn)行取樣(取中上部完全葉混合),每次取2盆。
1.2.2" 株高的測量
于試驗開始脅迫前與試驗結(jié)束后恢復(fù)供水70 d后分別對桑樹苗進(jìn)行株高測量,每個處理均完全測量,取平均值,計算平均株高。
1.2.3" 生理指標(biāo)的測定
桑樹葉片葉綠素含量的測定依靠葉綠素測量儀進(jìn)行,葉片相對含水量的測定參考杜成忠的方法[10],抗氧化酶活性測定參照陳建勛等的方法[11],超氧化物歧化酶(SOD)活性測定采用氮藍(lán)四唑(NBT)法,過氧化氫酶(CAT)活性測定采用紫外分光光度法,可溶性糖含量的測定采用蒽酮法[12],可溶性蛋白含量的測定采用考馬斯亮藍(lán)法[13]。每個處理重復(fù)3次。
2" 結(jié)果與分析
2.1" 干旱脅迫下脫落酸對桑樹株高的影響
由圖1可知,對照組(CK)的桑樹高度在恢復(fù)供水30 d后較干旱脅迫前增加了41.42%,而噴施脫落酸溶液的兩組處理中,15 μmol·L-1組的株高增加了13.06%,30 μmol·L-1組增加了9.46%,同期干旱對照處理的0 μmol·L-1組增加了28.66%。可見,干旱脅迫顯著影響了桑樹的正常生長,而外源脫落酸的噴施對其生長的抑制作用更為明顯,且脫落酸濃度越高其生長越緩慢。
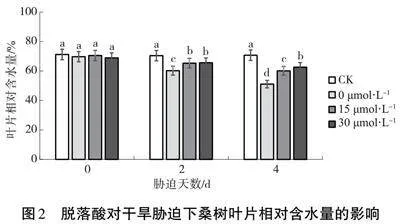
2.2" 干旱脅迫下脫落酸對桑樹葉片相對含水量的影響
由圖2可知,干旱脅迫前(0 d) 4個處理的葉片相對含水量均穩(wěn)定在70%左右,無顯著差異。干旱脅迫后,桑樹葉片逐漸失去水分,其相對含水量開始下降,且受害程度也隨之加深,其中以噴施清水的對照下降最快,施用脫落酸的桑樹葉片維持了較高的含水量, 30 μmol·L-1的脫落酸對于桑樹葉片保水能力的提高有較大作用。
2.3" 干旱脅迫下脫落酸對桑樹葉綠素含量的影響
由圖3可知,對照組在正常澆水的情況下葉綠素含量穩(wěn)定在41左右,干旱脅迫使葉綠素分解加快,導(dǎo)致葉綠素含量逐漸降低。噴施清水處理組下降最快,第4 d降低至32.9,而噴施脫落酸濃度為15、30 μmol·L-1的兩組處理,桑樹葉片葉綠素含量均維持在一個比較平緩的下降水平,其中前者的葉綠素含量從第0 d到第4 d下降了5.1,而后者的葉綠素含量僅下降了2.7。可見,在干旱脅迫的條件下,噴施外源脫落酸可有效減緩桑樹葉片葉綠素的降解,且濃度越高其緩解效果越顯著。
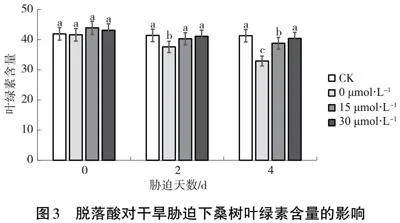
2.4" 干旱脅迫下脫落酸對桑樹葉片可溶性糖含量的影響
由圖4可知,干旱脅迫對可溶性糖含量有顯著影響,其含量呈現(xiàn)出上升的趨勢。干旱程度的加劇會導(dǎo)致桑樹體內(nèi)的可溶性糖含量不斷積累,以應(yīng)對干旱脅迫對桑樹葉片的損害。試驗中,噴施脫落酸的處理組其積累的可溶性糖均高于其他組,其中以30 μmol·L-1濃度的外源脫落酸尤為明顯,積累量顯著高于其他各處理組。
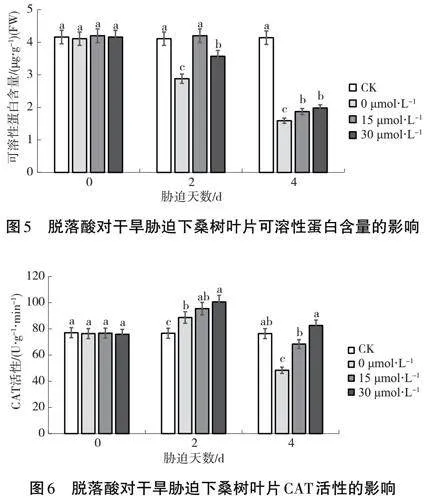
2.5" 干旱脅迫下脫落酸對桑樹葉片可溶性蛋白含量的影響
由圖5可知,干旱條件下,3個處理的桑樹葉片可溶性蛋白含量逐漸下降,到第4 d時急劇下降。清水處理組下降幅度最大,在第4 d其可溶性蛋白含量已下降到干旱前的1/3,而噴施脫落酸的2個處理組,可溶性蛋白含量下降相對較慢,且噴灑30 μmol·L-1濃度的脫落酸更能有效緩解其含量的下降。
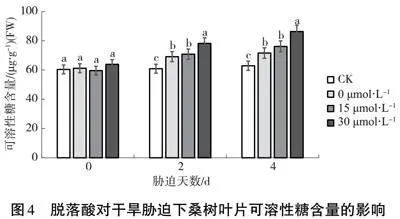
2.6" 干旱脅迫下脫落酸對桑樹葉片過氧化氫酶(CAT)活性的影響
由圖6可知,隨著干旱脅迫程度的加劇,CAT活性表現(xiàn)為先上升后下降的趨勢。在處理的第2 d,其活性達(dá)到最大值,0、15、30 μmol·L-1組分別比CK組升高了15.65%、24.52%、31.21%,到第4 d又急劇下降,其中以清水組下降最為明顯。可見,在干旱脅迫的條件下,葉面噴施脫落酸可促使桑樹葉片維持較高的CAT活性。
2.7" 干旱脅迫下脫落酸對桑樹葉片超氧化物歧化酶(SOD)活性的影響
由圖7可知,隨著干旱時間的延長,SOD活性在3種濃度的脫落酸處理下均呈現(xiàn)出先下降后上升的趨勢,其中第4 d噴施30 μmol·L-1脫落酸處理組的SOD活性達(dá)到CK組的2倍,而噴施清水的同期干旱處理組與CK組無顯著差異。隨著干旱時間的延長,噴灑了外源脫落酸的桑樹葉片SOD活性顯著高于其他處理。
3" 討論與結(jié)論
對植物來說由干旱引起的影響是多層次的,最根本的原因還是干旱時土壤可利用水分短缺,導(dǎo)致葉片蒸騰失水且無法得到補(bǔ)償[14]。本研究結(jié)果顯示,干旱脅迫對桑樹的生長造成了一定程度的影響,使葉片含水量和營養(yǎng)供給不足,即使在后期恢復(fù)供水,桑樹的生長依然受到影響。施用脫落酸使桑樹的株高受到了一定的限制,這主要是因為脫落酸本身就是一種抑制生長的植物激素。相關(guān)研究表明,植物體內(nèi)的脫落酸通過調(diào)節(jié)植物葉片衰老,促使庫區(qū)水分和養(yǎng)分的再分配來增強(qiáng)作物的抗旱性。植物的光合、呼吸、物質(zhì)合成和代謝等生命活動與體內(nèi)水分含量直接相關(guān)。當(dāng)植物的水分代謝出現(xiàn)異常,正常生理活動將被中斷,嚴(yán)重時可能導(dǎo)致植物死亡。當(dāng)面臨干旱脅迫時,植物葉片相對含水量越高,其抗旱性越強(qiáng),二者呈正相關(guān)[15]。當(dāng)植物遭遇干旱脅迫時,體內(nèi)積累了大量活性氧,導(dǎo)致膜結(jié)構(gòu)發(fā)生變化,從而影響葉片的葉綠素含量,嚴(yán)重缺水時,還可能導(dǎo)致葉綠素消失,阻礙葉綠素合成,使原有的葉綠素加快分解,進(jìn)而影響光合作用的光能吸收、傳遞和轉(zhuǎn)化。本研究中,脫落酸的施用,減緩了桑樹葉片水分流失的速度,進(jìn)而維持了葉綠素的穩(wěn)定,且以噴灑30 μmol·L-1脫落酸的效果為最佳,而未噴施脫落酸的處理組其葉片含水量和葉綠素含量下降得更快。
滲透調(diào)節(jié)是植物在因干旱、高溫等多種逆境形成的水分脅迫下,降低滲透勢,提高細(xì)胞吸水能力,從而適應(yīng)水分脅迫環(huán)境的一種重要方式,其中可溶性糖和可溶性蛋白含量的增加對提高植株滲透能力具有重要作用[16]。干旱脅迫下植物葉片會通過增加可溶性糖含量來維持細(xì)胞的膨壓[17]。本研究結(jié)果表明,桑樹葉片可溶性糖含量隨著脅迫程度的加深而增加,噴施30 μmol·L-1濃度的脫落酸處理組相較于未噴施脫落酸的同期干旱對照組效果尤為顯著。一般情況下,干旱脅迫會導(dǎo)致可溶性蛋白含量大幅度積累,但不同植物會呈現(xiàn)出不同的變化趨勢,本研究中桑樹體內(nèi)的可溶性的蛋白含量在干旱脅迫加劇的過程中逐漸下降,噴施清水的處理組變化最為明顯,其主要原因可能是桑葉本身蛋白質(zhì)含量極高,加之脫落酸及干旱脅迫的應(yīng)激,使其發(fā)生分解作用來應(yīng)對這種脅迫。
干旱使植物活性氧的動態(tài)平衡被打破,導(dǎo)致植物正常代謝受損。SOD、POD、CAT等可以清除活性氧,使植物活性氧保持平衡,保護(hù)細(xì)胞膜結(jié)構(gòu)的完整性,從而使作物的抗逆性得到增強(qiáng)[18]。研究結(jié)果顯示,在輕度干旱脅迫時,SOD活性呈現(xiàn)下降趨勢,隨著干旱時間的延長,脅迫程度增加,最終導(dǎo)致桑樹葉片的SOD活性上升。干旱前期桑樹葉片SOD活性出現(xiàn)小幅度的降低,可能是其對輕微干旱脅迫的初步反應(yīng),隨著脅迫時間的延長,誘導(dǎo)了桑樹內(nèi)部編碼SOD基因的表達(dá),使SOD活性升高,以消除因干旱脅迫產(chǎn)生的活性氧。CAT的活性在干旱處理前期較對照先增加,而后降低,這可能是由于桑樹在干旱前期,增加CAT活性用于消除活性氧,但隨著干旱脅迫時間的持續(xù),桑樹對干旱脅迫的耐受力下降,導(dǎo)致CAT活性下降,這與不同干旱脅迫對煙草葉片保護(hù)酶活性的影響研究結(jié)果相似[19]。相對于噴施清水的處理,干旱脅迫下對葉面進(jìn)行脫落酸處理的葉片SOD活性更高,也能維持桑樹葉片的CAT活性,使其受干旱脅迫影響較小,其中以噴施30 μmol·L-1濃度的脫落酸對于SOD活性的提高和CAT活性的維持效果最好。
本試驗以脫落酸為外源物,研究其對干旱脅迫下桑樹生長及生理生化特性的影響。結(jié)果表明,干旱對桑樹幼苗的正常生長和生理生化代謝均產(chǎn)生了不利影響。施用外源脫落酸使桑樹植株生長更緩慢,同時有效緩解了桑樹葉片相對含水量和葉綠素含量及滲透調(diào)節(jié)物質(zhì)可溶性蛋白的下降,積累了較多的可溶性糖,提高了桑樹葉片的SOD活性和維持CAT活性。可見,外源脫落酸能有效啟動桑樹的防御系統(tǒng),從而減小干旱對其造成的傷害。綜合分析表明,噴施30 μmol·L-1濃度的脫落酸能在一定程度上增強(qiáng)桑樹的抗旱性,緩解干旱脅迫對桑樹造成的傷害。
參考文獻(xiàn):
[1] LI D M, ZHANG J, SUN W J, et al. 5-Aminolevulinic acid pretreatment mitigates drought stress of cucumber leaves through altering antioxidant enzyme activity[J]. Scientia Horticulturae, 2011,130:820-828.
[2] ASHRAF M. Biotechnological approach of improving plant salt tolerance using antioxidants as markers[J]. Biotechnology Advances, 2009, 27(1):84-93.
[3] GILL S S,TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010, 48(12): 909-930.
[4] 翟學(xué)昌,彭麗. 植物水分脅迫研究進(jìn)展[J]. 科技信息,2008(36):351,378.
[5] HU H H,XIONG L Z. Genetic engineering and breeding of drought-resistant crops[J]. Annual Review of Plant Biology, 2014, 65: 715-741.
[6] DURBAK A,YAO H,MCSTEEN P. Hormone signaling in plant development[J]. Current Opinion in Plant Biology, 2012, 15(1): 92-96.
[7] DAVIES W J,ZHANG J. Root signals and the regulation of growth and development of plants in drying soil[J]. Annu. Rev. Plant Physiol. Plant Mol. Biol,1991,42(1):55-76.
[8] RODR??GUEZ-GAMIR J,ANCILLO G,GONZ? LEZ-MAS M C,et al. Root signalling and modulation of stomatal closure in flooded citrus seedlings[J]. Plant Physiology amp; Biochemistry,2011,49(6):636-645.
[9] 李長寧.水分脅迫下外源脫落酸提高甘蔗抗旱性的機(jī)理研究[D].南寧:廣西大學(xué),2012.
[10] 杜成忠.不同甘蔗品種抗旱性的生理和分子機(jī)制[D].南寧:廣西大學(xué),2018.
[11] 陳建勛,王曉峰. 植物生理學(xué)實驗指導(dǎo)[M]. 廣州:華南理工大學(xué)出版社,2002.
[12] 劉海英,王華華,崔長海,等. 可溶性糖含量測定(蒽酮法)實驗的改進(jìn)[J]. 實驗室科學(xué),2013,16(2):19-20.
[13] 牛建峰,王廣策,曾呈奎,等. 帶形蜈蚣藻多糖和可溶性蛋白含量測定及藻紅蛋白分析鑒定[J]. 海洋科學(xué),2006,30(8):50-53.
[14] 柴守璽,王自忠.與小麥抗旱性篩選有關(guān)的幾個水分指標(biāo)[J].甘肅農(nóng)業(yè)科技,1990(6):12-14.
[15] 任安芝,高玉葆,梁宇,等.白草和賴草無性系生長對干旱脅迫的反應(yīng)[J].中國沙漠,1999(19):31-34.
[16] 吳強(qiáng)盛,夏仁學(xué),張瓊?cè)A. 果樹對水分脅迫反應(yīng)研究進(jìn)展[J]. 亞熱帶植物科學(xué),2003,32(2):72-76.
[17] 梁文斌,聶東伶,吳思政,等. 水分脅迫對短梗大參生理生化特征的影響[J]. 經(jīng)濟(jì)林研究,2016,34(3):99-104,186.
[18] 賈慧,其力木格,李特日根,等. 外源SNP對干旱脅迫下不同馬鈴薯品種葉片抗氧化酶活性的影響[J]. 西北植物學(xué)報,2016,36(3):551-557.
[19] 袁有波,李繼新,丁福章,等. 不同干旱脅迫對煙草葉片保護(hù)酶活性的影響[J]. 中國煙草科學(xué),2009,30(5):10-13.
(責(zé)任編輯:易" 婧)
基金項目:廣西壯族自治區(qū)大學(xué)生創(chuàng)新訓(xùn)練項目(S202210609206);2022年度百色市科學(xué)研究與技術(shù)開發(fā)計劃課題(百科20223722)。
作者簡介:韓素蒙(2002—),在讀本科生,主要從事作物栽培生理研究。E-mail:1580168301@qq.com。
*為通信作者,E-mail:337375159@qq.com。

