原兒茶酸對高脂血癥大鼠血脂代謝及MAPK通路的影響
摘要 目的:探究原兒茶酸(PCA)對高脂血癥大鼠血脂代謝及絲裂原活化蛋白激酶(MAPK)通路的影響。方法:將SD大鼠按照隨機數表法分為對照組、模型組、陽性藥物對照組(陽性組)、低PCA組和高PCA組,每組10只。對照組大鼠給予基礎對照飼料喂養,模型組、陽性組、低PCA組和高PCA組大鼠均給予45%高脂飼料喂養造模。建模第3周開始,陽性組大鼠每日給予阿伐他汀鈣溶劑(5 mg/kg)灌胃;低PCA組和高PCA組大鼠每日分別給予100 mg/kg和200 mg/kg的PCA溶劑灌胃;對照組和模型組大鼠每日分別灌胃等量的生理鹽水,各組大鼠均持續給藥4周。給藥過程中,每周分別測量各組大鼠的體質量。給藥結束時,各組大鼠采用腹腔1%戊巴比妥鈉麻醉,開胸腔后分離大鼠肝臟組織和采集腹主動脈血,分離收集血清。通過全自動生化分析儀檢測大鼠血清中總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)和高密度脂蛋白膽固醇(HDL-C)水平。采用試劑盒檢測各組大鼠肝臟和血清中丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽過氧化物酶(GSH-Px)水平,檢測血清白細胞介素(IL)-1β、IL-6和腫瘤壞死因子α(TNF-α)水平。采用逆轉錄-聚合酶鏈式反應(RT-PCR)檢測各組大鼠肝臟組織中膽固醇調節元件結合蛋白2(SREBP2)和3-羥基-3-甲基戊二酸單酰輔酶A還原酶(HMGCR)基因的相對表達量。采用蛋白質免疫印跡法(Western Blot)檢測各組大鼠肝臟組織中SREBP2、HMGCR、p38MAPK、磷酸化p38MAPK(p-p38MAPK)、胞外調節蛋白激酶(ERK)、磷酸化ERK(p-ERK)、Jun氨基末端激酶(JNK)和磷酸化JNK(p-JNK)表達水平。采用蘇木素-伊紅(HE)染色檢測各組大鼠肝臟組織的病變情況。結果:與對照組比較,模型組、陽性組、低PCA組和高PCA組大鼠肝臟指數、TC、TG、LDL-C、MDA、IL-1β、IL-6和TNF-α水平均升高(P<0.05),HDL-C、SOD和GSH-Px水平均降低(P<0.05);與模型組比較,陽性組、低PCA組和高PCA組大鼠肝臟指數、TC、TG、LDL-C、MDA、IL-1β、IL-6和TNF-α水平均降低(P<0.05),HDL-C、SOD和GSH-Px水平均升高(P<0.05)。與對照組比較,模型組、陽性組、低PCA組和高PCA組大鼠肝臟組織中HMGCR和SREBP2的mRNA和蛋白表達水平均升高(P<0.05),p38MAPK、ERK和JNK蛋白磷酸化水平均升高(P<0.05);與模型組比較,陽性組、低PCA組和高PCA組大鼠肝臟組織中HMGCR和SREBP2的mRNA和蛋白表達水平均降低(P<0.05),p38MAPK、ERK和JNK蛋白磷酸化水平均降低(P<0.05)。結論:原兒茶酸可有效調節高脂血癥大鼠的血脂水平,抑制肝臟組織的氧化應激反應和炎癥損傷,可能通過MAPK信號通路調節脂質合成與代謝水平,進而發揮降血脂作用。
關鍵詞 高脂血癥;原兒茶酸;脂代謝;絲裂原活化蛋白激酶通路;炎癥;實驗研究
doi:10.12102/j.issn.1672-1349.2024.20.006
Effects of Protocatechuic Acid on Lipid Metabolism and MAPK Pathway in Hyperlipidemia Rats
CHEN Liyuan1, MA Youwei2, DAI Qing1, LIU Yang1, ZHAO Xiaochen3
1.Lintong Rehabilitation Center of Joint Logistics Support Force, Xi′an 710699, Shaanxi, China; 2.Gansu Province Central Hospital, Lanzhou 730050, Gansu, China; 3.The 940th Hospital of Joint Logistics Support Force, Lanzhou 730050, Gansu, China
Corresponding Author MA Youwei, E-mail: 78250989@qq.com
Abstract Objective:To explore the effects of protocatechuic acid on lipid metabolism and mitogen-activated protein kinase(MAPK) pathway in hyperlipidemia rats.Method:SD rats were randomly divided into control group,high fat model group,positive drug control group(positive group),low dose protocatechuic acid group(low PCA group) and high dose protocatechuic acid group(high PCA group) according to random number table,with 10 rats in each group.The rats in the control group were fed a basal control diet,while the rats in the model group,positive group,low PCA group,and high PCA group were fed a 45% high-fat diet for modeling.At the 3rd week of modeling,rats in the positive group were administered daily with atorvastatin calcium solvent(5 mg/kg).The rats in the low PCA group and high PCA group were given PCA solvent 100 mg/kg and 200 mg/kg daily,respectively.Rats in the control group and model group were administered the same volume of normal saline intragastrically every day,and all rats in each group received continuous medication for 4 weeks.The body weight of each group was measured weekly.At the end of the administration,1% sodium pentobarbital was injected into the abdominal cavity for anesthetization.The liver tissue and abdominal aortic blood were then separated,and serum was collected after thoracotomy.The contents of total cholesterol(TC),triglyceride(TG),low-density lipoprotein cholesterol(LDL-C) and high-density lipoproteincholesterol(HDL-C) in serum of rats were detected by automatic biochemical analyzer.The contents of malonaldehyde(MDA),superoxide dismutase(SOD) and glutathione peroxidase(GSH-Px) in liver and serum of rats in each group were detected by the kit,and the levels of interleukin(IL)-1β,IL-6 and TNF-α in serum were detected by the kit.The relative expression levels of cholesterol regulatory element binding protein 2(SREBP2) and 3-hy-droxy-3-methylglutaryl-coenzyme areductase(HMGCR) genes in liver tissues of each group were detected by reverse transcription-polymerase chain reaction(RT-PCR).The expression levels of SREBP2,HMGCR,p38MAPK,phosphorylated p38MAPK(p-p38MAPK),extracellular signal-regulated kinase(ERK),phosphorylated ERK(p-ERK),JNK,and p-JNK in rat liver tissues of each group were detected by Western Blot.The pathological changes of rat liver tissue in each group were detected by hematoxylin-eosin(HE) staining.Result:Compared with control group,liver index and the levels of TC,TG, LDL-C,MDA,IL-1β,IL-6,and TNF-α in model group,positive group,low PCA group and high PCA group increased(P<0.05),while the levels of HDL-C,SOD,and GSH-Px decreased(P<0.05).Compared with model group,liver index and the levels of TC,TG,LDL-C, MDA,IL-1β,IL-6,and TNF-α in positive group,low PCA group,and high PCA group decreased(P<0.05),while the levels of HDL-C,SOD,and GSH-Px increased(P<0.05).Compared with the control group,the mRNA and protein expression levels of HMGCR and SREBP2 in liver tissues of model,positive,low PCA,and high PCA groups were increased(P<0.05),and the protein phosphorylation levels of p38MAPK,ERK,and JNK were increased(P<0.05).Compared with model group,the mRNA and protein expression levels of HMGCR and SREBP2 in liver tissues of rats in positive,low PCA and high PCA groups were decreased(P<0.05), and protein phosphorylation levels of p38MAPK,ERK,and JNK were less(P<0.05).Conclusion:PCA can effectively regulate blood lipid levels in hyperlipidemia rats,inhibit oxidative stress response and inflammatory damage in liver tissue,and may regulate lipid synthesis and metabolism through MAPK signaling pathway,thus playing some role in lowering blood lipid.
Keywords hyperlipoidemia; protocatechuic acid; lipid metabolism; mitogen-activated protein kinase pathway; inflammatory; experimental study
基金項目 甘肅省科技計劃項目(創新基地和人才項目)(No.21JR7RA013)
作者單位 1.聯勤保障部隊臨潼康復療養中心(西安 710699);2.甘肅省中心醫院(蘭州 730050);3.聯勤保障部隊第九四〇醫院(蘭州 730050)
通訊作者 馬有偉,E-mail:78250989@qq.com
引用信息 陳麗媛,馬有偉,戴慶,等.原兒茶酸對高脂血癥大鼠血脂代謝及MAPK通路的影響[J].中西醫結合心腦血管病雜志,2024,22(20):3689-3696.
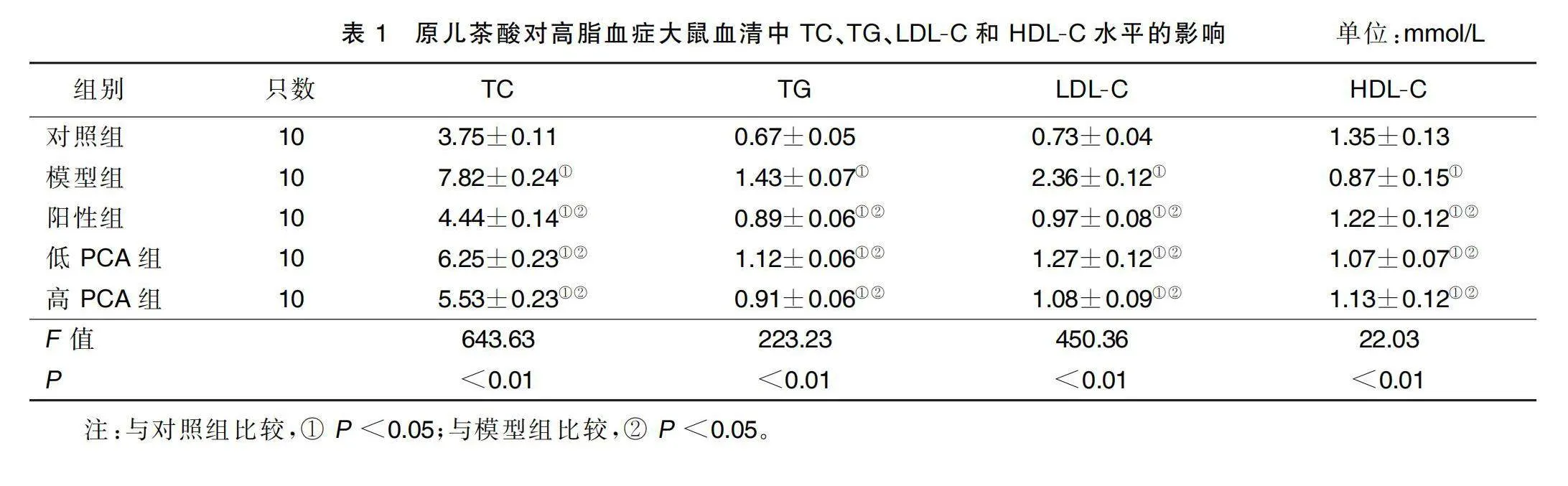
高脂血癥(hyperlipoidemia,HLP)通常被稱為高血脂,主要由于機體內脂代謝和運行異常,導致血漿中一種或多種脂質水平偏高或偏低而形成的一種全身代謝性疾病[1-2]。目前臨床上對于高脂血癥的判定主要根據血漿中總膽固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白膽固醇(low-density lipoprotein cholesterol,HDL-C)這4種脂質指標的變化來確定。在成人中,高血脂已被證明是誘發動脈粥樣硬化、冠心病和腦卒中等心血管疾病的主要危險因素[3]。因此,對于高脂血癥的預防和治療目前仍然是公共衛生領域的巨大難題。
原兒茶酸(protocatechuic acid,PCA)化學名為3,4-二羥基苯甲酸,是廣泛存在于蔬菜、水果和藥材中的一種酚酸類產物,花青素是其主要的來源之一[4]。一些研究表明,原兒茶酸具有廣泛的抗炎、抗氧化、抗菌、自由基清除、抗癌和抗菌等活性,具有降低心血管疾病風險和保護肝臟和腎臟等作用[5]。動物實驗表明,在不同劑量原兒茶酸喂飼處理的糖尿病模型大鼠中,PCA可以有效提高過氧化氫酶(catalase,CAT)和谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶的活性,降低血清中丙二醛(malondialdehyde,MDA)水平,減少活性氧(reactive oxygen species,ROS)的積累[6-7]。對載脂蛋白E(ApoE)基因缺陷型小鼠補充原兒茶酸飲食處理后,小鼠主動脈中膽固醇的積累顯著減少[8]。諸多研究結果表明,原兒茶酸存在通過抗炎或抗氧化等途徑調節血脂代謝的可能。
絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路廣泛存在于哺乳動物體內,參與調節多種生理和病理過程,如細胞的分化、增殖和凋亡等[9],近年來,研究發現MAPK信號通路與脂類代謝疾病(如脂肪肝)存在緊密關系。Nandipati等[10]研究顯示MAPK及其亞型信號通路的激活能夠引起脂質代謝相關的調節蛋白表達異常,進而引發非酒精性脂肪肝的發生和發展。肥胖作為代謝類疾病的典型,也被認為可能是由于病人體內游離的脂肪酸和炎性因子過多而激活了MAPK途徑,進而影響脂類代謝和胰島素的功能紊亂[11]。有研究報道,原兒茶酸通過抑制MAPK途徑降低RAW264.7細胞中白細胞介素1β(IL-1β)等促炎因子水平而抑制炎癥的發生[12]。但目前原兒茶酸對哺乳動物血脂代謝的調節機制以及是否可能與MAPK通路存在關聯尚未明確,本研究旨在通過不同濃度原兒茶酸處理高脂血癥模型大鼠,以探討原兒茶酸在大鼠中對于血脂代謝的調節作用以及與MAPK通路的關聯機制。
1 材料與方法
1.1 材料
1.1.1 試劑和儀器
原兒茶酸(純度≥98%,貨號P104382)購自上海阿拉丁生化科技股份有限公司;阿托伐他汀鈣片購自美國輝瑞制藥有限公司(國藥準字J20030047);TC(貨號A111-1-1)、TG(貨號A110-1-1)、LDL-C(貨號A113-1-1)和HDL-C(貨號A112-1-1)試劑盒購自南京建成生物工程研究所有限公司;MDA(貨號BC0020)、超氧化物歧化酶(SOD,貨號BC0170)和GSH-Px(貨號BC1195)含量檢測試劑盒購自北京索萊寶科技有限公司;IL-1β(貨號PI303)、IL-6(貨號PI328)和TNF-α(貨號PT516)酶聯免疫吸附實驗(ELISA)試劑盒購自上海碧云天生物技術有限公司;RevertAid RT試劑盒(貨號K1691)購自美國Thermo公司;一抗膽固醇調節元件結合蛋白2(SREBP2)、3-羥基-3-甲基戊二酸單酰輔酶A還原酶(HMGCR)、p38MAPK、磷酸化p38MAPK(p-p38MAPK)、胞外調節蛋白激酶(ERK)、磷酸化ERK(p-ERK)、C-Jun氨基末端激酶(JNK)、磷酸化JNK(p-JNK)、甘油醛-3-磷酸脫氫酶(GAPDH)和IgG-HRP二抗均購自英國Abcam公司;蘇木素-伊紅(HE)染色試劑盒(貨號C0105S)購自上海碧云天生物技術有限公司;PUZS-300全自動生化分析儀購自上海帝博思生物科技有限公司。
1.1.2 動物和飼料
無特定病原體(SPF)級雄性SD大鼠,6周齡,體質量195~210 g,購自陜西醫藥控股集團生物制品有限公司[SCXK(陜)2018-001]。飼養在動物實驗室屏障環境,溫度(24±2)℃,濕度(50±5)%,12 h光暗交替,每日早晚喂食,不限制飲水。45%高脂飼料(貨號TP 23000)和基礎對照飼料(型號LAD3001G)均購自南通特洛菲飼料科技有限公司。
1.2 方法
1.2.1 分組處理與動物建模
SD大鼠適應性喂養1周后,將大鼠按照隨機數表法分為對照組、模型組、陽性藥物對照組(陽性組,阿托伐他汀鈣片,每片10 mg)、低PCA組和高PCA組,每組10只大鼠。對照組大鼠給予基礎對照飼料喂養,模型組、陽性組、低PCA組和高PCA組大鼠均給予45%高脂飼料喂養造模。建模2周時,各組大鼠禁食12 h,分別取尾血,按照試劑盒所述步驟檢測血清中TC、TG、LDL-C和HDL-C水平,造模大鼠血清中TC、TG和LDL-C水平明顯升高,HDL-C水平明顯降低,則表示造模成功。第3周開始,陽性組大鼠每日給予阿伐他汀鈣溶劑灌胃,劑量為5 mg/kg;低PCA組和高PCA組大鼠每日分別給予劑量為100 mg/kg和200 mg/kg的原兒茶酸溶劑灌胃;對照組和模型組大鼠每日分別灌胃等量的生理鹽水。各組大鼠均持續給藥4周。
1.2.2 大鼠體質量和肝臟質量檢測
給藥過程中,每周分別測量各組大鼠的體質量。給藥結束時,各組大鼠采用腹腔1%戊巴比妥鈉麻醉,開胸腔后采集腹主動脈血,然后血液樣品在3 500 r/min離心(4 ℃)10 min,分離血清保存于-80 ℃備用。然后采集各組大鼠肝臟,采用生理鹽水處理洗凈后稱重,然后一部分于-80 ℃留存備用,另一部分采用4%的多聚甲醛固定,用于fdnsX6v/9VXpZ9/bqFY+7g==后續切片制作和組織學觀察。肝臟系數=肝臟質量/體質量×100%。
1.2.3 大鼠血清血脂指標水平測定
取采集的各組大鼠血清,分別采用全自動生化分析儀檢測大鼠血清中TC、TG、LDL-C和HDL-C含量。
1.2.4 大鼠血清氧化應激指標水平測定
稱取各組大鼠備用肝臟組織各1 g,與預冷的1×磷酸緩沖鹽溶液(PBS)混合后冰浴充分勻漿,懸濁液于8 000 r/min低溫離心10 min,取上清液-20 ℃保存待檢測。分別取各組大鼠保存的血清和肝臟組織勻漿上清液,嚴格按照試劑盒操作說明步驟檢測各組大鼠肝臟和血漿中MDA、SOD和GSH-Px的含量。
1.2.5 大鼠血清炎性指標水平測定
分別取各組大鼠保存的血清,嚴格按照ELISA試劑盒操作說明步驟檢測各組大鼠血清中白細胞介素-1β(interleukin-1β,IL-1β)、白細胞介素-6(interleukin-6,IL-6)和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)的含量。
1.2.6 逆轉錄-聚合酶鏈反應(RT-PCR)檢測SREBP2和 HMGCR基因表達
分別取各組大鼠保存的肝臟組織,采用Trizol試劑提取總RNA。然后使用Thermo Scientific RevertAid RT試劑盒以總RNA為模板逆轉錄合成cDNA。通過TB GreenTM Premix Ex TaqTM(Tli RNaseH Plus)試劑盒按照50 μL體系進行PCR反應,擴增程序條件為:95 ℃預變性5 min,95 ℃變性35 s,58 ℃退火45 s,72 ℃延伸40 s,共35個循環。GAPDH作為內參蛋白,采用2-ΔΔCt法計算SREBP2和 HMGCR基因的相對表達量。SREBP2引物序列:正向引物為5′-CTGACCACAATGCCGGTAAT-3′,反向引物為5′-CTTGTGCATCTTGGCATCTG-3′;HMGCR引物序列:正向引物為5′-TGGCAGGACGCAACCTCTAC-3′,反向引物為5′-AATAGTTACCACTGACCGCCAGAA-3′;GAPDH引物序列:正向引物為5′-GCAAGTTCAACGGCACAG-3′,反向引物為5′-ATCCGTTCACACCGACCTTC-3′。
1.2.7 蛋白質免疫印跡法(Western Blot)檢測SREBP2、HMGCR、p38MAPK、ERK和JNK蛋白表達
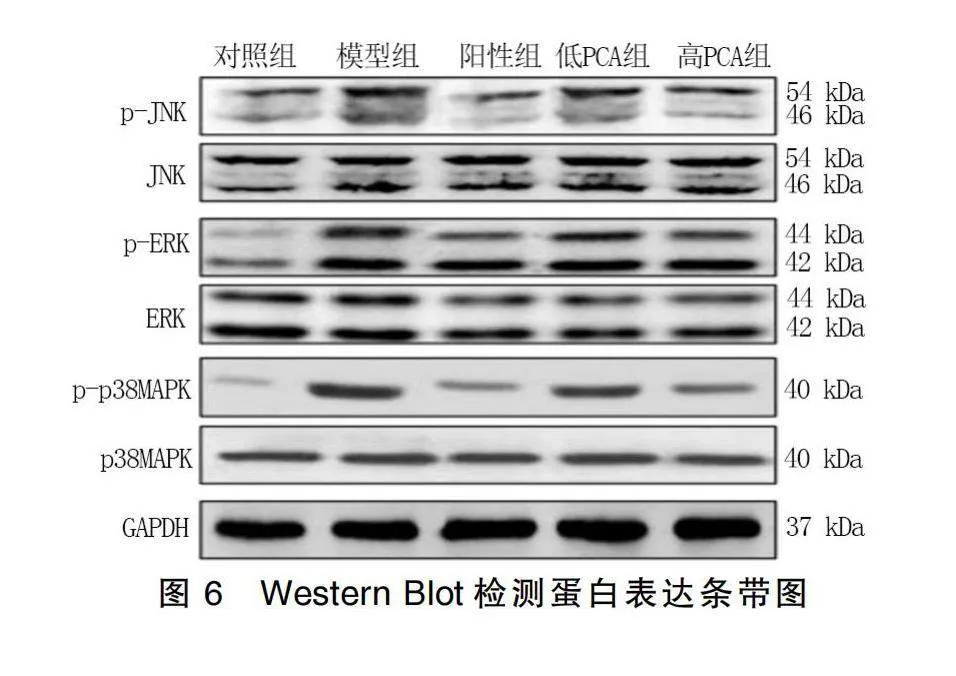
分別取各組大鼠保存的肝臟組織,加入含有磷酸酶抑制劑的RIPA裂解液中置于冰上充分勻漿處理,懸濁液于8 000 r/min低溫離心10 min,取上清液通過二喹啉甲酸(BCA)試劑盒進行蛋白定量分析。各組分別取等量蛋白上樣,采用10% SDS-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白,然后轉移至聚偏二氟乙烯(PVDF)膜。將膜與含有5% BSA的TBS-T溶液于室溫下封閉孵育處理2 h。然后分別加入按比例稀釋后的一抗SREBP2(1∶2 000)、HMGCR(1∶2 000)、p38MAPK(1∶1000)、p-p38 MAPK(1∶1 000)、ERK(1∶1 000)、p-ERK(1∶1 000)、JNK(1∶1 000)、p-JNK(1∶1 000)和GAPDH(1∶2 000),于4 ℃下孵育過夜處理。第2天采用TBS-T溶液洗膜3次,然后加入IgG-HRP二抗(1∶2 000)于室溫下孵育處理1 h后TBS-T溶液沖洗。采用電化學發光法(ECL)顯影后凝膠成像,通過Image J軟件對蛋白進行灰度值分析。
1.2.8 大鼠肝臟組織HE染色
分別取各組大鼠采用4%多聚甲醛固定的肝臟組織,蒸餾水洗滌后,再經過乙醇脫水、透明和石蠟包埋,制備4 μm切片,按照HE染色試劑盒的說明方法進行HE染色,每組隨機選擇5個切片,在光學顯微鏡下(×400)觀察大鼠肝臟病變情況。
1.3 倫理審查
本研究得到聯勤保障部隊第九四○醫院醫學倫理委員會審批(審批號:2021KYLL178)。
1.4 統計學處理
采用SPSS 21.0軟件進行數據統計學分析,GraphPad Prism 18.0軟件用于數據作圖分析,符合正態分布的定量資料以均數±標準差(x±s)表示,各組間數據差異分析采用單因素方差分析和LSD檢驗。以P<0.05為差異有統計學意義。
2 結 果
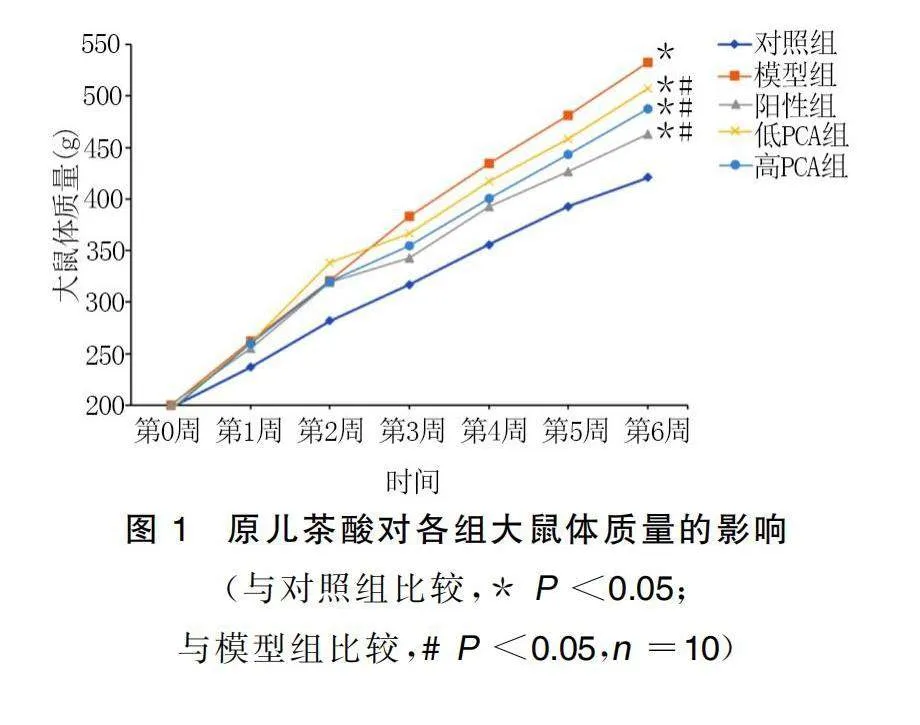
2.1 原兒茶酸對高脂血癥大鼠體質量和肝臟指數的影響
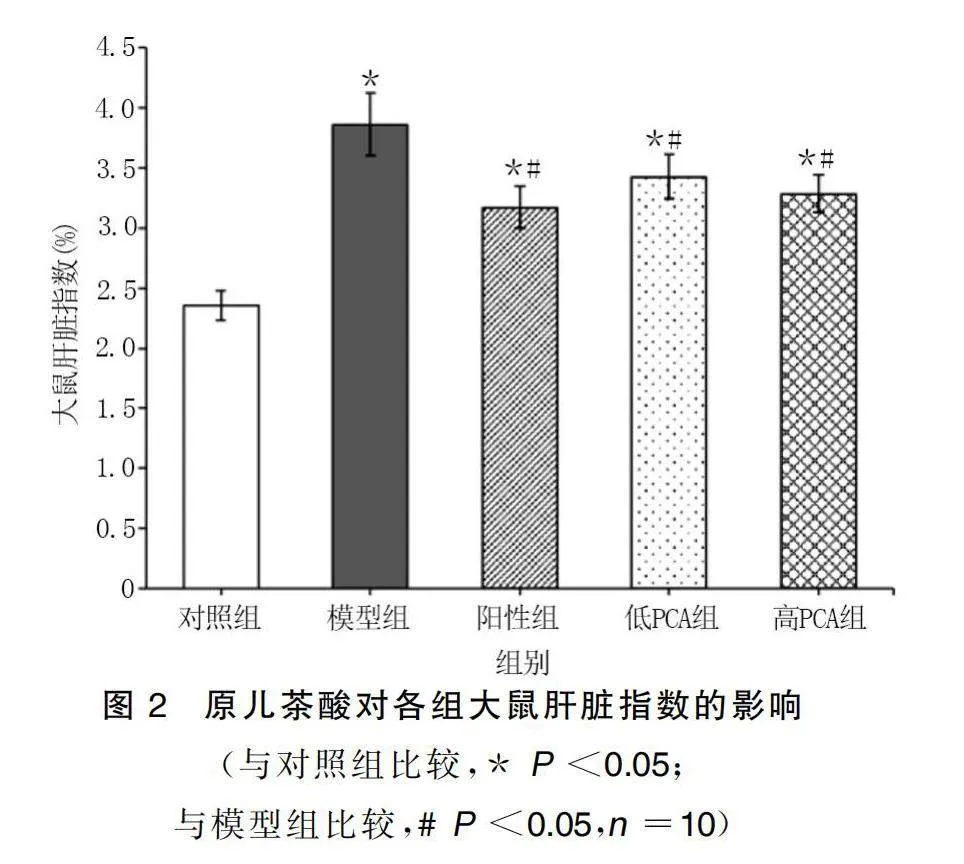
與對照組比較,模型組大鼠體質量持續增長。給藥處理后,與對照組比較,陽性組、低PCA組、高PCA組大鼠體質量升高(P<0.05),但增長速率降低;與模型組比較,陽性組、低PCA組、高PCA組大鼠體質量降低(P<0.05)。給藥結束后,與對照組比較,模型組、陽性組、低PCA組和高PCA組大鼠肝臟指數升高(P<0.05);與模型組比較,陽性組、低PCA組和高PCA組大鼠肝臟指數降低(P<0.05)。詳見圖1、圖2。
2.2 原兒茶酸對高脂血癥大鼠血脂水平的影響
給藥結束后,與對照組比較,模型組、陽性組、低PCA組、高PCA組大鼠TC、TG和LDL-C水平升高(P<0.05),HDL-C水平降低(P<0.05);與模型組比較,陽性組、低PCA組、高PCA組大鼠TC、TG和LDL-C水平降低(P<0.05),HDL-C水平升高(P<0.05)。詳見表1。
2.3 原兒茶酸對高脂血癥大鼠氧化應激水平的影響
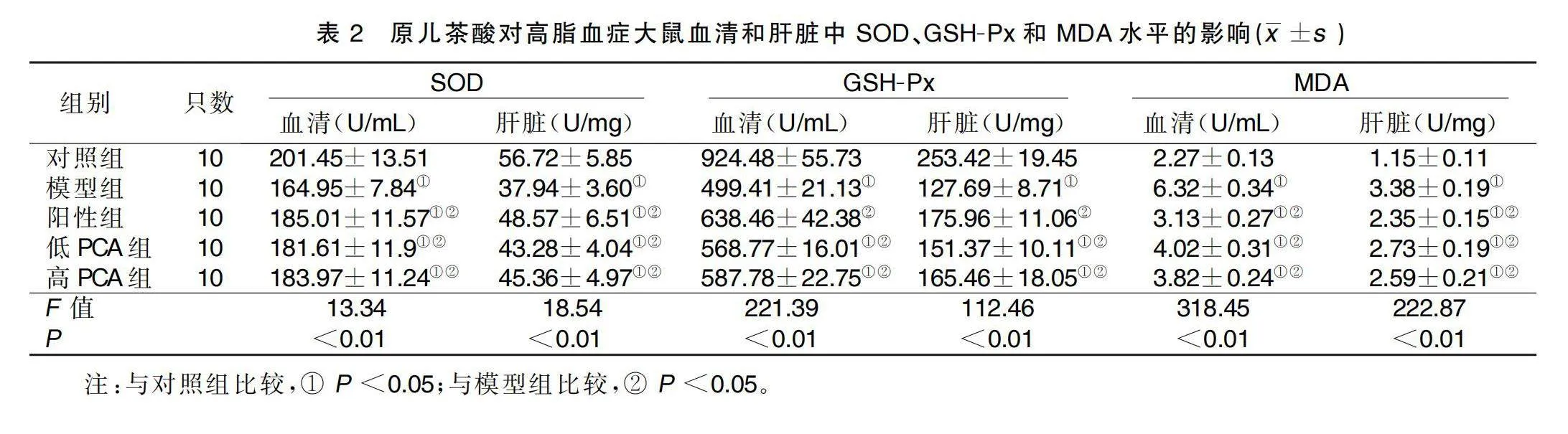
給藥結束后,與對照組比較,模型組、陽性組、低PCA組、高PCA組大鼠血清和肝臟中SOD、GSH-Px水平均降低(P<0.05),MDA水平升高(P<0.05);與模型組比較,陽性組、低PCA組、高PCA組大鼠血清和肝臟中SOD、GSH-Px水平均升高(P<0.05),MDA水平降低(P<0.05)。詳見表2。
2.4 原兒茶酸對高脂血癥大鼠炎癥水平的影響
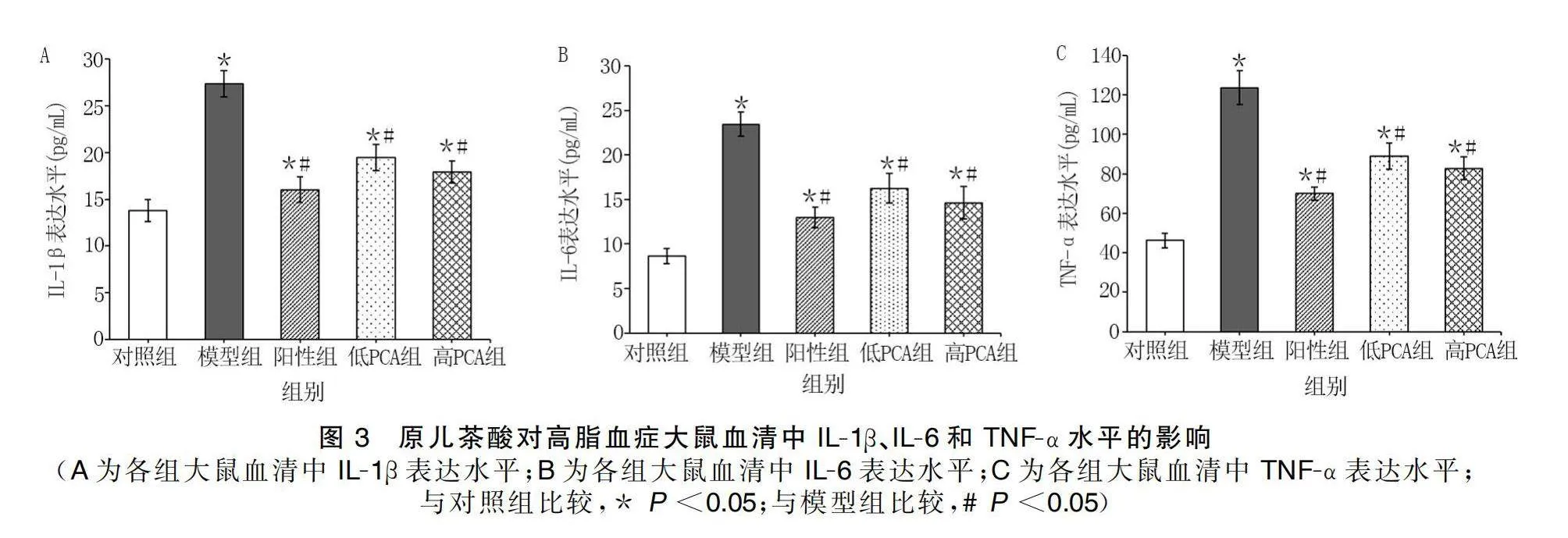
給藥結束后,與對照組比較,模型組、陽性組、低PCA組、高PCA組大鼠血清中IL-1β、IL-6和TNF-α水平均升高(P<0.05);與模型組比較,陽性組、低PCA組、高PCA組大鼠血清中IL-1β、IL-6和TNF-α水平均降低(P<0.05)。詳見圖3。
2.5 原兒茶酸對高脂血癥大鼠肝臟組織中HMGCR和SREBP2的mRNA和蛋白表達水平的影響
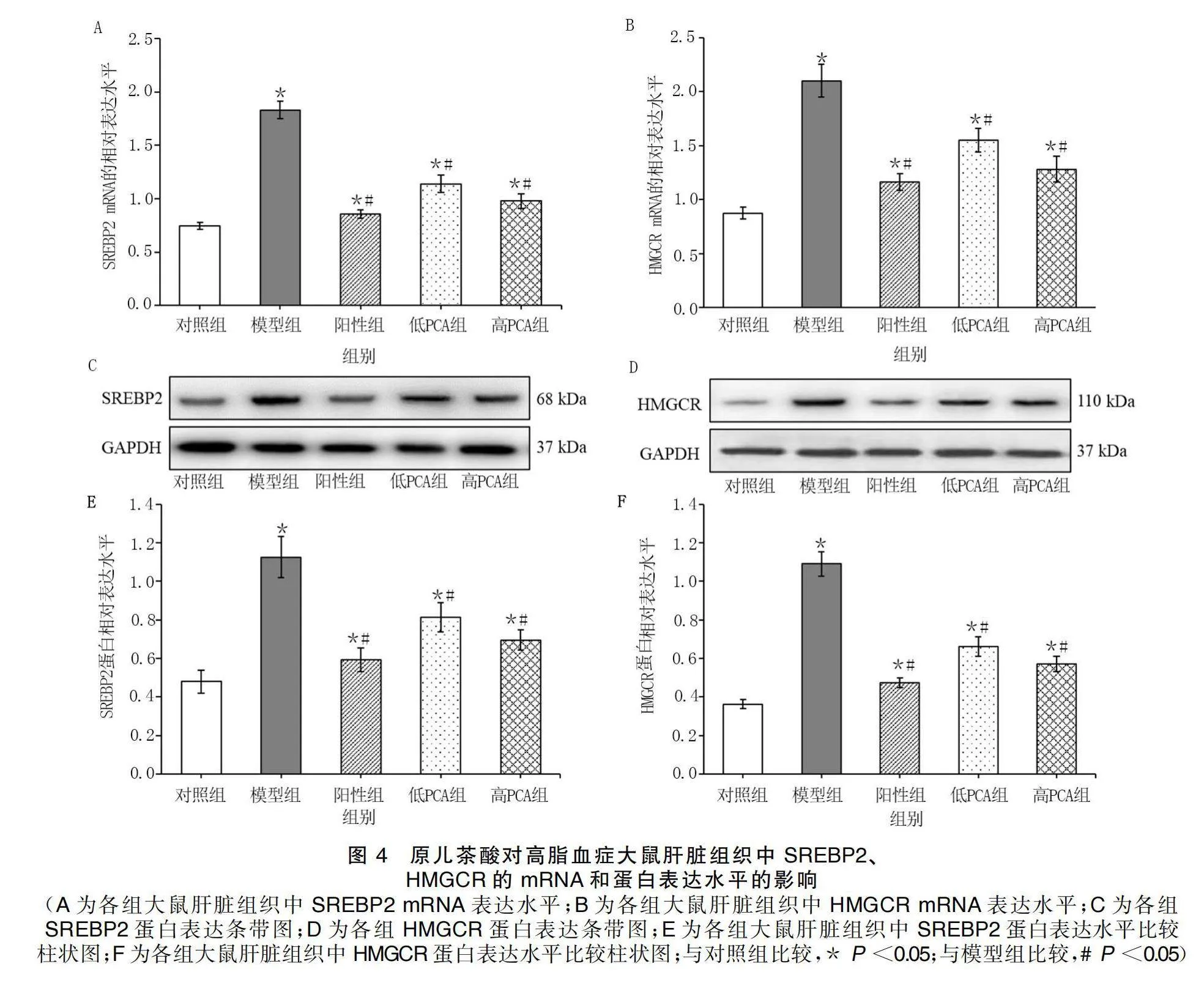
給藥結束后,與對照組比較,模型組、陽性組、低PCA組和高PCA組大鼠肝臟組織中HMGCR和SREBP2的mRNA和蛋白表達水平均升高(P<0.05);與模型組比較,陽性組、低PCA組和高PCA組大鼠肝臟組織中HMGCR和SREBP2的mRNA和蛋白表達水平均降低(P<0.05)。詳見圖4。
2.6 原兒茶酸對高脂血癥大鼠肝臟組織病理的影響
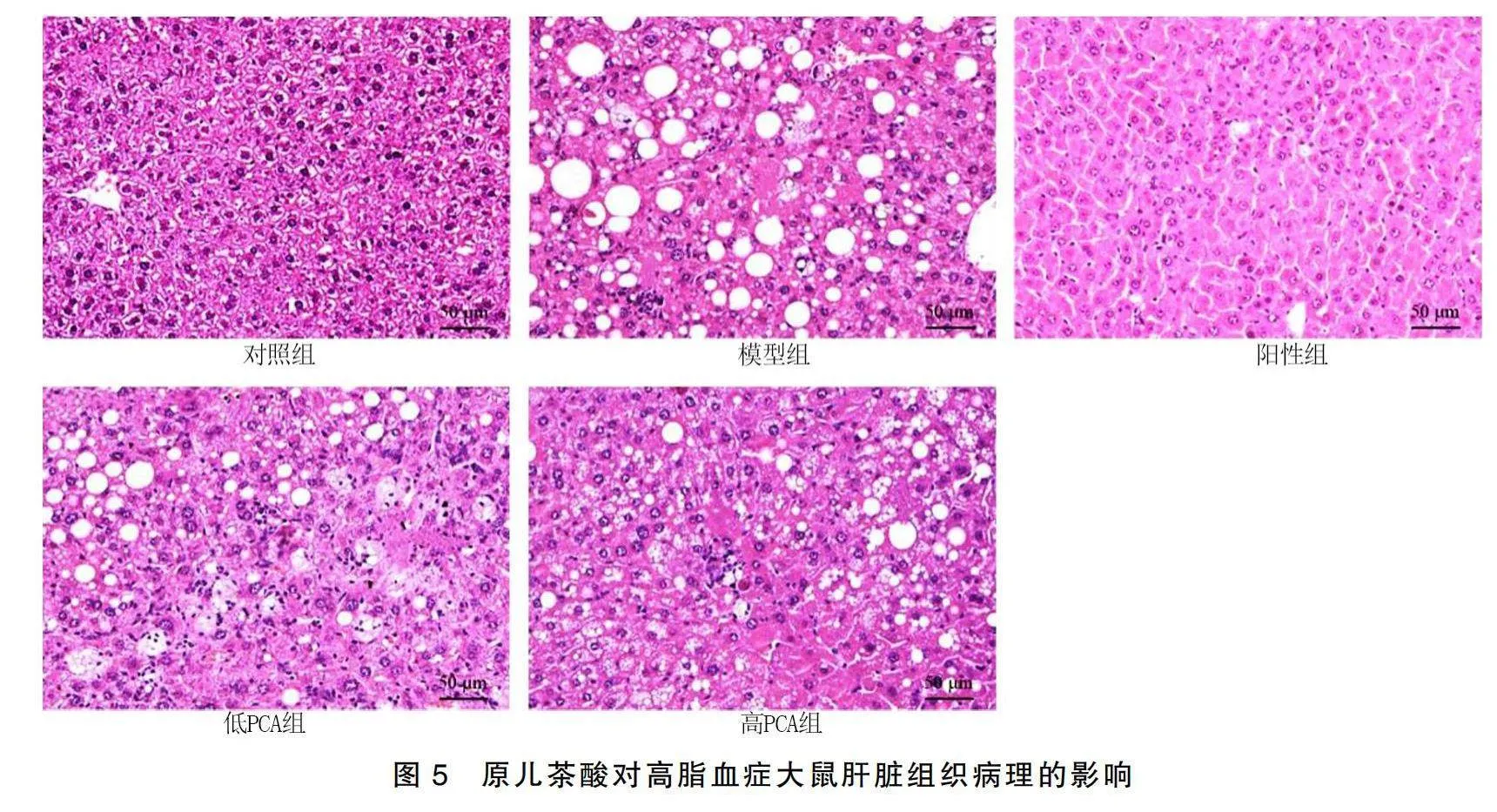
HE染色結果顯示,對照組大鼠肝臟組織結構正常,細胞排列整齊,無病理狀態,肝細胞內也無脂肪滴分布。模型組大鼠肝臟組織病變嚴重,細胞混亂排列,肝細胞漿內出現數量多、體積大的透明空泡,主要為脂肪滴,同時出現少量炎性細胞浸潤。陽性組大鼠肝臟組織病變程度較輕,細胞排列較為整齊,肝細胞內出現少量的脂肪滴。與模型組比較,低PCA組和高PCA組大鼠肝臟組織病變程度降低,也未發現明顯的炎性細胞浸潤,肝細胞漿內也出現部分大小不一的透明空泡,但數量和分布密度比模型組低,同時高PCA病變程度也更輕。詳見圖5。
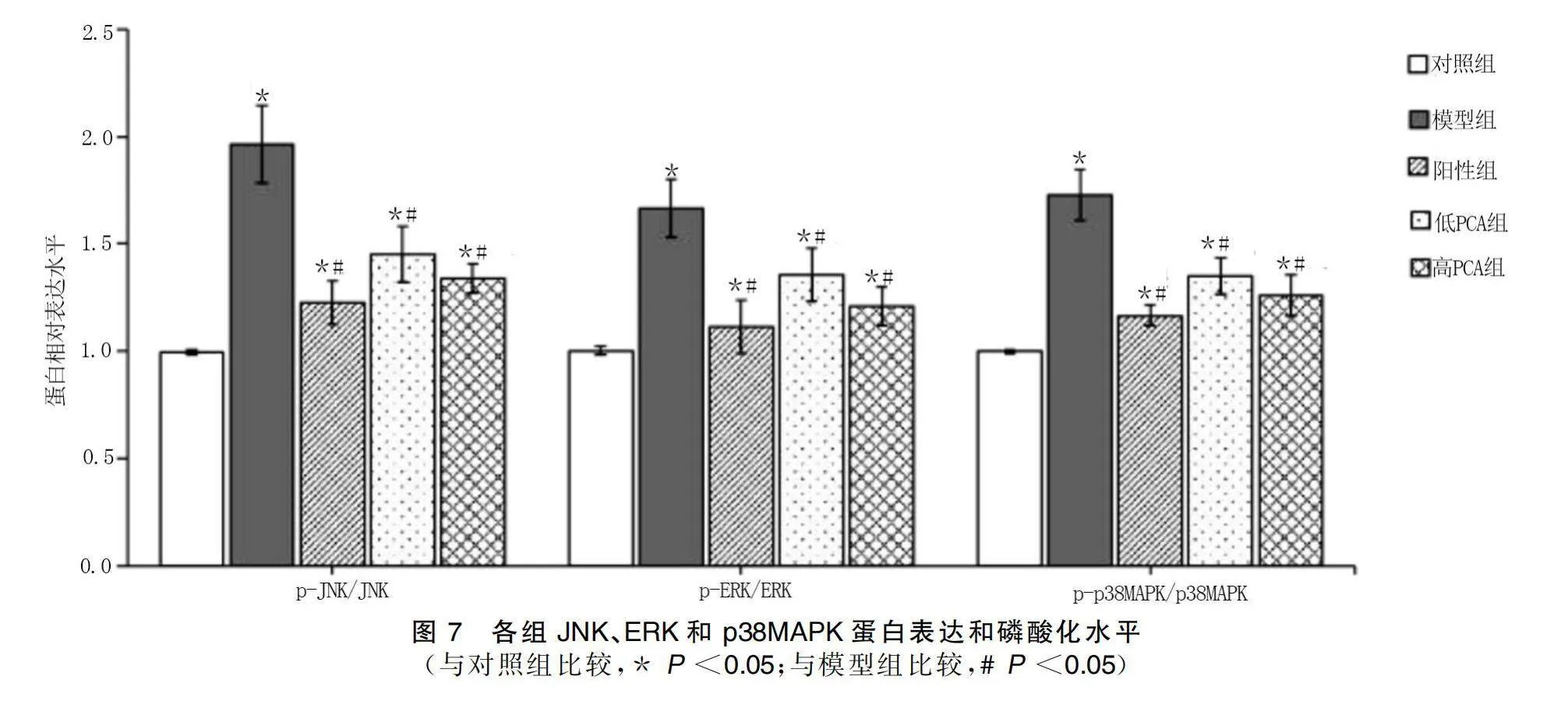
2.7 原兒茶酸對高脂血癥大鼠MAPK通路的影響
給藥結束后,與對照組比較,模型組、陽性組、低PCA組和高PCA組大鼠肝臟組織中p38MAPK、ERK和JNK蛋白磷酸化水平均升高(P<0.05);與模型組比較,陽性組、低PCA組和高PCA組大鼠肝臟組織中p38MAPK、ERK和JNK蛋白磷酸化水平均降低(P<0.05)。詳見圖6、圖7。
3 討 論
高脂血癥作為一種全身性的代謝疾病,已被證明是誘發動脈粥樣硬化、冠心病和腦卒中等心血管疾病的主要危險因素。高脂血癥發生可能存在先天性遺傳的因素,如家族性高膽固醇血癥(familial hypercholesterolemia,FH);而更多的是受到年齡、不良飲食和作息習慣、精神和情緒活動以及其他未知環境因素的影響引發血脂異常導致的[2]。目前臨床上以血清中脂質指標(TG、TC、LDL-C和HDL-C)其中有異于正常值的,可初步認定為高脂血癥[13],而對于高脂血癥的治療效果的判斷也多是參考該4項指標的變化。薛婧[14]通過聯合用藥治療高脂血癥老年病人,結果顯示,聯合用藥后病人TC、TG和LDL-C水平降低,而HDL-C水平明顯升高;而Saadat等[15]也通過TG、TC、LDL-C和HDL-C水平的變化來確定高脂血癥大鼠模型構建成功與否。本研究中,首先在建模第2周檢測大鼠尾血中脂質指標,結果發現TG、TC和LDL-C水平降低,HDL-C水平升高,表示高脂血癥大鼠模型構建成功。通過給予降脂藥物阿伐他汀鈣和不同濃度原兒茶酸治療后,相較于模型組,接受藥物治療的大鼠血清中TG、TC和LDL-C水平均明顯降低,HDL-C水平明顯升高,表明原兒茶酸具有潛在的降低脂質指標功能。
臨床和動物實驗研究表明,代謝疾病的發生發展多與自由基代謝和氧化應激反應紊亂密切相關。當機體內血脂水平升高時,細胞和組織中多不飽和脂肪酸容易受到自由基的攻擊而引發過氧化反應,產生大量脂質過氧化物,最終導致代謝異常[16]。MDA是脂質過氧化反應的產物,對細胞和組織結構產生損傷和破壞作用[17]。SOD和GSH-Px作為機體內的抗氧化成員,都具有清除氧自由基的作用[18]。原兒茶酸已在過往的研究中被證明具有優良的抗氧化和抗炎癥能力,王麗惠等[19]研究發現原兒茶酸能夠提高免疫性肝損傷小鼠肝組織中內源性抗氧化酶活力,以及增強對氧自由基的清除能力。本研究中,高血脂模型大鼠血清和肝臟中SOD和GSH-Px水平均降低,且MDA水平升高,說明高脂飲食引發的機體血脂水平異常導致體內脂質過氧化反應水平升高。給予原兒茶酸治療后,大鼠血清和肝臟中SOD和GSH-Px水平均升高,且MDA水平降低,說明大鼠體內的脂質過氧化反應過程受到抑制調控,這也進一步證實了原兒茶酸的抗氧化能力。
近年來,原兒茶酸的抗炎作用研究報道逐漸增多,潘敏等[4]研究發現原兒茶酸可以抑制子宮內膜異位癥大鼠體內的炎癥反應,并抑制血管生成;Zhang等[20]研究結果顯示,原兒茶酸能夠降低3T3-L1細胞中的炎癥水平。本研究中,模型組大鼠血清中促炎因子IL-1β、IL-6和TNF-α水平均升高,表明高脂飲食引發大鼠機體產生炎癥反應。給予原兒茶酸治療后,大鼠血清中促炎因子IL-1β、IL-6和TNF-α水平均降低,表明原兒茶酸一定程度上抑制了大鼠機體內炎癥水平。同時通過對大鼠肝臟組織進行HE染色分析病理變化發現,高脂飲食誘導模型組大鼠的肝臟組織出現明顯的嚴重病變,由于機體氧化應激和炎癥反應的發生,導致細胞和組織中脂質氧化變性,形成大量脂質空泡,還伴有炎性細胞浸潤。給予原兒茶酸治療的大鼠,肝臟組織病變程度降低,脂質空泡的比例明顯降低,提示原兒茶酸影響了高脂血癥大鼠的肝臟組織病變進程。
HMGCR是體內肝臟中催化膽固醇合成的限速酶,直接關系膽固醇的合成速度和機體內含量[21]。 SREBP2是體內膽固醇合成和轉化的關鍵調節因子[22]。Hu等[23]研究顯示,阿托伐他汀酯可能通過調節過氧化物酶體增殖物激活受體(PPAR)信號通路和HMGCR基因的表達來改善高脂血癥大鼠的代謝紊亂。Shimano等[24]研究認為細胞內膽固醇水平降低時,調節因子SREBP2會促進HMGCR表達水平升高,進而上調膽固醇的合成水平。本研究中,高脂血癥大鼠給予原兒茶酸治療后,肝臟組織中HMGCR和SREBP2的mRNA和蛋白表達水平均降低。由此推測原兒茶酸有效下調了大鼠肝組織中SREBP2的表達水平,進而降低了膽固醇合成限速酶HMGCR及其他相關基因的表達,從而表現出降低血脂水平的功能。
近年來,研究發現MAPK信號通路與脂類代謝疾病(如脂肪肝)存在緊密關系,Nandipati等[10]認為非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)的發生發展可能與MAPK信號通路被磷酸化激活有關,如JNK和p38MAPK等亞型通路被激活后會引發脂質合成和分解相關蛋白的表達異常而最終發病。有研究發現,通過抑制MAPK通路的激活,可以降低NAFLD大鼠肝細胞中炎癥反應水平,調節大鼠機體內脂質代謝的紊亂情況。本研究中,高脂血癥模型大鼠的肝臟組織中p38MAPK、ERK和JNK蛋白磷酸化水平均升高,通過給予原兒茶酸治療后,大鼠肝臟組織中p38MAPK、ERK和JNK蛋白磷酸化水平均明顯降低。說明高脂血癥的發生發展與MAPK信號通路的過度激活有關,而原兒茶酸能夠一定程度上抑制MAPK信號通路上p38MAPK、ERK和JNK蛋白的磷酸化水平,進而改善高脂血癥的病理進展。
綜上所述,原兒茶酸可有效調節高脂血癥大鼠的血脂水平,抑制肝臟組織的氧化應激反應和炎癥損傷,可能通過MAPK信號通路調節脂質合成與代謝水平,進而發揮改善高脂血癥發生發展進程的功能。
參考文獻:
[1] STEWART J,MCCALLIN T,MARTINEZ J,et al.Hyperlipidemia[J].Pediatrics in Review,2020,41(8):393-402.
[2] 劉燕紅.中國人群高脂血癥遺傳風險和環境因素調查[D].合肥:安徽大學,2017.
[3] 李洪銘,謝曉瑩,陳振華,等.中藥降血脂機制研究進展[J].海峽藥學,2021,33(7):37-40.
[4] 潘敏,王曉莉,胡婷,等.原兒茶酸對子宮內膜異位癥大鼠炎癥反應及血管生成的作用機制研究[J].河北醫學,2023,29(1):81-85.
[5] ZHANG J L,FU B,CHEN X L,et al.Protocatechuic acid attenuates anterior cruciate ligament transection-induced osteoarthritis by suppressing osteoclastogenesis[J].Experimental and Therapeutic Medicine,2020,19(1):232-240.
[6] SEMAMING Y,KUMFU S,PANNANGPETCH P,et al.Protocatechuic acid exerts a cardioprotective effect in type 1 diabetic rats[J].The Journal of Endocrinology,2014,223(1):13-23.
[7] TAKEUCHI O,AKIRA S.Pattern recognition receptors and inflammation[J].Cell, 2010,140(6):805-820.
[8] WANG D L,WEI X Y,YAN X,et al.Protocatechuic acid, a metabolite of anthocyanins, inhibits monocyte adhesion and reduces atherosclerosis in apolipoprotein E-deficient mice[J].Journal of Agricultural and Food Chemistry,2010,58(24):12722-12728.
[9] ASL E R,AMINI M,NAJAFI S,et al.Interplay between MAPK/ERK signaling pathway and microRNAs:a crucial mechanism regulating cancer cell metabolism and tumor progression[J].Life Sciences,2021,278:119499.
[10] NANDIPATI K C,SUBRAMANIAN S,AGRAWAL D K.Protein kinases: mechanisms and downstream targets in inflammation-mediated obesity and insulin resistance[J].Molecular and Cellular Biochemistry,2017,426(1/2):27-45.
[11] LAWAN A,BENNETT A M.Mitogen-activated protein kinase regulation in hepatic metabolism[J].Trends in Endocrinology and Metabolism,2017,28(12):868-878.
[12] KHAN R S,BRIL F,CUSI K,et al.Modulation of insulin resistance in nonalcoholic fatty liver disease[J].Hepatology,2019,70(2):711-724.
[13] 李庚,曹文聰,譚俊,等.中醫藥治療高脂血癥臨床研究中復合結局指標應用情況分析[J].中醫雜志,2022,63(11):1037-1042.
[14] 薛婧.脂必泰膠囊聯合普羅布考治療高脂血癥臨床研究[J].現代藥物與臨床,2023,38(2):346-349.
[15] SAADAT S,BOSKABADY M H.Anti-inflammatory and antioxidant effects of rosuvastatin on asthmatic,hyperlipidemic,and asthmatic-hyperlipidemic rat models[J]. Inflammation,2021,44(6):2279-2290.
[16] 張森,洪芬芳,楊樹龍.肝脂質代謝與動脈粥樣硬化治療[J].中國比較醫學雜志,2021,31(8):122-127.
[17] 吳瑾,李寧,宋囡,等.基于脂質過氧化物介導線粒體能量損傷的痰阻氣機與動脈粥樣硬化的關系探討[J].時珍國醫國藥,2021,32(2):408-411.
[18] LIAO C Y,WU L Y,ZHONG W T,et al.Cellular antioxidant properties of Ischnoderma resinosum polysaccharide[J].Molecules,2022,27(22):7717.
[19] 王麗惠,張佳祥,劉雙平,等.原兒茶酸對刀豆蛋白A所致的免疫性肝損傷小鼠肝組織MDA、NO、SOD和GSH-Px表達的影響[J].實用肝臟病雜志,2021,24(3):323-326.
[20] ZHANG Q Z,GONZALEZ DE MEJIA E.Protocatechuic acid attenuates adipogenesis-induced inflammation and mitochondrial dysfunction in 3T3-L1 adipocytes by regulation of AMPK pathway[J].Journal of Functional Foods,2020,69:103972.
[21] LU X Y,SHI X J,HU A,et al.Feeding induces cholesterol biosynthesis via the mTORC1-USP20-HMGCR axis[J].Nature,2020,588(7838):479-484.
[22] OTENG A B,KERSTEN S.Mechanisms of action of trans fatty acids[J].Advances in Nutrition,2020,11(3):697-708.
[23] HU N,CHEN C Y,WANG J H,et al.Atorvastatin ester regulates lipid metabolism in hyperlipidemia rats via the PPAR-signaling pathway and HMGCR expression in the liver[J].International Journal of Molecular Sciences,2021,22(20):11107.
[24] SHIMANO H,SATO R.SREBP-regulated lipid metabolism: convergent physiology-divergent pathophysiology[J].Nature Reviews Endocrinology,2017,13(12):710-730.
(收稿日期:2023-04-16)
(本文編輯 王麗)

