不同溫度條件下老芒麥種子萌發特性和抗氧化生理研究
摘要:研究溫度影響種子吸脹過程中抗氧化生理的變化規律,對于揭示種子的萌發機制具有積極意義。本研究以老芒麥(Elymus sibiricus)種子為材料,探索在不同溫度(10℃,25℃和30℃)下種子萌發特性和吸脹過程中抗氧化生理變化。結果表明,與25℃相比,在10℃和30℃脅迫下,老芒麥種子的萌發率、發芽指數以及幼苗根長均顯著降低(P<0.05)。10℃對種子的影響更大,種子中過氧化物酶(Peroxidase,POD)、谷胱甘肽還原酶(Glutathione reductase,GR)、單脫氫抗壞血酸還原酶(Monodehydroascorbate reductase,MDHAR)活性和線粒體氧化型谷胱甘肽(Oxidized glutathione,GSSG)含量下降,發芽被抑制,萌發時間延遲。而30℃下種子中過氧化氫酶(Catalase,CAT)、POD,GR的活性和線粒體抗壞血酸(Ascorbic acid,AsA)、谷胱甘肽(Glutathione,GSH)、GSSG含量升高,繼而保證了種子的正常萌發進程。試驗結果為掌握種子吸脹過程中抗氧化生理的變化規律提供參考依據。
關鍵詞:老芒麥;溫度;種子吸脹;線粒體;抗氧化系統
中圖分類號:S543.9 文獻標識碼:A 文章編號:1007-0435(2024)10-3151-08
Study on Germination Characteristics and Antioxidant Physiology of Siberian wildrye Seeds under Different Temperature Conditions
SHI Jin-yu, SUN Shou-jiang, MA Wen, MAO Pei-sheng*
(College of Grass Science and Technology, China Agricultural University, Key Laboratory of Pratacultural Science,Beijing 100193, China)
Abstract:Study the effects of temperature on the antioxidant physiology of seed imbibition has a positive significance in revealing the seed imbibition and germination mechanism. The experiment used Siberian wildrye (Elymus sibiricus) seeds as materials to explore the changes in seed germination characteristics and antioxidant indexes during the imbibition process under different temperature conditions (10℃,25℃ and 30℃). The results showed that compared to 25℃,the seed germination percentage,germination index and root length of Siberian wildrye seedlings under 10℃ and 30℃ stress were decreased significantly (P <0.05). 10℃ had a greater impact on seeds. The activities of peroxidase (POD),monodehydroascorbate reductase (MDHAR),glutathione reductase (GR) and the content of mitochondrial oxidized glutathione (GSSG) in Siberian wildrye seeds were decreased at 10℃,while the germination was inhibited and the germination time was delayed. The activities of catalase (CAT),POD,GR and the contents of mitochondrial ascorbic acid (AsA),glutathione (GSH) and GSSG were increased at 30℃treatment,which maintained the normal process of seed germination. The results of our experiment provide a basis for further understanding the changes of antioxidant physiology during seed imbibition,and have reference value.
Key words:Siberian wildrye;Temperature;Seed imbibition;Mitochondria;Antioxidant system
收稿日期:2024-02-22;修回日期:2024-04-26
基金項目:鄉土草種種子干燥、引發、包衣、丸粒化技術研究(SJCZFY2022-4)資助
作者簡介:
石金玉(2001-),女,漢族,河北保定人,碩士研究生,主要從事草類種子生理與生產研究,E-mail:s20233243639@cau.edu.cn;*通信作者Author for correspondence,E-mail:maops@cau.edu.cn
種子是農業生產最基本的生產資料,是作物、牧草、草坪草種植生產的基礎條件。在植物的整個生命周期中,種子萌發是一個非常關鍵的階段,涉及多種形態結構變化、生理生化以及基因調控等代謝活動。通常將種子萌發分為3個階段。階段I是吸脹作用,種子迅速進行物理吸水,并開始修復線粒體等細胞器和生物大分子。階段II是萌動階段,種子重新啟動水代謝進程,吸收的速度放緩甚至停止,通過生物大分子的修復和細胞器的激活,種胚細胞重新生長,在此過程中,種子的含水量相對穩定。階段III是種子發芽階段,這時種胚細胞的分裂和分化速度顯著增加,胚根從種皮伸出,加速吸收水分[1]。
溫度、水分以及光照等環境因素都會對種子的萌發造成一定的影響[2]。其中,溫度條件是影響種子萌發的各項因素中最重要的外部因素之一[3]。有學者發現部分牧草種子在低于15℃或高于35℃時都不能很好地萌發[4]。當溫度變化造成脅迫時,種子的萌發會受到影響,細胞內活性氧(Reactive oxygen species,ROS)的平衡也會被打破,導致ROS過度積累。ROS作為信號分子在調節植物的生長、發育和對生物/非生物脅迫的反應中發揮著不可或缺的作用[5]。但是,當ROS過量積累且不能被及時清除的時候,就會形成氧化損傷,阻礙正常的細胞功能,破壞碳水化合物、脂質、蛋白質和DNA等生物分子,甚至導致細胞死亡[6]。種子細胞內的抗氧化防御系統可以有效清除細胞內多余的ROS,降低和消除氧化脅迫,從而保證種子的正常萌發。植物抗氧化系統大致可分為兩類:第一類是抗氧化劑,例如抗壞血酸(Ascorbic acid,AsA)和谷胱甘肽(Glutathione,GSH)等;第二類是抗氧化酶,例如超氧化物歧化酶(Superoxide dismutase,SOD)、過氧化氫酶(Catalase,CAT)、過氧化物酶(Peroxidase,POD)等。抗氧化酶能夠對外部脅迫環境或內部ROS的損害作出反應[7],并且影響和調節抗氧化劑的含量,是調節種子細胞內ROS平衡的主要因素。但不同溫度條件下種子吸脹過程中抗氧化生理變化規律仍不清楚。
老芒麥(Elymus sibiricus)是禾本科披堿草屬多年生草本植物,具有抗寒、抗旱、耐鹽、高產等優點[8-9],廣泛種植于我國東北、華北、西北和西南地區[10],多在春秋播種,時常遇到溫度脅迫。低溫脅迫和高溫脅迫均會對種子出苗率以及幼苗生長造成不利影響,進而降低老芒麥品質造成減產,在草地退化改良、生態環境建設和畜牧業發展等方面造成經濟損失。但是目前的研究多關注種子萌發后期,鮮有報道溫度對種子吸脹期的影響。本試驗以老芒麥種子為材料,通過發芽能力、抗氧化酶的活性、ROS和抗氧化物的含量,解析老芒麥種子萌發期間抗氧化系統各指標對低溫和高溫脅迫的變化規律,以期改善牧草種子的田間出苗狀況,促進幼苗和植株正常生長。
1 材料與方法
1.1 試驗材料
供試種子為‘同德’老芒麥,種子發芽率為89%。篩選大小相近、均勻飽滿的種子貯藏于中國農業大學牧草種子實驗室,以備后續試驗使用,貯藏平均溫度為25℃,平均濕度為35%。
1.2 種子吸脹曲線制作
根據《國際種子檢驗規程》[11](International Rules for Seed Testing,2023)種子發芽測定的方法進行種子吸脹。以培養溫度25℃為對照,設置低溫(10℃)和高溫(30℃)處理。選取大小均勻并且飽滿無病害的老芒麥種子,置于11.5 cm×11.5 cm發芽盒中,鋪三層濾紙,加入蒸餾水,放在光照培養箱中,分別在10℃,25℃和30℃且黑暗條件下,吸脹不同時間(0,4,8,12,16,20,24,28,32,36,40,44,48 h)后取出種子,用濾紙吸干種子表面的水分,準確稱重并統計計算種子的吸水率。每個吸脹時間點設4個生物學重復,每個重復50粒種子。計算方法:種子吸水率=[(吸水后種子質量-吸水前種子質量)/吸水前種子質量]×100%。
以種子吸脹時間為橫坐標,種子吸水率為縱坐標,建立三條吸脹曲線:正常條件吸脹曲線、高溫條件吸脹曲線和低溫條件吸脹曲線。根據種子吸脹的階段性變化規律,分別在快速吸水階段、緩慢吸水階段和露白階段選擇3個時間點。
1.3 種子發芽能力的測定
根據《國際種子檢驗規程》[11](2023),選擇100粒大小一致、飽滿、無病害的老芒麥種子,置于11.5 cm×11.5 cm發芽盒中,鋪三層濾紙。將發芽盒置于光照培養箱(GXZ-380B-LED)中,分別在10℃,25℃和30℃,光照8 h黑暗16 h條件下培養。每個溫度均設置4次重復。每24 h統計種子萌發情況,以胚根突破種皮2 mm為標準,計算種子萌發率、發芽指數和平均發芽時間;在第12 d從每個培養皿中隨機選取20根正常種苗測量苗長和根長。公式如下:
萌發率(%)=(胚根突破種皮2 mm種子數÷全部種子數)×100%。
發芽指數=∑(G/t),G為第t天胚根突破種皮2 mm的種子總數,t為發芽天數。
平均發芽時間=∑n/∑n,n為第t天胚根突破種皮2 mm的種子數,t為發芽天數。
1.4 生理生化指標的測定
1.4.1 提取液的制備 分別在10℃,25℃和30℃條件下,取吸脹時間分別為12 h,24 h和36 h的種子各0.2 g,在液氮中研磨粉碎,加入1.6 mL 1% 三氯乙酸(Trichloroacetic acid,TCA)振蕩均勻,12 000 g 4℃離心15 min,上清液記為種子提取液,用于測定抗氧化酶活性和活性氧含量。
1.4.2 線粒體提取與純化 分別在10℃,25℃和30℃條件下,取吸脹時間分別為12 h,24 h和36 h的種子各5 g。將其放入預冷的研缽中,加入研磨液,在冰浴上研磨成勻漿。再轉入10 mL預冷的離心管中,在2500 g 4℃條件下離心8 min。將上清液轉入新的預冷離心管中,在17 500 g 4℃條件下離心20 min。倒掉上清,用毛筆將沉淀輕輕打散,用吸管把沉淀轉入新的離心管中,加入稀釋1倍的洗滌液[pH值為7.5,含0.6 mol·L-1蔗糖,0.2% 牛血清白蛋白(Bovine serum albumin,BSA),20 mmol·L-1 N-三羥甲基甲基-2-氨基乙磺酸],在2500 g 4℃條件下離心8 min。將上清液轉入預冷的新的離心管中,在17 500 g 4℃條件下離心20 min。倒掉上清,用毛筆將沉淀輕輕打散,并用稀釋1倍的洗滌液(含BSA)沖洗毛筆。將得到的懸浮液輕輕加到梯度液上,配平,在40 000 g 4℃條件下離心40 min(離心機無制動停下)。吸走上部分溶液,留取底部的線粒體,加入稀釋1倍的洗滌液(不含BSA),在31 000 g 4℃條件下離心15 min。吸走上清液,留沉淀,加入稀釋1倍的洗滌液(不含BSA),在31 000 g 4℃條件下離心15 min。吸走上清液,將純化的線粒體收集到1.5 mL離心管,放入-80℃冰箱中保存備用,用于測定抗氧化劑。
1.4.3 抗氧化酶活性測定 可溶性蛋白含量測定采用考馬斯亮藍染色法,SOD活性測定采用氮藍四唑光化還原法,POD活性測定采用愈創木酚法,CAT活性采用紫外可見分光光度法測定[12]。參照相關方法測定谷胱甘肽還原酶(Glutathione reductase,GR)和單脫氫抗壞血酸還原酶(Monodehydroascorbate reductase,MDHAR)活性[13]。
1.4.4 抗氧化劑含量以及活性氧含量測定 AsA、氧化型抗壞血酸(Oxidized ascorbic acid,DHA)、GSH、氧化型谷胱甘肽(Oxidized glutathione,GSSG)和過氧化氫(Hydrogen peroxide,HO)的測定均參考蘇州科銘生物技術有限公司試劑盒說明書。
1.5 數據分析
數據整理使用WPS Office軟件,分析使用SPSS 27軟件,指標相關性聚類分析使用TBtools-Ⅱ軟件,作圖使用GraphPad Prism 9.5軟件。
2 結果與分析
2.1 溫度對老芒麥種子吸脹和發芽特性的影響
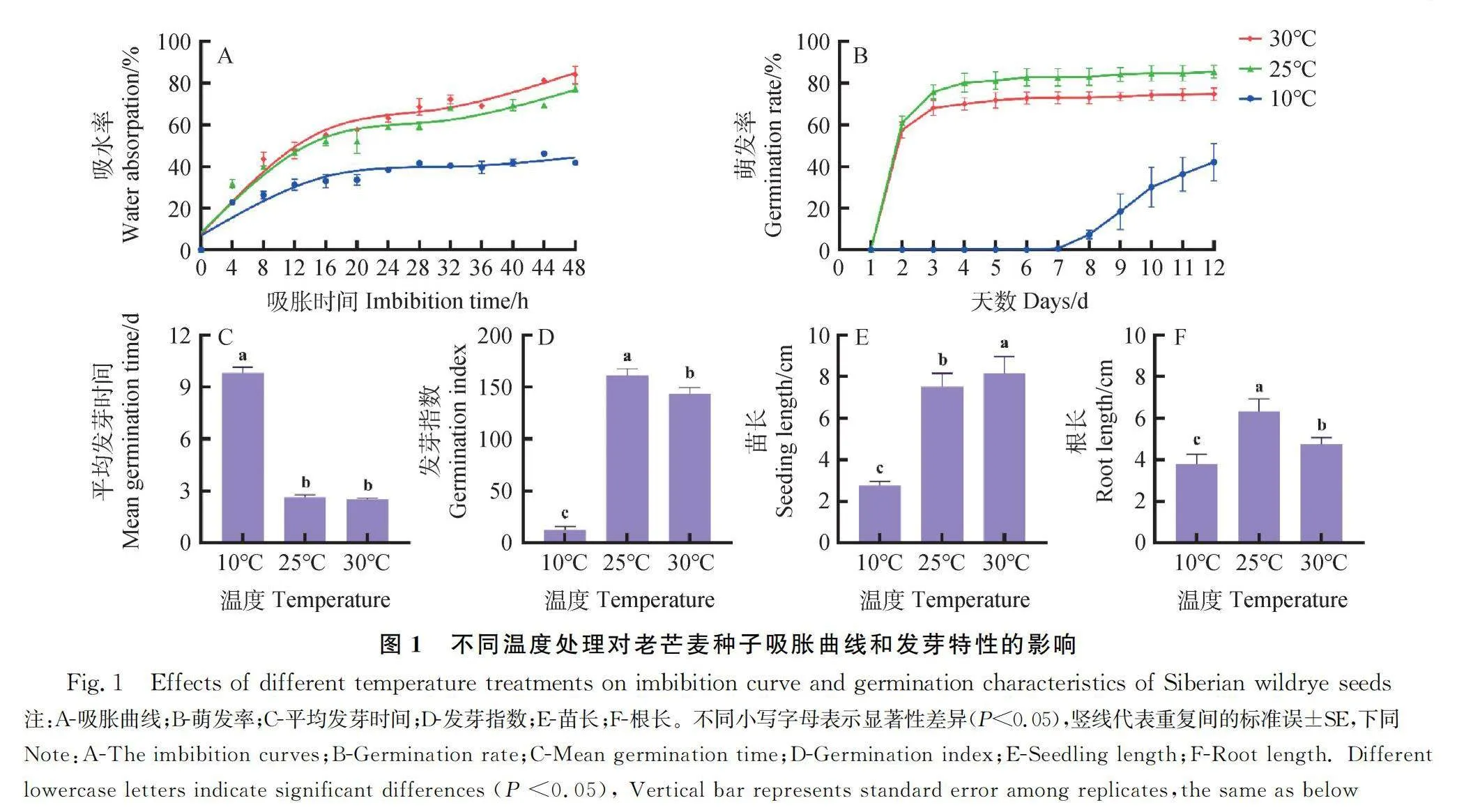
繪制老芒麥種子的吸脹曲線(圖1A),25℃條件下,老芒麥種子吸脹0~20 h時處于快速吸水階段,20~28 h時處于遲滯階段,28 h之后種子開始露白,進入發芽階段。在30℃高溫脅迫下,種子的吸水率較正常溫度有所提高,吸脹曲線變化進程差別不明顯,吸脹0~20 h時處于快速吸水階段,20~28 h處于遲滯階段,28 h之后種子開始露白,進入發芽階段。而在10℃低溫脅迫下,老芒麥種子的吸水率大幅降低,吸脹曲線變化相對平緩,0~24 h處于快速吸水階段,24 h之后為遲滯階段。根據三個溫度下老芒麥種子階段性吸脹的變化規律,選取吸脹三個階段對應的時間點:12 h,24 h和36 h。
不同溫度處理對老芒麥種子的發芽情況造成不同程度的影響,與25℃相比,10℃和30℃下種子的萌發率均降低,且10℃下老芒麥種子的萌發能力被大幅抑制,萌發時間嚴重推后(圖1B)。與25℃相比,30℃下老芒麥種子的平均發芽時間無顯著差異,種子發芽指數顯著降低(P<0.05),幼苗的苗長顯著增加(P<0.05),根長顯著降低(P<0.05);10℃下老芒麥種子的發芽能力被大幅抑制,平均發芽時間顯著增加(P<0.05),發芽指數顯著降低(P<0.05),幼苗的根長和苗長顯著降低(P<0.05)(圖1 C-F)。
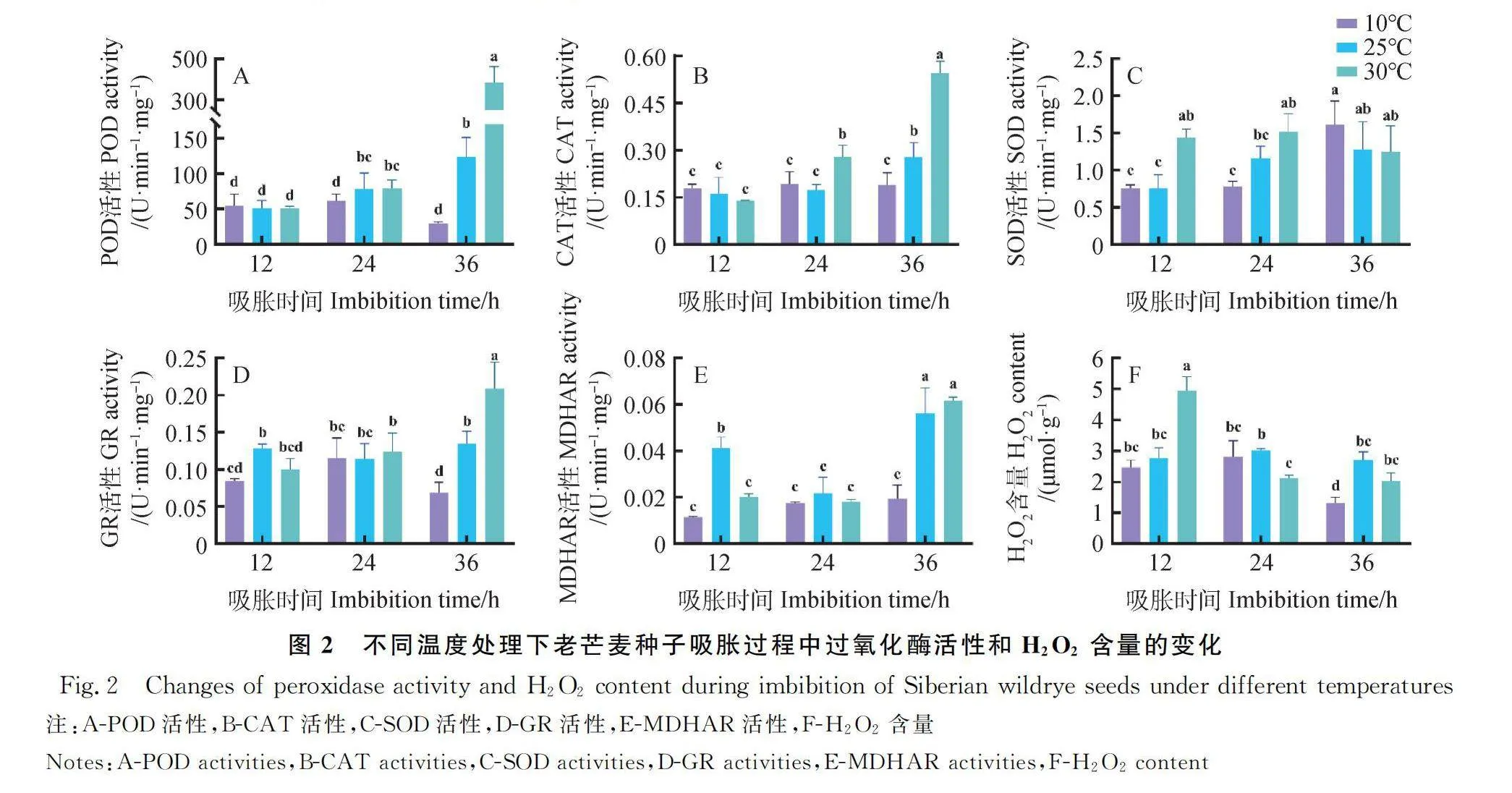
2.2 不同溫度處理下老芒麥種子抗氧化酶活性的變化
不同溫度條件下,老芒麥種子在不同吸脹時間點的CAT和POD活性變化趨勢基本相同。當種子吸脹12 h時,三個溫度下POD和CAT活性均無顯著變化;吸脹24 h時,10℃下POD活性顯著低于25℃和30℃(P<0.05),而30℃下CAT活性顯著高于25℃和10℃(P<0.05);吸脹36 h時,30℃下POD和CAT活性均顯著高于25℃和10℃(P<0.05),25℃下POD和CAT活性均顯著高于10℃(P<0.05)(圖2A-B)。當種子吸脹12 h時,30℃下SOD活性顯著高于25℃和10℃(P<0.05);吸脹24 h時,10℃下SOD活性顯著低于30℃(P<0.05)。當種子吸脹12 h時,25℃下GR活性顯著高于10℃(P<0.05);吸脹36 h時,30℃下GR活性顯著高于25℃和10℃(P<0.05),25℃下GR活性顯著高于10℃(P<0.05)。當種子吸脹12 h時,25℃下MDHAR活性顯著高于30℃和10℃(P<0.05);吸脹36 h時,10℃下MDHAR活性顯著低于25℃和30℃(P<0.05)(圖2 C-E)。
2.3 不同溫度處理下老芒麥種子ROS含量的變化
不同溫度條件下,老芒麥種子在吸脹期間HO含量呈不同的變化趨勢。隨著吸脹時間的增加,HO含量在25℃下基本穩定,而在10℃和30℃下呈現下降的趨勢。當種子吸脹12 h時,30℃下HO含量顯著高于10℃和25℃(P<0.05);吸脹24 h時,30℃下HO含量顯著低于25℃(P<0.05);吸脹36 h時,10℃下HO含量顯著低于25℃和30℃(P<0.05)(圖2F)。
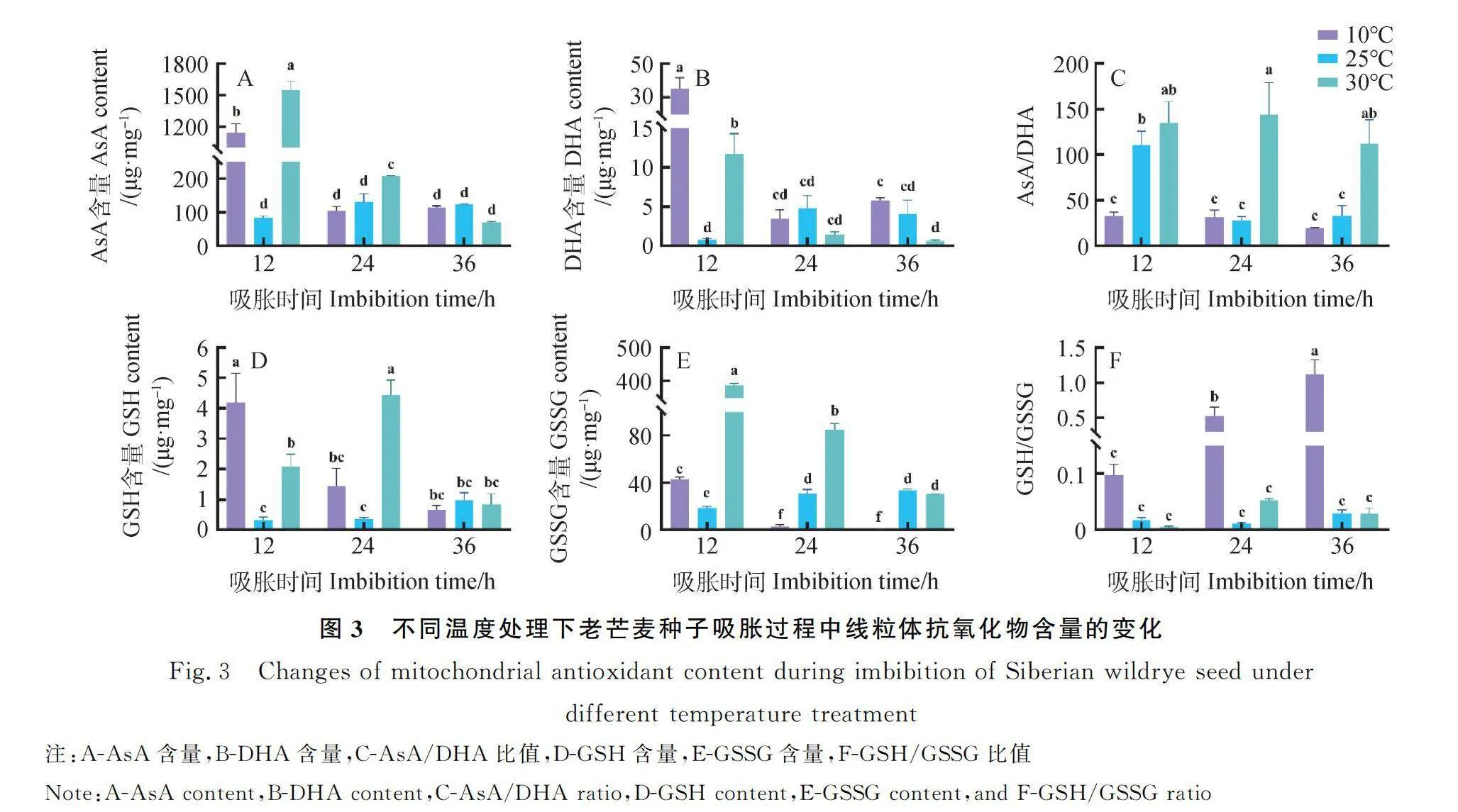
2.4 不同溫度處理下老芒麥種子線粒體抗氧化物含量的變化
隨著吸脹時間的增加,10℃和30℃條件下老芒麥種子線粒體中AsA,DHA,GSH,GSSG含量基本呈現下降趨勢,而25℃條件下老芒麥種子線粒體中AsA,DHA,GSH,GSSG含量基本保持穩定。
當種子吸脹12 h時,10℃和30℃下線粒體中AsA和DHA含量均顯著高于25℃(P<0.05),10℃下AsA/DHA比值顯著低于25℃(P<0.05);吸脹24 h時,30℃下AsA含量和AsA/DHA比值均顯著高于25℃和10℃(P<0.05);吸脹36 h時,30℃下DHA含量顯著低于10℃(P<0.05),而AsA/DHA比值顯著高于25℃和10℃(P<0.05)(圖3 A-C)。當種子吸脹12 h時,10℃和30℃下線粒體中GSH和GSSG含量均顯著高于25℃(P<0.05);吸脹24 h時,30℃下GSH含量顯著高于10℃和25℃(P<0.05),GSSG含量隨著吸脹溫度的增加顯著增加(P<0.05);吸脹36 h時,10℃下GSSG含量顯著低于25℃和30℃(P<0.05)。隨著吸脹時間的增加10℃下GSH/GSSG比值顯著增長(P<0.05),且在吸脹24 h和36 h時顯著高于30℃和25℃(P<0.05)(圖3D-F)。
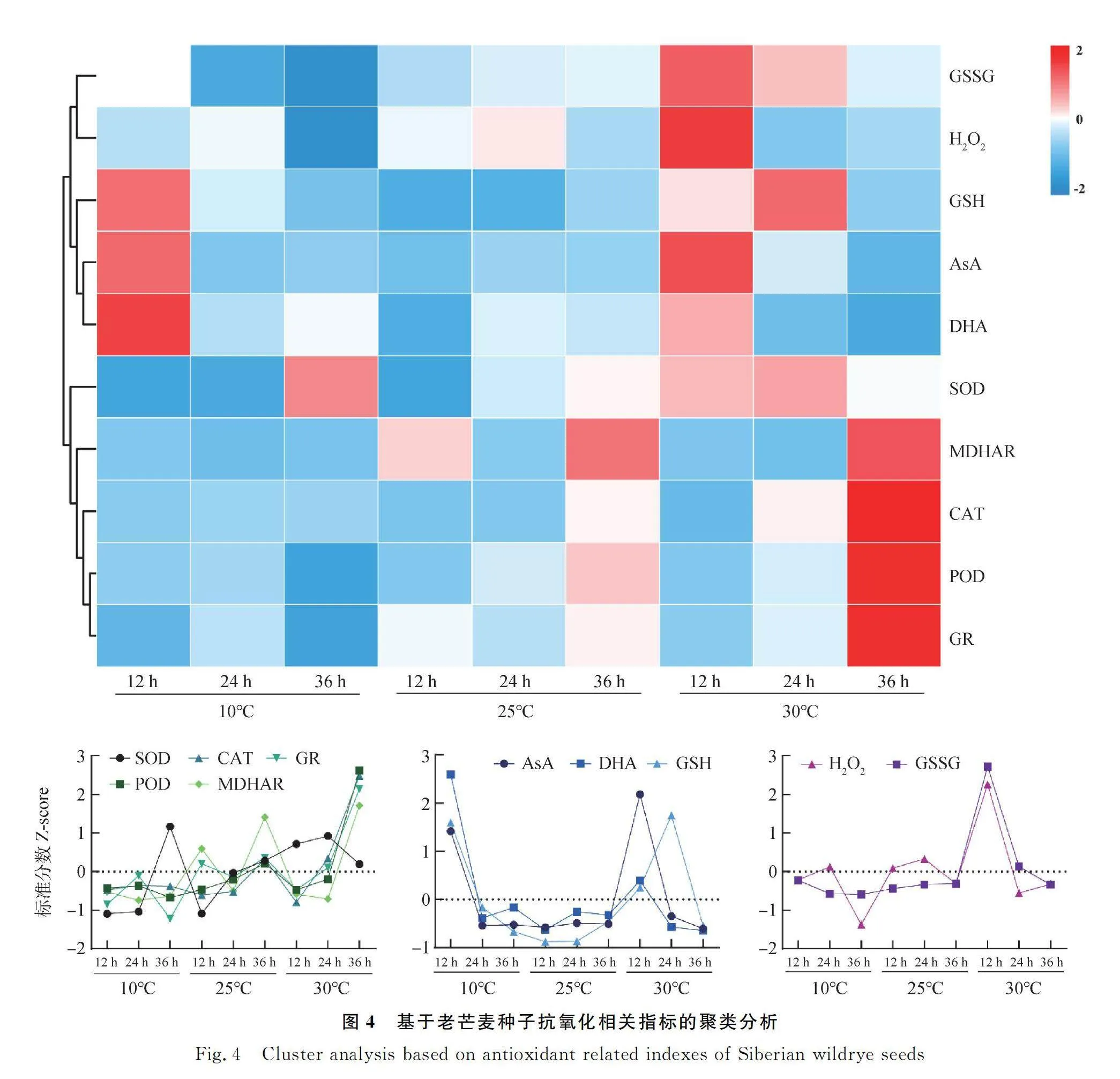
2.5 抗氧化系統指標聚類分析
通過聚類分析發現(圖4),10個老芒麥種子抗氧化防御系統相關指標主要分為3組:Ⅰ包括GSSG含量和HO含量;Ⅱ包括AsA含量、GSH含量和DHA含量;Ⅲ包括SOD活性、MDHAR活性、CAT活性、POD活性和GR活性。從熱圖中可以明顯看出,Ⅰ中GSSG含量和HO含量在30℃吸脹早期較大,在10℃吸脹后期較小,說明高溫和低溫脅迫均影響了GSSG含量和HO含量;Ⅱ中AsA含量、GSH含量和DHA含量在10℃和30℃吸脹早期均較大,而在25℃條件下吸脹早期較小,說明高溫和低溫脅迫均影響了AsA含量、GSH含量和DHA含量;Ⅲ中SOD活性、MDHAR活性、CAT活性、POD活性和GR活性在10℃均較小,在30℃吸脹后期較大,說明低溫脅迫影響了SOD活性、MDHAR活性、CAT活性、POD活性和GR活性,降低了種子的抗氧化能力,而高溫脅迫提高了MDHAR活性、CAT活性、POD活性和GR活性,增加了種子的抗氧化能力。
3 討論
3.1 溫度對老芒麥種子發芽特性的影響
溫度條件是影響種子萌發的各項因素中最重要的外部因素之一[3],種子發芽和幼苗生長都對外界溫度條件有一定的要求。本試驗發現,老芒麥種子在溫度過高或過低時,萌發率和發芽指數均下降,這與野生大豆(Glycine soja)在不同溫度下的萌發情況相似[14]。溫度過高時,老芒麥幼苗的根長也顯著下降,這與榔榆(Ulmus parvifolia)種子在不同溫度下幼苗的生長情況相似[15]。而30℃時,老芒麥種子的平均發芽時間比25℃時有所提前,苗長略高,推測這與30℃時種子吸水率高于25℃吸水率有關。10℃時,種子發芽時間大幅增長,生長進程減緩,根長苗長大幅縮短,這與西藏野生型老芒麥對溫度和水分的響應結果相似[16]。推測原因是低溫時種子吸水緩慢,多種酶活性受到抑制,代謝速度較慢。
3.2 溫度對老芒麥種子吸脹過程中抗氧化系統的影響
低溫和高溫等脅迫條件會導致種子內產生大量ROS,對細胞造成嚴重的破壞,進而引起種子體內的代謝紊亂,加劇膜脂過氧化程度,最終抑制種子的生長發育。同時種子也可以通過調控體內的抗氧化酶活性和抗氧化物含量,形成種子對逆境脅迫的防御機制,清除體內過量的ROS[13],維持細胞代謝的穩定。
在本研究中,25℃條件下的老芒麥種子內HO含量在不同吸脹時間點沒有顯著變化,認為種子中的ROS含量基本保持穩定,種子生長狀態正常。而在老芒麥種子吸脹12 h時,30℃條件下HO含量顯著高于正常溫度,后又下降達到新的平衡,說明熱脅迫刺激老芒麥種子開啟抗氧化防御機制,調節體內抗氧化物質含量來快速清除多余的HO,使其含量維持在一定范圍內。這與鰻草(Zostera marina)在30℃下HO含量變化類似[17]。在吸脹12 h和24 h時,低溫條件下HO含量和正常溫度下沒有顯著差異。在吸脹36 h時,低溫條件下HO含量顯著減少至較低水平,推測原因是種子吸水速率較慢,受到低溫脅迫時間較長,代謝速度減緩,甚至部分死亡,HO產生量減少。與之相比,高溫脅迫初期HO含量顯著增高,后又降低至穩定水平,說明30℃處理下老芒麥種子內部能夠將ROS含量控制在相對穩定的狀態,這可能是其能保持發芽率不大幅下降的原因之一。
POD,SOD和CAT是植物抗氧化系統里非常重要的酶,通過協同作用,使植物體內活性氧維持在一個較低的水平,從而防止植物受到過氧化損傷[18-19]。其中,CAT和POD可以共同協作將HO轉化為HO和O,以此完成對ROS的清除。在本試驗中,10℃條件下老芒麥種子的SOD,POD和CAT活性大部分時間與正常溫度處理無顯著差異。結合HO含量分析,推測原因是10℃時老芒麥種子吸脹萌發延緩。這也有可能與老芒麥種子具有一定抗寒性有關,有研究發現SOD,POD,CAT三種酶在低溫脅迫下活性的變化與植物的抗寒性相關[20-21]。而在30℃條件下,CAT和POD活性不斷升高,對高溫脅迫響應較快。有研究發現,植物為了應對高溫下ROS的過量產生,啟動了熱應激響應途徑,還誘導了應激相關蛋白和抗氧化蛋白的表達,進而提高了抗壞血酸過氧化物酶(Aseorbate peroxidase,APX)、CAT或SOD等抗氧化酶的活性,從而緩解了ROS引起的氧化損傷[22]。
MDHAR能夠催化NADH還原單脫氫抗壞血酸(Dehydroascorbic acid,MDHA)生成AsA和NAD+,GR能夠催化NADPH將GSSG還原再生成GSH,同時NADPH脫氫生成NADP+。因此,MDHAR和GR是確保AsA和GSH再生的關鍵酶[18],能維護AsA-GSH循環的順利進程,消除或減輕ROS對細胞造成的損害。在本試驗中,10℃條件下老芒麥種子的MDHAR和GR活性隨吸脹時間基本沒有變化,且常低于25℃條件下的活性。推測原因是MDHAR和GR活性受到低溫抑制。在30℃條件下,MDHAR和GR活性逐漸增加,這與玉米(Zea mays)在高溫脅迫下AsA-GSH循環中GR活性的變化相似,MDHAR活性的變化相反[23]。由于不同植物之間對低溫以及高溫的耐受程度有所不同,所以抗氧化酶活性對低溫以及高溫的反應結果也可能不盡相同。
AsA/DHA和GSH/GSSG具有電子受體的作用,是細胞內重要的氧化還原對。本試驗中,10℃和30℃條件下老芒麥種子線粒體中AsA,DHA,GSH,GSSG含量在吸脹12 h時均顯著高于25℃下含量,30℃條件下AsA/DHA比值顯著高于25℃,10℃條件下GSH/GSSG比值顯著高于25℃。這說明AsA,DHA,GSH,GSSG在種子應對低溫脅迫和高溫脅迫時均有重要作用,而GSH/GSSG在應對低溫脅迫更敏感,AsA/DHA在應對高溫脅迫時更敏感。有研究發現,在低溫脅迫下小麥(Triticum aestivum)幼苗AsA和GSH含量呈上升趨勢[24];在熱脅迫下白三葉(Trifolium repens)幼苗AsA和GSH含量顯著上升[25];不同品種的黃瓜(Cucumis sativus)幼苗在38℃下AsA,GSH和GSSG含量均高于28℃[26]。
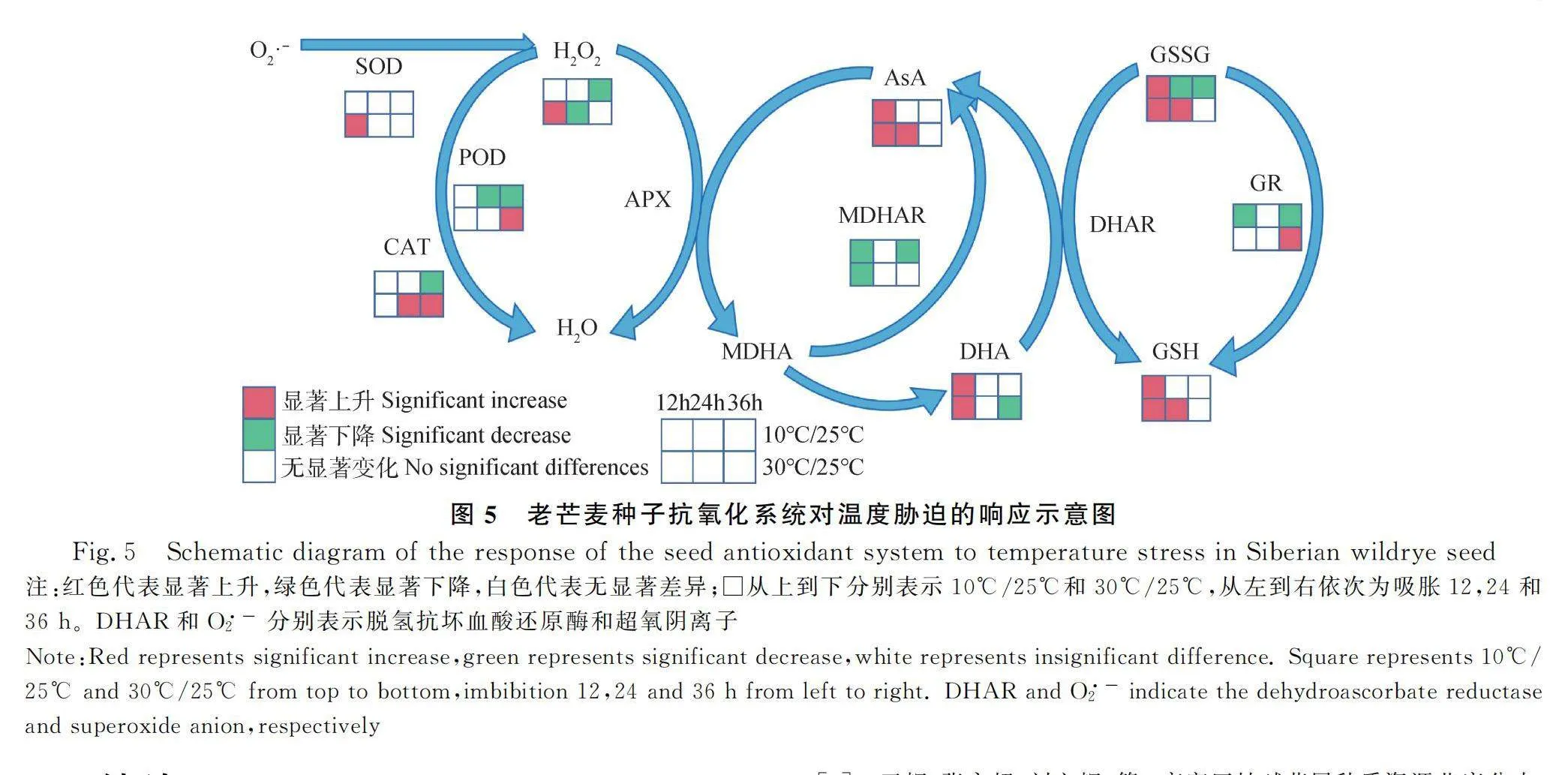
3.3 老芒麥種子吸脹過程中抗氧化系統對溫度的響應規律
基于本試驗中不同溫度處理對老芒麥種子吸脹過程中抗氧化酶活性、抗氧化劑含量和活性氧含量的變化,繪制了老芒麥種子吸脹過程中抗氧化系統對溫度的響應規律示意圖(圖5)。與正常25℃吸脹的種子相比,30℃下老芒麥種子在吸脹過程中,積極調動抗氧化酶和抗氧化劑及時清除ROS,隨著吸脹時間的增加,ROS清除速率大于產生速率,ROS含量逐漸降低,進而緩解了高溫脅迫對老芒麥種子萌發進程的影響。而10℃下老芒麥種子在吸脹過程中,吸水率較低,多個抗氧化酶活性降低,不能及時清除ROS,隨著脅迫時間的增加,部分種子死亡,萌發率降低。與10℃相比,30℃下活性增加的酶較多,這可能是老芒麥種子在30℃下萌發率降低較少,但是10℃下種子發芽特性嚴重下降的原因。
4 結論
與對照溫度(25℃)相比,低溫脅迫抑制了老芒麥種子的萌發和生長,主要表現為降低種子的萌發率、發芽指數、苗長和根長,增加平均發芽時間;通過降低種子中CAT,POD,MDHAR,GR活性和線粒體內GSSG含量,產生嚴重氧化損傷,繼而延緩了種子萌發的正常進程。而高溫脅迫對老芒麥種子萌發和生長的影響較小,主要表現為降低了種子的萌發率、發芽指數和根長,增加了苗長;通過提高種子中CAT,POD,SOD,GR活性和線粒體中AsA,DHA,GSH和GSSG含量,及時降低HO含量,從而減少氧化損傷,繼而維持種子萌發的正常進程。
參考文獻
[1]徐恒恒,黎妮,劉樹君,等. 種子萌發及其調控的研究進展[J]. 作物學報,2014,40(7):1141-1156
[2]SAEED S,ULLAH A,ULLAH S,et al. Validating the impact of water potential and temperature on seed germination of wheat(Triticum aestivum L.) via Hydrothermal Time Model[J]. Life,2022,12(7):983
[3]REED R C,BRADFORD K J,KHANDAY I. Seed germination and vigor:ensuring crop sustainability in a changing climate[J]. Heredity,2022,128(6):450-459
[4]王麗娟. 牧草種子萌發對溫度和水分脅迫的反應[D]. 呼和浩特:內蒙古農業大學,2008:18-29
[5]BAXTER A,MITTLER R,SUZUKI N. ROS as key players in plant stress signalling[J]. Journal of Experimental Botany,2014,65(5):1229-1240
[6]HASANUZZAMAN M,BHUYAN M H M B,PARVIN K,et al. Regulation of ROS metabolism in plants under environmental stress:A review of recent experimental evidence[J]. International Journal of Molecular Sciences,2020,21(22):8695
[7]劉備,宋玉梅,孫銘,等. 燕麥劣變種子吸脹過程中線粒體AsA-GSH循環的生理響應[J]. 草地學報,2021,29(2):211-219
[8]李欣瑞,陳淑嫻,鄢家俊,等. 老芒麥種質資源研究進展[J]. 草學,2021(1):6-17
[9]于輝,張永超,劉文輝,等. 高寒區披堿草屬種質資源花序分支與種子產量的關系分析[J]. 草地學報,2024,32(3):804-811
[10]何永濤,胡宇,段慧榮,等. 我國披堿草屬植物抗逆性評價指標研究進展[J]. 中國草地學報,2022,44(8):96-108
[11]ISTA.CH-8304 international rules for seed testing[S]. Wallisellen:The International Seed Testing Association,2023:1-14
[12]宗學鳳,王三根. 植物生理研究技術[M]. 第2版. 重慶:西南師范大學出版社,2021:223-228
[13]孫守江,唐藝涵,馬馼,等. 紫花苜蓿種子吸脹期胚根線粒體AsA-GSH循環對低溫脅迫的響應[J]. 草業學報,2023,32(3):152-162
[14]楊莉萍,張馳,張乃群. 溫度對野生大豆種子萌發及幼苗生長的影響探究[J]. 現代化農業,2022(10):15-18
[15]吳曉宇. 不同溫度處理對榔榆種子萌發及幼苗生理生化指標的影響[D]. 泰安:山東農業大學,2018:14-16
[16]王傳旗,徐雅梅,梁莎,等. 西藏野生老芒麥種子萌發對溫度和水分的響應[J]. 作物雜志,2017(6):165-169
[17]夏優,生西玲,孫田力,等. 高溫對鰻草氧化損傷和抗氧化系統的影響[J]. 海洋湖沼通報,2021,43(5):136-142
[18]許英,陳建華,朱愛國,等. 低溫脅迫下植物響應機理的研究進展[J]. 中國麻業科學,2015(1):40-49
[19]薛爽,饒麗莎,左丹丹,等. 植物低溫脅迫響應機理的研究進展[J]. 安徽農業科學,2016,44(33):17-19
[20]羅軍武,唐和平,黃意歡,等. 茶樹不同抗寒性品種間保護酶類活性的差異[J]. 湖南農業大學學報(自然科學版), 2001,27(2):94-96
[21]馬蘭濤,陳雙林,李迎春. 低溫脅迫對Guadua amplexfolia抗寒性生理指標的影響[J]. 林業科學研究,2008(2):235-238
[22]DEVIREDDY A R,TSCHAPLINSKI T J,TUSKAN G A,et al. Role of reactive oxygen species and hormones in plant responses to temperature changes[J]. International Journal of Molecular Sciences,2021,22(16):8843
[23]TIWARI Y K,YADAV S K. Effect of high-temperature stress on ascorbate-glutathione cycle in maize[J]. Agricultural Research,2020,9(2):179-187
[24]郭麗紅,王定康,王德斌,等. 抗壞血酸和谷胱甘肽在小麥幼苗冷激誘導抗冷性中的變化[J]. 昆明師范高等專科學校學報,2007,29(4):66-68
[25]LIU H L,LEE Z X,CHUANG T W,et al. Effect of heat stress on oxidative damage and antioxidant defense system in white clover (Trifolium repens L.)[J]. Planta,2021,254:103
[26]蘇世聞. 黃瓜種子萌發和幼苗生長的耐熱性差異及其產量和生理特性[D]. 南京:南京農業大學,2014:24-29
(責任編輯 閔芝智)

