把握學科知識 增進學科理解



摘要:基于“素養為本”視角,以“沉淀溶解平衡”為知識載體,以數據為證據材料,運用沉淀溶解平衡常數來判斷反應進行的方向以及進行的程度,旨在增進學科理解,更好地在教學中體現化學學科核心素養.
關鍵詞:沉淀溶解平衡;溶度積常數;化學學科理解;專業素養
中圖分類號:G632文獻標識碼:A文章編號:1008-0333(2024)28-0141-04
《普通高中化學課程標準(2017年版2020年修訂)》指出《化學反應原理》板塊從化學反應與能量,化學反應的方向、限度和速率以及水溶液中的離子反應與平衡等方面,探索化學反應的規律及應用.選考化學的同學在學習了必修課程,有了一定的化學基礎之后,通過該板塊的學習,引導學生進一步認識化學變化所遵循的基本原理,初步形成關于物質變化的科學觀念.了解化學反應中能量轉化所遵循的規律,贊賞運用化學反應原理對科學技術和人類社會文明所起的重要作用,發展化學學科核心素養.
下面以板塊中的主題3——水溶液中的離子反應與平衡中的“沉淀溶解平衡”為例,來談一談化學反應原理對初三化學及高一必修課程中一些化學知識的解釋作用,以努力增進學科理解,爭取做到深度學習.
1弱酸不能制強酸嗎?
往氯化鈣溶液中通CO2氣體,會出現沉淀嗎?
觀點一:會出現,CO2溶于水,生成碳酸,碳酸能電離出碳酸根離子,與Ca2+結合成沉淀.
觀點二:不會出現,CaCl2+CO2+H2OCaCO3+2HCl,假定生成了碳酸鈣,但同時又生成了鹽酸,鹽酸又把碳酸鈣溶解了.所以我們看到碳酸鈣固體中加鹽酸,碳酸鈣能溶解,反應還生成使澄清石灰水變渾濁的CO2氣體.但是反過來,往氯化鈣溶液中通CO2,不管通多長時間,都沒有沉淀生成.由此老師給了學生一個結論:弱酸不能制強酸.
果真弱酸不能制強酸嗎?往硫酸銅溶液中通H2S氣體,可見黑色沉淀,寫成化學方程式:CuSO4+H2SCuS+H2SO4.同學們發現不對了,這個反應中分明是弱酸氫硫酸反應生成了強酸硫酸.這是怎么回事呢?
我們學了反應原理,學了化學平衡常數,知道在一定溫度下,如果某反應的化學平衡常數K>1×105,就認為該反應能進行完全,反之,若化學平衡常數K<1×10-5,就認為該反應幾乎不能進行.
往氯化鈣溶液中通CO2氣體,假設CaCl2+CO2+H2OCaCO3+2HCl能進行,將CO2和H2O寫成H2CO3,寫作離子方程式:Ca2++H2CO3CaCO3+2H+,該反應的平衡常數K=c2(H+)/[c(Ca2+)c(H2CO3)]=[c2(H+)·c(CO2-3)]/[c(Ca2+)·c(CO2-3)·c(H2CO3)]=Ka1(H2CO3)·Ka2(H2CO3)]/Ksp(CaCO3)=4.30×10-7×5.61×10-11/4.96×10-9=4.86×10-9,K1×10-5,所以反應不能進行.
再看硫酸銅溶液中通H2S氣體,離子方程式:Cu2++H2SCuS+2H+,該反應的平衡常數K=c2(H+)/
[c(Cu2+)·c(H2S)]=[c2(H+)
·c(S2-)]/[c(Cu2+)·c(S2-)
·c(H2S)][Ka1(H2S)·Ka2(H2S)]/Ksp(CuS)=9.1×10-8×1.1×10-12/1.27×10-36=7.88×1016,K1×105,所以反應正向進行程度很大,幾乎完全.
用平衡常數K來判斷反應能否進行和進行的程度如何是可靠的辦法.當然,在初三或者是高一必修階段,學生尚未具備化學平衡常數的基礎,但在教學過程中教師不能簡單地一概而論,給出一些言之鑿鑿的錯誤結論.而當學生有了知識基礎以后,教師要及時設計教學環節,引導學生用新原理去解釋舊知識,以達到知識靈活運用的目的.2用氯化鈣溶液鑒別碳酸鈉和碳酸氫鈉溶液,可行嗎?
在高一認識碳酸鈉、碳酸氫鈉的性質時,會遇到一個問題:能否用氯化鈣溶液鑒別碳酸鈉和碳酸氫鈉?實驗是檢驗化學的唯一標準,當我們向碳酸氫鈉溶液中滴加氯化鈣溶液,發現也會有沉淀,當時作如下解釋:碳酸氫根在水溶液中會發生電離,生成碳酸根離子,所以也有沉淀碳酸鈣生成,因此一般不能用氯化鈣溶液鑒別碳酸鈉溶液和碳酸氫鈉溶液.但是問題又來了,碳酸氫根電離生成碳酸根離子的同時也生成了氫離子,氫離子不是會溶解碳酸鈣嗎?
碳酸氫根離子部分電離產生碳酸根離子:HCO-3H++CO2-3,Ca2+和CO2-3結合成CaCO3,促使CO2-3的電離平衡正向移動.同時溶液中會產生一定量的H+,H+應該會把CaCO3溶解.這是定性分析.但是如果我們關注離子之間量的關系,作如下分析:
為計算方便,我們假設將0.2 mol·L-1 CaCl2溶液和0.2 mol·L-1 NaHCO3溶液混合,混合后c(Ca2+)=0.1 mol·L-1,c(HCO-3)=0.1 mol·L-1,HCO-3H++CO2-3,
Ka2=[c(H+)·c(CO2-3)]/c(HCO3-)=5.6×10-11,則c(H+)=c(CO2-3)=5.6×10-11×0.1=5.6×10-12 =5.76×10-6,所以溶液中Qc(CaCO3)=c(Ca2+)·c(CO2-3)=0.1 mol·L-1×5.76×10-6=5.76×10-7>Ksp(CaCO3)=5.0×10-9,所以有沉淀碳酸鈣生成.
假設等濃度(設為2a mol·L-1)的CaCl2溶液和NaHCO3溶液混合,混合后c(Ca2+)=a mol·L-1,c(HCO-3)=a mol·L-1,HCO-3H++CO2-3,Ka2=[c(H+)·c(CO2-3)]/c(HCO3-)=5.6×10-11,則c(H+)=c(CO2-3)=5.6×10-11×a
所以溶液中Qc(CaCO3)=c(Ca2+)·c(CO2-3)=a mol·L-1×5.6×10-11×a<Ksp(CaCO3)=5.0×10-9,則無沉淀產生.由此計算出a<7.46×10-3,則CaCl2溶液和NaHCO3溶液的原始濃度小于1.49×10-2mol·L-1時兩溶液混合無沉淀產生.
化學反應能否進行,跟反應物的用量有直接關系,拋開反應物的量談反應能否發生是毫無根據的.《普通高中化學課程標準(2017版2020年修訂)》對水溶液中的離子反應和平衡提出的教學策略就是要“關注水溶液體系的特點,結合實驗現象和數據等證據材料,引導學生形成認識水溶液中離子反應和平衡的基本思路”[1].根據化學平衡常數,結合沉淀溶解平衡進行相關定量計算,對于反應能否發生有說服力.
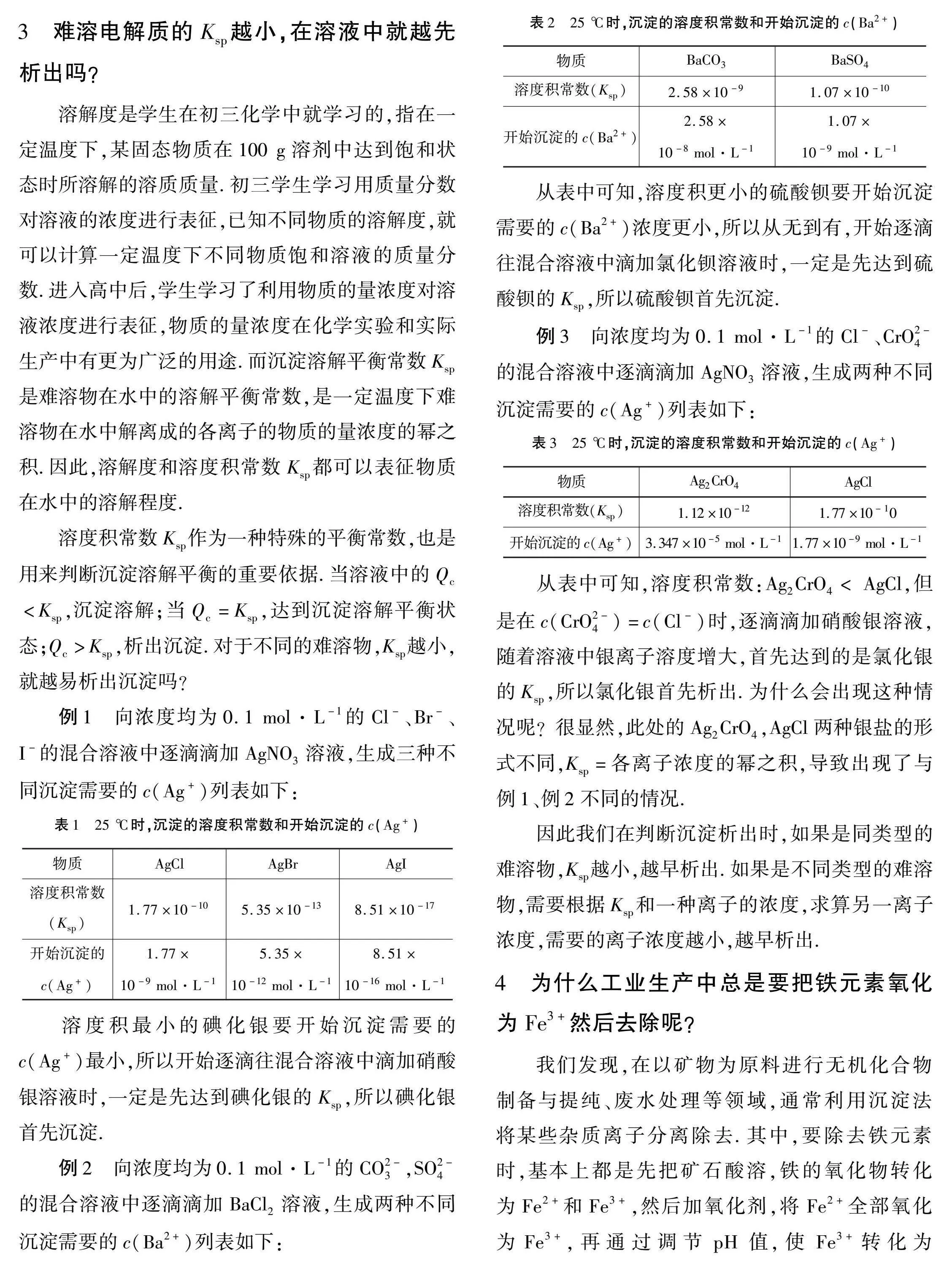
3難溶電解質的Ksp越小,在溶液中就越先析出嗎?
溶解度是學生在初三化學中就學習的,指在一定溫度下,某固態物質在100 g溶劑中達到飽和狀態時所溶解的溶質質量.初三學生學習用質量分數對溶液的濃度進行表征,已知不同物質的溶解度,就可以計算一定溫度下不同物質飽和溶液的質量分數.進入高中后,學生學習了利用物質的量濃度對溶液濃度進行表征,物質的量濃度在化學實驗和實際生產中有更為廣泛的用途.而沉淀溶解平衡常數Ksp是難溶物在水中的溶解平衡常數,是一定溫度下難溶物在水中解離成的各離子的物質的量濃度的冪之積.因此,溶解度和溶度積常數Ksp都可以表征物質在水中的溶解程度.
溶度積常數Ksp作為一種特殊的平衡常數,也是用來判斷沉淀溶解平衡的重要依據.當溶液中的Qc<Ksp,沉淀溶解;當Qc=Ksp,達到沉淀溶解平衡狀態;Qc>Ksp,析出沉淀.對于不同的難溶物,Ksp越小,就越易析出沉淀嗎?
例1向濃度均為0.1 mol·L-1的Cl-、Br-、I-的混合溶液中逐滴滴加AgNO3溶液,生成三種不同沉淀需要的c(Ag+)列表如下:
溶度積最小的碘化銀要開始沉淀需要的c(Ag+)最小,所以開始逐滴往混合溶液中滴加硝酸銀溶液時,一定是先達到碘化銀的Ksp,所以碘化銀首先沉淀.
例2向濃度均為0.1 mol·L-1的CO2-3,SO2-4的混合溶液中逐滴滴加BaCl2溶液,生成兩種不同沉淀需要的c(Ba2+)列表如下:
從表中可知,溶度積更小的硫酸鋇要開始沉淀需要的c(Ba2+)濃度更小,所以從無到有,開始逐滴往混合溶液中滴加氯化鋇溶液時,一定是先達到硫酸鋇的Ksp,所以硫酸鋇首先沉淀.例3向濃度均為0.1 mol·L-1的Cl-、CrO2-4的混合溶液中逐滴滴加AgNO3溶液,生成兩種不同沉淀需要的c(Ag+)列表如下:
從表中可知,溶度積常數:Ag2CrO4< AgCl,但是在c(CrO2-4)=c(Cl-)時,逐滴滴加硝酸銀溶液,隨著溶液中銀離子溶度增大,首先達到的是氯化銀的Ksp,所以氯化銀首先析出.為什么會出現這種情況呢?很顯然,此處的Ag2CrO4,AgCl兩種銀鹽的形式不同,Ksp=各離子濃度的冪之積,導致出現了與例1、例2不同的情況.
因此我們在判斷沉淀析出時,如果是同類型的難溶物,Ksp越小,越早析出.如果是不同類型的難溶物,需要根據Ksp和一種離子的濃度,求算另一離子濃度,需要的離子濃度越小,越早析出.
4為什么工業生產中總是要把鐵元素氧化為Fe3+然后去除呢?
我們發現,在以礦物為原料進行無機化合物制備與提純、廢水處理等領域,通常利用沉淀法將某些雜質離子分離除去.其中,要除去鐵元素時,基本上都是先把礦石酸溶,鐵的氧化物轉化為Fe2+和Fe3+,然后加氧化劑,將Fe2+全部氧化為Fe3+,再通過調節pH值,使Fe3+轉化為
Fe(OH)3沉淀再過濾除去.Fe2+和Fe3+的氫氧化物都是沉淀,為什么一定要把溶液中的Fe2+氧化為Fe3+之后再除去呢?
我們來看常見的金屬礦石中所含有的金屬離子的氫氧化物的Ksp:
一般認為當溶液中的離子濃度小于1×10-5mol·L-1時,離子已經除盡.下面我們以此為標準,計算下Fe2+和Fe3+完全除盡時,溶液pH值的大小.
Ksp Fe(OH)2=c(Fe2+)×c2(OH-)=4.87×10-17,
其中c(Fe2+)<1×10-5mol·L-1,計算可得c(OH-)>2.2×10-6,則溶液pH>8.34,此時Fe2+可除盡.
Ksp Fe(OH)3=c(Fe3+)×c3(OH-)=2.6×10-39,
其中c(Fe3+)<1×10-5mol·L-1,計算可得c(OH-)>6.38×10-12,則溶液pH>2.805,此時Fe3+可除盡.
計算后發現,Fe2+在堿性條件下才能沉淀完全,而Fe3+在酸性條件(pH較小)時就可沉淀完全.通過計算表格中羅列的這些氫氧化物完全沉淀的pH,可見在這些物質中,Fe3+完全沉淀的pH是最小的.也可以看出工業上選擇把鐵元素轉化為Fe(OH)3是因為能夠確保有用離子不被沉淀.如果選擇把鐵元素轉化為Fe(OH)2沉淀,則其他的有用離子也要沉淀甚至是先沉淀了.
(2021江蘇高考適應性考試乙卷15題第2問)軟錳礦漿(主要成分MnO2,雜質為Fe、Al等元素的氧化物)吸收了煙氣中
的 SO2的生成了 MnSO4,向該混合溶液中滴加氨水,調節pH進行除雜. 若溶液中c(Mn2+) =0.2 mol·L-1,欲使溶液中Fe3+、Al3+的濃度均小于1×10-6mol·L-1,需控制的pH范圍為.(已知:室溫下Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,Ksp[Mn(OH)2]=2×10-13.)
由題意,控制一定pH值,保證Fe3+,Al3+轉化為Fe(OH)3、Al(OH)3沉淀,而Mn2+不能沉淀.則溶液中c(Fe3+)×c3(OH-)>Ksp Fe(OH)3,c(Al3+)×c3(OH-)>Ksp Al(OH)3,c(Mn2+)×c2(OH-)>Ksp Mn(OH)2,將Fe3+,Al3+,Mn2+的濃度代入,即可知道滿足條件的pH范圍.
開展基于學生化學學科核心素養發展的課堂教學,對化學教師的專業素養提出了更高的要求,要求教師進一步增進化學學科理解.化學學科理解是指教師對化學學科知識及其思維方式和方法的一種本源性,結構化的認識,它不僅僅是對化學知識的理解,還包括對具有化學學科特質的思維方式和方法的理解[2].教師在教學中應認識到自身化學學科理解能力的不足,通過多渠道提高自身的學科理解力,包括主動參加各級培訓和學習活動,重視校內教研組、備課組的研討活動,在學習和教學中遇到問題主動提出,共同商量,不斷提升學科理解能力.
5結束語
化學選擇性必修1《化學反應原理》的內容是高中化學教學中的難點,在高考中的占比又很大,這部分內容是化學學得好和學不好的分水嶺.教師自身在教學中一定要把握好這部分內容,才能提升課堂教學能力.
參考文獻:
[1]
中華人民共和國教育部.普通高中化學課程標準(2017年版2020年修訂)[M].北京:人民教育出版社,2020:2,8
[2] 中華人民共和國教育部.普通高中化學課程標準(2017年版2020年修訂)[M].北京:人民教育出版社,2020:2,76
[責任編輯:季春陽]

