干擾和過表達CHRNG對牛成肌細胞增殖分化的影響



摘 要: 旨在研究CHRNG基因對牛成肌細胞增殖分化的影響及其潛在的分子作用途徑。本研究從健康3日齡秦川牛背最長肌和后腿肌中分離到成肌細胞,利用腺病毒在秦川牛成肌細胞中過表達及干擾CHRNG基因,分為干擾組(sh-CHRNG)、干擾對照組(sh-NC)、過表達組(OE-CHRNG)、過表達對照組(OE-NC),每組3個重復,采用CCK-8、EdU、qRT-PCR、Western blot、免疫熒光染色等方法分別檢測了干擾及過表達CHRNG基因對牛成肌細胞增殖分化的作用;通過RNA-Seq進一步篩選差異基因,富集信號通路。結果表明,過表達及干擾CHRNG均顯著下調了細胞周期因子 PCNA、CCNB1、CCND2 的表達(Plt;0.01),顯著上調了CDKN1A的表達(Plt;0.01),減少了發生增殖的細胞數量(CCK-8,Plt;0.01)且減少了處于S復制期的陽性細胞比例(EdU)。在牛成肌細胞上過表達和干擾CHRNG并誘導分化后D2、4、6進行形態學觀察和免疫熒光染色,結果表明干擾和過表達CHRNG抑制牛成肌細胞的分化和肌管形成。qRT-PCR和Western blot結果表明,過表達及干擾CHRNG下調了MYOD1、MYOG、MYH3基因mRNA和蛋白水平的表達(Plt;0.01)。通過RNA-Seq測序分析發現,過表達CHRNG篩選到的差異基因主要富集在內質網蛋白質加工、IL-17、甲狀腺激素合成、PPAR、PI3K-Akt等信號通路,KEGG分析富集的前20條通路中有10條通路與細胞分化相關;干擾CHRNG篩選到的差異基因主要富集在軸突導向、MAPK、PI3K-Akt等信號通路,KEGG分析富集的前20條通路中有8條通路與細胞分化相關。本研究結果表明,過表達和干擾CHRNG基因均能抑制牛成肌細胞的增殖和分化,且過表達和干擾CHRNG引起的差異基因所富集的通路大多與細胞分化相關。
關鍵詞: CHRNG基因;增殖和分化;成肌細胞;RNA-Seq
中圖分類號: S823.2
文獻標志碼: A
文章編號:0366-6964(2024)10-4360-17
收稿日期:2024-03-13
基金項目:陜西省科技計劃項目-重點研發計劃項目(2022GD-TSLD-46-0104);楊凌示范區青年育種專家培育支持計劃;2023年陜西省畜禽種業發展項目
作者簡介:毛曉宇(1999-),女,陜西西安人,碩士,主要從事動物遺傳育種研究,E-mail:maoxiaoyu@163.com
*通信作者:王洪寶,主要從事肉牛肌肉生長和脂肪沉積的分子調控機制及中國地方黃牛品種遺傳改良與新品種(系)培育的研究,E-mail:wanghongbao@nwsuaf.edu.cn
Effects of CHRNG Gene on Proliferation and Differentiation of Bovine Myoblasts
and Its Mechanism
MAO" Xiaoyu1, DU" Jiawei1, TANG" Jiayu1, PAN" Jinhai1, JIANG" Lei1, SUN" Xiaolei1, ZAN" Linsen
1,2, WANG" Hongbao1,2*
(1.College of Animal Science and Technology, Northwest Aamp;F University, Yangling 712100," China;
2.National Beef Cattle Improvement Center, Northwest Aamp;F University, Yangling" 712100, China)
Abstract:" This study aimed to investigate the effect of CHRNG gene on the proliferation and differentiation of bovine myoblasts and its potential molecular pathways. In this study, adenovirus was used to overexpress and interfere with CHRNG gene in Qinchuan cattle myoblasts. This study isolated myoblasts from the longissimus dorsi and hind leg muscles of healthy 3-day-old Qinchuan cattle. Adenovirus overexpression and interference with CHRNG gene were used in Qinchuan cattle myoblasts, which were divided into interference group (sh-CHRNG), interference control group (sh-NC), overexpression group (OE-CHRNG), and overexpression control group (OE-NC), with 3 replicates in each group. CCK-8, EdU, qRT-PCR, Western blot, immunofluorescence staining and other methods were used to detect the effects of interference and overexpression of CHRNG gene on the proliferation and differentiation of bovine myoblasts; Further screening of differential genes and enrichment of signaling pathways were performed through RNA-Seq. The results showed that overexpression and interference with CHRNG significantly downregulated the expression of cell cycle factors PCNA, CCNB1, and CCND2 (Plt;0.01), significantly upregulated the expression of CDKN1A (Plt;0.01), reduced the number of proliferating cells (CCK-8, Plt;0.01), and reduced the proportion of positive cells in the S replication phase (EdU). Overexpression and interference of CHRNG on bovine myoblasts and induction of differentiation were observed by morphological observation and immunofluorescence staining on D2, D4, and D6. The results showed that interference and overexpression of CHRNG inhibited the differentiation of bovine myoblasts and myotube formation. The qRT-PCR and Western blot results showed that overexpression and interference with CHRNG downregulated the mRNA and protein levels of MYOD1, MYOG and MYH3 genes (Plt;0.01). Through RNA-Seq sequencing analysis, it was found that the differentially expressed genes screened by overexpressing CHRNG were mainly enriched in endoplasmic reticulum protein processing, IL-17, thyroid hormone synthesis, PPAR, PI3K-Akt and other signaling pathways. Among the top 20 enriched pathways analyzed by KEGG, 10 pathways were related to cell differentiation; The differentially expressed genes screened by CHRNG were mainly enriched in signaling pathways such as axon guidance, MAPK, and PI3K-Akt. Among the top 20 enriched pathways analyzed by KEGG, 8 pathways were related to cell differentiation. The results suggested that overexpression and interference with CHRNG gene can inhibit the proliferation and differentiation of bovine myoblasts, and the pathways enriched by differential genes caused by overexpression and interference with CHRNG are mostly related to cell differentiation.
Key words: CHRNG gene; proliferation and differentiation; myoblast; RNA-Seq
*Corresponding author: WANG Hongbao, E-mail:wanghongbao@nwsuaf.edu.cn
骨骼肌是人類和動物體內最豐富的組織之一(占成年動物體重的40%~60%)[1],參與機體的運動和能量代謝。骨骼肌與畜禽的生產性狀息息相關[2],其數量和質量直接影響到肉制品的品質[3],在骨骼肌生長發育過程中導致的肌肉產量和肉質的差異能夠直接決定動物的經濟價值[4]。因此,研究肌肉分化再生的調控機制對畜牧業發展具有重要意義。骨骼肌發育是受遺傳調控和環境因素影響的多階段過程[5-7],這一過程包括核前體細胞的肌源性定向分化及成肌細胞的增殖、分化和融合。成肌細胞分化是一個復雜而高度協調的過程,涉及退出細胞周期[8]、細胞形態變化[9]、細胞融合[10]及許多其他生物學變化。開始分化進程后,增殖的成肌細胞暫停細胞周期,發生相互遷移和粘附,之后融合形成多核肌管[11-13]。肌生成依賴于許多細胞內通路,如生長因子與激素信號通路、Wnt信號通路、MAPK信號通路,細胞骨架組織和細胞外通訊,如粘附和內吞作用[14]。因此,探究成肌細胞分化的分子機制能夠為提高畜禽肉產品質量提供有價值的信息。
CHRNG(cholinergic receptor nicotinic gamma subunit)基因編碼的蛋白是肌肉型乙酰膽堿受體(nAChR)的一個γ亞基,在神經肌肉器官發生及配體結合中發揮重要作用[15-16],破壞γ亞基的表達會阻礙乙酰膽堿受體在細胞膜中的正確定位[17]。有研究稱nAChR在調節系統血壓方面發揮著重要作用[18];CHRNG基因的突變可導致埃斯科巴爾綜合征和多發性翼狀胬肉綜合征(Escobar syndrome and multiple pterygium syndrome)[17,19-20];一些報道還證明,CHRNG可能在細胞分化、生長等的生物過程中發揮重要作用[21]。目前尚未有文獻報道關于CHRNG基因在成肌細胞中的功能。本實驗室前期成肌細胞-前脂肪細胞的共培養相關研究中(結果尚未發表),通過轉錄組測序結合生物信息學分析發現,共培養下肌細胞可以促進脂肪細胞中CHRNG基因的表達,提示基因可能參與調控牛成肌細胞分化。因此本研究通過CCK-8、EdU、qRT-PCR、Western blot、免疫熒光染色等試驗技術,探究CHRNG對牛成肌細胞增殖和分化的影響,為揭示CHRNG在牛肌肉發育過程中的分子機理提供重要的理論支持,為肉牛肌肉組織生長發育的分子機制提供依據,進而為肉牛分子育種工作奠定基礎。
1 材料與方法
1.1 試驗材料
1.1.1 試驗樣品準備
本試驗中使用的牛原代成肌細胞均采自西北農林科技大學國家肉牛改良中心良繁場飼養的健康3日齡秦川牛后腿肌和背最長肌,具體分離步驟參照實驗室前期建立的方法[22]。
1.1.2 主要試劑與儀器
胎牛血清 (FBS, Gibco); TransDetect? Cell Counting Kit (北京全式金生物技術有限公司); DMEM/F-12、 PBS (Gibco); Cell-LightTM EdU Apollo567 In Vitro Kit (廣州銳博); PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time) kit、TB Green Premix ExTaqTMII (Tli RNaseH Plus) kit (TaKaRa); LipofectamineTM3000試劑盒、 CO2細胞培養箱(ThermoFisher); mRNA-Seq sample preparation kit (Illumina); 實時熒光定量PCR儀 (Biorad); 倒置熒光顯微鏡 (Olympus); 活細胞工作站 (Biotek); 化學發光成像系統 (Biorad); 多功能酶標儀 (TECAN)。
1.2 試驗方法
1.2.1 細胞培養
牛原代成肌細胞復蘇于6孔板中,用生長培養基(含20% FBS和1%青霉素/鏈霉素的DMEM/F12)進行培養(37℃和5% CO2的生長環境),每隔2 d更換1次生長培養基。當細胞密度達到 95%~100%時,通過將生長培養基換為誘導分化培養基(含2%馬血清和1%青霉素/鏈霉素的DMEM/F12)來啟動肌源性分化,培養基每2 d更換1次。
1.2.2 腺病毒包裝及侵染
CHRNG過表達腺病毒 (OE-CHRNG)及其空載對照 (OE-NC),干擾腺病毒(sh-CHRNG)及其空載對照(sh-NC)由上海和元生物科技有限公司包裝完成。腺病毒侵染試驗具體參照先前文獻[23]。
1.2.3 EdU染色
將牛成肌細胞接種于96孔板中,培養至匯合度達到40%~50%時進行腺病毒侵染,每組生物學重復3次。細胞侵染48 h后,使用EdU染色試劑盒 (Cell-LightTM EdU Apollo567 In Vitro Kit) 進行染色。根據制造商的說明,將細胞在EdU溶液中培養2 h,用PBS洗滌細胞2次,室溫下在細胞固定液(含有4%多聚甲醛的PBS)中孵育30 min,然后用PBS沖洗2次,之后用100 μL 0.5% Triton X-100滲透液孵育10 min;每個孔加入100 μL染色反應溶液并在搖床上室溫孵育培養30 min;用PBS清洗3次,之后將100μL 1×Hoechst 33342反應溶液添加到每個孔中在室溫下孵育30 min,最后用PBS清洗3次,將細胞放置在熒光顯微鏡下觀察。
1.2.4 CCK-8細胞增殖檢測
將牛成肌細胞接種于96孔板,分別用OE-NC、OE-CHRNG、sh-NC、sh-CHRNG處理(每組樣本重復數n=9)48 h后按照CCK-8說明書(TransDetect? Cell Counting Kit,全式金生物)將10% CCK-8溶液加入每個孔中,在細胞培養箱中培養4 h,使用酶標儀 (Infinite M200PRO, TECAN) 測定450 nm處的吸光度。
1.2.5 免疫熒光染色
在腺病毒侵染后細胞分化D4時,用PBS緩沖液洗滌細胞3次,然后用4%多聚甲醛固定30 min,之后每孔細胞加入含有0.5% Triton X-100的PBS滲透 10 min,然后用1% BSA/10%驢血清/0.3 mol·L-1甘氨酸溶液封閉1 h;將MYH3抗體(1∶200;PA5-103935;Thermo Fisher)在封閉溶液中稀釋后加入細胞,在4℃下過夜孵育;用PBS洗滌2次后,用在封閉液中稀釋后的驢抗小鼠IgG二抗(1∶500;ab150106;Abcam)室溫下孵育細胞2 h,除去二抗后用PBS洗滌細胞3次,最后加入DAPI染色劑(Sigma)(6孔板中每孔1 μL),在室溫下孵育10 min,將細胞放置在熒光顯微鏡下觀察。
1.2.6 RNA反轉錄及qRT-PCR
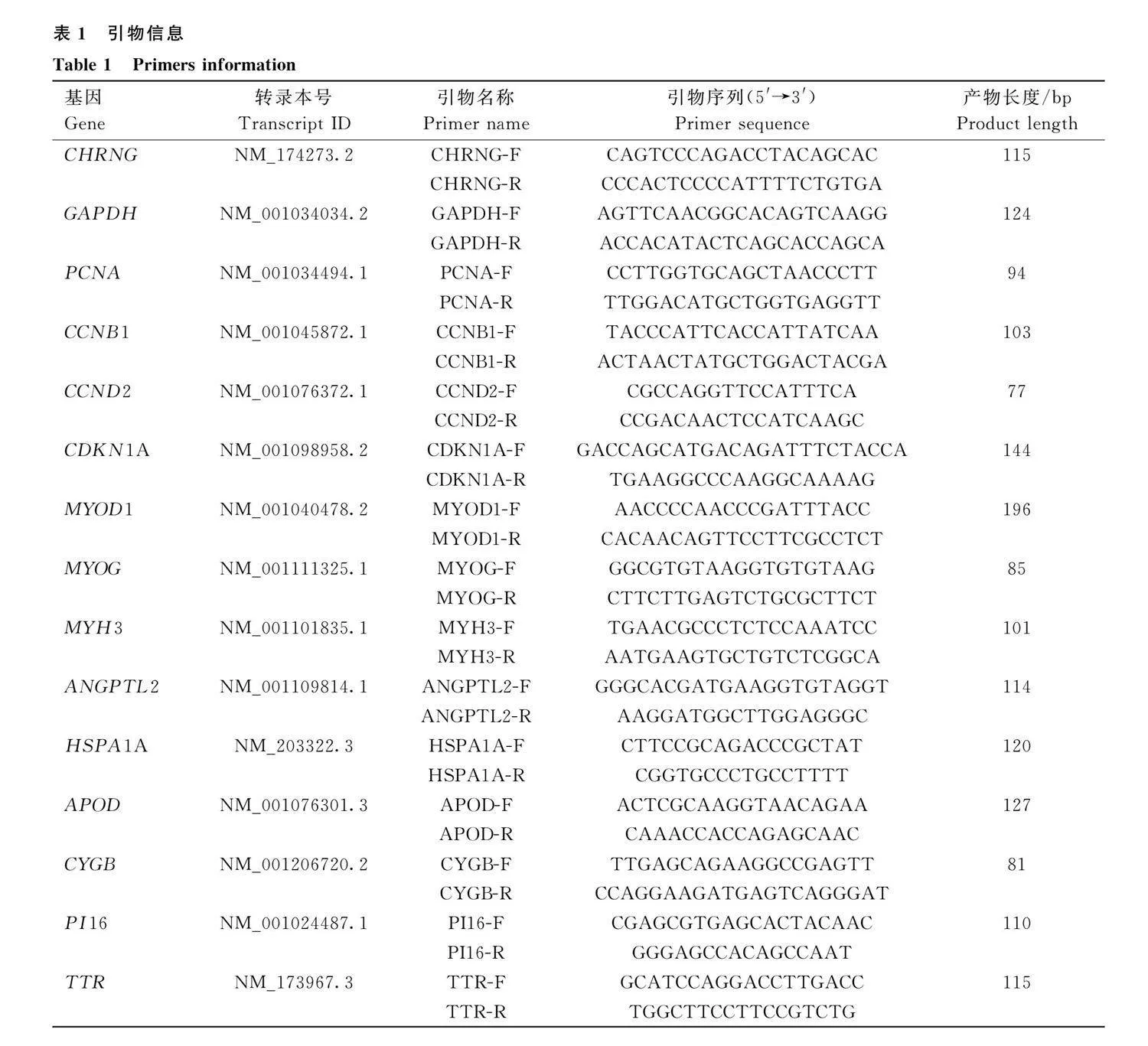
使用RNAiso Plus(TaKaRa)提取細胞總RNA,按照制造商的說明進行提取。按照 TaKaRa反轉錄試劑盒及SYBR Primix ExTaqTM Ⅱ試劑盒(TaKaRa)說明書進行 RNA 反轉錄和實時熒光定量 PCR。PCR體系總計15 μL:TB GreenⅡ7.5 μL,cDNA 1.2 μL,上游和下游引物各0.3 μL以及DEPC水5.7 μL。PCR反應在Bio-Rad熒光定量PCR儀(CFX Connect)進行。根據Gen-Bank中牛的基因序列,使用Primer premier 5軟件設計qRT-PCR上、下游引物,所有引物的序列如表1所示,引物均由陜西西安擎科生物技術有限公司合成。
1.2.7 Western blot
用于增殖和分化檢測的牛成肌細胞經PBS洗滌3次后,使用蛋白質提取試劑盒(北京索萊寶科技有限公司)根據制造商說明從細胞中提取總蛋白質。將20 μg蛋白質樣品上樣于12% SDS PAGE凝膠上電泳,然后將蛋白轉移到PVDF膜上,PVDF膜用5%脫脂牛奶密封2 h,之后將膜與Anti-GAPDH、MYOD1、MYOG等一抗4℃孵育過夜,回收抗體后將膜用TBST漂洗3次,然后在室溫避光環境中孵育二抗2 h,之后用TBST溶液漂洗膜3次,最后使用發光液進行化學發光、顯影。
1.2.8 cDNA文庫構建及轉錄組測序
在成肌細胞中過表達和干擾CHRNG基因后,收集分化D2的細胞,使用Trizol法提取細胞總RNA,分為過表達組和過表達對照組、干擾組和干擾對照組4組,每組3個生物學重復,根據制造商說明使用RNA 6000 Nano Kit (Agilent)和RINgt;7.0的安捷倫2100生物分析儀分析總RNA質量和純度。之后根據制造商說明,使用mRNA-Seq sample preparation kit(Illumina)構建cDNA文庫。在Illumina測序平臺上進行雙端測序,使用Illumina雙末端RNA-Seq方法對轉錄組進行測序,共產生數百萬個堿基的雙末端讀數,產生了千兆堿基(Gb)的序列。組裝前,去除低質量讀數(1.含有測序銜接子的讀數;2.含有測序引物的讀數;3.q質量分數低于20的核苷酸)。之后使用StringTie軟件組裝每個樣本中的映射讀數,合并樣本中的所有轉錄組,使用Perl腳本建立一個全面的轉錄組。生成最終轉錄組后,使用StringTie和Ballgroove軟件來估計轉錄本的表達水平。用StringTie軟件通過計算FPKM值來確定mRNA的表達水平,按照log2 (Fold change)gt;1或log2 (Fold change)lt;-1和統計學顯著性(Plt;0.05)標準進行差異表達基因(DEGs)篩選。在獲得差異表達基因后,對過表達組和干擾組中的DEGs進行GO和KEGG分析。
1.2.9 數據統計分析
本研究中,所有數據分析均使用2-ΔΔCt的方法,GAPDH作為內參基因使所有基因表達水平標準化。使用Excel表格分析處理數據,數據用“Means±SD”表示,單獨兩樣本之間利用t檢驗法檢測差異顯著性;*.Plt;0.05為差異顯著,**.Plt;0.01為差異極顯著;樣本重復數n=3,最后利用GraphPad prism 9.0軟件繪圖。
2 結 果
2.1 CHRNG基因在成肌細胞中不同分化時期的表達分析
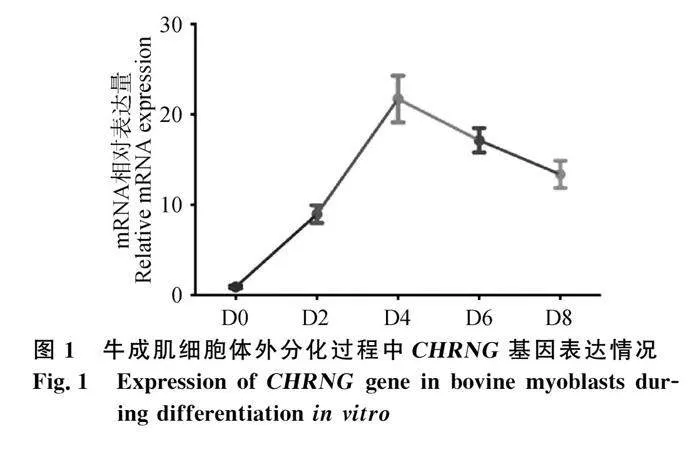
本研究提取了秦川牛原代成肌細胞體外誘導分化D0、D2、D4、D6、D8的細胞總RNA并反轉錄為cDNA,通過qRT-PCR檢測CHRNG基因在成肌細胞分化過程中的時序表達譜。CHRNG基因的mRNA表達水平在成肌細胞分化D0到 D8總體呈現先升高后降低的趨勢,誘導分化開始后CHRNG基因的表達量逐漸升高,并在D4時表達量達到峰值;分化D4之后CHRNG基因的表達量開始下降(圖1)。
2.2 腺病毒最佳MOI值的測定
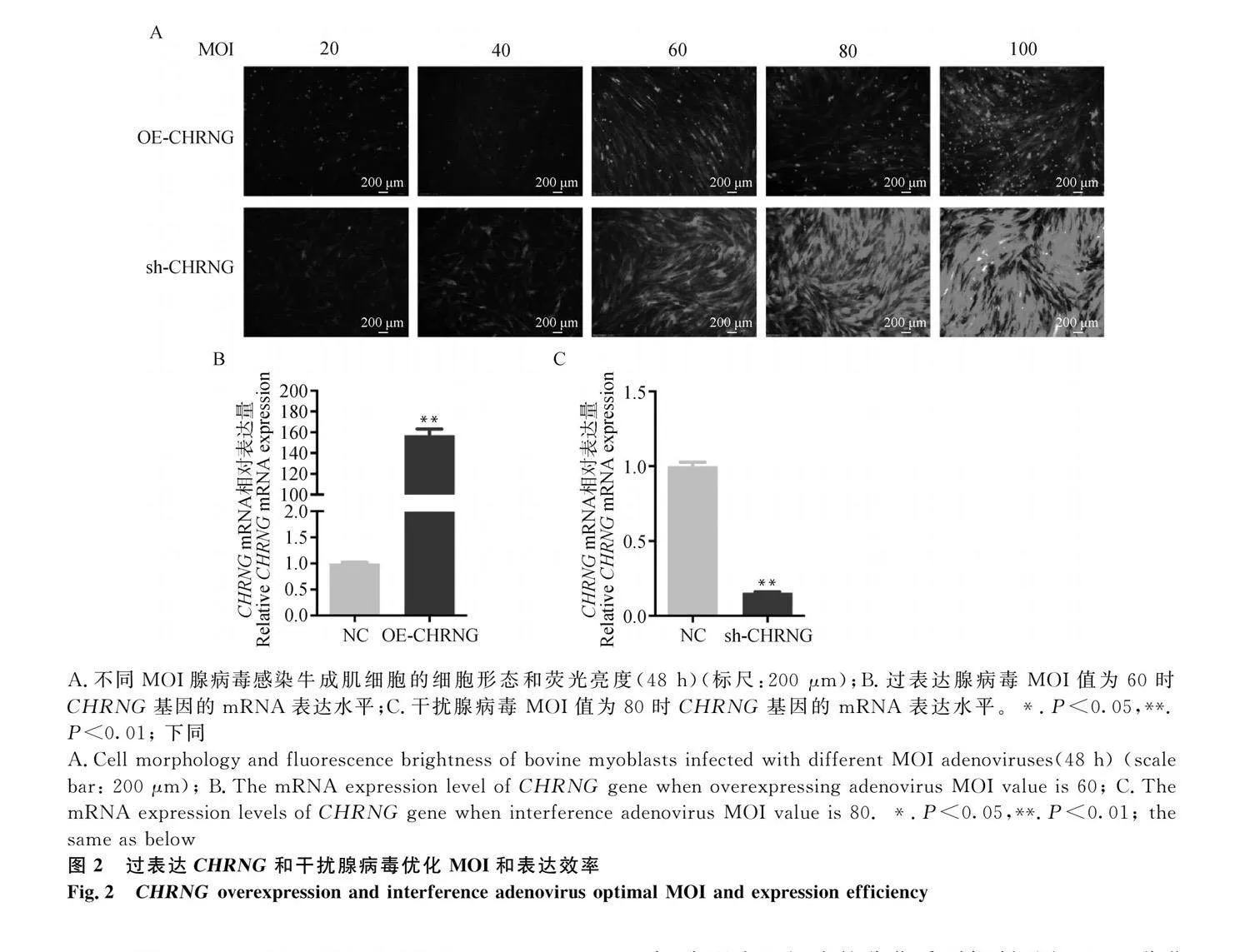
當成肌細胞生長至匯合程度達80%時,將OE-NC、OE-CHRNG、sh-NC、sh-CHRNG以不同感染復數(multiplicity of infection,MOI)侵染細胞。感染48 h后,觀察侵染效率和細胞狀態(圖2A)。經篩選,OE-CHRNG腺病毒最佳MOI=60,sh-CHRNG腺病毒最佳MOI=80。qRT-PCR和Western blot結果表明,OE-CHRNG腺病毒能顯著上調細胞中CHRNG基因的表達,sh-CHRNG腺病毒能顯著下調細胞中CHRNG基因的表達。與對照組相比,過表達組CHRNG基因mRNA水平上調了約160倍(圖2B,Plt;0.01),干擾組CHRNG基因mRNA水平約為對照組的15%(圖2C,Plt;0.01)。
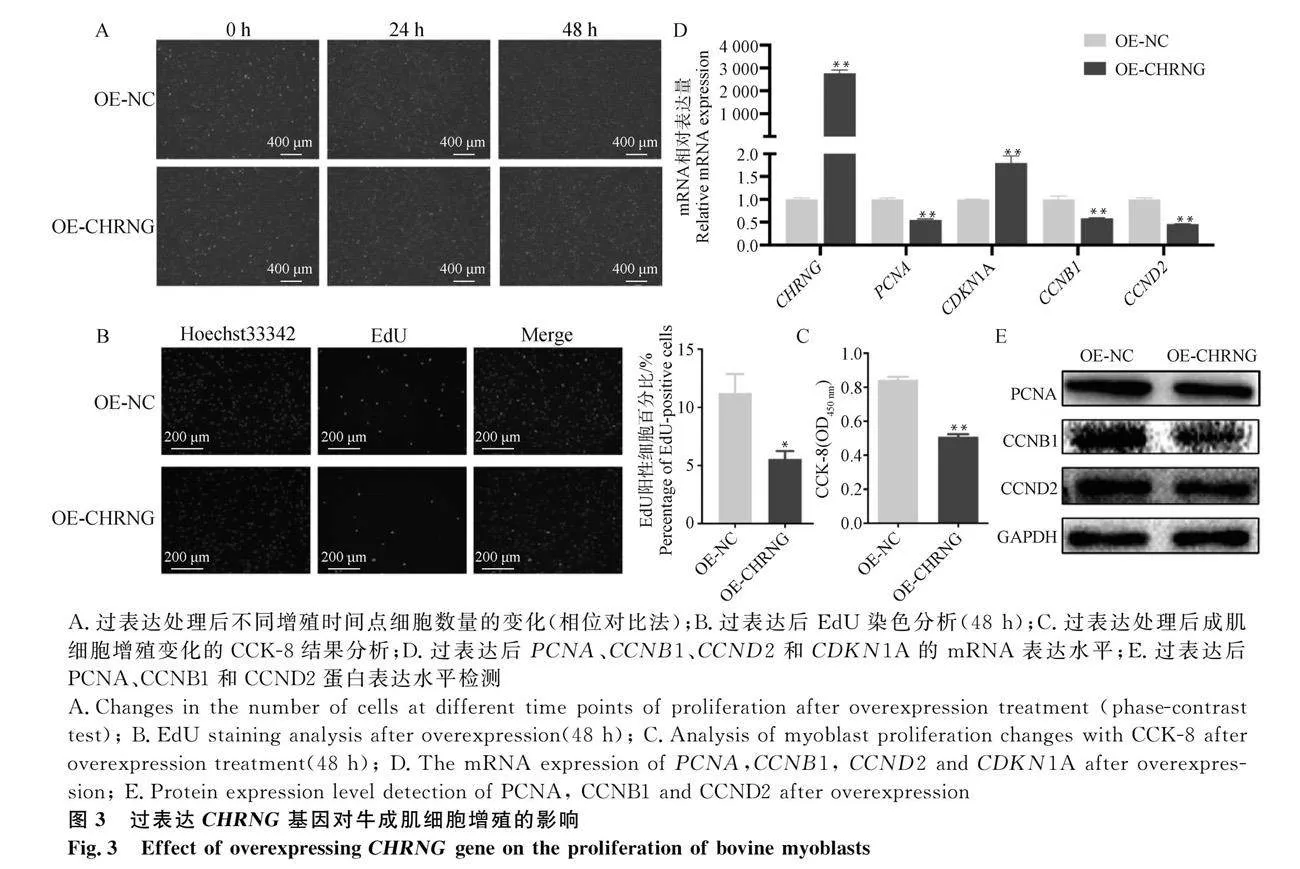
2.3 過表達CHRNG基因抑制成肌細胞增殖
首先,用熒光顯微鏡在不同時間觀察成肌細胞的形態(圖3A)。48 h后,對照組的細胞數量明顯多于過表達組,表明過表達CHRNG的成肌細胞增殖速度減慢。EdU染色結果顯示,CHRNG過表達后減少了EdU陽性細胞數量,表明DNA復制受到抑制(圖3B);CCK-8結果(圖3C)顯示,對照組的生長能力極顯著高于過表達組(Plt;0.01),這與EdU分析的結果一致。通過qRT-PCR和Western blot檢測細胞周期調節因子的表達水平發現,過表達組中細胞周期蛋白(PCNA)、細胞周期蛋白B1(CCNB1)和細胞周期蛋白D2(CCND2)mRNA和蛋白表達水平極顯著降低(Plt;0.01),細胞周期素依賴性激酶抑制劑1A(CDKN1A)mRNA和蛋白表達水平極顯著增加(Plt;0.01)(圖3D-E)。以上結果表明過表達CHRNG基因可以抑制成肌細胞增殖。
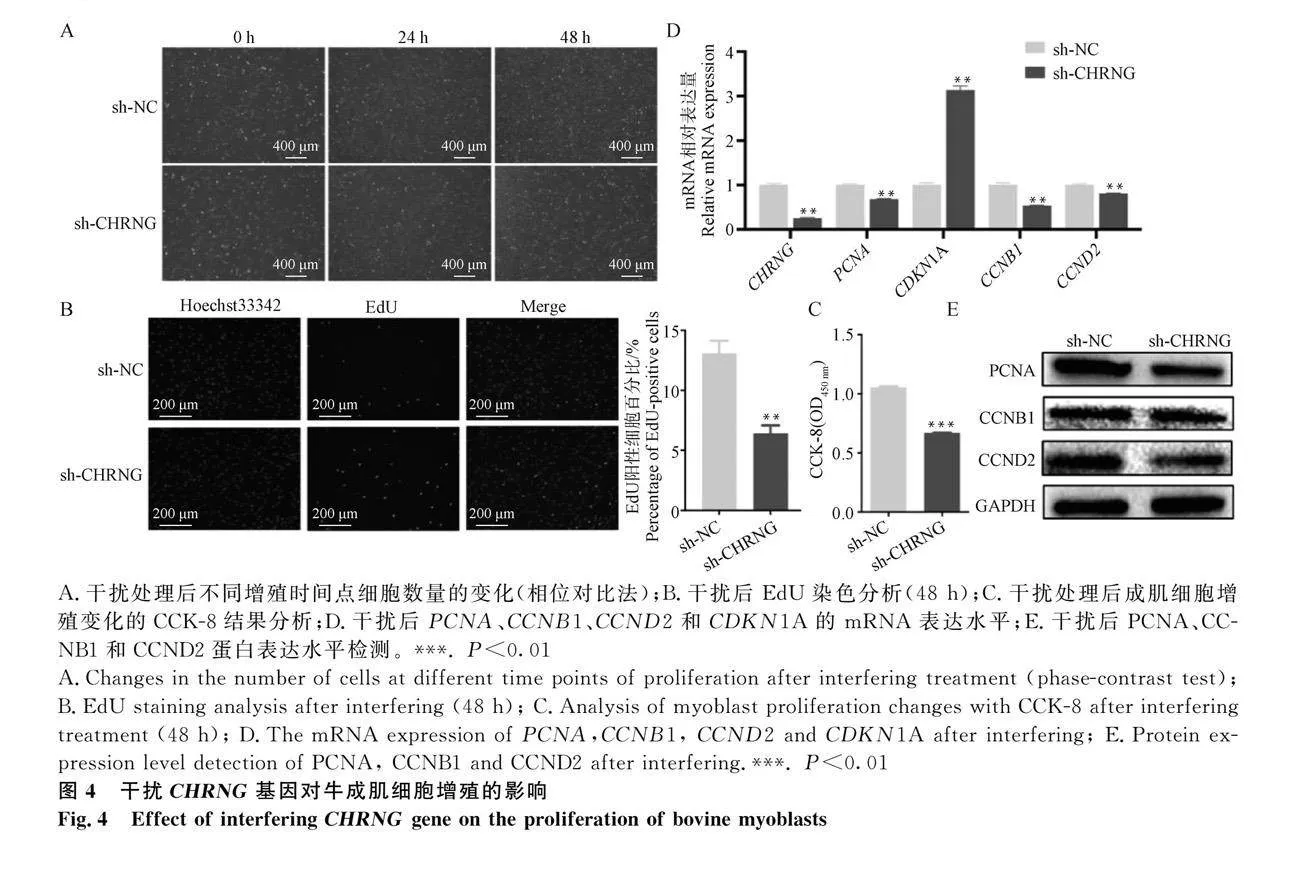
2.4 干擾CHRNG基因抑制成肌細胞增殖
使用sh-CHRNG腺病毒侵染牛成肌細胞后,通過熒光顯微鏡發現,在24、48 h時,細胞數量明顯少于對照組(圖4A)。EdU染色結果顯示(圖4B),EdU陽性細胞的數量少于對照組。CCK-8結果表明,對照組細胞的生長能力顯著高于干擾組(Plt;0.01)(圖4C)。通過檢測細胞周期調節因子的表達水平,發現在干擾CHRNG后,PCNA、CCNB1和CCND2的表達水平顯著降低(Plt;0.01),CDKN1A顯著增加(Plt;0.01)(圖4D)。Western blot分析和定量結果顯示PCNA、CCNB1和CCND2的蛋白水平降低(Plt;0.01)(圖4E)。綜上所述,所有結果表明干擾CHRNG基因抑制了成肌細胞的增殖。
2.5 過表達CHRNG基因抑制成肌細胞分化
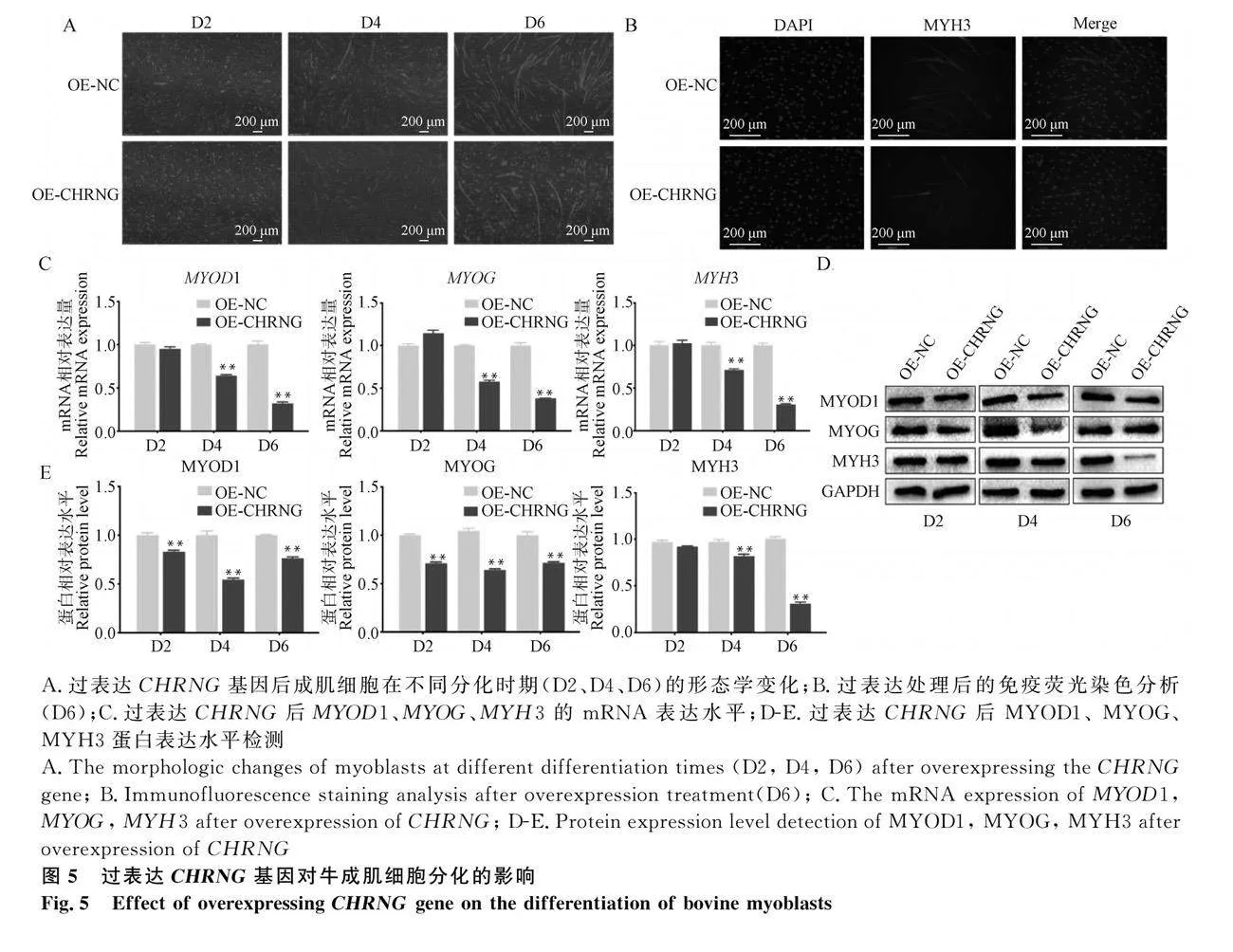
為了探究CHRNG基因對成肌細胞分化的影響,使用OE-CHRNG腺病毒侵染牛成肌細胞。在分化D2、4、6用熒光顯微鏡觀察成肌細胞分化狀態,發現成肌細胞的分化受到抑制(圖5A)。分化D4 MYH3免疫熒光染色結果顯示過表達組的肌管融合程度低,肌管數量較少(圖5B)。qRT-PCR 和 Western blot分析表明,分化的D4和D6,過表達組MYOD1、MYOG和MYH3的mRNA和蛋白表達水平顯著下調(Plt;0.01)(圖5C-E)。基于上述結果得出過表達CHRNG基因抑制成肌細胞分化。
2.6 干擾CHRNG基因抑制成肌細胞分化
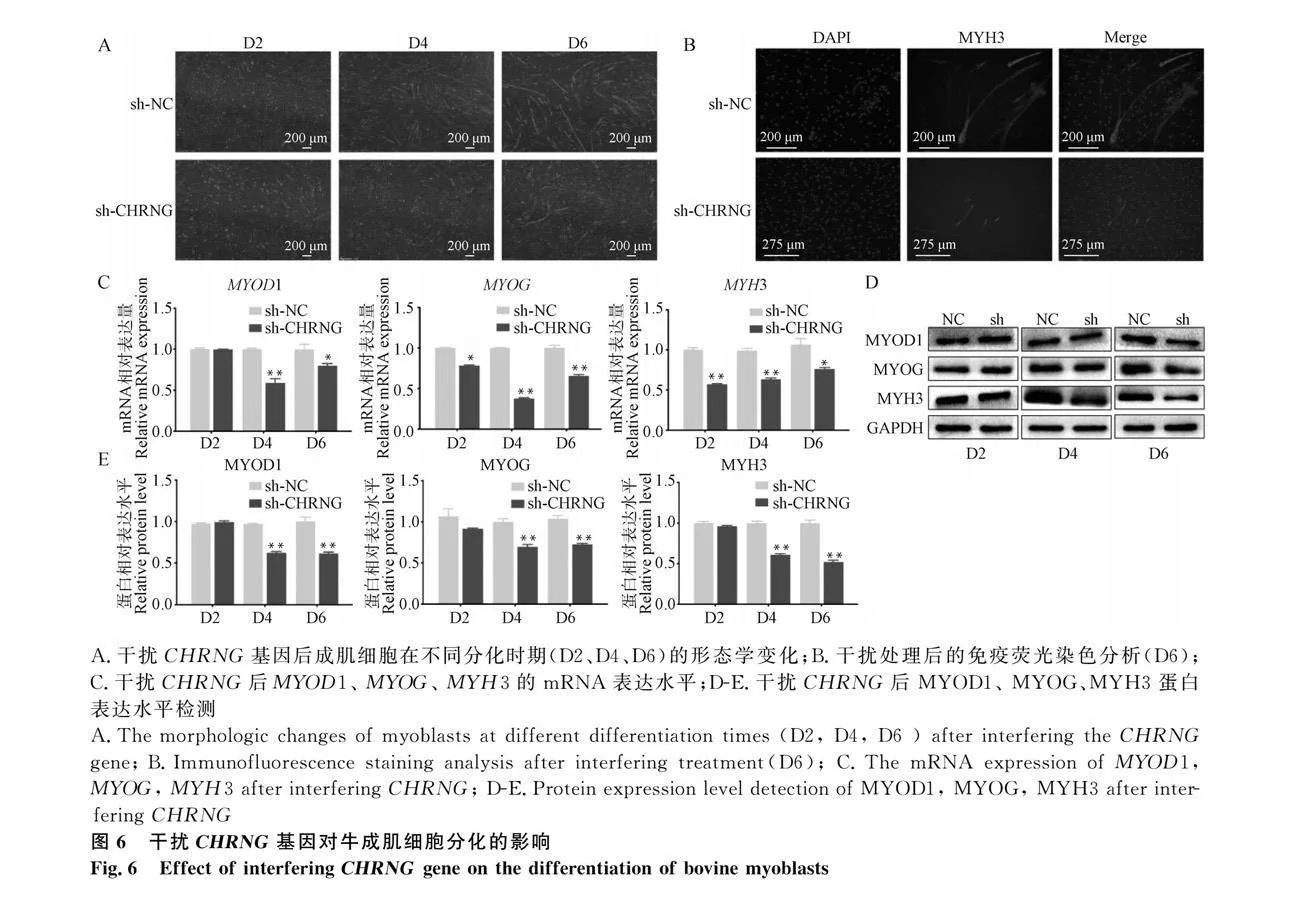
用sh-CHRNG腺病毒感染成肌細胞并誘導分化,通過細胞形態學觀察發現干擾組細胞的分化受到抑制(圖6A),分化D4 MYH3免疫熒光染色結果顯示干擾組的肌管較少,長度較短(圖6B)。通過qRT-PCR檢測成肌分化相關標志基因的表達,發現干擾組中MYH3和MYOG的表達在分化的D2、D4、D6顯著降低(圖6C),MYOD1的表達在分化的D2 和D4 顯著降低。Western blot分析和定量結果顯示,干擾組中MYOD1、MYOG和MYH3的蛋白表達量在D4和D6顯著降低(圖6D-E)。上述結果表明,干擾CHRNG抑制成肌細胞分化。
2.7 轉錄組測序分析CHRNG影響成肌細胞分化的潛在信號通路
為了進一步探究干擾和過表達CHRNG抑制牛成肌細胞分化的分子調控機制,對分化D2的成肌細胞進行轉錄組測序。
2.7.1 RNA-Seq結果可靠性驗證
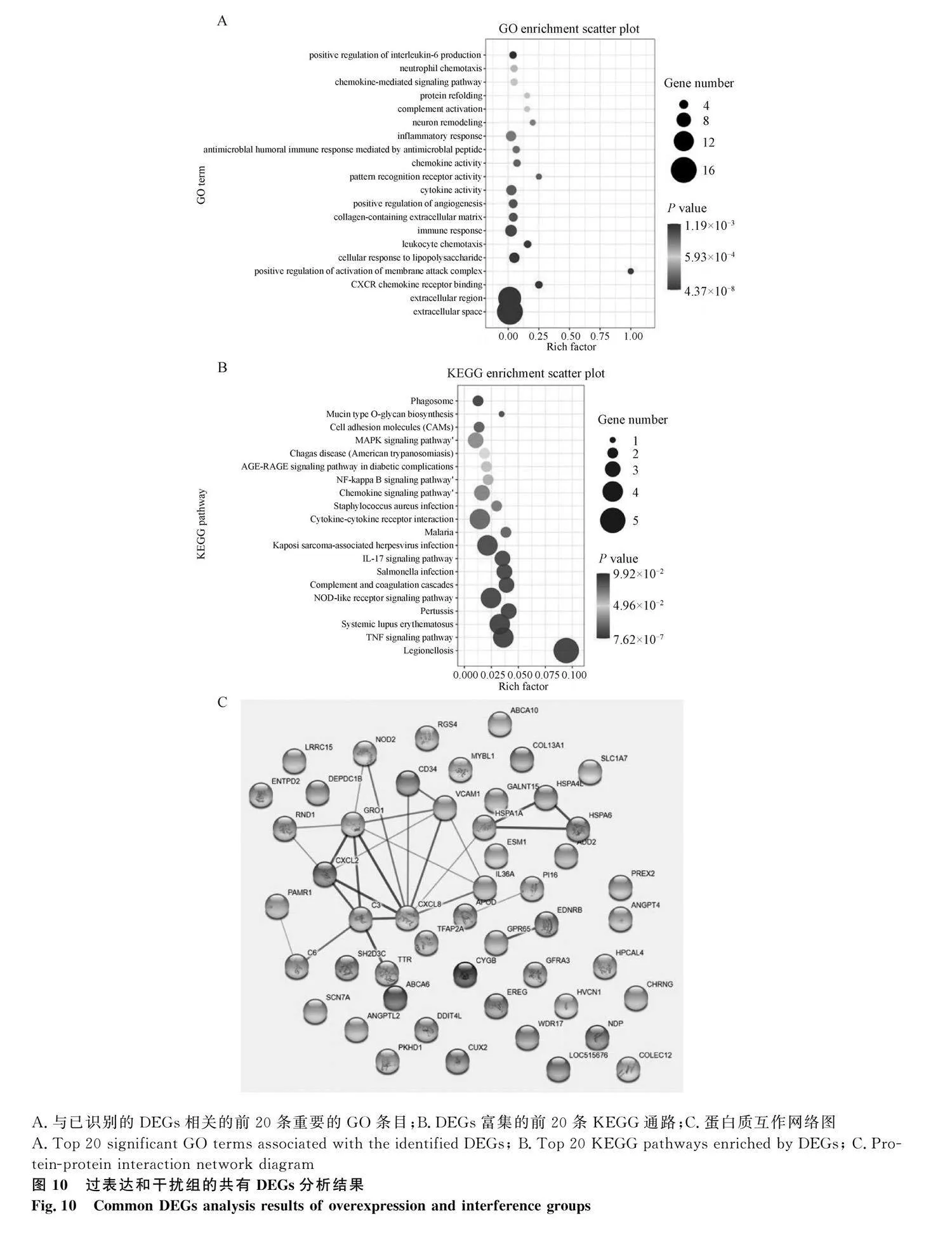
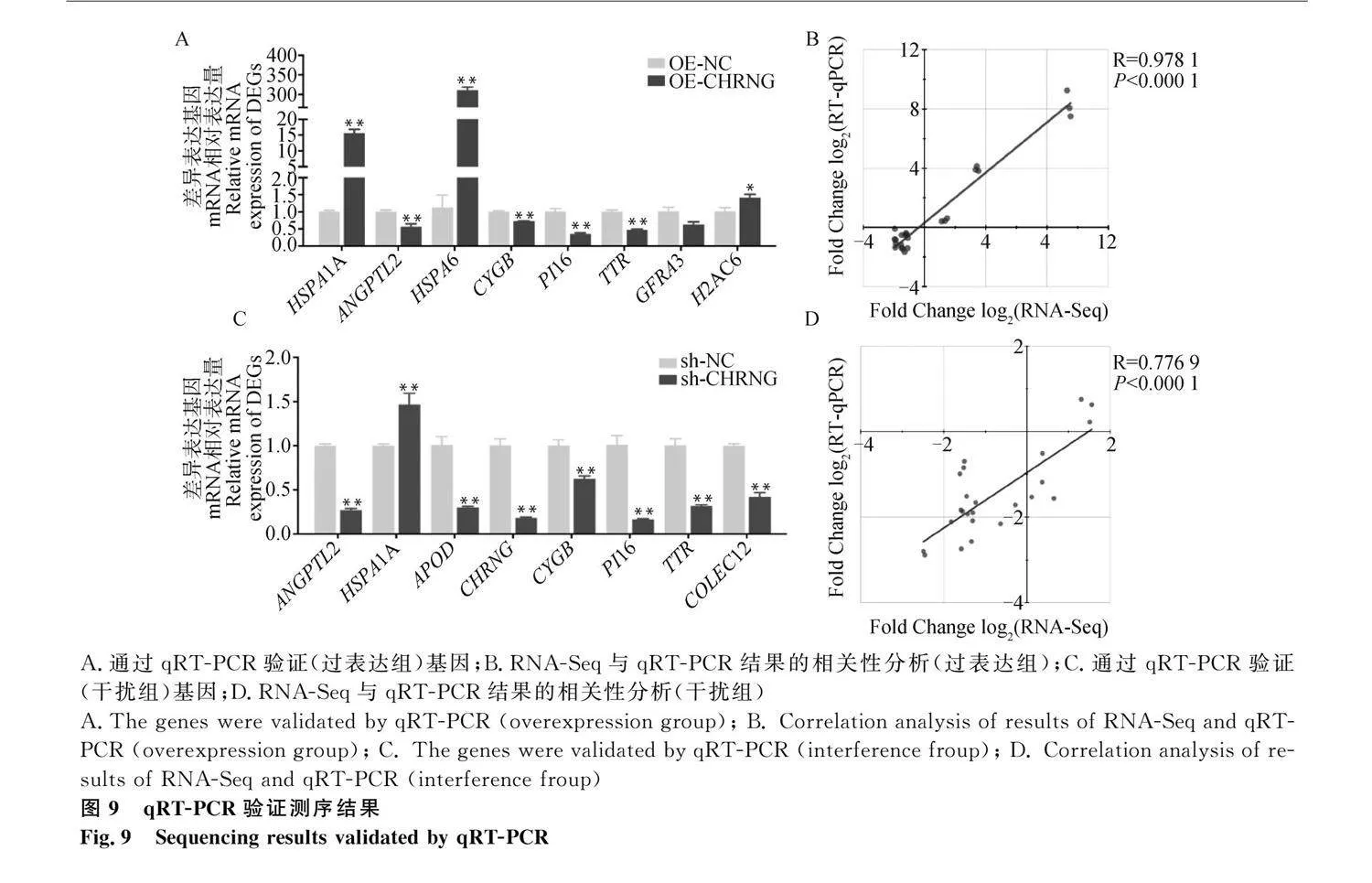
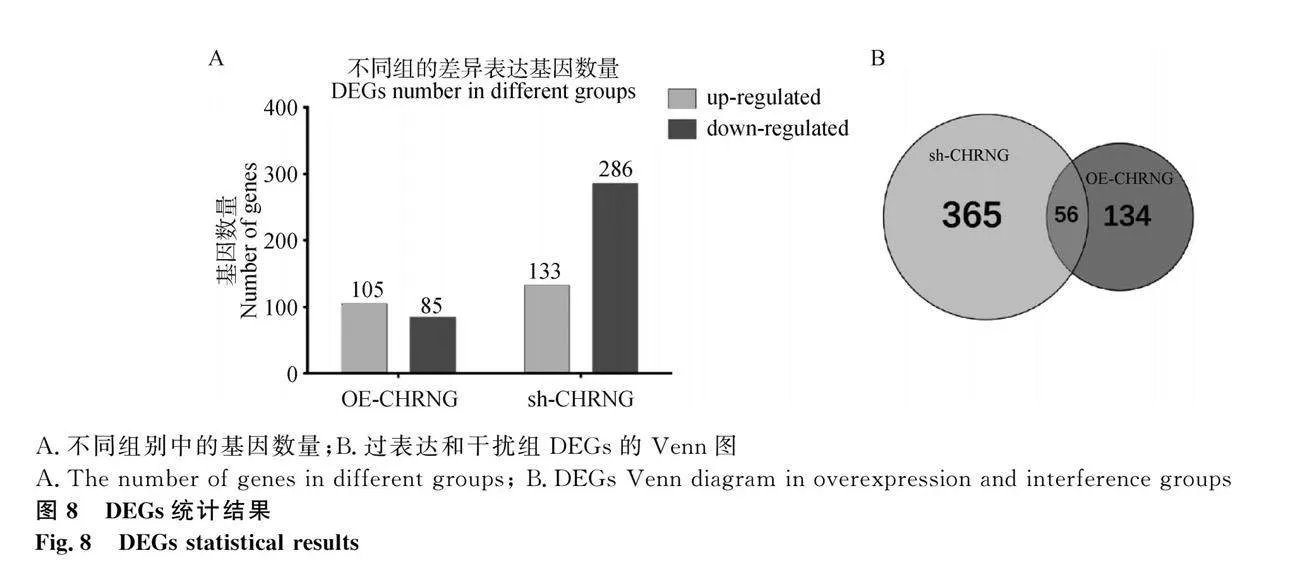
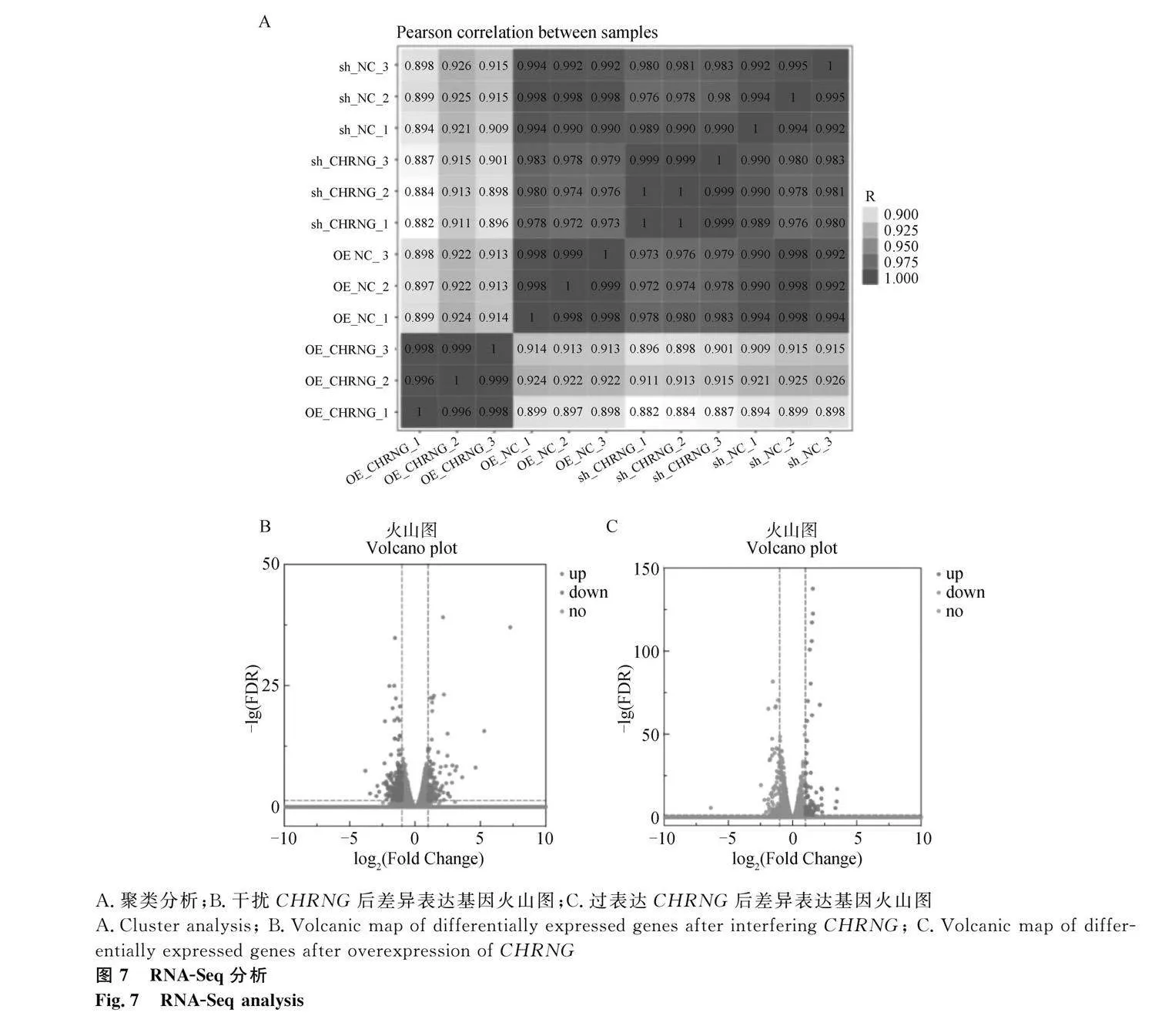
熱圖結果顯示,sh-CHRNG、sh-NC、OE-CHRNG、OE-NC能明顯分為4組,表明測序結果良好(圖7A)。與對照組相比,CHRNG過表達組有105個基因表達顯著上調,85個基因表達顯著下調;CHRNG干擾組有133個基因表達顯著上調,286個基因表達顯著下調(圖7B、7C,圖8A:log2 (Fold Change)gt;1或log2 (Fold Change)lt;-1)。發現過表達組和干擾組存在56個相同的差異表達基因(differential expression genes,DEGs)(圖8B),其中有18個基因在過表達組和干擾組均上調,25個基因在過表達組和干擾組均下調(表2和表3)。從過表達組和干擾組隨機選擇部分DEGs,使用qRT-PCR檢測其表達水平(圖9),結果顯示RNA-Seq測序結果可靠。
2.7.2 共同DEGs的GO和KEGG分析結果
通過對過表達和干擾組共同的差異基因進行基因功能(Gene Ontology, GO)和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路分析,細胞外空間和細胞因子活性信號通路具有最高的顯著性,這兩個信號通路包含的DEGs最多(圖10A)。KEGG分析顯示(圖10B),有12條信號通路與細胞分化相關,其中6條信號通路在過表達組和干擾組單獨的KEGG分析結果中沒有出現,如趨化因子信號通路和NOD樣受體信號通路。蛋白質互作網絡(PPI)結果顯示,CXCL8是蛋白質相互作用的核心蛋白質(圖10C),CXCL8參與12條信號通路。
2.7.3 過表達組中DEGs的GO和KEGG分析結果
對過表達組的DEGs進行GO和KEGG分析。前20個通路包括了與細胞因子相關的細胞外空間和細胞外區域這兩條通路。前20條KEGG通路中(圖11B),有10條信號通路,如PI3K-AKT信號通路和IL-17信號通路等與細胞分化有關,DEGs顯著富集在這些信號通路中。
2.7.4 干擾組中DEGs的GO和KEGG分析結果
對干擾組的DEGs進行GO和KEGG分析。前20個GO terms的結果(圖12A)顯示,DEGs更顯著的富集在細胞外區域、細胞外空間和細胞外基質通路中。通過分析前20條KEGG通路(圖12B),發現其中8條信號通路,包括MAPK信號通路和PI3K-Akt信號通路與細胞分化有關,其中軸突導向、Rap1信號通路、Wnt信號通路和ECM受體相互作用這4條信號通路僅在干擾組中富集。
3 討 論
肌肉的發育離不開成肌細胞的增殖和分化,成肌細胞增殖和分化的過程極其復雜,除了受生肌調節因子調節之外,還受到不同離子通道的調控[24]。CHRNG基因編碼肌肉型nAChR復合物的γ亞基,該基因作為構成煙堿乙酰膽堿受體的亞基之一,參與nAChR復合物行使配體門控離子通道的重要功能。nAChR與乙酰膽堿結合后,構象發生變化,導致橫跨質膜的離子傳導通道打開,細胞內Ca2+離子濃度發生變化。Ca2+作為第二信使之一,在細胞增殖、分化和凋亡中發揮著重要作用,細胞內Ca2+濃度的調節主要依靠機體細胞中存在的多種鈣離子通道[25]。骨骼肌發育進程中,成肌細胞的融合與分化嚴格依賴于鈣離子,并且鈣離子內流是成肌細胞肌管形成的先決條件[26]。CHRNG基因在胎兒神經肌肉信號轉導以及在建立肌肉和運動神經末梢的主要接觸中發揮重要作用[27],有研究表明CHRNG基因可被選為肉質嫩度相關的候選基因,與肉牛肌原纖維斷裂指數(MFI)相關[28],但CHRNG對肌肉生長發育的具體功能仍未見有研究。
細胞周期是細胞生命活動的基本過程,在CDK及Cyclin的相互調控下進行,通過G1/S 期與G2/M期兩個檢查點,S期在DNA解旋酶(MCM2-7)與DNA復制酶下進行DNA復制。本研究發現,PCNA、CCNB1和CCND2的表達量在干擾和過表達CHRNG基因后顯著降低,CDKN1A的表達量則顯著增加。PCNA是DNA聚合酶δ的輔因子,調節細胞DNA的合成,與細胞的增殖周期關系密切[29];CCNB1是有絲分裂主要調節因子,參與細胞分裂G2期并且可以與周期蛋白依賴激酶1(CDK1)結合形成復合物,從而促進細胞從G2期向M期的轉變[30];CCND2是一種D型細胞周期蛋白,通過與周期蛋白依賴激酶4(CDK4)、周期蛋白依賴激酶6(CDK6)的結合參與G1/S點的調控;CDKN1A編碼一種有效的周期蛋白依賴性激酶抑制劑,該蛋白與周期蛋白依賴激酶2(CDK2)或CDK4結合并抑制其活性,因此作為細胞G1期進程的調節劑調節細胞周期進展[31]。有研究發現,干擾和過表達LRRN1抑制牛成肌細胞增殖[32];在探究ACTC1基因對牛成肌細胞和前體脂肪細胞增殖和分化的作用時發現ACTC1的干擾和過表達均抑制成肌細胞的增殖[33]。產生這種現象可能是由于細胞中基因本底表達水平高,因此CHRNG過表達可能導致細胞周期調節紊亂;另一種原因可能是干擾和過表達CHRNG對細胞凋亡產生反向調控,導致細胞周期的正常運行受到影響。Bax和Bcl-2是細胞凋亡通路的核心調控因子,據前人研究,Bcl-2介導抗凋亡信號,Bax介導促凋亡信號,抗凋亡和促凋亡相互制衡,共同維系細胞凋亡進程的穩態[34-35]。因此還需深入探究CHRNG基因在細胞凋亡中的功能,從而對本研究結果進行深入解釋。
本研究通過過表達和干擾CHRNG基因發現,過表達和干擾CHRNG基因抑制了成肌細胞分化和肌管形成。對于這一結果,我們推測可能由于干擾和過表達CHRNG同時促進或抑制某些調控成肌分化的基因或者信號通路,也可能由于干擾和過表達CHRNG對某些成肌分化相關基因或信號通路分別造成影響,從而導致過表達和干擾CHRNG基因抑制成肌細胞的分化和肌管形成。接下來進行了RNA-Seq分析,結果發現過表達和干擾CHRNG都上調了HSPA1A、HSPA6、HSPA4L、MYBL1等基因的表達,下調了PIl6、TTR、ANGPTL2、COLEC12等基因的表達,HSPA1A、HSPA6、HSPA4L均屬于HSP70超家族,HSP70在釋放到細胞外環境中時,會觸發細胞因子TNF-α、IL-12和干擾素γ(IFN-γ)等的釋放[36],這些促炎細胞因子反過來可以抑制C2C12細胞的肌源性分化[37];通過誘導HSP70及其向細胞外環境釋放能通過直接抑制C2C12中的肌生成素抑制肌生成[36,38]。HSPA1A基因編碼熱休克蛋白HSP70-1,作為HSP70超家族的一員,HSP70-1主要作為防止錯誤折疊的蛋白質聚集的分子伴侶來發揮作用,在維持細胞對炎癥、氧化應激、低氧或高氧、低熱或高熱和感染等細胞應激條件的反應中發揮著重要作用[39];已有報道顯示,HSPA1A顯著抑制了C2C12肌細胞的增殖和肌管的分化[40];HSPA1A基因的過表達通過Wnt/β-連環蛋白信號通路促進骨髓的間充質干細胞成骨分化[41];HSPA1A誘導小鼠肌肉萎縮[42]。因而成肌分化抑制可能由于干擾和過表達CHRNG同時上調的HSPA1A所導致。
KEGG分析得到過表達和干擾CHRNG共同調節的DEGs主要富集在細胞因子-細胞因子受體相互作用、IL-17、MAPK、TNF、PI3K/Akt等信號通路,這些經典的信號通路在細胞當中發揮重要作用,細胞因子-細胞因子受體相互作用通路涉及多個信號傳導途徑,對細胞的生長、分化、生存和功能產生深遠影響;MAPK信號通路調節著細胞的生長、分化、對環境的應激適應、炎癥反應等多種重要的細胞生理/病理過程[43];PI3K/Akt信號通路在胰島素的刺激以及細胞生存當中發揮著重要作用[44]。
前人在探究MEF2A調控牛骨骼肌成肌細胞增殖和分化的機制時發現,干擾和過表達MEF2A抑制了成肌細胞分化[45],過表達MEF2A導致成肌細胞嚴重凋亡并產生大量細胞碎片,在本研究中未發現明顯的細胞凋亡情況,過表達和干擾CHRNG對成肌細胞分化調控與細胞異常凋亡無關,仍需對RNA-Seq結果進行深入驗證。盡管過表達和干擾是研究基因功能的有效手段,但由于細胞中復雜的調節機制,基因的過表達和干擾并不總是相反地調節細胞的生理過程,這提醒我們在探究基因功能時,要進行功能獲得和功能喪失的雙向研究。綜上所述,CHRNG基因對肌肉發育十分重要,在牛成肌細胞內CHRNG基因的表達量需要保持穩態,否則將會抑制牛成肌細胞的增殖和分化。本研究為秦川牛肌肉生長發育的分子機制提供了重要信息,有助于提高牛肉品質。
4 結 論
本研究通過腺病毒侵染技術實現在秦川牛成肌細胞中干擾和過表達CHRNG基因,并通過CCK-8、EdU、RT-qPCR、Western blot、免疫熒光染色等試驗發現,過表達和干擾CHRNG基因均抑制牛成肌細胞的增殖和分化。
參考文獻(References):
[1] SHAHRIYARI M,ISLAM M R,SAKIB S M,et al.Engineered skeletal muscle recapitulates human muscle development,regeneration and dystrophy[J].J Cachexia Sarcopenia Muscle,2022,13(6):3106-3121.
[2] CHOI K H,YOON J W,KIM M,et al.Muscle stem cell isolation and in vitro culture for meat production:a methodological review[J].Compr Rev Food Sci Food Saf,2021,20(1):429-457.
[3] SUN Y J,LIU K P,HUANG Y Z,et al.Differential expression of FOXO1 during development and myoblast differentiation of Qinchuan cattle and its association analysis with growth traits[J].Sci China Life Sci,2018,61(7):826-835.
[4] YAN E F,GUO J X,YIN J D.Nutritional regulation of skeletal muscle energy metabolism,lipid accumulation and meat quality in pigs[J].Anim Nutr,2023,14:185-192.
[5] YU M B,FENG Y Q,YAN J M,et al.Transcriptomic regulatory analysis of skeletal muscle development in landrace pigs[J].Gene,2024,915:148407.
[6] 劉 媛,李溪月,張維婭.MMP14調控骨骼肌衛星細胞分化的分子機制研究[J].畜牧獸醫學報,2024,55(4):1592-1604.
LIU Y,LI X Y,ZHANG W Y.Molecular mechanism of MMP14 regulating skeletal muscle satellite cell differentiation[J].Acta Veterinaria et Zootechnica Sinica,2024,55(4):1592-1604.(in Chinese)
[7] CAI S F,WANG X Y,XU R,et al.KLF4 regulates skeletal muscle development and regeneration by directly targeting P57 and Myomixer[J].Cell Death Dis,2023,14(9):612.
[8] RAI M,KATTI P,NONGTHOMBA U.Spatio-temporal coordination of cell cycle exit,fusion and differentiation of adult muscle precursors by Drosophila erect wing (Ewg)[J].Mech Dev,2016,141:109-118.
[9] TERRUZZI I,VACANTE F,SENESI P,et al.Effect of hazelnut oil on muscle cell signalling and differentiation[J].J Oleo Sci,2018,67(10):1315-1326.
[10] QUINN M E,GOH Q,KUROSAKA M,et al.Myomerger induces fusion of non-fusogenic cells and is required for skeletal muscle development[J].Nat Commun,2017,8:15665.
[11] ABMAYR S M,PAVLATH G K.Myoblast fusion:lessons from flies and mice[J].Development,2012,139(4):641-656.
[12] PANG K T,LOO L S W,CHIA S,et al.Insight into muscle stem cell regeneration and mechanobiology[J].Stem Cell Res Ther,2023,14(1):129.
[13] WANG Y J,LU J Q,LIU Y J.Skeletal muscle regeneration in cardiotoxin-induced muscle injury models[J].Int J Mol Sci, 2022,23(21):13380.
[14] BELGRANO A,RAKICEVIC L,MITTEMPERGHER L,et al.Multi-tasking role of the mechanosensing protein Ankrd2 in the signaling network of striated muscle[J].PLoS One,2011,6(10):e25519.
[15] SANDWEISS A J,PATEL S,BADER M Y,et al.A truncating variant of CHRNG as a cause of Escobar syndrome:a multiple pterygium syndrome subtype[J].J Pediatr Genet,2022,11(2):144-146.
[16] KAPUR A,DAVIES M,DRYDEN W F,et al.Activation of the Torpedo nicotinic acetylcholine receptor.The contribution of residues αArg55 and γGlu93[J].FEBS J,2006,273(5):960-970.
[17] HOFFMANN K,MLLER J S,STRICKER S,et al.Escobar syndrome is a prenatal myasthenia caused by disruption of the acetylcholine receptor fetal γ subunit[J].Am J Hum Genet,2006,79(2):303-312.
[18] BUCCAFUSCO J J.The role of central cholinergic neurons in the regulation of blood pressure and in experimental hypertension[J].Pharmacol Rev,1996,48(2):179-211.
[19] MORGAN N V,BRUETON L A,COX P,et al.Mutations in the embryonal subunit of the acetylcholine receptor (CHRNG) cause lethal and Escobar variants of multiple pterygium syndrome[J].Am J Hum Genet,2006,79(2):390-395.
[20] SEO J,CHOI I H,LEE J S,et al.Rare cases of congenital arthrogryposis multiplex caused by novel recurrent CHRNG mutations[J].J Hum Genet,2015,60(4):213-215.
[21] TORRO A S,BRITTO L R G.Neurotransmitter regulation of neural development:acetylcholine and nicotinic receptors[J].An Acad Bras Ciênc,2002,74(3):453-461.
[22] WANG Y N,YANG W C,LI P W,et al.Myocyte enhancer factor 2A promotes proliferation and its inhibition attenuates myogenic differentiation via myozenin 2 in bovine skeletal muscle myoblast[J].PLoS One,2018,13(4):e0196255.
[23] JUNJVLIEKE Z,KHAN R,MEI C G,et al.Effect of ELOVL6 on the lipid metabolism of bovine adipocytes[J]. Genomics, 2020, 112(3):2282-2290.
[24] 李雯茜,閆百儀,丁愷志,等.離子通道調控成肌細胞分化的研究進展[J].生物化工,2022,8(6):167-169.
LI W X,YAN B Y,DING K Z,et al.Advances in myoblast differentiation and ion channel regulation[J].Biological Chemical Engineering,2022,8(6):167-169.(in Chinese)
[25] SI Y F,WEN H S,DU S J.Genetic mutations in jamb,jamc,and myomaker revealed different roles on myoblast fusion and muscle growth[J].Mar Biotechnol,2019,21(1):111-123.
[26] 朱 燕,羅 欣,周光宏.鈣離子處理對成肌細胞μ-calpain mRNA和蛋白表達的影響[J].山東農業大學學報(自然科學版),2006,37(4):561-567,572.
ZHU Y,LUO X,ZHOU G H.Effect of cacium IoM on the MRNA and protein level expresslon of μ-calpain in rat L6 myoblast[J].Journal of Shandong Agricultural University (Natural Science),2006,37(4):561-567,572.(in Chinese)
[27] ROBINSON K G,VIERECK M J,MARGIOTTA M V,et al.Neuromotor synapses in Escobar syndrome[J].Am J Med Genet A,2013,161(12):3042-3048.
[28] MUNIZ M M M,FONSECA L F S,MAGALHES A F B,et al.Use of gene expression profile to identify potentially relevant transcripts to myofibrillar fragmentation index trait[J].Funct Integr Genomics,2020,20(4):609-619.
[29] CARDANO M,TRIBIOLI C,PROSPERI E.Targeting proliferating cell nuclear antigen (PCNA) as an effective strategy to inhibit tumor cell proliferation[J].Curr Cancer Drug Targets,2020,20(4):240-252.
[30] BAO B,YU X J,ZHENG W J.MiR-139-5p targeting CCNB1 modulates proliferation,migration,invasion and cell cycle in lung adenocarcinoma[J].Mol Biotechnol,2022,64(8):852-860.
[31] RAN T F,KE S,SONG X,et al.WIPI1 promotes osteosarcoma cell proliferation by inhibiting CDKN1A[J]. Gene,2021, 782: 145537.
[32] 宋貴兵,賈鴻儒,蔣 蕾,等.秦川牛LRRN1基因表達分析及其對成肌細胞增殖分化的影響[J].農業生物技術學報,2023,31(7):1419-1429.
SONG G B,JIA H R,JIANG L,et al.Expression analysis of qinchuan cattle (Bos taurus) LRRN1 gene and its effect on proliferation and differentiation of myoblasts[J].Journal of Agricultural Biotechnology,2023,31(7):1419-1429.(in Chinese)
[33] LI A Q,SU X T,TIAN Y,et al.Effect of actin alpha cardiac muscle 1 on the proliferation and differentiation of bovine myoblasts and preadipocytes[J].Animals (Basel),2021,11(12):3468.
[34] ZHENG J H,VIACAVA FOLLIS A,KRIWACKI R W,et al.Discoveries and controversies in BCL-2 protein-mediated apoptosis[J].FEBS J,2016,283(14):2690-2700.
[35] PEA-BLANCO A,GARCíA-SEZ A J.Bax,bak and beyond—mitochondrial performance in apoptosis[J].FEBS J,2018,285(3):416-431.
[36] TODRYK S,MELCHER A A,HARDWICK N,et al.Heat shock protein 70 induced during tumor cell killing induces Th1 cytokines and targets immature dendritic cell precursors to enhance antigen uptake[J].J Immunol,1999,163(3):1398-1408.
[37] LANGEN R C J,SCHOLS A M W J,KELDERS M C J M,et al.Inflammatory cytokines inhibit myogenic differentiation through activation of nuclear factor-κB[J].FASEB J,2001,15(7):1169-1180.
[38] LONDHE P,DAVIE J K.Gamma interferon modulates myogenesis through the major histocompatibility complex class Ⅱ transactivator,CIITA[J].Mol Cell Biol,2011,31(14):2854-2866.
[39] NONG W D,HUANG F,MAO F P,et al.DCAF12 and HSPA1A may serve as potential diagnostic biomarkers for myasthenia gravis[J].Biomed Res Int,2022:8587273.
[40] BOLUS D J,SHANMUGAM G,NARASIMHAN M,et al.Recurrent heat shock impairs the proliferation and differentiation of C2C12 myoblasts[J].Cell Stress Chaperones,2018,23(3):399-410.
[41] ZHANG W,XUE D T,YIN H F,et al.Overexpression of HSPA1A enhances the osteogenic differentiation of bone marrow mesenchymal stem cells via activation of the Wnt/β-catenin signaling pathway[J].Sci Rep,2016,6:27622.
[42] ZHANG G H,LIU Z L,DING H,et al.Tumor induces muscle wasting in mice through releasing extracellular Hsp70 and Hsp90[J].Nat Commun,2017,8(1):589.
[43] 姜 勇,羅深秋.細胞信號轉導的分子基礎與功能調控[M].北京:科學出版社,2005.
JIANG Y,LUO S Q.The molecular basis and functional regulation of cellular signal transduction[M].Beijing:Science Publishing,2005.(in Chinese)
[44] ACOSTA-MARTINEZ M,CABAIL M Z.The PI3K/Akt pathway in meta-inflammation[J].Int J Mol Sci,2022,23(23):15330.
[45] 王亞寧.MEF2A對秦川牛骨骼肌成肌細胞增殖和分化的調控作用及機理研究[D].楊凌:西北農林科技大學,2019.
WANG Y N.The roles of MEF2A in the regulation of skeletal muscle myoblasts proliferation and differentiation in Qinchuan beef cattle[D].Yangling:Northwest Aamp;F University,2019.(in Chinese)
(編輯 郭云雁)

