瘤胃酸中毒對山羊胃腸道功能、形態和菌群的影響


摘 要: 旨在通過誘導瘤胃酸中毒模型,探究瘤胃酸中毒對山羊胃腸道組織和菌群結構的影響。本試驗選取8只健康波爾山羊為試驗對象,對照組4只,造模后的酸中毒組4只。通過瘤胃插管灌服玉米面的方法構建山羊瘤胃酸中毒模型。取胃腸道組織進行HE染色、RT-qPCR和Western blot檢測,探究瘤胃酸中毒對山羊消化道組織形態、功能蛋白的影響。另外分別取瘤胃液和盲腸內容物,應用 Illumina MiSeq 高通量測序技術測定樣本中細菌的16S rRNA,分析酸中毒對山羊胃腸道細菌群落組成的影響。結果顯示:與對照組相比,酸中毒組山羊的瘤胃和小腸的組織形態出現損傷,其結構完整性被破壞;瘤胃和十二指腸中的MCT1 mRNA相對表達量和蛋白質表達量均極顯著升高(Plt;0.01),而SLC5A8 mRNA相對表達量和蛋白表達量均極顯著降低(Plt;0.01)。對瘤胃內容物進行高通量測序后,相較于對照組,酸中毒組Alpha多樣性分析中Shannon指數顯著低(Plt;0.05),擬桿菌門(Bacteroidetes)、互養菌門(Synergistetes)的相對豐富度極顯著降低(Plt;0.01),纖維桿菌門(Fibrobacteres)、軟壁菌門(Tenericutes)的相對豐度顯著升高(Plt;0.05),瘤球菌屬(Ruminococcus)、普雷沃氏菌屬(Prevotella)的相對豐富度顯著降低(Plt;0.05)。對盲腸內容物高通量測序后,與對照組相比,酸中毒組的瘤胃球菌屬(Ruminococcus)、顫螺旋菌屬(Oscillospira)的相對豐富度顯著降低(Plt;0.05),梭菌屬(Clostridium)相對豐富度顯著升高(Plt;0.05)。綜上可知,瘤胃酸中毒可使山羊消化道組織形態完整性破壞,相關蛋白表達受影響,導致消化道菌群結構發生紊亂。
關鍵詞: 山羊;瘤胃酸中毒;胃腸道形態;高通量測序;菌群分析
中圖分類號: S858.26
文獻標志碼:A
文章編號:0366-6964(2024)10-4760-13
收稿日期:2023-10-17
基金項目:安徽省現代農業產業技術體系建設專項基金資助(AHCYJSTX-07);安徽省自然科學基金優青項目(2208085Y13);安徽省自然科學基金(2308085QC104);安徽農業大學引進高層次人才科研啟動經費(RC92107)。
作者簡介:張道亮(1999-),男,河南淮濱人,研究生,主要從事畜禽營養代謝病研究,E-mail:zdl15936569251@stu.ahau.edu.cn
*通信作者:李 玉,主要從事畜禽營養代謝病與中毒病研究,E-mail:lydhy2014@ahau.edu.cn
Effect of Rumen Acidosis on Gastrointestinal Function, Morphology, and Microflora
in Goats
ZHANG" Daoliang1, DING" Hongyan2, WANG" Liuxing1, TAI" Wenjun1, KONG" Hao1, ZHAO" Chang1,
FENG" Shibin1, WANG" Xichun1, XUE" Yanfeng1, WU" Jinjie1, LI" Yu1*
(1.College of Animal Science and Technology, Anhui Agricultural University, Hefei 230036," China;
2.Institute of Animal Husbandry and Veterinary Medicine, Anhui Academy of Agricultural Sciences,
Hefei 230031," China)
Abstract:" This study utilized a model of rumen acidosis induced by the administration of corn flour to investigate its impact on the gastrointestinal tract flora structure of goats. In this experiment, eight healthy Boer goats were selected as test subjects, 4 in the control group and 4 in the acidosis group after modeling. Gastrointestinal(GI) tissues were collected for HE staining, RT-qPCR, and Western blot assay to investigate the effects of rumen acidosis on the morphology and functional proteins of goat GI tissues. Illumina MiSeq high-throughput sequencing was used to determine the 16S rRNA of the bacteria in rumen fluid and cecum content, aimed to sutdy the effect of acidosis on the bacterial communities in the gastrointestinal tracts. The results showed that, compared with the control group, the tissue morphology and structural integrity of the rumen and small intestine were damaged in the acidosis group. The relative expression levels of MCT1 mRNA and protein in rumen and duodenum were extremely significantly increased (Plt;0.01), while the relative expression levels of SLC5A8 mRNA and protein were extremely significantly decreased (Plt;0.01). The results of high-throughput sequencing in rumen contents showed that, the Shannon index of Alpha diversity analysis in the acidosis group was significantly lower than that in the control group (Plt;0.01), and the relative richness of Bacteroidetes and Synergistetes was significantly decreased (Plt;0.01). The relative abundance of Fibrobacteres and Tenericutes was significantly increased (Plt;0.05), while the relative abundance of Ruminococcus and Prevotella was significantly decreased (Plt;0.05). After high-throughput sequencing of cecum contents, compared with the control group, the relative richness of Ruminococcus and Oscillospira in acidosis group was significantly decreased (Plt;0.05), while the relative richness of Clostridium was significantly increased (Plt;0.05). In conclusion, rumen acidosis can destroy the integrity of digestive tract morphology, affect the expression of related proteins, and disturb digestive tract flora structure.
Key words: goat; rumen acidosis; gastrointestinal morphology; high-throughput sequencing; flora analysis
*Corresponding author: LI Yu,E-mail:lydhy2014@ahau.edu.cn
在反芻動物養殖過程中,為了經濟效益最大化,人們通過改變飼喂方式和增加飼糧中精料比例來實現反芻動物的快速育肥。然而,這種飼喂方法雖然在短期內可能有助于提高反芻動物生長性能和經濟效益,但對動物的胃腸健康有相當大的影響。提高反芻動物日糧中精料比例時,瘤胃內的短鏈脂肪酸(short chain fatty acid,SCFA)的濃度會增加,瘤胃pH也隨之降低,繼而有可能引發瘤胃酸中毒[1]。
胃腸道屏障具有阻止病原體及毒害物質侵入的功能,在維持和穩定胃腸道健康方面發揮著重要作用,也是維持腸-肝軸穩定的核心[2]。使用谷物類飼料誘導牛羊等反芻動物發生亞急性瘤胃酸中毒(subacute ruminal acidosis, SARA)后發現,與對照組相比,高谷物飼糧組瘤胃乳頭出現角化不全,角質層細胞與顆粒層細胞之間的黏連受到損害,減少上皮細胞緊密連接,使細胞間縫隙增大,通透性升高對瘤胃組織造成長久的影響[3-4]。與此同時,飼喂高谷物的日糧不僅會影響山羊瘤胃的功能,還可能影響腸道功能,瘤胃中未經消化的碳水化合物會進入小腸,較高的滲透壓和低pH環境可引起腸道上皮結構和微生物發酵發生改變[5]。SCFA主要由反芻動物胃腸道內微生物發酵飼糧所產生,是腸道微生物的產物之一,通過腸道上皮被機體快速吸收,為動物提供60%~70%的能量[6]。當反芻動物食用的日糧成分發生變化時,其瘤胃液中的SCFA的含量也會隨之發生相應的變化。與此同時,單羧酸轉運蛋白1(monocarboxylate transporter,MCT1)和Na+耦合單羧酸轉運蛋白1(solute carrier gene family 5 member 8,SLC5A8)則介導了SCFA的轉運吸收[7-8]。
反芻動物胃腸道中棲息著大量的微生物,而這些胃腸道微生物與胃腸道正常的生理機能密切相關,胃腸道菌群失調會引起機體代謝紊亂和微生物感染,從而打破與宿主的互利作用,對動物機體健康產生影響。反芻動物瘤胃內微生物數量豐富,種類繁多,主要菌門為擬桿菌門、厚壁菌門,主要菌屬為普雷沃氏菌屬[9]。當給反芻動物飼喂精料過高的日糧時,瘤胃pH下降,LPS濃度升高,引起瘤胃菌群之間的平衡發生紊亂,從而影響反芻動物纖維消化率以及正常生理性能[10]。盲腸微生物在反芻動物腸道健康方面以及消化吸收營養物質方面的重要作用不可忽視[11]。瘤胃酸中毒會導致反芻動物腸道發酵產生大量揮發性脂肪酸、pH下降,進而改變腸內容物中微生物群落組成結構,對動物的健康和生長性能造成一定的危害[12]。綜上,改變日糧中精料比例,可能會引起后腸微生物的群落發生改變。
本試驗通過瘤胃插管灌服玉米面的方法構建山羊瘤胃酸中毒模型,研究假設,瘤胃酸中毒產生的代謝產物是導致黏膜屏障破損、重要功能蛋白異常表達、瘤胃和盲腸菌群異常定/增殖的原因,以此探究瘤胃酸中毒對山羊消化道組織形態、功能蛋白、菌群的影響,進一步為瘤胃酸中毒對山羊造成的危害提供理論依據。
1 材料與方法
1.1 試驗動物與模型建立
選取8只12月齡左右的健康波爾山羊分為酸中毒組與對照組,每組4只,公母隨機,分欄預飼養1周。在預飼養期間,所有的山羊每日定時飼喂3次,飼喂原料以花生秧、玉米、麩皮、豆粕等飼糧為主,不限制飲水。試驗期間,保持圈舍衛生,確保通風和飼糧清潔,并做好山羊基本情況記錄。預飼養1周后,采用瘤胃插管灌注玉米面法構建立試驗動物模型,以45 g·kg-1體重的比例確定玉米面用量,用溫開水攪拌呈稀糊狀對山羊進行灌服。灌服前抽取瘤胃液,測定造模前瘤胃pH。灌服結束后,在不同時間節點(12、24、36、48 h)抽取瘤胃液檢測pH的變化。并時刻觀察山羊臨床特征,根據精神狀況、血氣指標、pH等綜合變化來判定是否造模成功。
1.2 樣本采集與處理
在整個試驗過程中,觀察記錄山羊基本情況:體溫、呼吸數、精神狀況、飲食狀況、糞便狀態等情況。試驗開始前和試驗結束時對全部試驗山羊進行靜脈采血,肝素抗凝,盡快送往實驗室使用愛德士VetStat電解質和血氣分析儀進行血氣分析檢測(pH、CO2分壓、HCO3-、總CO2、剩余堿、緩沖堿、Na+、K+、Cl-)。采集山羊造模前和造模后每12 h的新鮮糞便(直腸檢查獲取)、尿液(導尿管獲取)、瘤胃液(胃管導出)并用精密pH儀進行pH的檢測。試驗結束后,將酸中毒組與對照組各4只山羊放血致死后,解剖腹腔,取出瘤胃、小腸和盲腸等組織。用生理鹽水(0.9% NaCl)沖洗后,分裝于5 mL的凍存管和含4%多聚甲醛的離心管中。用于后期的蛋白質印跡分析法(Western blot)、實時熒光定量PCR(RT-qPCR)分析以及組織切片的制作。將采集的瘤胃液(四層紗布過濾后)分裝于15 mL的凍存管內,無菌法截斷盲腸,將盲腸內容物分裝于2個無菌凍存管內,用于胃腸道菌群的測定。
1.3 組織切片的制作
將收集的瘤胃和小腸組織進行依次固定、漂洗、脫水、透明后包埋于石蠟中。每個蠟塊不連續切5塊厚6 μm的組織,進行HE染色,最后封片。在顯微鏡下鏡檢,對胃腸道組織形態進行觀察。
1.4 RT-qPCR和Western blot檢測瘤胃及十二指腸MCT1和SLC5A8的mRNA及蛋白質的相對表達量
RNA快速提取試劑盒(山東思科捷生物技術有限公司)提取瘤胃與小腸組織的總RNA,使用反轉錄試劑盒合成cDNA。引物序列如表1所示,所有引物由欣樂生物技術(安徽)有限公司合成。使用RT-qPCR儀(PIKOREAL96 Thermo Scientific)對目的基因及內參基因進行定量。反應程序如下:95℃ 30 s預變性;95℃ 5 s,60℃ 34 s,重復40個循環。使用20 μL反應體系(2 μL cDNA、10 μL qPCR mix、1 μL primer F、1 μL primer R、6 μL ddH2O),所有樣品設3個重復,數據分析結果采用2-ΔΔCt方法。
稱取0.1 g組織,按比例加入配好的總蛋白提取液,勻漿后4℃孵育20min,離心取上清使用BCA檢測盒(山東思科捷生物技術有限公司)測算組織樣品蛋白濃度。Western blot試驗過程參考文獻[13]。在膜上滴入按1∶1配好的ECL化學發光液(武漢塞維爾生物有限公司),使用凝膠成像系統(美國伯樂 BIO-RAD 有限公司)自動曝光。
1.5 胃腸道內容物高通量測序
胃腸道內容物的總DNA提取和純化參考Li等[9]描述的方法進行。采用Nanodrop對DNA進行定量,并通過1.2%瓊脂糖凝膠電泳檢測DNA提取質量。選擇16S rRNA 基因的V4區作為擴增和測序的目的片段,引物序列為:515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和806R (5′-GGACTACVSGGGTATCTAAT-3′),然后對目的基因片段進行擴增。使用熒光試劑為 Quant-iT PicoGreen dsDNA Assay Kit,將PCR擴增回收產物進行熒光定量,采用Illumina平臺進行測序。按照QIIME2 dada2或Vsearch分析流程進行序列去噪或OTU聚類。對各組在不同物種分類學水平的具體組成進行展示,了解整體概況。根據ASV/OTU在不同樣本中的分布,評估每個樣本的Alpha多樣性水平,并通過稀疏曲線反映測序深度是否合適。在物種分類學組成層面,通過各種非監督、監督的排序、聚類和建模手段,結合相應統計學檢驗方法,進一步衡量不同組間的物種豐度組成差異。
1.6 數據分析及繪圖
本試驗所有數據采用Excel進行整理,數據均以“平均值±標準差”的形式表示。采用SPSS20.0對數據進行獨立性T檢驗,上標*表示差異顯著(Plt;0.05),上標**表示差異極顯著(Plt;0.01)。運用Image j軟件對Western blot結果進行灰度值分析,文中柱狀圖繪制均采用Graphpad Prism7數據軟件進處理。
2 結 果
2.1 造模成功的判定
在試驗造模前后,采集山羊新鮮的瘤胃液、尿液、糞便并用精密pH試紙分別進行pH的檢測記錄。結果如圖1所示,山羊造模前的瘤胃液、尿液、糞便的pH在7~8之間,呈弱堿性。造模后,隨著時間的變化山羊瘤胃液、糞便、尿液pH出現急劇降低。在造模后12~24 h內山羊瘤胃液、尿液pH均在5.0~5.8之間,呈弱酸性。與造模后12 h內相比,在造模后36~48 h之間山羊瘤胃液、尿液pH隨著造模時間的延長出現上升,但均低于造模前。
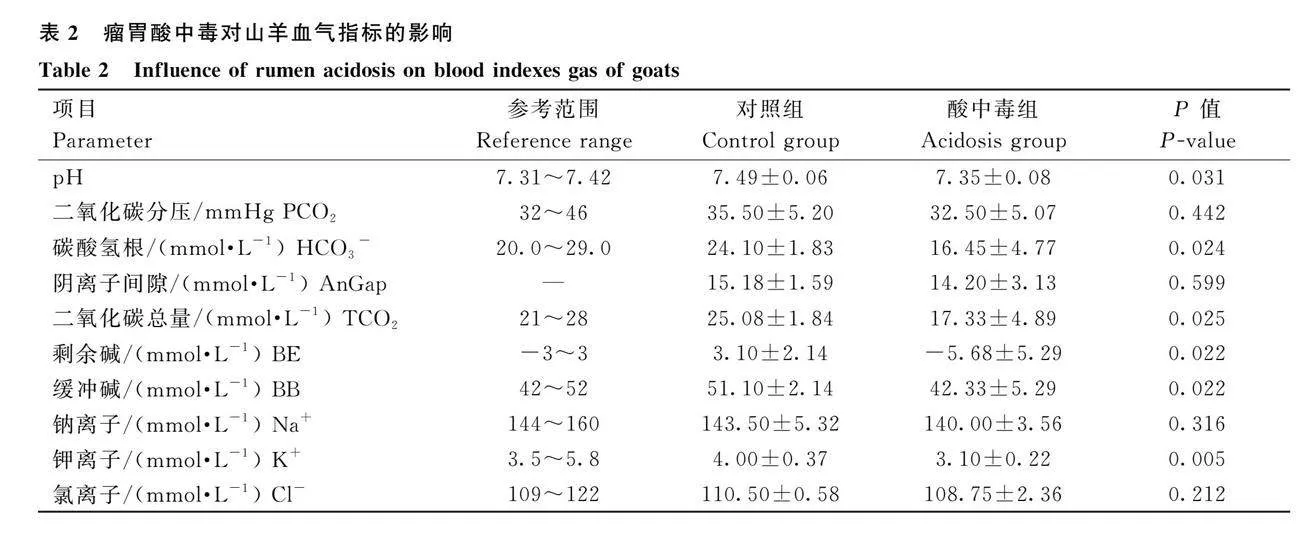
如表2所示,采用動物血氣分析儀測定山羊造模前后血液血氣指標。與對照組相比,酸中毒組山羊血液中K+極顯著降低(Plt;0.01),pH、HCO3-、TCO2、BE、BB均顯著降低(Plt;0.05)。表明以45g·kg-1的玉米面誘導山羊瘤胃酸中毒模型成功。
2.2 瘤胃酸中毒對消化道形態結構的影響
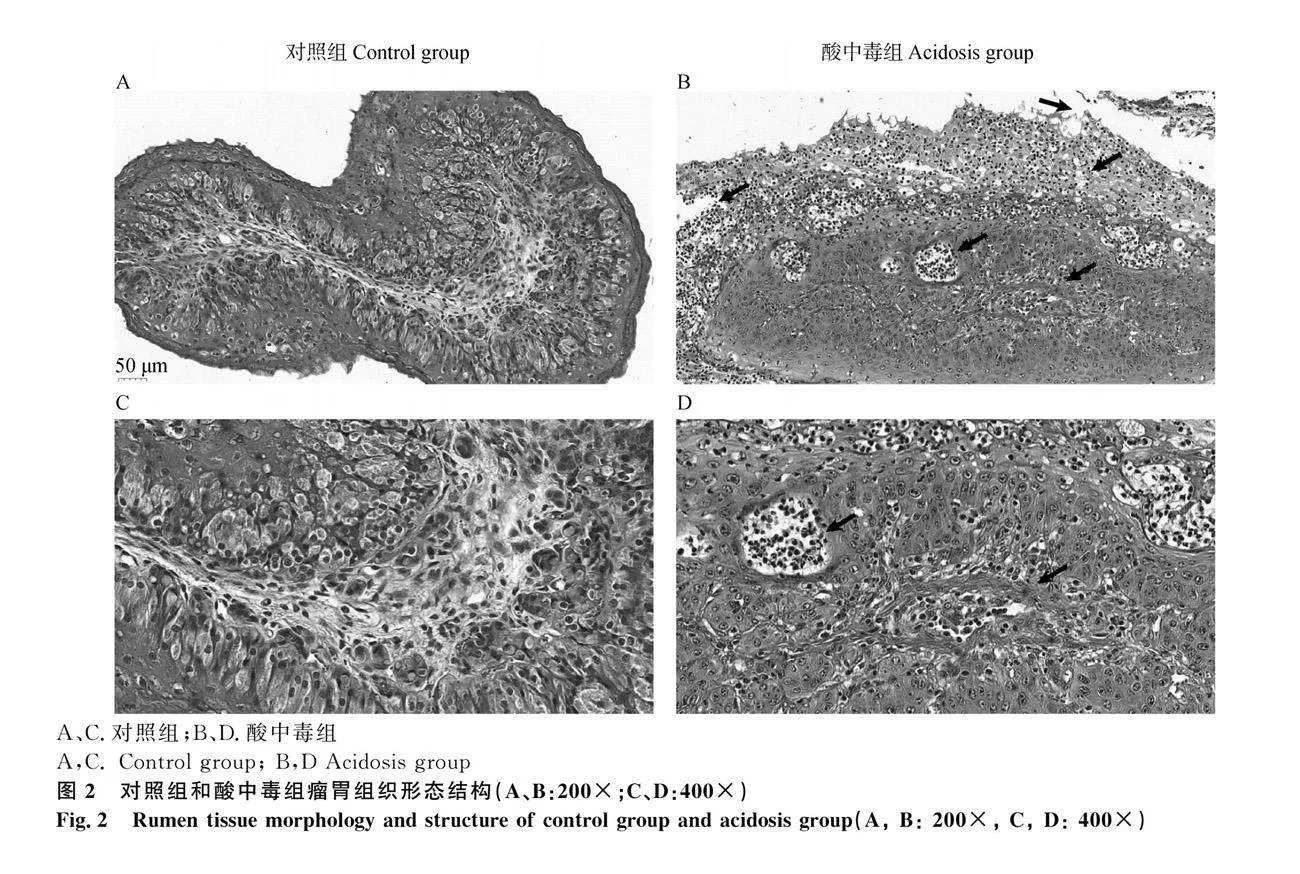
如圖2所示,在光學顯微鏡下,對照組A、C的瘤胃上皮組織形態結構完整,細胞排列緊密、毛細血管無明顯擴張。與對照組相比,如圖2中黑色箭頭指出的,酸中毒組B、D的瘤胃上皮組織形態層次結構完整性被破壞,角質層細胞出現糜爛壞死、脫落、瘤胃部分乳頭出現缺損、毛細血管擴張充血,炎癥細胞浸潤、細胞間隙增大。
如圖3所示,A、C、E分別為十二指腸、空腸、回腸的對照組,B、D、F依次為十二指腸、空腸、回腸的酸中毒組。通過光學顯微鏡對小腸上皮形態組織進行觀察,對照組腸絨毛排列整齊,腸組織形態結構完整,無脫落破損現象。與對照組相比,如圖3中黑色箭頭指出的,酸中毒組腸組織形態完整性被破壞,出現明顯缺損,且腸絨毛排列不齊、出現明顯破損、脫落現象。
2.3 酸中毒對瘤胃和十二指腸MCT1和SLC5A8 mRNA與蛋白相對表達量影響
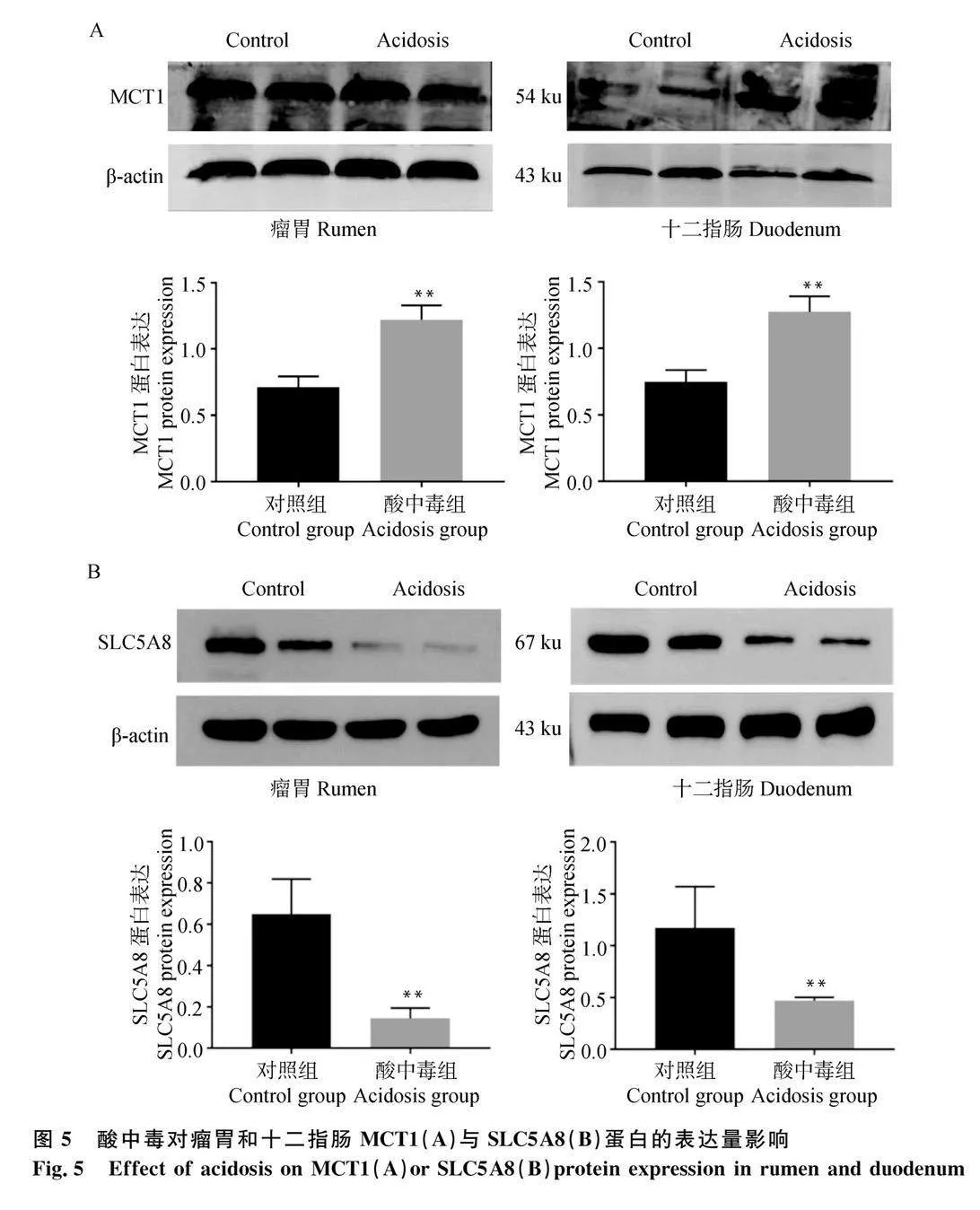
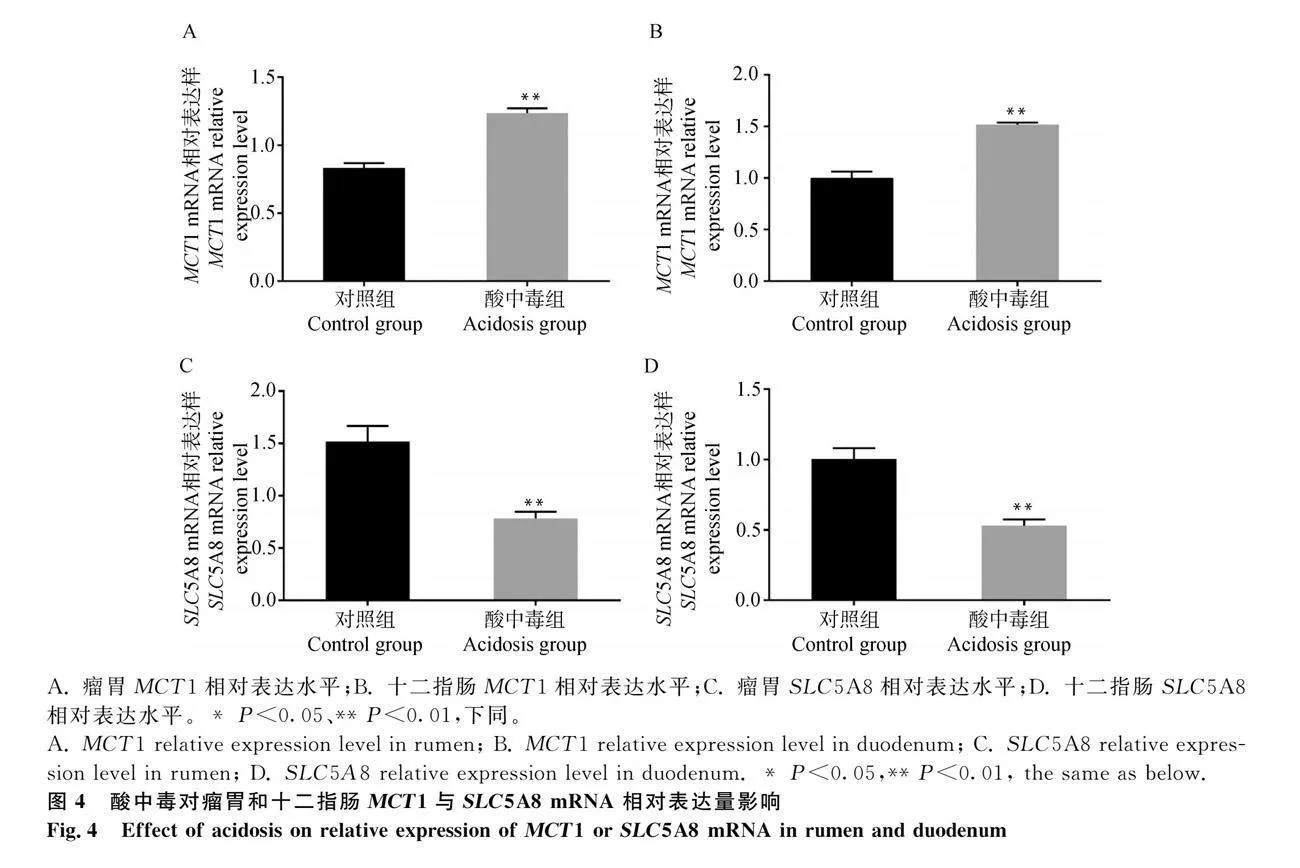
試驗通過采用RT-qPCR法,檢測MCT1與SLC5A8在對照組與酸中毒組山羊瘤胃和十二指腸mRNA的表達。結果如圖4A和4B所示,與對照組相比,酸中毒組瘤胃和十二指腸中MCT1 mRNA相對表達量極顯著升高(Plt;0.01)。如圖4C和D所示,與對照組相比,瘤胃和十二指腸中SLC5A8 mRNA相對表達量極顯著降低(Plt;0.01)。
試驗采用Western blot試驗法檢測MCT1與SLC5A8在對照組和酸中毒組瘤胃和十二指腸中蛋白的表達。結果如圖5A所示,與對照組相比,酸中毒組瘤胃和十二指腸中的MCT1蛋白表達量均極顯著升高(Plt;0.01)。如圖5B所示,與對照組相比,酸中毒瘤胃和十二指腸中SLC5A8的蛋白表達量極顯著降低(Plt;0.01)。
2.4 瘤胃酸中毒對瘤胃和盲腸菌群的影響
2.4.1 瘤胃和盲腸菌群多樣性的分析
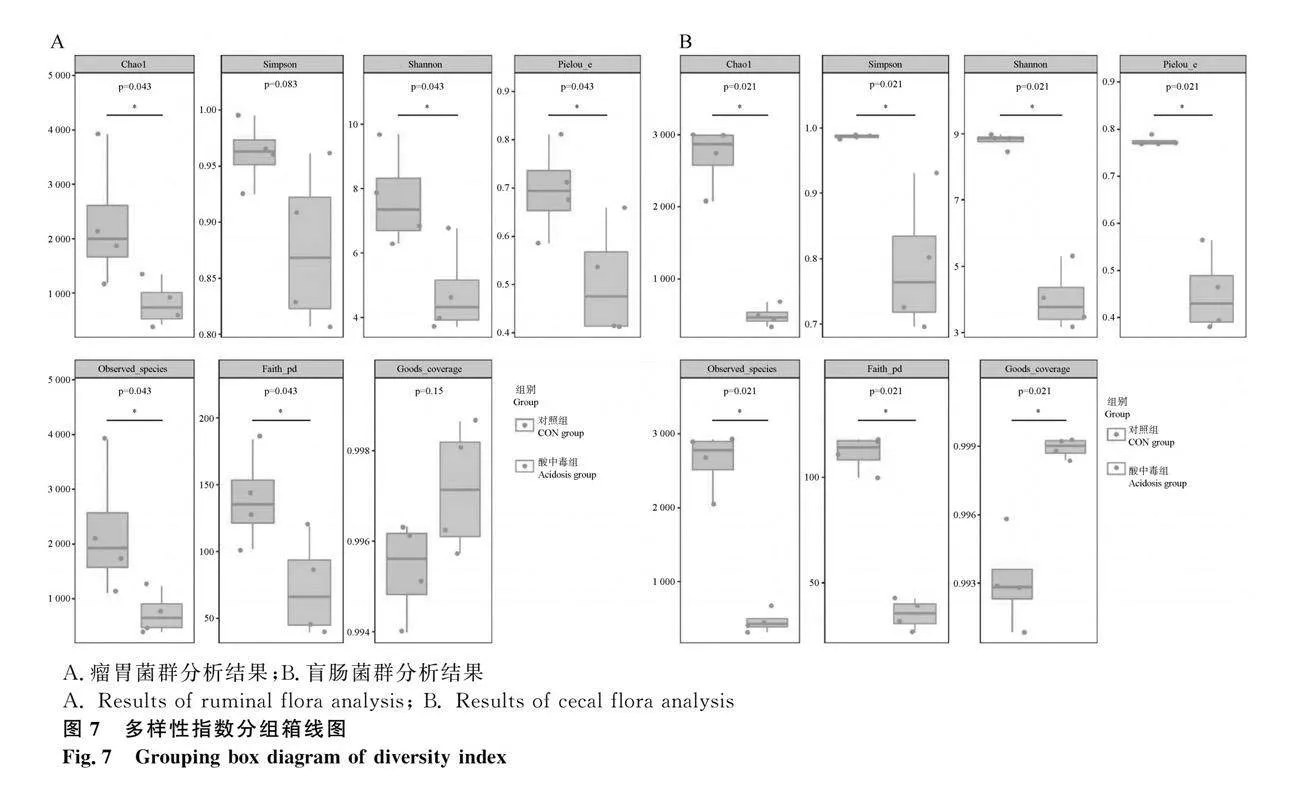
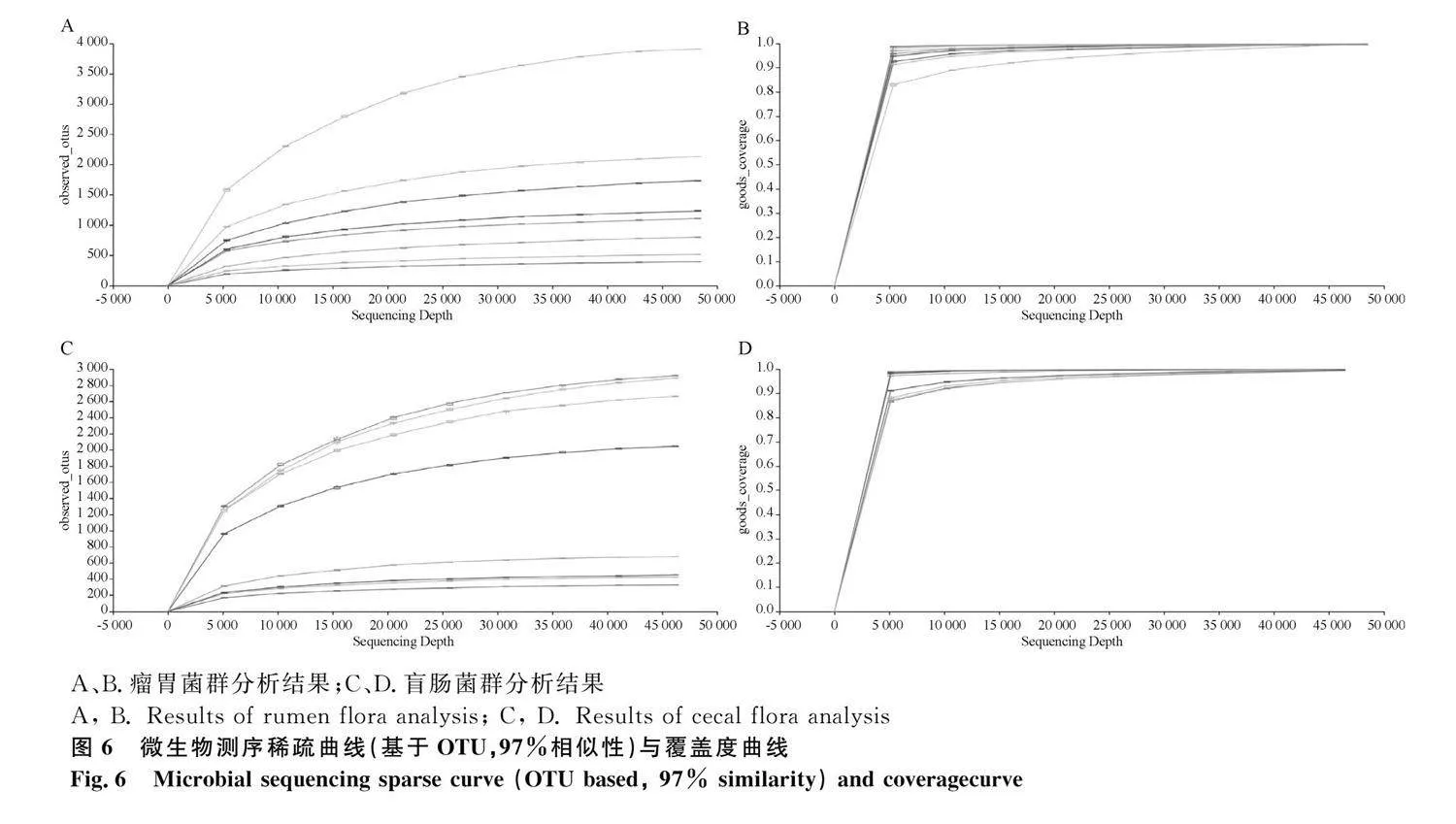
對照組與酸中毒組各樣品稀釋曲線和覆蓋度曲線由圖6所示,樣本稀釋曲線隨著試驗測序深度的增加,各曲線趨于平坦。表明取樣合理,能夠大部分覆蓋山羊瘤胃和盲腸內容物菌群的變化。結合所有樣本的覆蓋度曲線圖,表明本試驗對于樣本的測序量及測序深度合理。
2.4.2 goods_coverage指數評估測序
測序結果代表了各樣本中微生物的覆蓋率,Faith_pd指數是對細菌菌群豐富度指數的評估,Pielou_e指數是評估物種豐富度有關的均勻度指數。由圖7所示,與對照組相比,酸中毒組Observed species、Chao1、Shannon、Pielou_e、Faith_pd指數差異均顯著降低(Plt;0.05)。以上結果表明,酸中毒改變了盲腸內容物中的細菌多樣性和豐富度。
2.4.3 酸中毒對瘤胃和盲腸菌群門水平與屬水平的影響
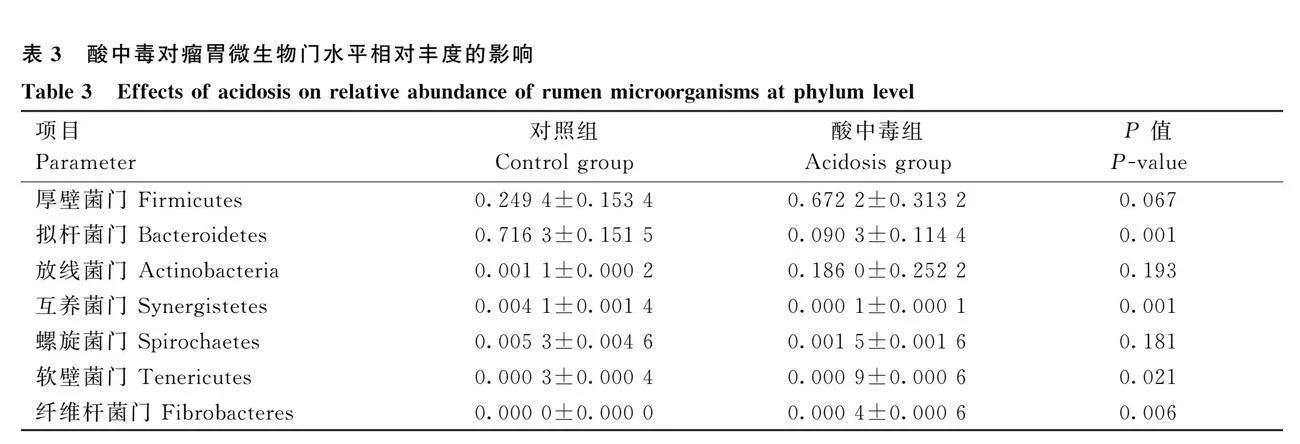
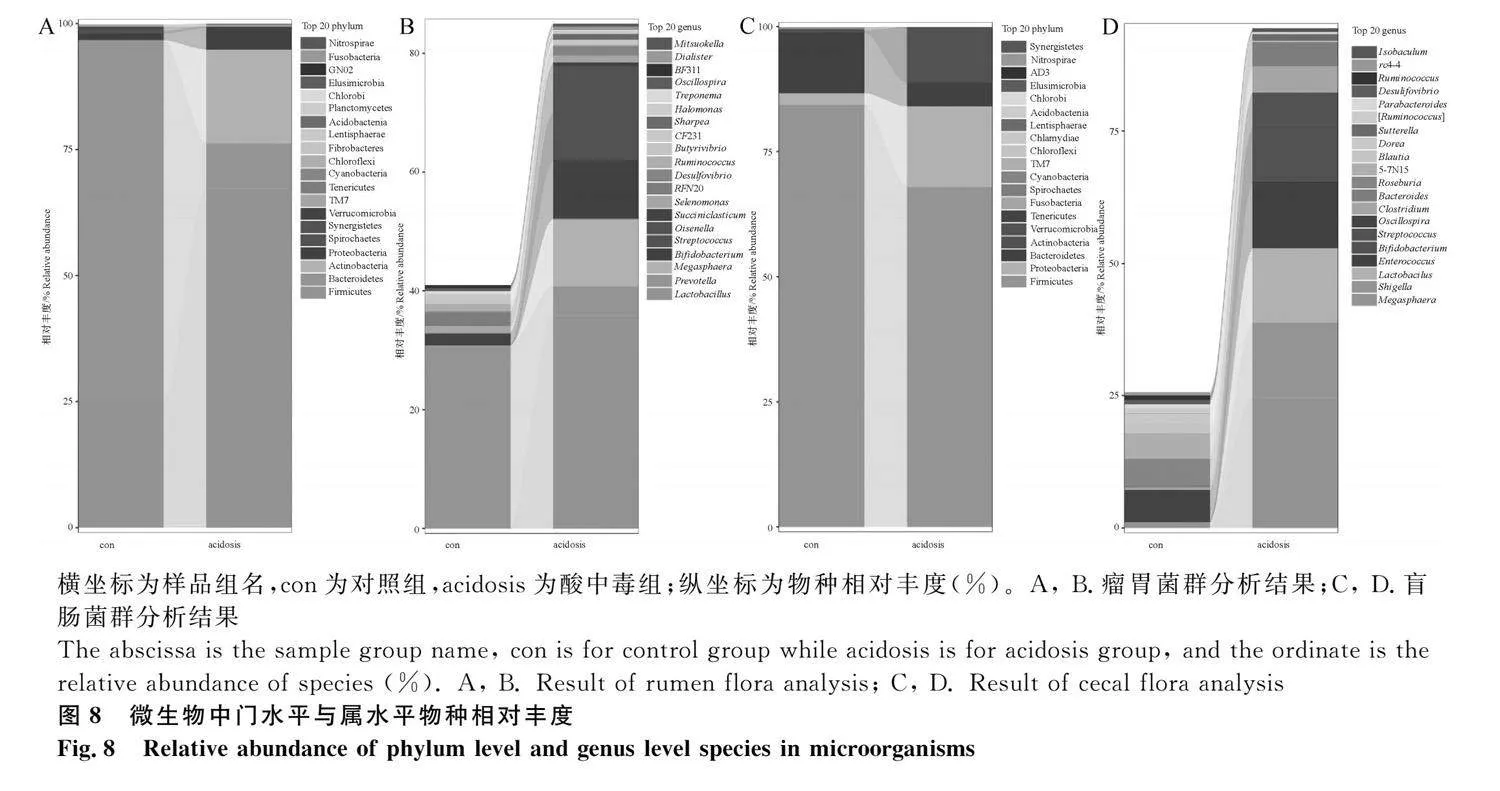
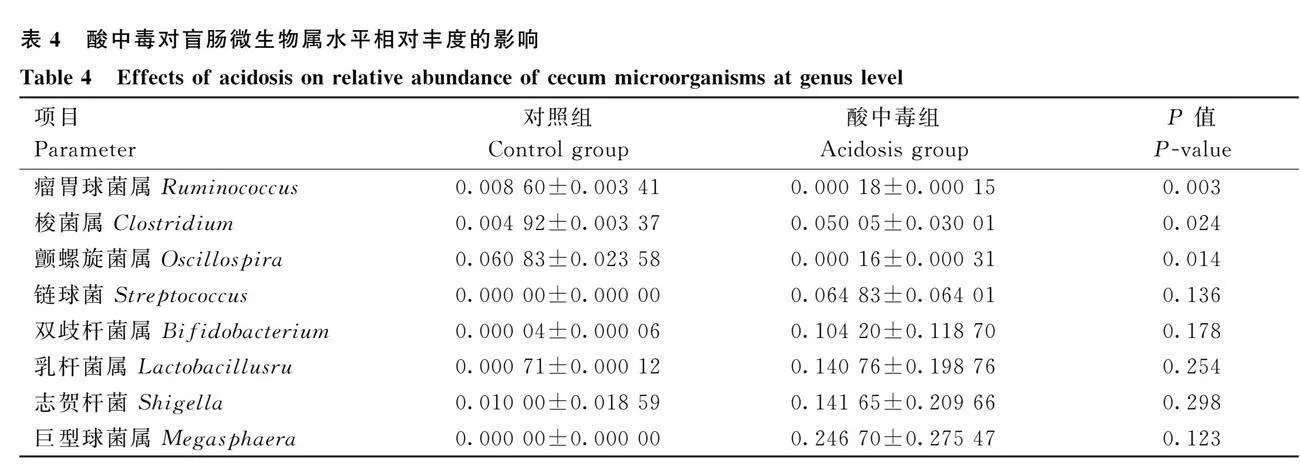
反芻動物胃腸道主要優勢菌門為厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)和變形菌門(Proteobacteria)。如圖8A和表3所示,顯示了瘤胃內容物樣品在門水平上各菌門的相對豐富度變化。在瘤胃微生物門水平上,與對照組相比,酸中毒組極顯著降低了擬桿菌門、互養菌門(Synergistetes)的相對豐富度(Plt;0.01)。極顯著升高了纖維桿菌門(Fibrobacteres)的相對豐富度(Plt;0.01),顯著升高了軟壁菌門(Tenericutes)的相對豐富度(Plt;0.05)。如圖8B所示,瘤胃微生物中屬水平相對豐度的變化情況。根據相對豐度不同,主要優勢菌屬為普雷沃氏菌屬(Prevotella)、乳酸菌屬(Lactobacillus)、鏈球菌屬(streptococcus)以及雙歧桿菌屬(Bifidobacteria)。與對照組相比,酸中毒組極顯著降低了瘤胃球菌屬(Ruminococcus)的相對豐富度(Plt;0.01),顯著降低了普雷沃氏菌屬相對豐富度(Plt;0.05)。如圖8C所示,顯示了盲腸內容物樣品在門水平上各菌門的相對豐富度。與對照組相比,酸中毒組產生了較高的變形桿菌門,降低了厚壁菌門、擬桿菌門的相對豐度。如圖8D和表4所示,盲腸微生物中屬水平相對豐度的變化情況。與對照組相比,酸中毒組極顯著降低了瘤球菌屬的相對豐富度(Plt;0.01)。顯著降低了顫螺旋菌屬(Oscillospira)的相對豐富度(Plt;0.05)。顯著升高了梭菌屬(Clostridium)相對豐富度(Plt;0.05)。
3 討 論
近年來,國家高度重視“三農”問題,各級政府對農業尤其是畜牧業的重視力度越來越大。在鄉村振興戰略中牛羊產業迎來高質量發展,養殖規模也逐漸朝向標準化、規模化、高效化模式發展。但是以瘤胃酸中毒為代表的營養代謝性疾病的發生比例逐年升高,嚴重影響了養殖業的經濟效益。因此,需要研究出更多對策來應對反芻動物瘤胃酸中毒,為提高生產需求提供實際的指導意義。
多種因素都能夠影響到瘤胃組織結構,其中日糧成分則是主要的影響因素之一。以往研究報道,長時間飼喂高精日糧會降低瘤胃pH,導致瘤胃乳頭脫落、角質化不全、細胞間隙變大等異常現象[4,14]。本研究發現,酸中毒組山羊的瘤胃上皮組織形態層次結構完整性被破壞,角質層脫落,瘤胃部分乳頭出現缺損、毛細血管擴張充血等,這與上述試驗結果一致。這一結果提示,瘤胃酸中毒破環了瘤胃組織形態使其組織受損,對反芻動物瘤胃組織形態造成了危害。
小腸調控著腸道消化吸收,是機體內主要的營養物質吸收、轉運的部位。因此,保持腸道結構的完整性對維持動物機體消化系統以及健康十分重要。前人研究報道,飼喂高精飼料導致的瘤胃酸中毒增加了微生物和LPS通過瘤胃上皮進入血液循環,觸發炎癥反應,導致奶山羊腸上皮細胞間隙明顯增寬造成腸組織損傷[15]。本研究中,使用玉米面造模誘導山羊發生瘤胃酸中毒后,酸中毒組山羊小腸組織形態結構發生明顯變化。其十二指腸、空腸、回腸腸絨毛均出現脫落、排列不齊等現象。這與薛春旭[16]試驗結果基本一致。上述試驗結果表明,酸中毒可造成小腸的腸道組織形態受損。
可溶性碳水化物在瘤胃不斷發酵累積產生大量SCFA在瘤胃內蓄積引發瘤胃酸中毒。位于瘤胃上皮細胞基底外側膜的MCT1,介導轉運細胞內SCFA和其代謝產物轉運等[17-18]。Yan等[19]與劉軍花等[20]研究均發現,給反芻動物長期飼喂高比例精飼料或提高日糧中精料比例均可顯著提高瘤胃上皮細胞中MCT1 mRNA以及蛋白表達量。本研究發現,造模后酸中毒組上調了山羊瘤胃和十二指腸組織MCT1 mRNA以及蛋白表達量。結果可能表明,當瘤胃快速發酵產生大量SCFA時,瘤胃為了穩定pH和適應這一變化加速SCFA從瘤胃快速轉出,進而提升了MCT1的表達,但具體調控機制還需進一步的探究[21]。SLC5A8參與多種代謝物轉運,如SCFA、煙酸和乳酸等。在本試驗中,造模后酸中毒組SLC5A8在瘤胃和十二指腸的表達量均降低。這可能是因為山羊酸中毒后,瘤胃內蓄積大量的SCFA,使機體內環境發生改變,導致pH降低影響其表達量。
瘤胃酸中毒打破動物機體內菌群之間的平衡,引起瘤胃菌群結構發生改變。本試驗結果表明,酸中毒組山羊瘤胃細菌多樣性(Shannon)指數顯著低于對照組。這表明瘤胃酸中毒降低了山羊瘤胃內菌群組成的多樣性,對瘤胃菌群組成影響較大。與此同時,在瘤胃菌群的門水平中,厚壁菌門、擬桿菌門、變形菌門均為山羊瘤胃菌群中的優勢菌門,這與先前研究報道的一致[22]。Khafipour等[23]研究使用谷物類飼糧誘導奶牛發生SARA后,擬桿菌門在反芻動物瘤胃中的相對豐度降低,而厚壁菌門在反芻動物瘤胃中的相對豐度增加。本研究中,相比于對照組,酸中毒組擬桿菌門數量顯著降低,而厚壁菌門在山羊瘤胃內容物中的相對豐度升高,但差異不顯著。擬桿菌門中的雷沃氏菌屬為豐富革蘭陰性菌屬,當飼喂高精日糧反芻動物后擬桿菌門數量和相對豐度降低。這可能是由于發生酸中毒后瘤胃處于酸性環境狀態,而革蘭陰性菌不耐酸,因此較低的pH導致與革蘭陰性菌有關細菌發生破裂或死亡[22]。放線菌門、纖維桿菌門與纖維降解有關,其主要作用能夠促進瘤胃對纖維物質的降解。本研究中,酸中毒組顯著提高了山羊瘤胃菌群中放線菌門的相對豐度,降低了纖維桿菌門的相對豐度。本試驗還觀察到,山羊瘤胃酸中毒后降低了互養菌門的相對豐度,顯著提升了軟壁菌門相對豐度,但具體作用,還需進一步探究。在屬水平上,普雷沃氏菌屬為擬桿菌門中相對豐度較高的菌屬,可產生大量的復合酶,參與多種代謝活動,其作用是促進非纖維性多糖和蛋白質的降解。而瘤球菌屬和密螺旋體屬則在降解纖維和半纖維過程中起重要的作用[24]。Mao等[22]試驗結果表明,SARA組中普雷沃氏菌屬、密螺旋體的豐度均低于對照組,而雙歧桿菌屬的豐富度顯著增加。而在本試驗中,通過玉米面灌服法誘導山羊發生酸中毒后,降低了瘤胃微生物中普雷沃氏菌屬、密螺旋體屬的相對豐富度,提高了雙歧桿菌屬的相對豐富度,試驗結果與以上研究一致。丁酸弧菌屬和乳酸菌屬是瘤胃中主要的乳酸產生菌屬。本試驗中,在發生酸中毒后,山羊瘤胃菌群微生物中,丁酸弧菌的相對豐度出現下降,而乳酸桿菌的相對豐度呈升高趨勢。其結果可能與酸中毒后瘤胃pH降低有關,提示瘤胃處于酸性環境下,乳酸桿菌亦能大量繁殖生存。
本試驗結果表明,造模后酸中毒組盲腸微生物中Simpson、Chao1、Shannon指數均顯著低于對照組,這與Liu等[25]的研究結果一致。表明酸中毒對盲腸微生物結構產生了較大的影響。已有研究報道,在山羊盲腸菌群門水平中,厚壁菌門與擬桿菌門占總菌門的比例較大,為優勢菌門[26]。本試驗結果表明,對照組與酸中毒組山羊盲腸微生物中優勢菌門依次為厚壁菌門、擬桿菌門和變形菌門,這與上述報道基本一致;并且酸中毒組降低了盲腸微生物中瘤球菌屬數量、升高乳桿菌屬的相對豐度。乳桿菌屬為乳酸主要產生者,顫螺菌屬、瘤球菌屬其作用是參與降解纖維,以供宿主基本的代謝[27]。雙歧桿菌可利用淀粉、葡萄糖等作為底物產生乳酸和乙酸。王悅[28]研究報道,使用谷物類飼糧飼喂湖羊時,隨著谷物類飼料比例的提高,結腸微生物中雙歧桿菌的數量也呈升高趨勢。牛鏈球菌具有很強的發酵淀粉產生乳酸的能力,一旦給反芻動物飼喂高精飼糧時易引起瘤胃pH的降低,發生SARA,致使胃腸道牛鏈球菌大量增殖[29]。在本試驗中,酸中毒組提高了山羊盲腸菌群中雙歧菌屬、鏈球菌屬的相對豐度。這可能與山羊發生酸中毒后改變了腸道內pH有關。在低pH情況下,一些對低pH敏感的細菌數量發生下降,反之適應低pH的細菌數量增加。有報道指出,梭菌屬作為腸道致病菌,可能會誘導腸道發生炎癥[30]。而在本試驗中,酸中毒確實使山羊盲腸內容物梭菌屬的比例顯著增加,這可能進一步加劇對腸道的損傷。
基于當前研究的發現,考慮到反芻動物獨特的消化和吸收機制,增加精料在飼料中的比例可能會帶來雙刃劍的效果:一方面,這將有助于加快經濟效益產出;另一方面,它可能會破壞消化系統的平衡。因此,尋找一個能夠最大化利益的平衡點,對于當代的科研人員而言,仍然是一個重要的研究目標。此外,開發出一種優化的飼養模式或者進行優良育種至關重要,同時,選擇適當的益生菌以促進其在胃腸道中的定殖,保持腸道微生物群的平衡,對于推動牛羊產業的高質量增長也是必不可少的。
4 結 論
山羊在發生瘤胃酸中毒后,瘤胃和小腸的組織形態、蛋白功能、菌群結構與組成產生了較大變化,具體表現為:酸中毒后瘤胃和小腸組織形態出現損傷,其結構完整性被破壞;酸中毒后瘤胃內環境蓄積大量SCFA,從而對具有轉運吸收SCFA及其代謝產物乳酸、乙酸等相關蛋白的表達造成了影響,上調了瘤胃和十二指腸中MCT1的表達,降低了SLC5A8的表達;瘤胃酸中毒改變了瘤胃微生物菌群的組成結構,使瘤胃微生物多樣性發生顯著下降,同時,降低了瘤胃微生物中與纖維降解菌有關細菌的相對豐度,升高了與發酵碳水化合物有關菌群的相對豐富度;使盲腸菌群多樣性和豐富性發生下降,降低了與纖維降解菌有關菌群相對豐富度,升高了與乳酸產生菌相關菌群的相對豐度。
參考文獻(References):
[1] RIVERA-CHACON R,CASTILLO-LOPEZ E,RICCI S,et al.Supplementing a phytogenic feed additive modulates the risk of subacute rumen acidosis,rumen fermentation and systemic inflammation in cattle fed acidogenic diets[J].Animals,2022,12(9):1201.
[2] 張 璐,陳愛華,吳清明.腸道菌群與代謝相關脂肪性肝病[J].臨床內科雜志,2023,40(1):6-9.
ZHANG L,CHEN A H,WU Q M.Gut flora and metabolic associated fatty liver disease[J].Journal of Clinical Internal Medicine,2023,40(1):6-9.(in Chinese)
[3] STEELE M A,CROOM J,KAHLER M,et al.Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J].Am J Physiol Regul Integr Comp Physiol,2011,300(6):R1515-R1523.
[4] 程 萌.亞急性瘤胃酸中毒對奶山羊瘤胃上皮通透性及細胞連接蛋白表達的影響[D].呼和浩特:內蒙古農業大學,2016.
CHENG M.Effect of subacute ruminal acidosis on rumen epithelium permeability and intercellula junction protein expression in dairy goats[D].Hohhot:Inner Mongolia Agricultural University,2016.(in Chinese)
[5] 魏子維,鄧 銘,孫寶麗,等.高精料飼糧對反芻動物胃腸道健康的影響及調控措施[J].動物營養學報,2021,33(3):1277-1285.
WEI Z W,DENG M,SUN B L,et al.Effects of high concentrate diet on gastrointestinal Health of ruminants and its regulation measures[J].Chinese Journal of Animal Nutrition,2021,33(3):1277-1285.(in Chinese)
[6] KOH A,DE VADDER F,KOVATCHEVA-DATCHARY P,et al.From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites[J].Cell,2016,165(6):1332-1345.
[7] 王 倩.灰葡萄孢單羧酸轉運蛋白基因BcMCT1的功能解析[D].杭州:浙江工業大學,2013.
WANG Q.Cloning and functional analisis of monocarboxylate transporter gene (BcMCT1) in Botryils cinerea[D].Hangzhou:Zhejiang University of Technology,2013.(in Chinese)
[8] COADY M J,WALLENDORFF B,BOURGEOIS F,et al.Establishing a definitive stoichiometry for the Na+/monocarboxylate cotransporter SMCT1[J].Biophys J,2007,93(7):2325-2331.
[9] LI L P,PENG K L,XUE M Y,et al.An age effect of rumen microbiome in dairy buffaloes revealed by metagenomics[J].Microorganisms,2022,10(8):1491.
[10] WANG K J,ZHENG M L,REN A,et al.Effects of high rice diet on growth performance,nutrients apparent digestibility,nitrogen metabolism,blood parameters and rumen digestibility,nitrogen metabolism,blood parameters and rumen[J].Kafkas niversitesi Veteriner Fakültesi Dergisi,2019,25(6):749-755.
[11] ZHANG Y,CHOI S H,NOGOY K M,et al.Review:the development of the gastrointestinal tract microbiota and intervention in neonatal ruminants[J].Animal,2021,15(8):100316.
[12] FANIYI T O,ADEGBEYE M J,ELGHANDOUR M M M Y,et al.Role of diverse fermentative factors towards microbial community shift in ruminants[J].J Appl Microbiol,2019,127(1):2-11.
[13] LI Y,DING H Y,LIU L H,et al.Non-esterified fatty acid induce dairy cow hepatocytes apoptosis via the mitochondria-mediated ROS-JNK/ERK signaling pathway[J].Front Cell Dev Biol,2020,8:245.
[14] MA J,SHAH A M,WANG Z S,et al.Potential protective effects of thiamine supplementation on the ruminal epithelium damage during subacute ruminal acidosis[J].Anim Sci J,2021,92(1):e13579.
[15] HU H L,YANG S Q,CHENG M,et al.Long-term effect of subacute ruminal acidosis on the morphology and function of rumen epithelial barrier in lactating goats[J].J Integr Agric,2022,21(11):3302-3313.
[16] 薛春旭.高精料日糧對山羊小腸微生物發酵、微生物區系及上皮形態結構的影響[D].南京:南京農業大學,2017.
XUE C X.The impact of high concentrate diet on small intestinal fermentation,microbial community and epithelial morphology of goats[D].Nanjing:Nanjing Agricultural University,2017.(in Chinese)
[17] DALILE B,VAN OUDENHOVE L,VERVLIET B,et al.The role of short-chain fatty acids in microbiota-gut-brain communication[J].Nat Rev Gastroenterol Hepatol,2019,16(8):461-478.
[18] BIONAZ M,VARGAS-BELLO-PéREZ E,BUSATO S.Advances in fatty acids nutrition in dairy cows:from gut to cells and effects on performance[J].J Anim Sci Biotechnol,2020,11(1):110.
[19] YAN L,ZHANG B,SHEN Z M.Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats[J].J Dairy Sci,2014,97(9):5668-5675.
[20] 劉軍花,朱偉云,毛勝勇.高谷物日糧促進山羊瘤胃上皮單羧酸轉運蛋白1及鈉鉀ATP酶mRNA的表達[J].草業學報,2017,26(2):95-101.
LIU J H,ZHU W Y,MAO S Y.A high-grain diet promotes expression of MCT1 and Na+/K+-ATPase mRNAs in the ruminal epithelium of goats[J].Acta Prataculturae Sinica,2017,26(2):95-101.(in Chinese)
[21] 蘇效雙,張春剛,劉光磊,等.單羧酸轉運蛋白:在揮發性脂肪酸轉運中的作用及影響基因表達的因素[J].動物營養學報,2016,28(9):2709-2714.
SU X S,ZHANG C G,LIU G L,et al.Monocarboxylate transporters:function in volatile fatty acid transport and gene expression influencing factors[J].Chinese Journal of Animal Nutrition,2016,28(9):2709-2714.(in Chinese)
[22] MAO S Y,ZHANG R Y,WANG D S,et al.Impact of subacute ruminal acidosis (SARA) adaptation on rumen microbiota in dairy cattle using pyrosequencing[J].Anaerobe,2013,24:12-19.
[23] KHAFIPOUR E,LI S C,PLAIZIER J C,et al.Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J].Appl Environ Microbiol,2009,75(22):7115-7124.
[24] KIM Y H,NAGATA R,OHKUBO A,et al.Changes in ruminal and reticular pH and bacterial communities in Holstein cattle fed a high-grain diet[J].BMC Vet Res,2018,14(1):310.
[25] LIU J H,XU T T,ZHU W Y,et al.High-grain feeding alters caecal bacterial microbiota composition and fermentation and results in caecal mucosal injury in goats[J].Br J Nutr,2014,112(3):416-427.
[26] 金 磊,王立志,王之盛,等.基于高通量測序技術對山羊盲腸細菌多樣性的分析[J].微生物學通報,2019,46(6):1423-1433.
JIN L,WANG L Z,WANG Z S,et al.Analysis of cecum bacterial diversity of goat based on Illumina MiSeq sequencing[J].Microbiology China,2019,46(6):1423-1433.(in Chinese)
[27] TIGCHELAAR E F,BONDER M J,JANKIPERSADSING S A,et al.Gut microbiota composition associated with stool consistency[J].Gut,2016,65(3):540-542.
[28] 王 悅.湖羊結腸微生物區系及上皮形態和功能對高精料日糧的適應性應答研究[D].南京:南京農業大學,2018.
WANG Y.The adaptive response of the microbiota and epithelial morphology and function to high grain diets in the colon of Hu sheep[D].Nanjing:Nanjing Agricultural University,2018.(in Chinese)
[29] HOSSAIN M E.Sub-acute ruminal acidosis in dairy cows:its causes,consequences and preventive measures[J].Online J Anim Feed Res,2020,10(6):302-312.
[30] SCHIRMER M,GARNER A,VLAMAKIS H,et al.Microbial genes and pathways in inflammatory bowel disease[J].Nat Rev Microbiol,2019,17(8):497-511.
(編輯 范子娟)

