流產對母馬陰道和腸道菌群多樣性的影響及陰道細菌的分離鑒定

摘 要: 本試驗旨在研究流產對母馬陰道和腸道菌群結構的差異性,并對陰道致病菌進行分離鑒定,探討造成馬流產的陰道致病菌的生物學特性。分別采集流產母馬和健康母馬陰道分泌物和糞便樣品,流產母馬組10匹和健康組6匹,并對陰道和糞便樣本進行 16S rRNA V3~V4 區高通量測序,比較兩組之間陰道和腸道菌群差異,同時分離鑒定流產母馬的陰道細菌。結果顯示:與健康組相比,Alpha多樣性顯示,流產組陰道、腸道菌群豐富度及多樣性有增高趨勢。通過Binary jaccard及unweighted unifrac兩種距離矩陣分析可知兩組陰道、腸道菌群的相似性、分散性、豐度及進化關系均存在差異。在門水平上,與健康組相比,流產組陰道菌群中擬桿菌門和梭桿菌門豐度降低,而螺旋菌門和厚壁菌門豐度增加;流產組腸道菌群中厚壁菌門和擬桿菌門豐度降低,變形菌門和放線菌門豐度增加。LEfSe分析乳桿菌科、乳桿菌屬、腸桿菌目、腸桿菌科、鐮刀菌屬為流產組陰道菌群優勢菌種;放線菌屬、放線菌門、放線菌綱、棒狀桿菌科、棒狀桿菌屬、嗜肽菌屬、嗜肽菌科是流產組的腸道優勢菌種,這些細菌豐度的改變可能與疾病的發生發展以及預后相關。功能預測及相關性分析發現正常陰道細菌與健康相關微生物之間存在正相關。正常陰道微生物與流產相關病原菌呈負相關。流產母馬腸道中代謝相關通路與陰道中疾病的發生相關通路有較高的相關性;腸道中免疫疾病相關通路與陰道中免疫系統的變化也存在正相關,提示腸道中代謝功能的紊亂可能會引發陰道某些疾病的發生。從流產母馬陰道中分離并鑒定出4種主要致病菌,分別為沙門菌、馬鏈球菌獸疫亞種、克雷伯菌和大腸桿菌。母馬陰道及腸道菌群高度參與流產疾病的發生與免疫的過程,在妊娠時,菌群的代謝途徑可能起溝通腸道與陰道菌群和宿主免疫的橋梁作用,陰道菌群中厚壁菌門和放線菌門及腸道菌群中Arcanobacterium hippocoleae和Streptococcus infantarius與流產相關的變形菌門呈負相關。沙門菌可能是造成馬流產的主要致病菌,并且變形菌門、嗜胨菌屬、彎曲桿菌屬可能是發生流產的陰道菌群生物標志物。
關鍵詞: 流產;陰道菌群;高通量測序;功能預測;細菌分離鑒定
中圖分類號:S857.23;S852.61
文獻標志碼:A
文章編號:0366-6964(2024)10-4700-20
收稿日期:2024-02-27
基金項目:國家自然科學基金青年科學基金項目(32002322);伊犁州科技計劃項目成果轉化之鄉村振興(YXC2023A07);新疆重要馬病診防關鍵技術的集成創新與應用(ZYYD2023C03)
作者簡介:付 涵(1997-),男,河南洛陽人,碩士生,主要從事臨床獸醫學研究,E-mail: 2332300667@qq.com
*通信作者:買占海,主要從事臨床獸醫學研究,E-mail:mzh881231@126.com;況 玲,主要從事臨床獸醫學研究,E-mail:kuangling62@126.com
Effects of Abortion on the Diversity of Vaginal and Intestinal Flora in Mares and the
Isolation and Identification of Vaginal Bacteria
FU" Han1, LU" Chong1, MIAO" Ronghao1, LU" Yabin1, LI" Jianlong1, LIU" Jianhua1, GENG" Mingyang
2, GUO" Qingyong1, MAI Zhanhai1*, KUANG Ling1*
(1.College of Veterinary Medicine, Xinjiang Agricultural University, Urumqi 830052," China;
2.
Xinjiang Shanhai Herding Limited Liability Company, Ili 835303," China)
Abstract:" The aim of this experiment was to investigate the differences in the vaginal and intestinal flora structure of mares affected by abortion, and to isolate and identify vaginal pathogens and explore the biological characteristics of vaginal pathogens responsible for equine abortion. Vaginal secretion and faecal samples were collected from 10 mares in the aborted mare group and 6 mares in the healthy group. High-throughput sequencing of vaginal and faecal samples was performed in the V3-V4 region of the 16S rRNA to compare the differences in the vaginal and intestinal flora between the two groups, and to isolate and identify the vaginal bacteria in the aborted mares. Alpha diversity showed a trend of increased vaginal and intestinal flora richness and diversity in the aborted group compared with the healthy group. The similarity, dispersion, abundance and evolutionary relationship of the vaginal and intestinal flora of the two groups were found to be different by both Binary jaccard and unweighted unifrac distance matrix analyses. At the phylum level, compared with the healthy group, the vaginal flora of the abortion group showed a decrease in the abundance of Anaplasma and Clostridium phyla and an increase in the abundance of Helicobacter phyla and Thick-walled phyla, while the intestinal flora of the abortion group showed a decrease in the abundance of Thick-walled phyla and Anaplasma phyla, and an increase in the abundance of Aspergillus phyla and Actinobacterium phyla. LEfSe analysed Lactobacillaceae, Lactobacillus, Enterobacterales, Enterobacteriaceae, and Fusarium as the dominant vaginal flora species in the abortion group; and Actinomyces, Actinobacteria, Actinomycetia, Corynebacteriaceae, Corynebacterium, Peptoniphilus, and Peptinophilae were the dominant intestinal species in the abortion group, and the altered abundance of these bacteria may be correlated with the development of the disease, as well as with the prognosis.
Functional prediction and correlation analyses revealed a positive correlation between normal vaginal bacteria and health-related microorganisms. Normal vaginal microbes were negatively correlated with abortion-associated pathogens. Metabolic pathways in the gut of aborted mares were highly correlated with vaginal disease pathways, and immune disease pathways in the gut were positively correlated with changes in the vaginal immune system, suggesting that metabolic dysfunction in the gut may trigger the development of certain vaginal diseases. Four main pathogenic bacteria were isolated and identified from the vagina of aborted mares: Salmonella, Streptococcus equi subspecies zoonoticus, Klebsiella and Escherichia coli. Vaginal and intestinal flora of mares are highly involved in the process of abortive disease and immunity, and the metabolic pathways of the flora may play a role in bridging the intestinal and vaginal flora and host immunity at the time of gestation, with the phyla Thick-walled and Actinobacteria in the vaginal flora and the phyla Arcanobacterium hippocoleae and Streptococcus infantarius were negatively correlated with the abortion-associated Aspergillus phylum. Salmonella may be the main causative agent of equine abortion and that Aspergillus phylum, Peptostreptococcus spp. and Campylobacter spp. may be the vaginal flora biomarkers for the occurrence of abortion.
Key words: abortion; vaginal flora; high-throughput sequencing; functional prediction; bacterial isolation and identification
*Corresponding authors:" MAI Zhanhai, E-mail: mzh881231@126.com; KUANG Ling, E-mail: kuangling62@126.com
目前,新疆馬產業正處于由傳統馬業向現代馬業轉變的關鍵時期,馬匹正由傳統的農用,交通運輸等方式逐漸適應社會發展需要,從而轉向體育競技、休閑、娛樂等用途。擴大馬匹生產繁育規模,提高幼駒的培育水平和母馬繁殖成活率十分關鍵。盡管獸醫產科學在近年來有巨大的發展,但晚期胎兒死亡率、流產等不良妊娠結局仍然是育馬業面臨的主要問題[1]。馬屬動物繁殖障礙性疾病是以馬屬動物繁殖障礙為主要特征的一類疾病的總稱,是馬屬動物養殖中最常見病癥之一[2]。臨床上主要表現為久配不孕和流產兩個方面,嚴重影響了馬屬動物的繁育,給馬屬動物養殖業造成了巨大的經濟損失。其中,子宮內膜炎是導致馬繁殖障礙的第一大原因,同時位列馬常見疾病的第三位[3-6],而馬副傷寒(馬流產沙門菌病)是導致馬大規模流產的主要病因之一[7-12],20世紀70年代末,馬流產沙門菌病曾在我國華北、西北、東北等養馬地區陸續暴發,并造成了比較嚴重的經濟損失。直至2014年,在各地陸續發生馬流產疫情,馬流產集中地區流產率高達66.7%。該病在歐美國家得到了較好的控制,但仍有一些國家散在發生,2016年,克羅地亞報道發生了2起由馬流產沙門菌導致的馬匹流產,流產率分別為11%(2/18)和44%(18/38)[13];在阿根廷和日本等國家也有報道[10,14]。因此,了解造成馬流產的致病因素顯得尤為重要。
陰道菌群在生殖健康中扮演重要角色,高通量16S rRNA測序技術[15]為人們探索陰道菌群與不良妊娠結局的潛在聯系搭建了橋梁。研究表明,復發性流產[16]、早產[17]、輔助生殖失敗[18]、胎膜早破[19]、異位妊娠[20]等疾病都存在陰道菌群紊亂。伴隨著對菌群認知的深入研究,越來越多的研究結果表明,菌群與疾病的發生和發展有著極其重要的聯系。有研究表明,陰道菌群可能通過維持局部免疫平衡,建立宮頸引導屏障,病原體的感染引起局部免疫應答并導致過度的炎癥反應,陰道細菌通過逆行進入宮腔,并形成子宮內膜定植菌,改變母胎界面的局部微環境這四個途徑來影響妊娠及相關活動[21]。與陰道菌群相同,腸道菌群同樣會發生與成功妊娠必不可少的免疫和生理適應性變化[22]。腸道微生物對免疫系統的建立同樣起著重要作用,并協同免疫系統以維持腸道穩態[23]。在妊娠早期,腸道黏膜表面處于低炎癥狀態,炎性細胞因子的釋放和白細胞的產生是其典型的生理現象。為進一步了解流產對母馬陰道和腸道菌群多樣性的影響,本試驗通過16S rRNA測序技術對流產母馬及健康母馬的陰道菌群和腸道菌群進行結構特征分析,發現變形菌門、嗜胨菌屬、彎曲桿菌屬可能是發生流產的陰道菌群生物標志物。并對采集到的流產及健康母馬的陰道拭子進行純化培養,并進行分離鑒定。對陰道及腸道菌群中相應差異菌可能通過細胞因子及其受體的相互作用等生物學途徑與宿主發生聯系提供可靠的科學依據。
1 材料與方法
1.1 主要試劑和儀器
普通營養肉湯(NB)培養基、氯化鎂孔雀綠肉湯(MM)培養基、肉湯(LB)培養基、綿羊鮮血瓊脂培養基、營養瓊脂(NA)、SS瓊脂、HE瓊脂、LB瓊脂購自青島海博有限公司。DNA Marker 2000(CW0623M)、Taq DNA聚合酶(CW0690M)、細菌基因組DNA抽提試劑盒(CW0552S)、瓊脂糖凝膠DNA回收試劑盒(CW2302M)均購自康為世紀生物科技股份有限公司。TPro fessional PCR 儀(Biometra);DYY-6C 型電泳儀(北京市六一儀器廠);BIO RAD 凝膠成像系統(MODEL:Universal Hood II)。
1.2 試驗動物及樣品
試驗動物選取新疆伊犁某馬場年齡組成相近(12±3)歲,飼養條件一致的10匹流產的母馬(LC組)和6匹健康妊娠期母馬(JK組),其中,孕馬在流產前未出現任何征兆,突發流產,且胎衣隨流產馬駒共同娩出體外,同時陰道流出污穢的紅褐色惡露,絕大多數流產幼駒為死胎。
清洗消毒試驗動物的外陰,用無菌陰道拭子分別采集流產和健康母馬的陰道分泌物(YD)置于無菌無酶5 mL凍存管和肉湯培養基中分別保存,凍存管于液氮中存放后干冰運輸,用于陰道菌群多樣性分析,肉湯中保存的樣品進行細菌學檢查和病原菌分離培養及純化。分別在每匹母馬直腸中采集糞便(FY),收集10 g新鮮糞便樣品于滅菌凍存管內,立即放入液氮中保存備用。
1.3 陰道及腸道菌群多樣性分析
1.3.1 16S rRNA 高通量測序
本研究采用 MagPure Stool DNA KF Kit B 制備總基因組 DNA,進行建庫與測序。對于合格的樣品使用 DNA分選磁珠對樣本進行純化及下一輪 PCR 擴增,再使用 QubitTM dsDNA BR Assay Kit 檢測試劑盒對最終擴增子進行定量。擴增區域為細菌多樣性鑒定對應區域:16S rRNA 基因 V3~V4 區域,樣品采用 Illunima Miseq 平臺測序,測序策略為 PE300。使用 Trimmomatic引物、標簽去除以及質量控制[24]。進行預處理后,使用 Vsearch 軟件對相似度≥97%的序列進行聚類,并合并到一個可操作分類單元(operational taxonomic unit,OTU)中。選取豐富度最高的序列作為代表,將代表序列與 Greengenes 和 SILVA 數據庫進行比較,標注與分類[25]用于后續分析。
1.3.2 OTU劃分和分類鑒定
OTU是將某一基因相似度設定為某個閾值,將兩組基因進行逐個比對,將這兩組基因的相似比率超過設定的目標閾值,即認為這兩組研究對象的DNA是來源于同一物種的,那么超過這一閾值的DNA序列認為是一個OTU,通常將97%的序列相似度作為該閾值劃分。通過QIIME軟件并調用VSEARCH,對前面獲得的全部陰道菌群的DNA的序列按97%的序列相似度進行歸并及OTU劃分。
1.3.3 菌群的多樣性分析方法
1.3.3.1 Alpha多樣性數據處理:
使用Qiime軟件計算Observed_species指數、Chao1指數、Shannon指數、Simpson指數、ACE指數、覆蓋度(Goods-coverage)和PD_whole_tree指數。使用R軟件繪制Rank abundance曲線。
1.3.3.2 beta多樣性數據處理:
使用 Qiime 軟件計算 Unifrac 距離,構建UPGMA樣本聚類樹。使用R軟件繪制主成分分析( PCA) 和主坐標分析( PCoA) 圖。PCA 使用R軟件的 ade4 和 ggplot2 軟件包,PCoA 使用R軟件的 WGCNA、stats 和 ggplot2 軟件包。
LEfSe 分析使用 LEfSe 軟件,使用線性判別分析及影響因子分析(linear discriminant analysis effect size, LEfSe)尋找不同組間具有顯著差異的物種,分為3個計算步驟:第1步,按照分組,采用非參數Kruskal Wallis秩和檢驗,計算出在不同組間豐度具有顯著差異的物種,通過檢驗的物種進行第2步操作;第2步,對各組中的亞組使用Wilcoxon秩和檢驗進行兩兩比較,對具有顯著差異的物種進行第3步操作;第3步,對上一步得出的物種數據采用LDA分析進行降維并評估影響力,得出LDA評分。選擇LDA值>2的物種進行繪圖展示。
1.3.3.3 功能注釋:
使用Picrust軟件預測菌群的功能。功能分析對微生物多樣性分析有著重要生物學意義,而基于預測軟件能將物種及其功能聯系起來,以獲得群落整體功能的大致分布。PICRUSt2 (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)是一款基于標記基因序列來預測功能豐度的軟件,包括KEGG,COG,Meta Cyc代謝通路等功能的預測。功能通常指的是基因家族,如:KEGG同源基因和酶分類號,預測通常基于16S rRNA基因測序數據,也可以使用其他標記基因。通過PICRUST2獲得細菌群落KEGG功能的豐度預測結果。功能以KO ID為名稱,代表了特定的功能基因,再根據KEGG數據庫的信息獲得代謝通路的3個水平信息,并分別得到各個水平的豐度表。
為了進一步探索兩組間的差異性物種潛在的功能路徑,本研究通過PICRUSt2、R軟件預測微生物群落功能,探索宿主、環境和微生物群落之間的潛在相互作用。其原理是通過16S測序將相應同源祖先的全基因組進行匹配,然后將其映射到代謝物和通路,實現功能預測。根據基因組百科全書(KEGG)數據庫,在健康組和流產組的富集途徑分析在2級和3級功能維度上采用 R 進行分析不同組別的微生物功能和微生物群的顯著差異。
1.4 細菌的分離與鑒定
1.4.1 細菌分離培養
使用無菌操作將所采集到的樣品分別取500μL接種于普通營養肉湯(NB)培養基、氯化鎂孔雀綠肉湯(MM)培養基、肉湯(LB)培養基、THB培養基和BHI培養基中進行增菌,37 ℃、180 r·min-1、培養12~16 h;接種環蘸取菌液于綿羊鮮血瓊脂培養基、營養瓊脂(NA)、SS瓊脂上進行稀釋涂布,倒置培養12~18 h,觀察菌落形態,挑取不同形態的單菌落,再次接種于液體培養基中,37 ℃、180 r·min-1、培養12~16 h進行純化;在平板上隨機挑取單個菌落,劃線于固體平板,進行純化培養。純化三代后的單菌落分別接種于對應液體培養基中進行擴大增菌培養,以便進行后續的研究及菌種保藏。觀察到培養基上均為同一種菌落時,可進行細菌革蘭染色鏡檢,觀察細菌的形態。
1.4.2 細菌形態學觀察
進行革蘭染色時,參照革蘭染色液的使用說明書進行嚴格操作。挑取經三純劃線后的單菌落,37 ℃、180 r·min-1過夜培養后進行革蘭染色,待載玻片加熱干燥后,將載玻片置于光學顯微鏡下進行細菌形態學觀察。
1.4.3 16S rRNA基因擴增及序列分析
采用細菌通用引物27F/1492R,引物序列16S rRNA-F:AGAGTTTGATCCTGGCTCAG,16S rRNA-R:G-GTTACCTTGTTACGACTT,引物由上海生工生物工程技術服務有限公司合成。PCR反應總體系12.5 μL,Taq DNA聚合酶6.5 μL,DNA模板1 μL,上、下游引物各0.5 μL,加ddH2O至12.5 μL。16S rRNA基因PCR反應條件:95 ℃預變性5 min;95 ℃變性30 s,56 ℃退火30 s,72 ℃延伸90 s,共36個循環;72 ℃總延伸10 min。
PCR產物經凝膠電泳檢測后選取檢測結果為陽性的樣品進行膠回收,將膠回收產物送至上海生工生物工程股份有限公司測序。測序結果經過BLAST后,用DNAStar軟件進行分離菌株的核苷酸序列與GenBank中上傳的相似菌株進行序列和相似性分析,用Mega7.0軟件構建系統發育樹。
1.5 統計分析
使用SPSS軟件進行Alpha和beta多樣性指數組間差異分析,并選用Tukey檢驗對Alpha和beta多樣性指數組間差異分別進行有參數檢驗和非參數檢驗。計數資料采用(%)表示;計量資料采用 Kruskal-Wallis檢驗進行比較分析;以 P<0.05為差異有統計學意義。
相關性網絡分析采用R(v3.4.1)、Cytoscape,閾值設置為0.3。從可視化的角度去表現物種或代謝功能與樣本、樣本分類三者之間的相關關系,從網絡結構圖中發現重要的模式或信息。
2 結 果
2.1 Rank-Abundance分析與不同組的OTU差異性分析
曲線的水平寬度和平滑程度反映物種的豐富度和均勻度,如圖1顯示,橫坐標上曲線的范圍越大,表明菌種的豐富度越大,曲線越平滑表明樣本物種越均勻。兩種樣本具有足夠的豐度,腸道樣本中物種的分布較陰道樣本均勻。對流產組和健康組的陰道和腸道OTU進行比較,可以發現其中陰道菌群共有OTU 2 082個,流產組特有1 654個,健康組特有487個;可以發現其中腸道菌群共有OTU 2 789個,流產組特有985個,健康組特有222個。結果顯示,健康組和流產組陰道及腸道微生物群落和物種分布存在一定程度的相似性和差異性。
2.2 不同組母馬陰道菌群物種多樣性分析
2.2.1 流產組和健康組母馬陰道菌群 Alpha 多樣性分析
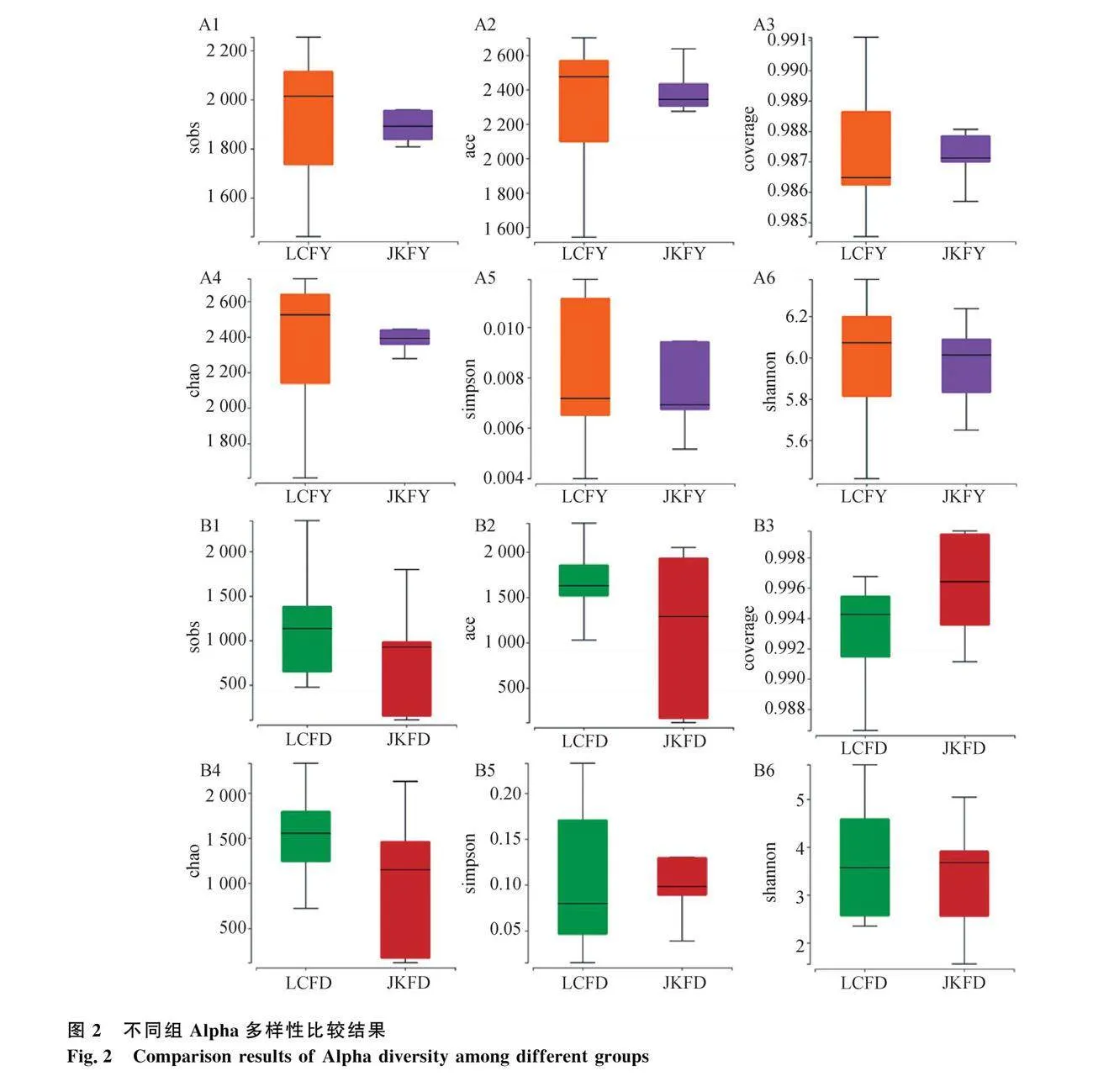
對兩組母馬陰道和腸道菌群進行Alpha多樣性分析,如圖2所示,流產組和健康組母馬陰道和腸道菌群的Sobs指數(圖2 A1、B1),ACE指數(圖2 A2、B2),Shannon指數(圖2 A6、B6),Simpson指數(圖2 A5、B5)均無顯著差異(P>0.05)。陰道菌群中,與健康組相比,流產組的Chao1指數(圖2 A4)說明陰道菌群豐富度和多樣性有增加的趨勢;腸道菌群中,與健康組相比,Chao1(圖2 B4)和Shannon指數(圖2 B6)表明流產組腸道菌群豐富度和多樣性也有增加的趨勢。且各組樣品覆蓋度均超過0.98,說明數據均能準確反映流產及健康母馬陰道菌群和腸道菌群的組成(圖2 A3、B3)。
2.2.2 流產組和健康組母馬陰道和腸道菌群 beta 多樣性分析
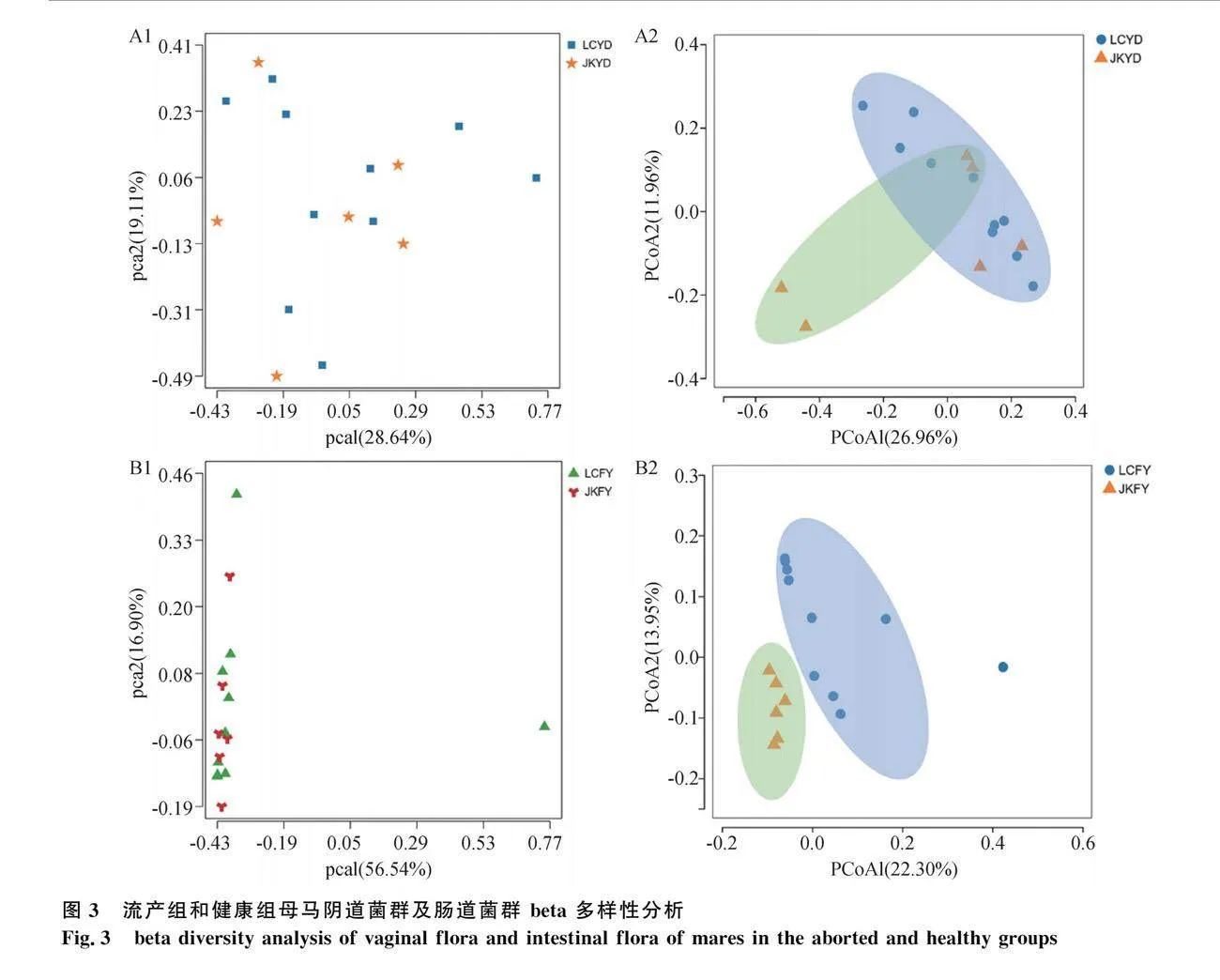
為評估不同樣本組間陰道、腸道菌群的差異,從而判斷流產組和健康組菌群的群落結構,對陰道和腸道樣本進行β多樣性分析。采用PCoA分析的方法對組間差異和不同物種間的相互關系進行較為全面的測繪。
多樣性分析見圖3,結果表明,組成流產組和健康組的之間的菌群明顯不同。在陰道菌群中,由 PCoA 圖可知(圖3 A2),第 1 主成分對樣本變異的貢獻為 26.96%,第 2 主成分對樣本變異的貢獻為 11.96%,兩組菌群的相似性較高;PCA圖顯示(圖3 A1),第 1 主成分對樣本方差的貢獻為28.64%,第 2 主成分對樣本方差的貢獻為 19.11%,流產組和健康組母馬陰道菌群的相似性較高;在腸道菌群中,由 PCoA 圖可知(圖3 B2),第 1主成分對樣本變異的貢獻為 22.30%,第 2 主成分對樣本變異的貢獻為 13.95%,組和組菌群的相似性較高; PCA圖顯示(圖3 B1),第 1 主成分對樣本方差的貢獻為56.54%,第 2 主成分對樣本方差的貢獻為 16.90%,流產組和健康組母馬陰道菌群的相似性較高。這些結果表明,與健康組相比,流產母馬的陰道菌群與腸道菌群結構發生了變化。
2.3 陰道、腸道菌群組成
2.3.1 陰道菌群組成
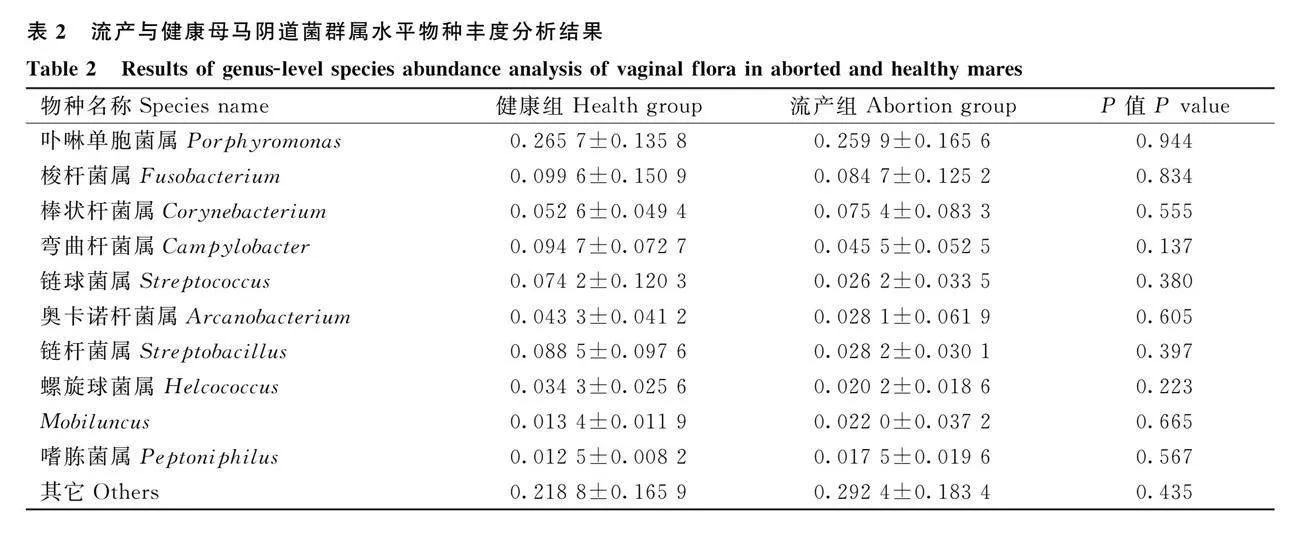
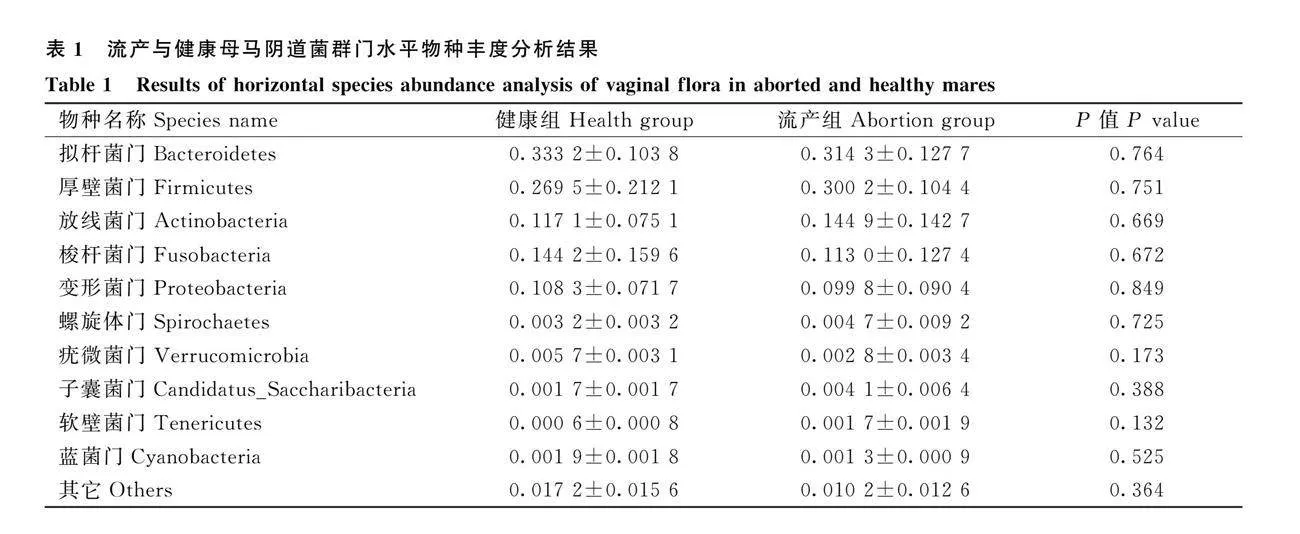
由表1可知,流產組和健康組母馬陰道菌群在門水平上相對豐度排在前 10 的物種為擬桿菌門、厚壁菌門、放線菌門、梭桿菌門、變形菌門、螺旋體門、疣微菌門、子囊菌門、特內里菌門、藍菌門和其它組成。其中,擬桿菌門、厚壁菌門、放線菌門、變形菌門和梭桿菌門的相對豐度之和在95%以上。在門水平上,流產組疣微菌門量明顯減少。
由表2可知,為進一步探索屬分類水平上陰道菌群結構,進行了流產組和健康組母馬陰道菌群分析,在屬水平上相對豐度排在前 10 的物種為卟啉單胞菌屬、梭桿菌屬、棒狀桿菌屬、彎曲桿菌屬、鏈球菌屬、奧卡諾桿菌屬、鏈桿菌屬、螺旋球菌屬、Mobiluncus、嗜肽菌屬和其它。在屬水平上,流產組彎曲桿菌屬和螺旋球菌屬數量明顯降低。
2.3.2 腸道菌群組成
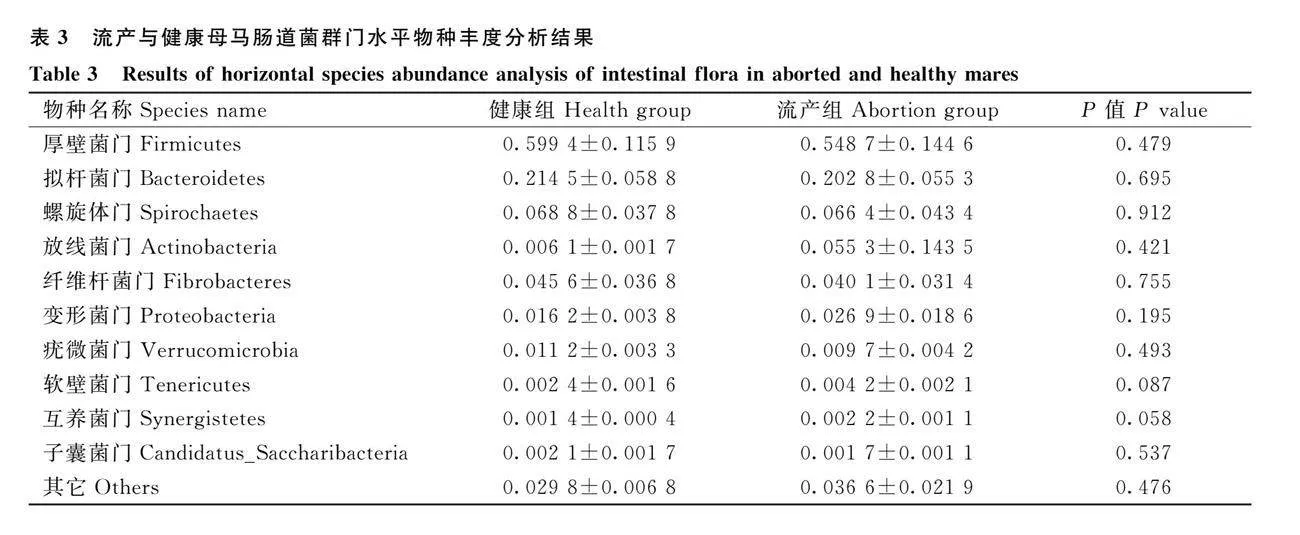
由表3可知,選取流產組和健康組母馬腸道菌群在門水平上相對豐度排在前 10 的物種,主要由厚壁菌門、擬桿菌門、螺旋體門、放線菌門、纖維桿菌門、變形菌門、疣微菌門、特內里菌門、互養菌門、子囊菌門和其它組成,其中,厚壁菌門、擬桿菌門、螺旋菌門、放線菌門和纖維桿菌門的相對豐度之和在90%以上。在門水平上,流產組變形菌門、特內里菌門和互養菌門數量明顯增加。
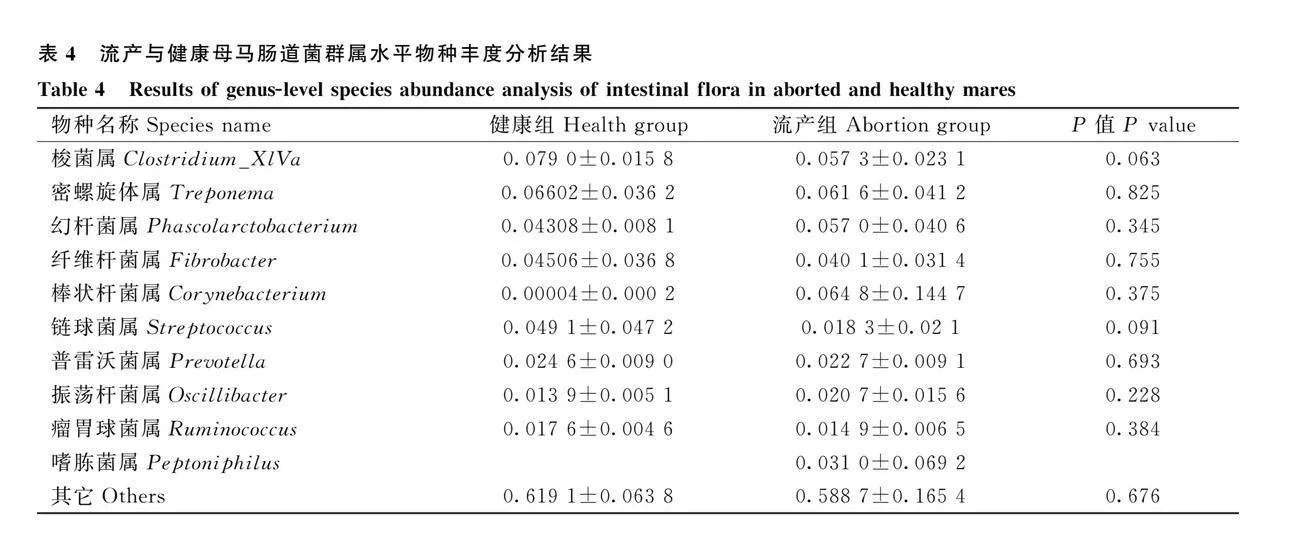
由表4可知,在屬水平上流產組和健康組母馬腸道菌群選取相對豐度排在前 10 的物種進行分析,主要有梭菌屬、密螺旋體屬、幻桿菌屬、纖維桿菌屬、棒狀桿菌屬、鏈球菌屬、普雷沃氏菌屬、振蕩桿菌屬、瘤胃球菌屬、嗜肽菌屬和其它組成。在屬水平上,流產組梭菌屬、鏈球菌屬數量明顯降低。
2.3.3 差異分析
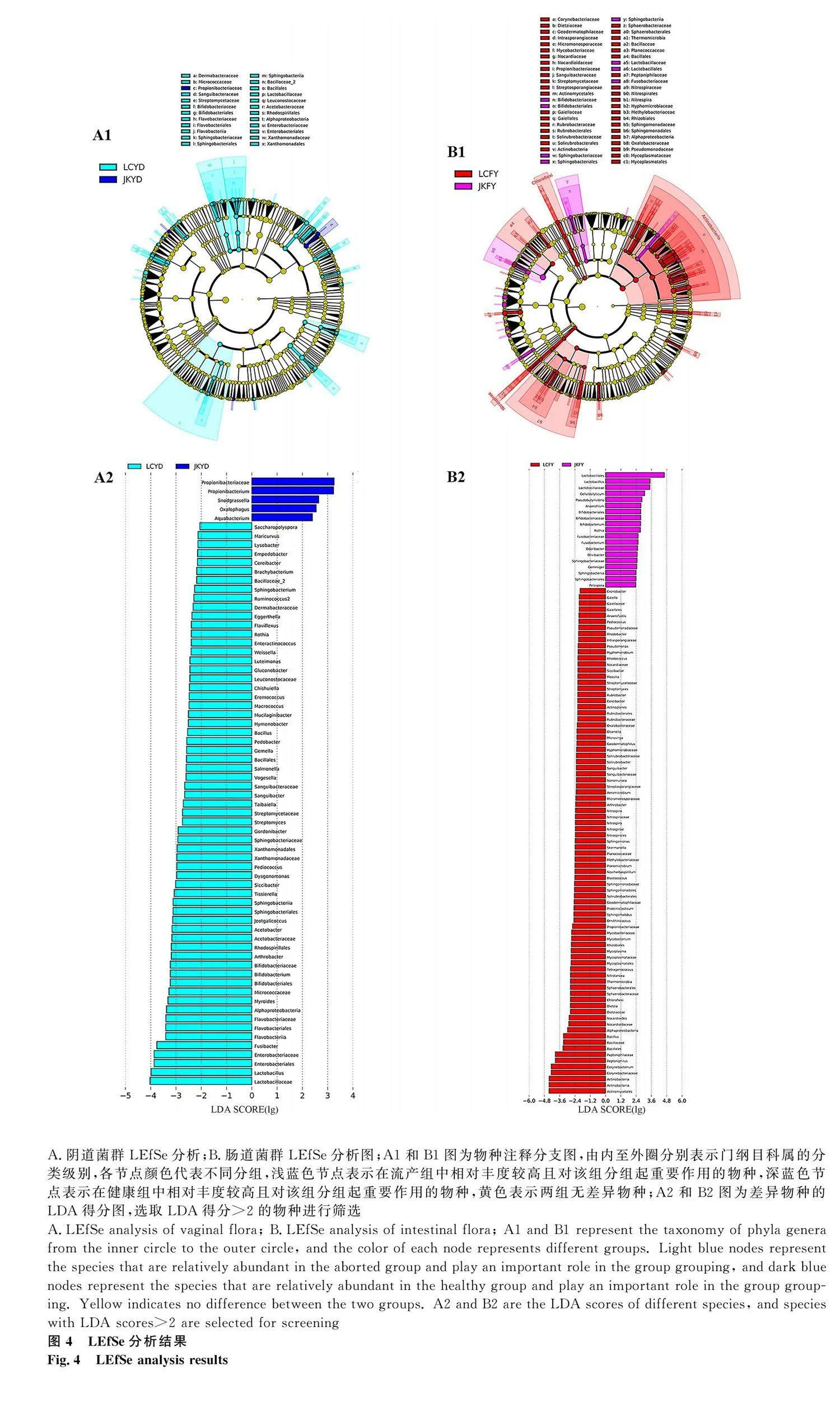
為了尋找流產組和健康組陰道和腸道菌群具體差異物種,采用LEfSe分析的方法篩選兩組間相對豐度具有顯著差異的菌群,并計算差異效應的大小。由圖4 A1和A2可知,陰道菌群在門綱目科屬水平上,健康組菌群無差異性物種,流產組菌群中有顯著差異的物種有 5 種,分別為乳桿菌科、乳桿菌屬、腸桿菌目、腸桿菌科、鐮刀菌屬,其中,流產組中沙門菌的豐度顯著高于健康組;由圖4 B1和B2可知,腸道菌群在門綱目科屬上,共發現8類差異物種。其中,健康組菌群中有顯著性差異的物種有1個,為乳桿菌科;流產組菌群中有顯著差異的物種有 7 個,分別為放線菌屬、放線菌門、放線菌綱、棒狀桿菌科、棒狀桿菌屬、嗜肽菌屬和嗜肽菌科。
2.3.4 功能預測
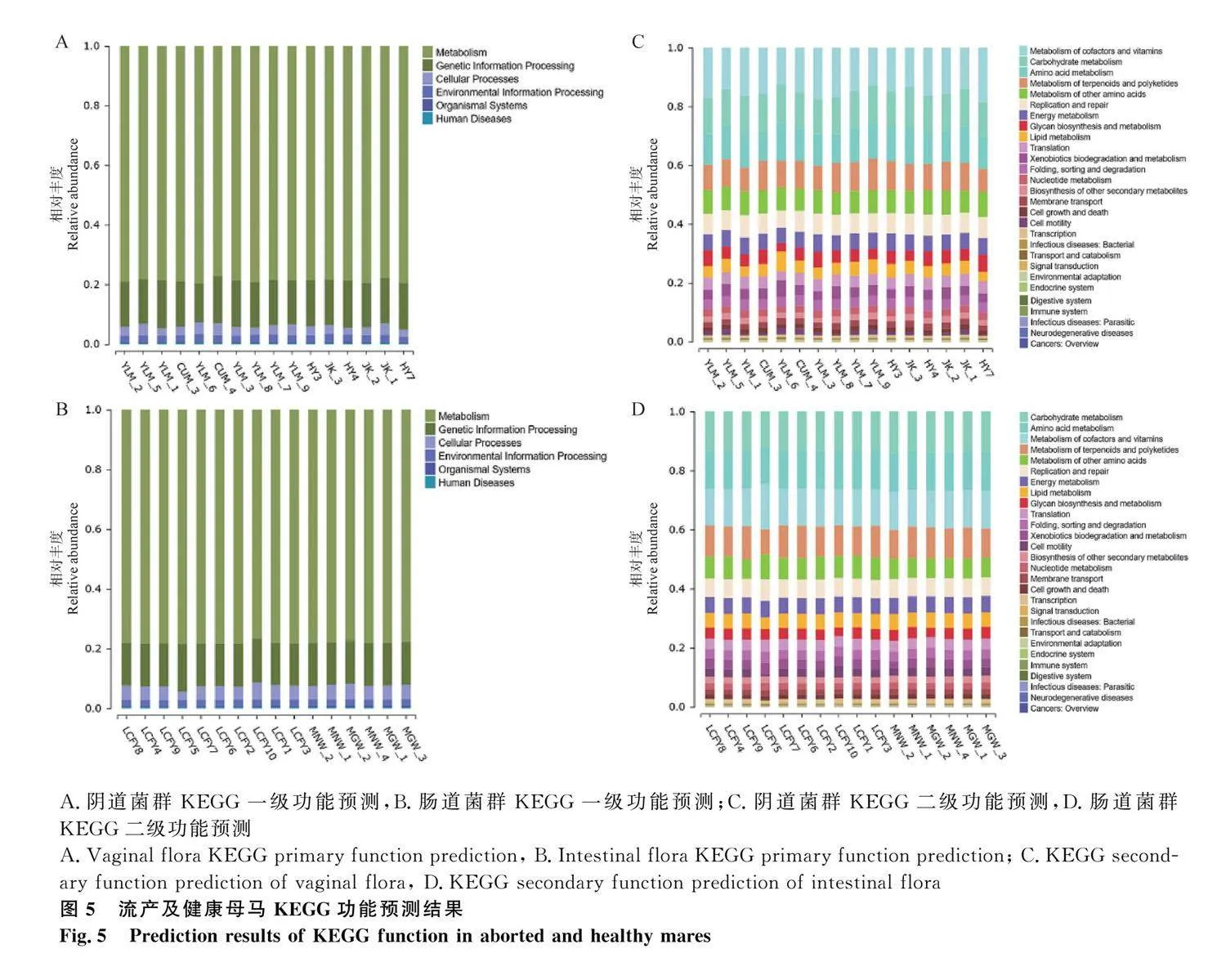
2.3.4.1 KEGG功能注釋分析:KEGG (Kyoto Encyclopedia of Genes and Genomes) 是一個有關生物系統較完善的數據庫,整合了基因組、化學物質和系統功能信息。其包括:生物體系統(organismal systems)、代謝(metabolism)、人類疾病(human diseases)、遺傳信息處理(genetic information processing)、環境信息處理(environmental information processing)及細胞過程(cellular processes)6 個模塊。兩個菌群中,三者均以代謝模塊為絕對優勢功能(豐度占比均gt;50%),表明菌群內部微生物代謝活動較為旺盛,如圖5A和5B。
KEGG 二級功能包括碳水化合物代謝(carbohydrate metabolism)、氨基酸代謝及運輸(amino acid metabolism)和分解代謝(transport and catabolism)等多種模塊。陰道菌群中(圖5 C),流產組和健康組在輔助因子和維生素代謝模塊基因中具有較高的豐度占比;腸道菌群中(圖5 D),流產組和健康組在碳水化合物代謝模塊基因中具有較高的豐度占比。
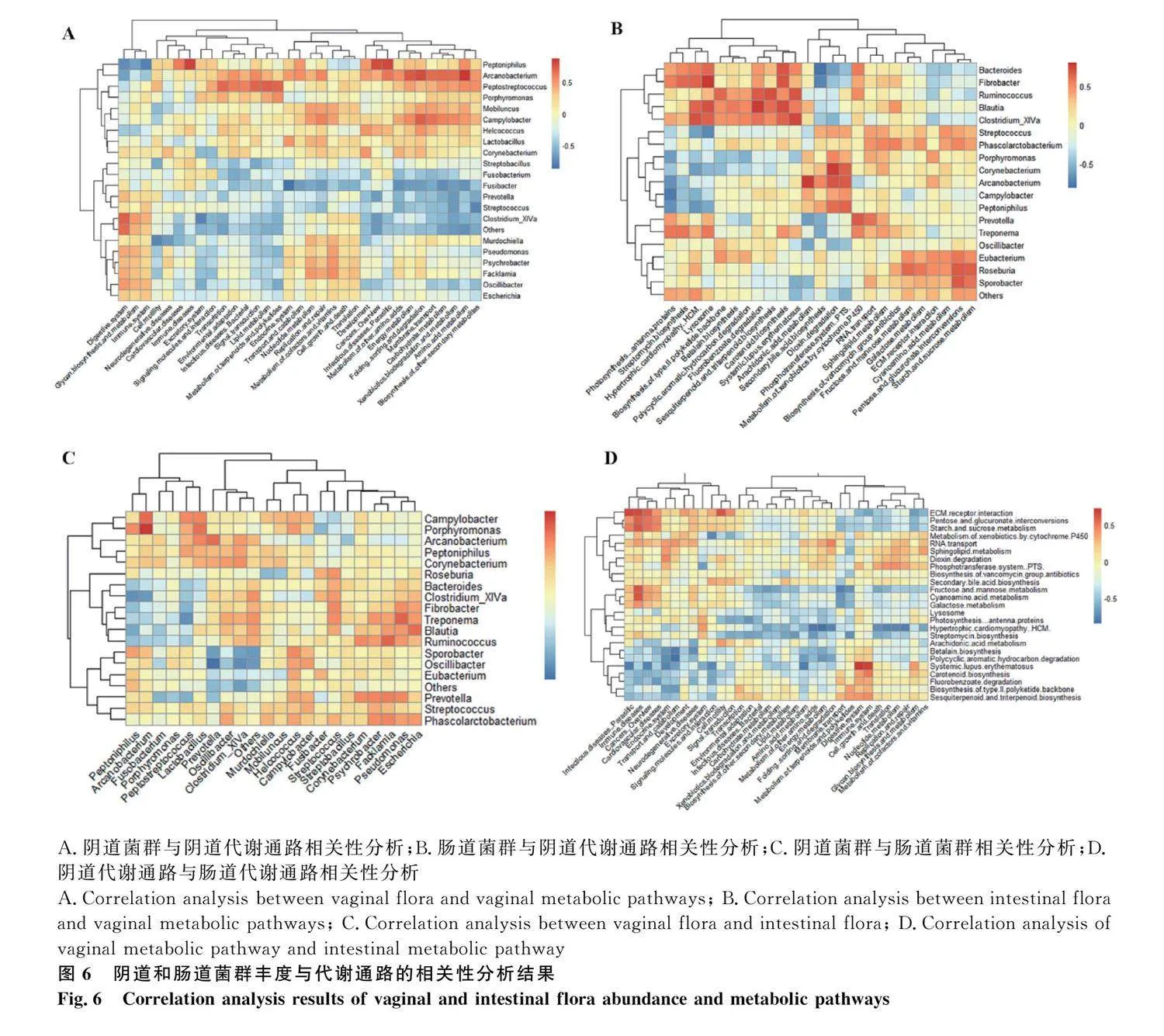
2.3.4.2 陰道、腸道菌群豐度與代謝通路的相關性分析:
為探討陰道、腸道菌群豐度與代謝通路間的關系,本研究分別計算了陰道和腸道微生物菌群豐度與KEGG 2,3級代謝通路差異指標間的相關性熱圖。
陰道微生物菌屬豐度與2級代謝通路間具有的相關性(圖6 A),嗜胨菌屬(Peptoniphilus)與免疫疾病(immune diseases)、癌癥的發生(cancers:" overview)、寄生蟲(infectious diseases: parasitic)的相關性較高;彎曲桿菌屬(Campylobacter)與奧卡諾桿菌屬(Arcanobacterium)與氨基酸代謝(Amino acid metabolism)、氨基酸的折疊、分類和降解(folding, sorting and degradation)的相關性較高。腸道微生物菌屬豐度與3級代謝通路間具有顯著相關性(圖6 B),奧卡諾桿菌屬(Arcanobacterium)可能花生四烯酸代謝(arachidonic acid metabolism)有較為緊密的聯系;棒狀桿菌屬(Corynebacterium)與二惡英降解(dioxin degradation)有著較高的相關性。
在腸道微生物和陰道微生物的相關性分析中可知(圖6 C),卟啉單胞菌屬(Porphyromonas)與奧卡諾桿菌屬(Arcanobacterium)呈正相關,瘤胃球菌屬(Ruminalococcus),密螺旋體屬(Spirochaetes)和經黏液真桿菌屬(Blautia)與埃希氏菌屬(Escherichia),假單胞菌屬(Pseudomonas)和費克藍姆菌屬(Facklamia)呈正相關;顫螺菌屬和普雷沃菌屬(Prevotella),梭菌屬(Clostridium_XlVa)呈負相關;在腸道相關通路和陰道相關通路的相關性分析中可知(圖6 D),腸道中氰基氨基酸代謝以及碳水化合物代謝中的果糖和甘露糖代謝,戊糖和葡萄糖醛酸酯相互轉化,淀粉和蔗糖代謝與陰道中疾病相關通路如免疫疾病(immune diseases),細胞運動(cell motility)和癌癥:概述(cancers: Overview)和傳染病等疾病相關通路有較高的相關性;同時,腸道中免疫疾病(immune disease)與陰道中免疫系統(immune system)也存在較高的相關性。以上結果提示,陰道中的某些致病菌可能受到腸道致病菌的調控和影響,進而調節其在陰道菌群中的功能作用。
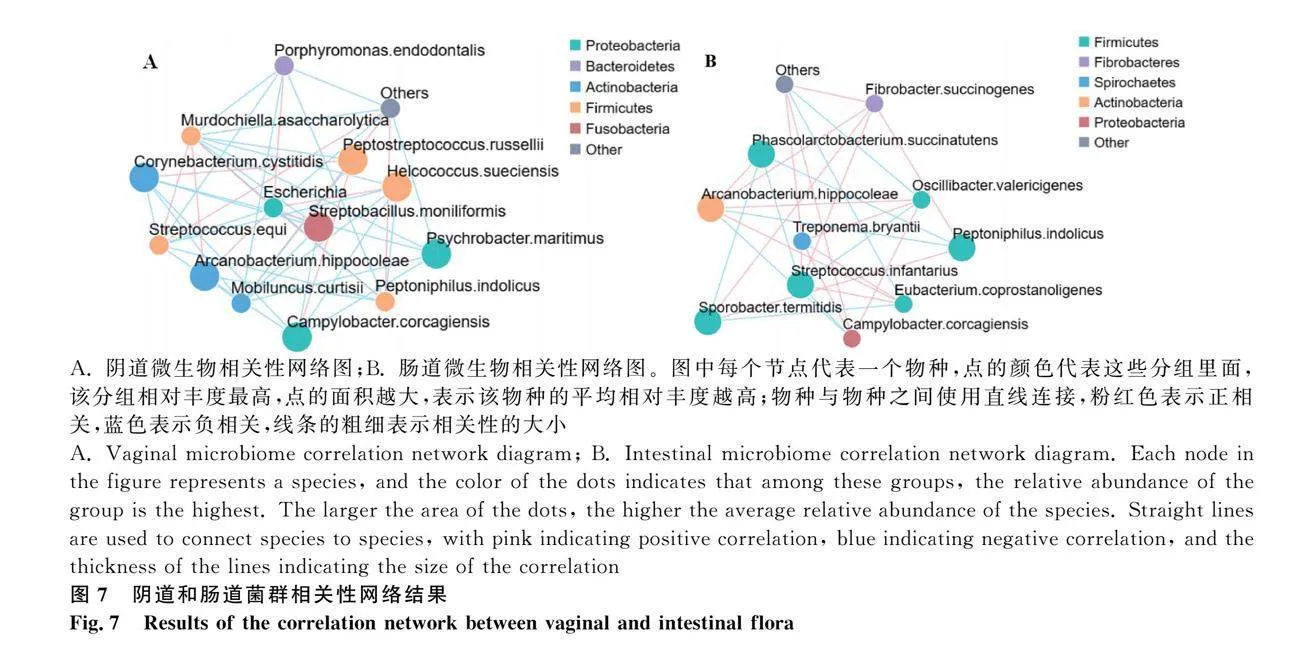
2.3.4.3 微生物相關網絡圖:
正常陰道細菌與健康相關微生物(Escherichia、Murdochiella asaccharolytica、Arcanobacterium hippocoleae)之間存在正相關;正常陰道微生物與流產相關病原菌呈負相關,如厚壁菌門和放線菌門與變形菌門呈負相關(圖7 A)。正常腸道細菌與健康相關微生物(Sporobacter termitidis、Peptoniphilus indolicus、Fibrobacter succinogenes;Treponema bryantii、Streptococcus infantarius、Eubacterium coprostanoligenes)之間存在正相關;正常腸道微生物與流產相關病原菌呈負相關,如Arcanobacterium.hippocoleae和Streptococcusinfantarius與變形菌門呈負相關(圖7B)。
2.4 細菌分離鑒定結果
2.4.1 細菌的分離純化及鑒定
基于前期高通量測序技術的結果,發現流產母馬及健康母馬陰道拭子中含有不同的致病菌。本試驗采用細菌純培養技術對流產及健康母馬陰道拭子進行細菌分離鑒定。
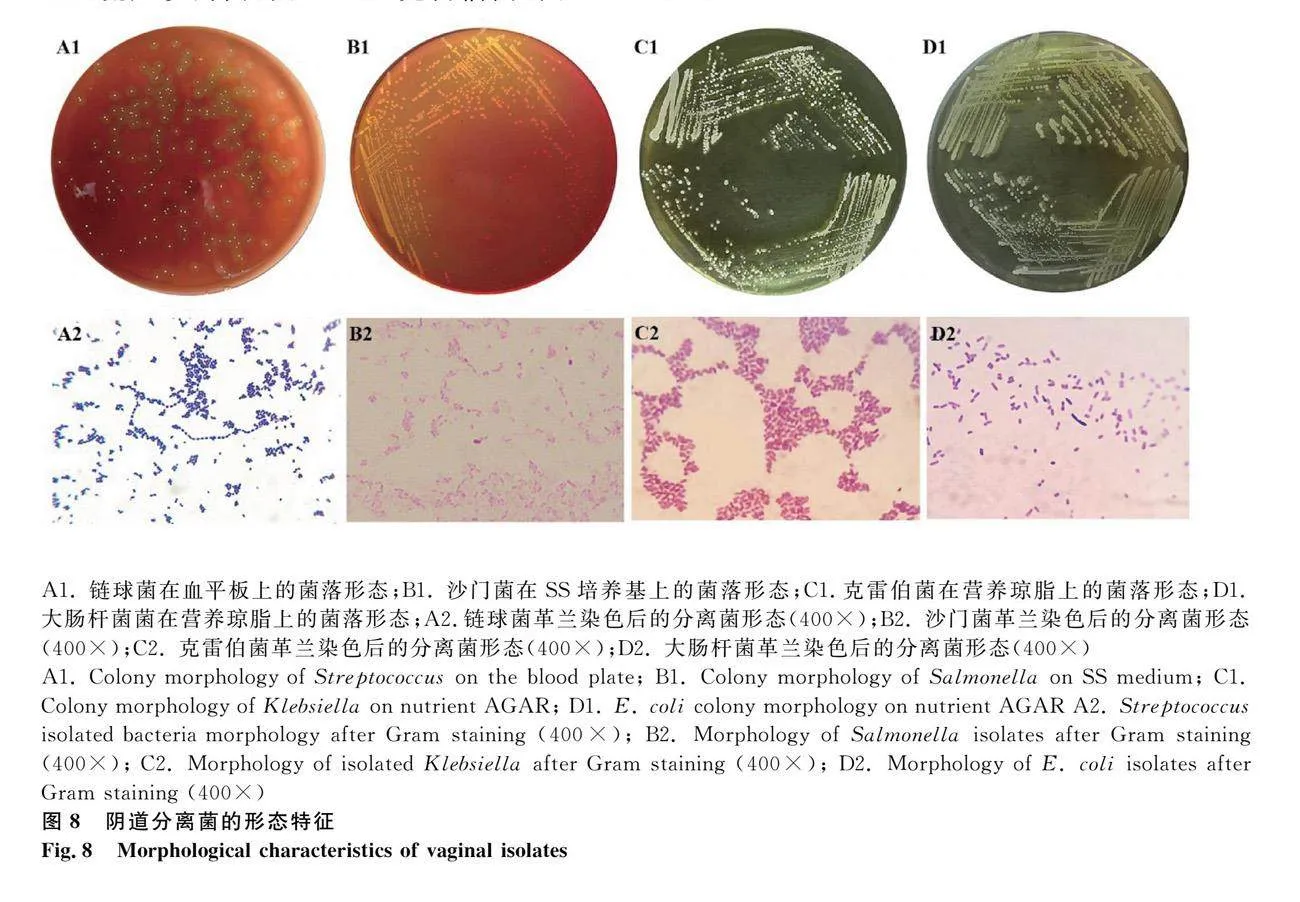
從流產母馬陰道拭子中分離的菌株在營養瓊脂平板及SS平板上培養后出現菌落邊緣光滑或呈波形,表面光滑或粗糙,不同菌種菌落大小不一,多數呈現乳白色或淡黃色,少部分菌落偏透明,有的形成膠水樣菌苔。主要致病菌包括馬鏈球菌獸疫亞種(圖8 A1)、流產沙門菌(圖8 B1)、克雷伯菌(圖8 C1)和大腸桿菌(圖8 D1)。
分離菌株鏈球菌為革蘭陽性菌,菌體為球形或卵圓形、細菌無鞭毛、無芽孢、呈鏈狀排列,符合鏈球菌的基本形態(圖8 A2);分離菌株沙門菌為革蘭陰性菌,細菌有鞭毛、能運動、呈兩端鈍圓的短桿狀、無莢膜和芽胞,符合沙門菌的基本形態(圖8 B2);分離菌株克雷伯菌為革蘭陰性菌,細菌無鞭毛、能運動、呈較粗短桿狀、成雙或短鏈狀排列、有較厚的莢膜,符合克雷伯菌的基本形態(圖8 C2);分離菌株大腸桿菌為革蘭陰性菌,細菌有鞭毛、能運動、呈短桿狀、無芽胞,符合大腸桿菌的基本形態(圖8 D2)。
2.4.2 16S rRNA基因擴增及遺傳進化分析
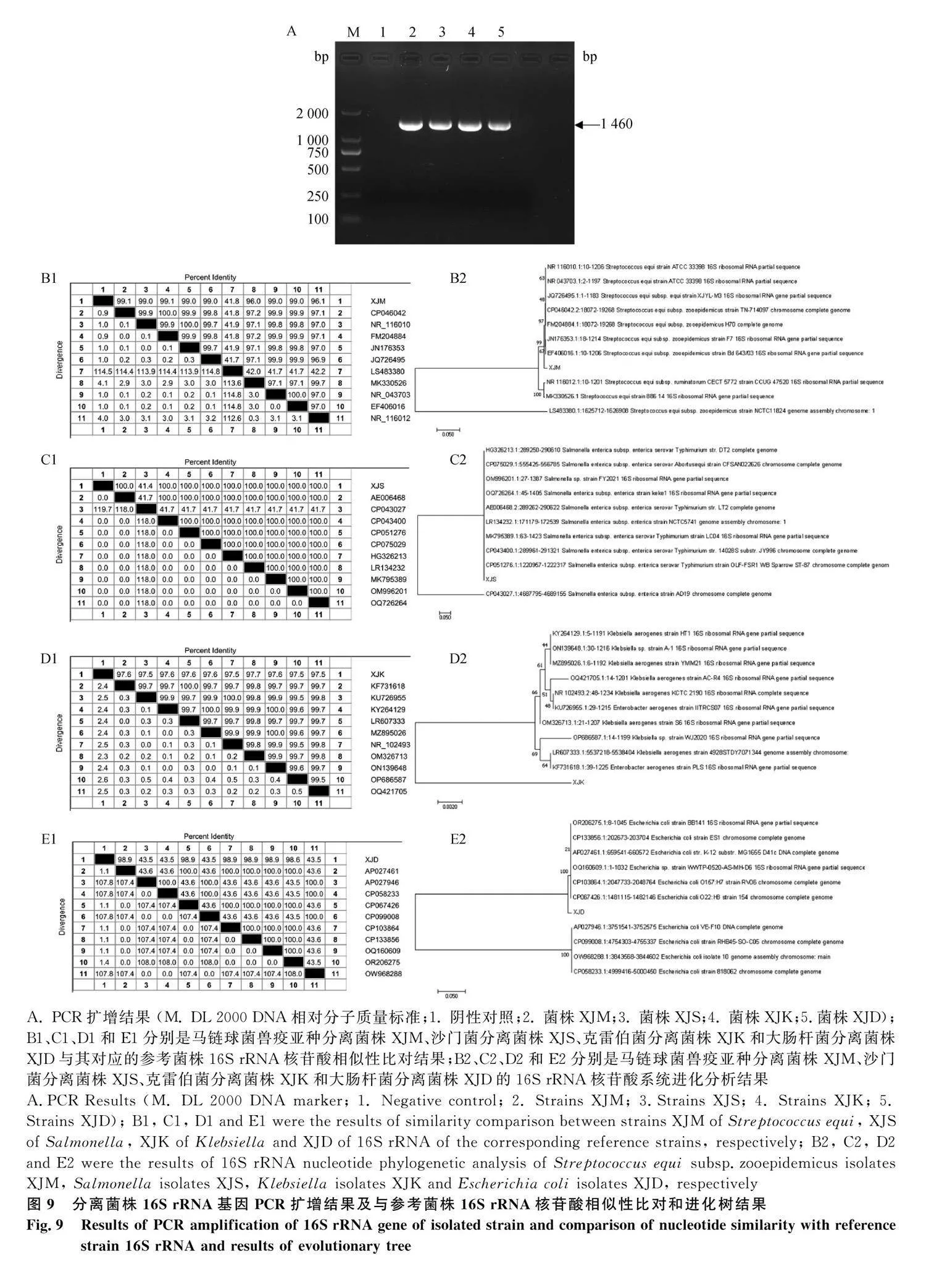
將4株分離菌株的基因組DNA為模板PCR擴增16S rRNA基因,獲得了約1 460 bp的目標條帶
(圖9A),與預期大小相符。4株分離株的 16S rRNA基因進行相似性比對結果表明分離株XJM、XJS、XJK、XJD的16S rRNA基因的核苷酸序列分別在GenBank中進行對比,發現4株菌分別與馬鏈球菌獸疫亞種美國分離株USA-CP046042、沙門菌中國分離株CHINA-OQ726264、克雷伯菌中國分離株CHINA-OP686587和大腸桿菌中國分離株CHINA-OR206275的相似性均gt;99%。利用DNASTAR、MAGA7軟件對4株分離株的16S rRNA基因與 GenBank中登錄的相應序列進行同源性比對分析。由圖9 B1可知,鏈球菌新疆分離菌株XJM與其他鏈球菌分離株的16S rRNA基因核苷酸序列相似性為41.7%~100.0%;沙門菌新疆分離菌株XJS與其他沙門氏菌分離株的16S rRNA基因核苷酸序列相似性為22.3%~100.0%(圖9 C1);克雷伯菌新疆分離菌株XJK分離株與其他克雷伯菌分離株的16S rRNA基因核苷酸序列相似性為23.2%~100.0%(圖9 D1);大腸桿菌新疆分離菌株XJD分離株與其他大腸桿菌分離株的16S rRNA基因核苷酸序列相似性為24.8%~100.0%(圖9 E1)。
3 討 論
本試驗對采集的流產及健康母馬陰道拭子進行細菌的分離鑒定,分離鑒定結果對測序結果進行補充,更加清晰地了解導致母馬可能發生流產的相關致病菌,同時對流產母馬和健康母馬的陰道、腸道菌群進行了表征,希望找到母馬流產與陰道和腸道菌群的關聯。對養殖場中發生流產現象的母馬陰道拭子進行細菌分離鑒定,成功分出沙門菌,與高通量測序結果一致,流產組中沙門菌的豐度顯著高于健康組,從而達到對測序數據的補充與證實,同時其余可能引發馬流產病的馬鏈球菌獸疫亞種,大腸桿菌、克雷伯菌也在發生流產的母馬陰道拭子中被分離得到,而在健康母馬樣本中分離率較低。
在兩組陰道菌群中對比發現其結構組成是相似的,在門水平上主要以擬桿菌門、厚壁菌門、放線菌門等為主。其中,擬桿菌門和厚壁菌門的物種豐度占絕對優勢。對于健康組而言,流產組母馬的陰道菌群具有更高的多樣性和豐富度。前期研究表明,基于培養的方法或顯微鏡下觀察的細菌性陰道炎與流產風險的增加有關[26-27]。另外一項巢式病例對照研究發現高多樣性的陰道菌群菌落組成與流產的高患病率存在正相關關系[28]。與預期研究結果相符。陰道微生物可能通過多種途徑調節胚胎植入、胎盤滋養層侵襲[29-31]。通過LEfSe篩選出流產組母馬和健康組母馬的陰道差異菌,具有顯著貢獻度的細菌包括乳桿菌科、乳桿菌屬、腸桿菌目、腸桿菌科、鐮刀菌屬。乳桿菌是陰道含量最高、最重要的益生菌之一,高含量的乳桿菌分泌乳酸維持陰道的酸性環境,有效防止宮頸陰道的感染[32-33]。乳桿菌在妊娠過程中起重要的作用。妊娠期幾乎機體每個器官和系統都在發生變化,一方面陰道黏膜厚度和血管增加,加速宮頸分泌物的分泌,導致富含糖原的陰道上皮細胞聚集,糖原是乳酸代謝的重要來源,另外雌激素增加誘導糖原增加,同樣促使陰道酸性環境加劇,更加有利于乳桿菌的生長[34]。有研究發現流產早期陰道中乳桿菌含量較正常分娩母畜陰道減少,但本研究中并未體現出來這一論點,推測可能是由于流產母馬在細菌感染后,陰道內乳桿菌為抵御微生物的入侵和定植而大量繁殖。因此,乳桿菌群豐度的增加和病原菌及雜菌的減少可能是妊娠母馬為降低細菌感染和流產發生率的一種自我保護機制。同樣,馬匹的個體差異,樣本量的局限性和測序水平的限制均可能造成這一結果。另外,張瑩軒[21]認為孕期乳桿菌豐度的增加與雌二醇含量相關,流產患者雌二醇含量降低,糖原的來源減少,影響陰道酸性環境促使乳桿菌豐度降低可能是解釋流產患者陰道乳桿菌豐度低的原因之一,在研究中,納入的流產馬匹激素水平暫未出現明顯下降的情況,可能是乳桿菌無明顯變化的原因。另外,LEfSe篩選出健康母馬陰道菌群中的放線菌屬于腸道益生菌。本試驗在陰道菌群中檢測到放線菌,且在流產母馬陰道菌群中豐度相較于健康組降低,提示放線菌門的增加可能會降低流產發生的風險。雙歧桿菌屬于放線菌門,有相關報道,推測陰道雙歧桿菌與腸道相同,發揮益生菌作用,某些特殊菌株具有調節妊娠免疫的功能,可能參與胚胎植入或妊娠維持的母胎免疫環節[21]。
在兩組腸道菌群中對比發現其結構組成是相似的,在門水平上,主要以厚壁菌門,擬桿菌門,螺旋菌門等為主。其中,厚壁菌門和擬桿菌門占有菌群豐度的絕對優勢,健康組腸道菌群中,二者共占腸道菌群的80%以上,但流產組腸道菌群中,二者占比有下降趨勢。基于Binary Jaccard、Bray Curtis和Unweighted Unifrac距離比較兩組菌群中的β多樣性發現兩組樣本物種相似性、豐度和進化關系等均有差異。其中,變形菌門(Proteobacteria)有上升的趨勢,其與炎癥的發生有關,在妊娠后期,隨著孕齡時間的延長,變形菌豐度增加[35],伴隨著TNF-α、IL-6等炎癥因子的產生[36]。變形菌門是細菌中主要的物種,包括很多病原菌,如大腸桿菌、沙門菌、霍亂弧菌、幽門螺桿菌等菌屬。以往的研究結果表明,沙門菌屬中的馬流產沙門菌廣泛存在于各年齡段的馬匹中,且年齡越大越易發生。據文獻報道和流行病學調查研究表明,母馬由本病引起的流產率一般占流產總數的30%~60%,清潔區一旦傳入此病,則流產率高達90%以上[37]。另外有人提及妊娠相關疾病中腸道菌群多樣性的改變會引起機體免疫異常。妊娠屬于促炎和抗炎相互平衡的過程,這一結果在一定程度上說明流產組中可能出現促炎/抗炎過程的失衡,而這可能是導致母馬流產的發生原因之一[21]。同樣通過LEfSe分析對兩組間的標志性腸道菌群進行了篩查。結果顯示,流產組的特征性物種包括放線菌屬、放線菌門、放線菌綱、棒狀桿菌科、棒狀桿菌屬、嗜胨菌屬、嗜胨菌科;健康組的特征性物種為乳桿菌科。
最近的研究表明,微生物群與妊娠并發癥之間可能存在聯系[38-39]。為了進一步確定流產組和健康組陰道和腸道菌群功能基因可能涉及的生物學過程,使用PICURSt軟件,比對KEGG數據庫進了相關功能預測,并使用R對相關菌群和相關代謝途徑進行相關性分析。結果發現,在發生流產的母馬腸道中出現流產致病菌的定植,變形桿菌等致病菌的比例升高,擬桿菌門和厚壁菌門的比例降低。短鏈脂肪酸乙酸、丙酸和丁酸是由腸道內的微生物發酵產生的[40]。而丁酸可以促進細胞內的平衡,調節促炎因子的產生,其抗炎特性可增強機體的特異性免疫[41]。另外,陰道菌群可能是維持局部免疫平衡的因素,菌群的失衡可能誘導陰道上皮的抗炎反應,從而導致免疫應答下降。陰道菌群同樣可以參與機體免疫中,并可能通過調節免疫平衡、影響黏膜屏障功能和細胞因子變化等途徑在機體生殖健康中發揮重要作用[26]。
本試驗中,相對于健康母馬腸道,流產母馬腸道中產丁酸鹽的細菌數量減少,其中,包括厚壁菌門中的梭菌屬(Clostridium_XlVa)、瘤胃球菌屬(Ruminococcus)等產丁酸鹽的益生菌豐度有下降趨勢,提示可以認為腸道菌群特征可能與病情有關。本研究發現,流產母馬腸道中代謝相關通路與陰道中疾病的發生相關通路有較高的相關性。另外,腸道中免疫疾病與陰道中免疫系統也存在正相關,提示腸道中代謝功能的紊亂可能會引發陰道某些疾病的發生。腸道微生物對于妊娠的影響可能來自于妊娠時腸道微生物向母體子宮的定植,但細菌轉移的方式目前仍有待研究[42]。本試驗中,在陰道微生物發現與腸道微生物中重疊菌群后,腸道菌群被認為是可能的宮內感染來源。腸道功能異常可通過細菌異位引起疾病的發生[43]。綜上所述,陰道及腸道菌群高度參與宿主疾病的發生與免疫的過程。在妊娠時,菌群的代謝可能起溝通腸道與陰道菌群和宿主免疫的橋梁作用,陰道和腸道菌群的變化可能是流產等相關疾病發生的原因之一[26]。
在檢測方面,郭奎等[44]利用獲得的可溶性ompA3蛋白,成功建立了ELISA抗體檢測方法,并證實了該方法具有良好的特異性以及沙門菌屬的廣譜適用性,可以作為馬流產沙門菌病的通用型診斷方法。劉香等[45]針對FliC基因和invA基因建立了馬流產沙門菌雙重PCR診斷方法,對提高馬流產沙門菌檢測效率和推動馬場對該菌的凈化具有積極意義。
馬流產疾病的發生對馬產業造成很大的經濟損失,環境因素、飼養管理、細菌性因素等均可引起馬屬動物的流產,其中,細菌性流產占主要部分[46-47]。總的來說,有研究表明意大利中部馬流產沙門菌引起的流產暴發病例中運用新一代佐劑(MontanideTM Seppic IMS 1313)替代氫氧化鋁,并對感染提供了高保護滴度[48]。另外,俄羅斯學者為了防止沙門菌誘導的馬流產,已經開發了一種基于馬流產BN-12菌株的滅活疫苗,并將枯草芽胞桿菌 TNP-3 菌株濾液用作免疫調節劑[49]。在國內,胡哲等[50]以我國當前流行的馬流產沙門菌的分離株作為候選疫苗株,研制了馬流產沙門菌馬源株滅活疫苗,免疫保護率高。
4 結 論
母馬陰道及腸道菌群高度參與了流產疾病的發生與免疫的過程,本試驗結果表明,馬屬動物的流產可能是由沙門氏菌、馬鏈球菌獸疫亞種等致病菌引起的,妊娠母馬陰道乳桿菌豐度的增加和病原菌及雜菌的減少可能是妊娠母馬為降低細菌感染和流產發生率的一種自我保護機制。腸道中的氨基酸代謝與碳水化合物代謝與陰道中疾病相關通路有較高的相關性,提示腸道的代謝物會影響陰道疾病的產生與發展。在妊娠時,菌群的代謝途徑可能起溝通腸道與陰道菌群和宿主免疫的橋梁作用,陰道菌群中厚壁菌門和放線菌門及腸道菌群中Arcanobacterium hippocoleae和Streptococcus infantarius與流產相關的變形菌門呈負相關。沙門菌可能是造成馬流產的主要致病菌,并且變形菌門、嗜胨菌屬、彎曲桿菌屬可能是發生流產的陰道菌群生物標志物。以上結論可推測陰道及腸道菌群高度參與了宿主疾病的發生與免疫的過程,菌群的代謝途徑起溝通腸道與陰道菌群和宿主免疫的橋梁作用,本研究解析了母馬流產與陰道和腸道菌群變化的相關性,即陰道和腸道菌群變化與流產的發生密切相關,研究結果可為后期開展防治馬屬動物的流產疾病提供理論基礎。
參考文獻(References):
[1] 姚新奎, 韓國才. 馬生產管理學[M]. 北京: 中國農業大學出版社, 2008.
YAO X K, HAN G C. Equine production management[M]. Beijing: China Agricultural University Press, 2008. (in Chinese)
[2] SNIDER T A. Reproductive disorders in horses[J]. Vet Clin North Am Equine Pract, 2015, 31(2):389-405.
[3] CANISSO I F, SEGABINAZZI L G T, FEDORKA C E. Persistent breeding-induced endometritis in mares-a multifaceted challenge:from clinical aspects to immunopathogenesis and pathobiology[J]." Int J Mol Sci, 2020, 21(4):1432.
[4] TRAUB-DARGATZ J L, SALMAN M D, VOSS J L. Medical problems of adult horses, as ranked by equine practitioners[J]. J Am Vet Med Assoc, 1991, 198(10):1745-1747.
[5] TROEDSSON M H T. Uterine clearance and resistance to persistent endometritis in the mare[J]. Theriogenology, 1999, 52(3):461-471.
[6] K?HNE M, KUHLMANN M, T?NIEN A, et al. Diagnostic and treatment practices of equine endometritis-a questionnaire[J]. Front Vet Sci, 2020, 7:547.
[7] WANG H, LIU K J, SUN Y H, et al. Abortion in donkeys associated with Salmonella abortus equi infection[J]. Equine Vet J, 2019, 51(6):756-759.
[8] MADIC′ J, HAJSIG D, SOSTARI B, et al. An outbreak of abortion in mares associated with Salmonella abortusequi infection[J]. Equine Vet J, 1997, 29(3):230-233.
[9] BUIGUES S, IVANISSEVICH A, VISSANI M A, et al. Outbreak of Salmonella abortus equi abortion in embryo recipient polo mares[J]. J Equine Vet Sci, 2012, 32(10):S69-S70.
[10] DI GENNARO E E, GUIDA N, FRANCO P G, et al. Infectious abortion caused by Salmonella enterica subsp enterica serovar Abortusequi in Argentina[J]. J Equine Vet Sci, 2012, 32(10 Suppl):S74.
[11] 郭 奎, 王 寧, 王金慧, 等. 馬流產沙門氏菌的分離鑒定及其微量凝集抗體檢測方法的建立與應用[J]. 中國農業科學, 2020, 53(10):2112-2121.
GUO K, WANG N, WANG J H, et al." Establishment and preliminary application of microagglutination detection method for Salmonella abortus equi[J]." Scientia Agricultura Sinica, 2020, 53(10):2112-2121. (in Chinese)
[12] 楊 康. 馬流產沙門氏菌新疆分離株鑒定免疫及其FliC蛋白增強SeM蛋白及gD蛋白抗體應答的研究[D]. 烏魯木齊:新疆農業大學, 2016.
YANG K. Study on the identification and immunization of Salmonella abortus equi isolated from Xinjiang and its FliC protein enhance effect on the humoral immune response of recombinant protein SeM and gD[D]. Urumqi:Xinjiang Agricultural University, 2016. (in Chinese)
[13] STRITOF Z, HABUS J, GRIZELJ J, et al. Two outbreaks of Salmonella abortusequi abortion in mares in Croatia[J]. J Equine Vet Sci, 2016, 39 Suppl:S63.
[14] NIWA H, HOBO S, KINOSHITA Y, et al. Aneurysm of the cranial mesenteric artery as a site of carriage of Salmonella enterica subsp. enterica serovar Abortusequi in the horse[J]. J Vet Diagn Invest, 2016, 28(4):440-444.
[15] SROKA-OLEKSIAK A, GOSIEWSKI T, PABIAN W, et al. Next-generation sequencing as a tool to detect vaginal microbiota disturbances during pregnancy[J]. Microorganisms, 2020, 8(11):1813.
[16] BAYAR E, BENNETT P R, CHAN D, et al. The pregnancy microbiome and preterm birth[J]. Semin Immunopathol, 2020, 42(4):487-499.
[17] KUMAR M, MURUGESAN S, SINGH P, et al. Vaginal microbiota and cytokine levels predict preterm delivery in Asian women[J]. Front Cell Infect Microbiol, 2021, 11:639665.
[18] KARAER A, DOGˇAN B, GNAL S, et al. The vaginal microbiota composition of women undergoing assisted reproduction:a prospective cohort study[J]. Bjog, 2021, 128(13):2101-2109.
[19] DE SIENA M, LATERZA L, MATTEO M V, et al. Gut and reproductive tract microbiota adaptation during pregnancy:new insights for pregnancy-related complications and therapy[J]. Microorganisms, 2021, 9(3):473.
[20] ZHANG Y X, CHEN S, CHEN X F, et al. Association between vaginal Gardnerella and tubal pregnancy in women with symptomatic early pregnancies in China:a nested case-control study[J]. Front Cell Infect Microbiol, 2022, 11:761153.
[21] 張瑩軒. 自然流產菌群特征及補腎安胎法干預流產菌群-代謝物-免疫調節的研究[D]. 廣州:廣州中醫藥大學, 2021.
ZHANG Y X. The characteristics of vaginal and gut microbiome in spontaneous abortion women and effect of Modified Shoutai Wan on microbiome-metabolites-immune regulation[D]. Guangzhou:Guangzhou University of Chinese Medicine, 2021. (in Chinese)
[22] TILG H, MOSCHEN A R. Microbiota and diabetes:an evolving relationship [J]. Gut, 2014, 63(9):1513-1521.
[23] ZHANG Y, ZHANG H P. Microbiota associated with type 2 diabetes and its related complications[J]. Food Sci Hum Well, 2013, 2(3/4):167-172.
[24] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nat Methods, 2010, 7(5):335-336.
[25] SEGATA N, IZARD J, WALDRON L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biol, 2011, 12(6):R60.
[26] RALPH S G, RUTHERFORD A J, WILSON J D. Influence of bacterial vaginosis on conception and miscarriage in the first trimester:cohort study[J]. BMJ, 1999, 319(7204):220-223.
[27] VAN OOSTRUM N, DE SUTTER P, MEYS J, et al. Risks associated with bacterial vaginosis in infertility patients:a systematic review and meta-analysis[J]. Hum Reprod, 2013, 28(7):1809-1815.
[28] AL-MEMAR M, BOBDIWALA S, FOURIE H, et al. The association between vaginal bacterial composition and miscarriage:a nested case-control study[J]. BJOG:An Int J Obstetr Gynaecol, 2020, 127(2):264-274.
[29] MOR G, KWON J Y. Trophoblast-microbiome interaction:a new paradigm on immune regulation[J]. Am J Obstetr Gynecol, 2015, 213(4):S131-S137.
[30] GELLERSEN B, BROSENS J J. Cyclic decidualization of the human endometrium in reproductive health and failure[J]. Endocr Rev, 2014, 35(6):851-905.
[31] GELLERSEN B, BROSENS I A, BROSENS J J. Decidualization of the human endometrium:mechanisms, functions, and clinical perspectives[J]." Semin Reprod Med, 2007, 25(6):445-453.
[32] R?NNQVIST P D J, FORSGREN-BRUSK U B, GRAHN-HKANSSON E E. Lactobacilli in the female genital tract in relation to other genital microbes and vaginal pH[J]. Acta Obstetr Gynecol Scand, 2006, 85(6):726-735.
[33] ALDUNATE M, SRBINOVSKI D, HEARPS A C, et al. Antimicrobial and immune modulatory effects of lactic acid and short chain fatty acids produced by vaginal microbiota associated with eubiosis and bacterial vaginosis[J]. Front Physiol, 2015, 6:164.
[34] PRINCE A L, CHU D M, SEFEROVIC M D, et al. The perinatal microbiome and pregnancy:moving beyond the vaginal microbiome[J]. Cold Spring Harbor Perspect Med, 2015, 5(6):a023051.
[35] KOREN O, GOODRICH J K, CULLENDER T C, et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy [J]. Cell, 2012, 150(3):470-480.
[36] 孫 璐, 李一卉, 袁慶新. 妊娠期糖尿病與腸道菌群關系的研究進展[J]. 中國臨床醫學, 2018, 25(1):141-146.
SUN L, LI Y H, YUAN Q X. Research progresses of the relationship between gestational diabetes mellitus and intestinal flora[J]. Chinese Journal of Clinical Medicine, 2018, 25(1):141-146. (in Chinese)
[37] 童昆周, 白文彬, 田楓嵐, 等. 馬流產沙門氏桿菌C系弱毒菌苗的研究[J]. 中國農業科學, 1980(1):80-89.
TONG K Z, BAI W B, TIAN F L, et al. Studies on a live attenuated vaccine against paratyphoid equine abortion[J]. Scientia Agricultura Sinica, 1980(1):80-89. (in Chinese)
[38] GUZZARDI, M A, EDERVEEN T H A, RIZZO F, et al. Maternal pre-pregnancy overweight and neonatal gut bacterial colonization are associated with cognitive development and gut microbiota composition in pre-school-age offspring[J]. Brain Behav Immun, 2022, 100, 311-320.
[39] MOLINA-VEGA M, PICóN-CéSAR M J, GUTIéRREZ-REPISO C, et al. Metformin action over gut microbiota is related to weight and glycemic control in gestational diabetes mellitus:a randomized trial[J]. Biomed Pharmacother, 2022, 145:112465.
[40] LOUIS P, FLINT H J. Formation of propionate and butyrate by the human colonic microbiota[J]. Environ Microbiol, 2017, 19(1):29-41.
[41] 周海燕, 史俊奇, 裴 宇, 等. 濕疹兒童腸道菌群特征及與病情的相關性[J]. 中國婦幼保健, 2023, 38(14):2570-2573.
ZHOU H Y, SHI J Q, PEI Y, et al. Characteristics of intestinal flora in children with eczema and its correlation with disease[J]. Maternal and Child Health Care of China, 2023, 38(14):2570-2573. (in Chinese)
[42] COLLADO M C, RAUTAVA S, AAKKO J, et al. Human gut colonisation may be initiated in utero by distinct microbial communities in the placenta and amniotic fluid[J]. Sci Rep, 2016, 6(1):23129.
[43] CHEN X, LI P, LIU M, et al. Gut dysbiosis induces the development of pre-eclampsia through bacterial translocation[J]. Gut, 2020, 69(3):513-522.
[44] 郭 奎, 張澤楠, 李帥杰, 等. 致馬屬動物流產沙門氏菌通用型間接ELISA抗體檢測方法的建立與應用[J]. 中國農業科學, 2023, 56(12):2421-2430.
GUO K, ZHANG Z N, LI S J, et al. Development and application of a universal iELISA antibody assay for abortion-causing Salmonella in equidae[J]. Scientia Agricultura Sinica, 2023, 56(12):2421-2430. (in Chinese)
[45] 劉 香, 梁佳平, 張 燦, 等. 馬流產沙門菌雙重PCR檢測方法的建立[J]. 中國獸醫科學, 2023, 53(3):292-297.
LIU X, LIANG J P, ZHANG C, et al." Establishment of a duplex PCR method for detection of Salmonella abortus equi[J]. Chinese Veterinary Science, 2023, 53(3):292-297. (in Chinese)
[46] 李玉學. 群牧母馬發生流產的原因及防制措施[J]. 畜牧獸醫科技信息, 2014(4):32-34.
LI Y X. Causes and preventive measures of abortion in herd mares[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2014(4):32-34. (in Chinese)
[47] 王世民, 王彩蝶, 張艷楠, 等. 馬流產沙門菌fimY基因同源性分析及蛋白表達[J]. 動物醫學進展, 2015, 36(6):39-42.
WANG S M, WANG C D, ZHANG Y N, et al. Homology analysis and expression of gene fimY of Salmonella abortus equine[J]. Progress in Veterinary Medicine, 2015, 36(6):39-42. (in Chinese)
[48] STAZI M, PELLEGRINI M, RAMPACCI E, et al. A new MontanideTM Seppic IMS1313-adjuvanted autogenous vaccine as a useful emergency tool to resolve a Salmonella enterica subsp. enterica serovar abortus equi abortion outbreak in mares[J]. Open Vet J, 2022, 12(2):303-307.
[49] NEUSTROEV M P, PETROVA S G. Developmental results of a vaccine against salmonella-induced equine abortion[J]. Russ Agric Sci, 2020, 46(5):530-533.
[50] 胡 哲, 郭 奎, 王金慧, 等. 我國馬、驢流產沙門氏菌病的研究進展[J]. 中國畜牧業, 2022(12):49-50.
HU Z, GUO K, WANG J H, et al. Research progress of Salmonella abortus in horses and donkeys in China[J]. China Animal Industry, 2022(12):49-50. (in Chinese)
(編輯 白永平)

