PPP5C基因調控牛脂肪細胞增殖、分化的功能研究


摘 要: 旨在探究PPP5C基因在牛脂肪細胞增殖、分化過程中的作用。本研究以固原黃牛為研究對象,在牛前體脂肪細胞中進行PPP5C基因功能缺失和功能獲得性試驗,利用qRT-PCR、EdU、CCK-8和流式細胞術檢測候選標志基因的mRNA表達水平和細胞增殖活力,甘油三酯(TG)檢測、油紅O、BODIPY和Nile red染色結果為脂肪細胞分化過程中脂滴蓄積情況提供表型數據支撐。結果表明,相比對照組,干擾PPP5C基因顯著上調增殖標志基因(CDK1、CDK2和PCNA)mRNA表達量(Plt;0.01),細胞活力顯著上升(Plt;0.01),促進牛前體脂肪細胞從S期向G2期的轉變(Plt;0.01)。研究結果也提示,PPP5C可能也在牛前體脂肪分化過程中發揮負調控作用。主要表現在干擾PPP5C基因后,顯著上調成脂標志基因(PPARγ、C/EBPα和FABP4)的mRNA表達(Plt;0.01),脂肪細胞中TG含量顯著增多(Plt;0.01)。同時,油紅O、BODIPY和Nilered染色的細胞表型數據結果提示干擾PPP5C會促進牛前體脂肪細胞分化,脂滴蓄積增多。而PPP5C基因的功能獲得性試驗結果恰好與之相反。綜上,干擾PPP5C基因后促進牛前體脂肪細胞增殖和分化,過表達PPP5C基因后抑制牛前體脂肪細胞增殖和分化,提示PPP5C基因可能在牛前體脂肪細胞增殖和分化過程中作為負調控因子發揮作用。本研究為進一步探究PPP5C基因調控牛脂肪沉積分子機制提供基礎數據。
關鍵詞: PPP5C;牛;前體脂肪細胞;分化;增殖;流式細胞術
中圖分類號:S823.2
文獻標志碼:A
文章編號:0366-6964(2024)10-4391-12
收稿日期:2024-03-25
基金項目:國家自然科學基金項目(U22A20506;32072720);寧夏回族自治區重點研發計劃項目(2023BCF01006;2021BEF01002);自治區科技創新領軍人才培養項目(2020GKLRLX02)
作者簡介:馮 蘭(1990-) ,女,寧夏吳忠人,碩士生,主要從事肉牛遺傳育種研究,E-mail: 15202683541@163.com
*通信作者:馬 云,主要從事生物技術與牛的生產和遺傳改良,E-mail: mayun@nxu.edu.cn
Study on the Function of PPP5C Gene in Regulating the Proliferation and Differentiation
of Bovine Adipocytes
FENG" Lan1, FENG" Xue1, MA" Yulin1, ZHANG" Lingkai1, MA" Yanfen1, WEI" Dawei1, LI" Fen2, ZHANG" Lupei3, YANG" Runjun4, MA" Yun1*, CAI" Bei1*
(1.Key Laboratory of Ruminants Molecular Cell Breeding,College of Animal Science and Technology, Ningxia University, Yinchuan 750021, China;
2.School of Food Science and Engineering, Ningxia University, Yinchuan 750021, China;
3.Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
4.College of Animal Science, Jilin University, Changchun 130000, China)
Abstract:" The aim of this study was to investigate the role of PPP5C gene in the proliferation and differentiation of bovine adipocytes. Loss-of-function and gain-of-function experiments of PPP5C gene were performed in precursor adipocytes of Guyuan cattle. mRNA expression levels of marker genes and cell proliferation viability were detected using qRT-PCR, EdU, CCK-8 and flow cytometry. The results of TG assay, Oil Red O, BODIPY and Nile red staining provided phenotypic data support of lipid droplets accumulation during adipocytes differentiation. The results showed that, compared with the control group, interfering with the PPP5C gene significantly up-regulated the mRNA expression of proliferation marker genes (CDK1, CDK2, and PCNA) (Plt;0.01), and cell viability was significantly increased (Plt;0.01), which facilitated the transition of bovine precursor adipocytes from the S-phase to the G2-phase (Plt;0.01). The results also suggested that PPP5C might also play a negative regulatory role in bovine precursor adipose differentiation. This was mainly manifested in the significant up-regulation of mRNA expression of lipogenic marker genes (PPARγ, C/EBPα, and FABP4) (Plt;0.01) and the significant increase of TG content in adipocytes (Plt;0.01) after interfering with the PPP5C gene. Meanwhile, the results of cellular phenotypic data of Oil Red O, BODIPY and Nilered staining suggested that interfering with PPP5C promoted bovine precursor adipocyte differentiation and increased lipid droplet accumulation. The results of functional acquisition experiments with the PPP5C gene were just the opposite. In summary, interfering with the PPP5C gene promotes bovine precursor adipocyte proliferation and differentiation, and overexpression of the PPP5C gene inhibits bovine precursor adipocyte proliferation and differentiation, suggesting that the PPP5C gene may play a role as a negative regulator in bovine precursor adipocyte proliferation and differentiation. This study provides basic data for further investigation of the molecular mechanism of PPP5C gene in regulating bovine fat deposition.
Key words: PPP5C; bovine; precursor adipocytes; differentiation; proliferation; flow cytometry
*Corresponding author: MA Yun, E-mail: mayun@nxu.edu.cn
脂肪沉積和脂肪酸代謝是一個復雜而又高度協調的基因表達程序,涉及前體脂肪細胞的增殖、分化和成熟,目前已經發現了大量基因參與調控這一形成過程,這些調節過程中所涉及的重要調控因子主要包括糖皮質激素、各種細胞因子、胰島素、脂聯素和瘦素,以及對脂肪細胞分化的調控起著至關重要作用的轉錄因子PPARy、C/EBPs和SREBP-1c等[1-3]。
PPP5C基因是PPP家族的一種蛋白磷酸酶,有研究證明干擾PPP5C導致Dvl2磷酸化在基礎水平和Wnt刺激后均升高[4]。PPP5C基因與多種應激蛋白相互作用,包括凋亡信號調節激酶1(ASK1)、熱休克蛋白-90(HSP-90)和HSP-90合子復合蛋白(糖皮質激素受體[GR]、STIP1、CDC37)等[5-7]。PPP5C基因在物種間具有高度保守性[8](在氨基酸水平上,牛和人類約98%、與小鼠具有99%以上的同一性)(NCBI保守型檢測),表明PPP5C的作用在哺乳動物中是保守的。本課題組前期測序結果顯示,該基因在固原黃牛中的表達量高于和牛和中國西門塔爾牛。從功能上講,PPP5C已被證實是激素和應激相關信號傳導的重要調節劑[9-10],參與多種信號傳導途徑,包括細胞周期控制和細胞生長[11],同時,PPP5C基因還被發現與肥胖和胰島素存在密切關系,例如,敲低PPP5C可防止高脂飲食(HFD)引起的小鼠體重增加[8]。然而,截止目前PPP5C基因對牛脂肪沉積的作用尚不明晰。因此,本研究通過進行PPP5C功能獲得和缺失試驗,采用qRT-PCR、CCK-8、EdU、流式細胞術、TG檢測、油紅O、BODIPY和Nile red染色方法探究PPP5C基因在牛脂肪細胞增殖和分化過程中發揮的作用,以期為進一步探究其對牛脂肪沉積的分子機制提供參考。
1 材料與方法
1.1 牛脂肪組織采集與細胞分離
本試驗中使用的細胞取自固原黃牛健康公犢(1周齡)皮下脂肪細胞,利用高糖DMEM培養基,添加1%青鏈霉素和10%胎牛血清(FBS)培養。
1.2 主要試劑
胎牛血清(PAN,德國)、高糖DMEM(BI,以色列)、胰酶(HyClone,美國)、青鏈霉素雙抗(HyClone,美國)、2×M5HiPerSYBRPremixEsTaq(聚合美,中國);反轉錄試劑盒(TaKaRa公司,日本);CCK-8試劑(蘭博利德,中國);EDU增殖檢測試劑盒(碧云天,中國)、TG測試盒(建成,中國);細胞周期與凋亡檢測試劑盒(碧云天,中國)。
1.3 牛前體脂肪細胞分離培養及誘導分化
本試驗采用組織塊法分離培養牛前體脂肪細胞。
組織塊法:將剔除表皮、筋膜、血管的脂肪組織用PBS溶液(含1%青鏈霉素)清洗2次后,剪成1 mm3大小的脂肪塊;依據一定密度接種于9 cm皿中,37℃倒置培養6 h,向皿中加入10 mL培養基(貼壁,不可晃動),37℃,5% CO2環境中進行培養,并定期觀察。大概長到5 d的時候細胞出現,8 d左右挑出組織塊,進行清洗消化傳代凍存。
獲得的細胞融合度達到90%以上時,將培養基更換為誘導分化培養基(地塞米松、IBMX、胰島素、羅格列酮、雙抗、高糖DMEM),2 d后,棄去誘導分化培養基,加維持培養基(胰島素、羅格列酮、雙抗、高糖DMEM),每2 d換液1次并收集一批細胞。誘導8 d后,收獲最后一批細胞,用于qRT-PCR分析。
1.4 PPP5C siRNA的合成和轉染
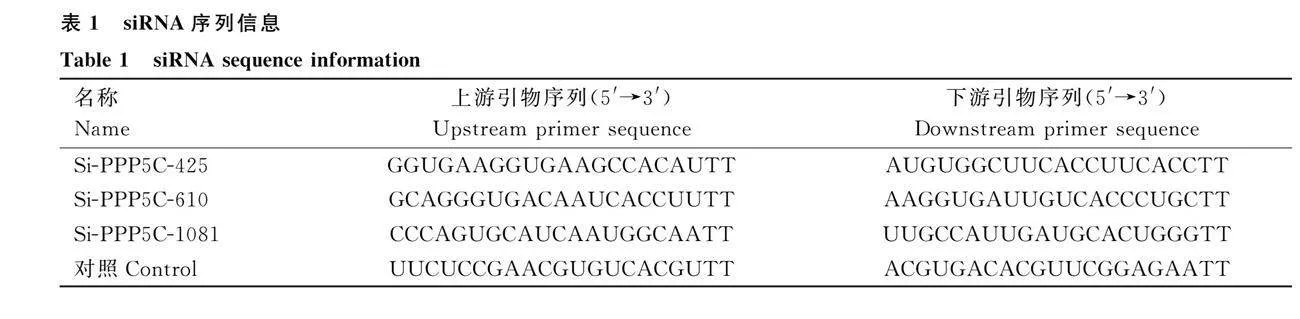
由上海生工合成3條針對牛PPP5C基因的siRNA和1條陰性對照(表1)。當前體脂肪細胞匯合度達70%~80%左右時,換成opti/DMEM培養基進行培養,并利用LipofectamineTM 3000試劑進行siRNA的轉染,轉染后6 h換為生長培養基培養。
細胞轉染:當脂肪細胞融合度達到90%以上時進行消化,計數后將每組細胞配成1.0×105個·mL-1后,六孔板中每孔加入2 mL的無抗培養基,每孔鋪130 μL細胞,于37℃,5% CO2培養箱中培養過夜;12~20 h后,觀察細胞的融合率達到70%~90%左右進行轉染;配制質粒和轉染試劑稀釋液,干擾片段體系,A液:100 μL opti+3.75 μL Lipo3000;B液:100 Ml opti+7 μL NC/si;過表達體系,A液:100 μL opti+3.75 μL Lipo3000;B液:100 μL opti+4 μL P3000+2 500(ng)/質粒(ng·μL-1)。各體系轉染試劑混勻,常溫孵育5 min;A液轉入B液混勻,常溫靜置15 min;轉入先提前加入1 000 μL opti/DMEM的6孔板中,6 h后換成完全培養基,轉染48 h后,利用TRIZOL收取細胞,直接使用進行下一步試驗或者-80℃冰箱保存備用。
1.5 細胞RNA提取及反轉錄
收取細胞后離心,棄去上清,然后每孔加200 μL氯仿,劇烈振蕩混勻1 min,冰上靜置2 min,循環10 min;4℃離心機,12 000 r·min-1離心15 min;吸取上清至新的1.5 mL無酶EP管中,加入等體積預冷的異丙醇,輕度混勻1 min,冰上靜置2 min,循環10 min;4℃,12 000 r·min-1離心10 min后,棄掉上清液;4℃預冷的75%乙醇(含DEPC水)洗滌,4 ℃,12 000 r·min-1離心5 min,循環兩遍,棄去上清,冰上放置15~30 min,先添加20~60 μL RNase-free水,等待充分溶解后,測定RNA的濃度與吸光值,-80℃冰箱保存備用。
總RNA反轉錄操作參照反轉錄試劑盒(TaKaRa)進行。
1.6 實時熒光定量PCR
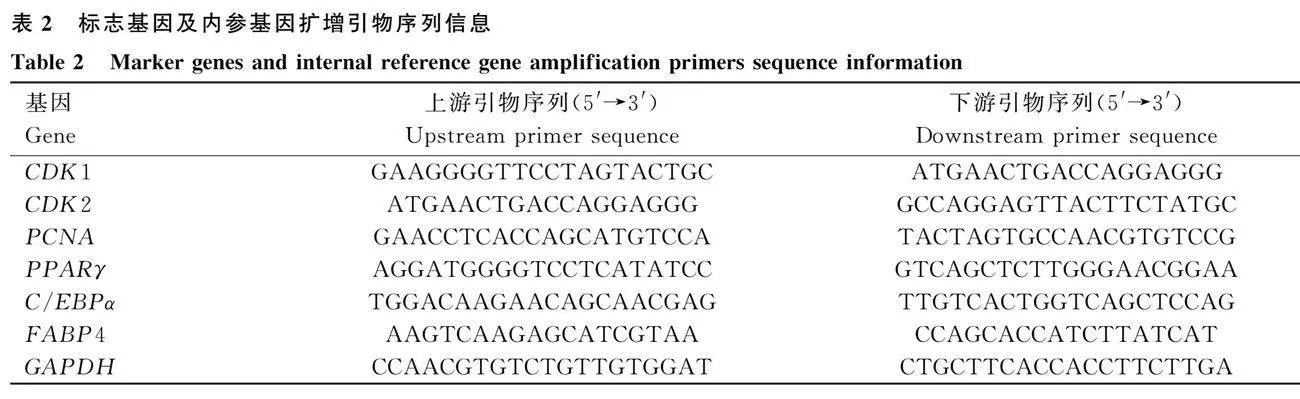
引物使用NCBI在線網站和Primer6.0相結合設計,脂肪細胞增殖(CDK1、CDK2和PCNA)和脂肪細胞分化(PPARγ、CEBPα和FABP4)標志基因及內參引物序列見表2。
1.7 細胞增殖測定
使用CCK-8方法對細胞的增殖能力進行定量分析,具體步驟如下:細胞經過消化作用、重懸和計數后,鋪于96孔板上,細胞貼壁后,根據分組進行對應處理,在每個檢測時間點(0、6、12、24、36和48 h)棄上清,加入CCK-8試劑10 μL于每孔中,經過1 h后,用酶標儀檢測450 nm OD值。
1.8 EdU檢測
牛脂肪細胞轉染 48 h 后棄去培養液,將已預熱的EdU工作液(EdU工作液∶培養基=1∶1)加入培養板中,孵育6 h。棄培養液,加入適量固定液,室溫條件下固定15 min。根據EdU試劑盒操作說明進行洗滌、通透,最后進行 Click 反應和細胞核進行染色,倒置顯微鏡下進行熒光檢測,并拍照記錄。
1.9 TG測定
細胞樣品經PBS清洗后,加入200 μL勻漿介質,并于冰水浴條件下進行超聲破碎。采用TG測定試劑盒(南京建成)檢測處理組與試驗組脂肪細胞中TG含量。計算公式如下:
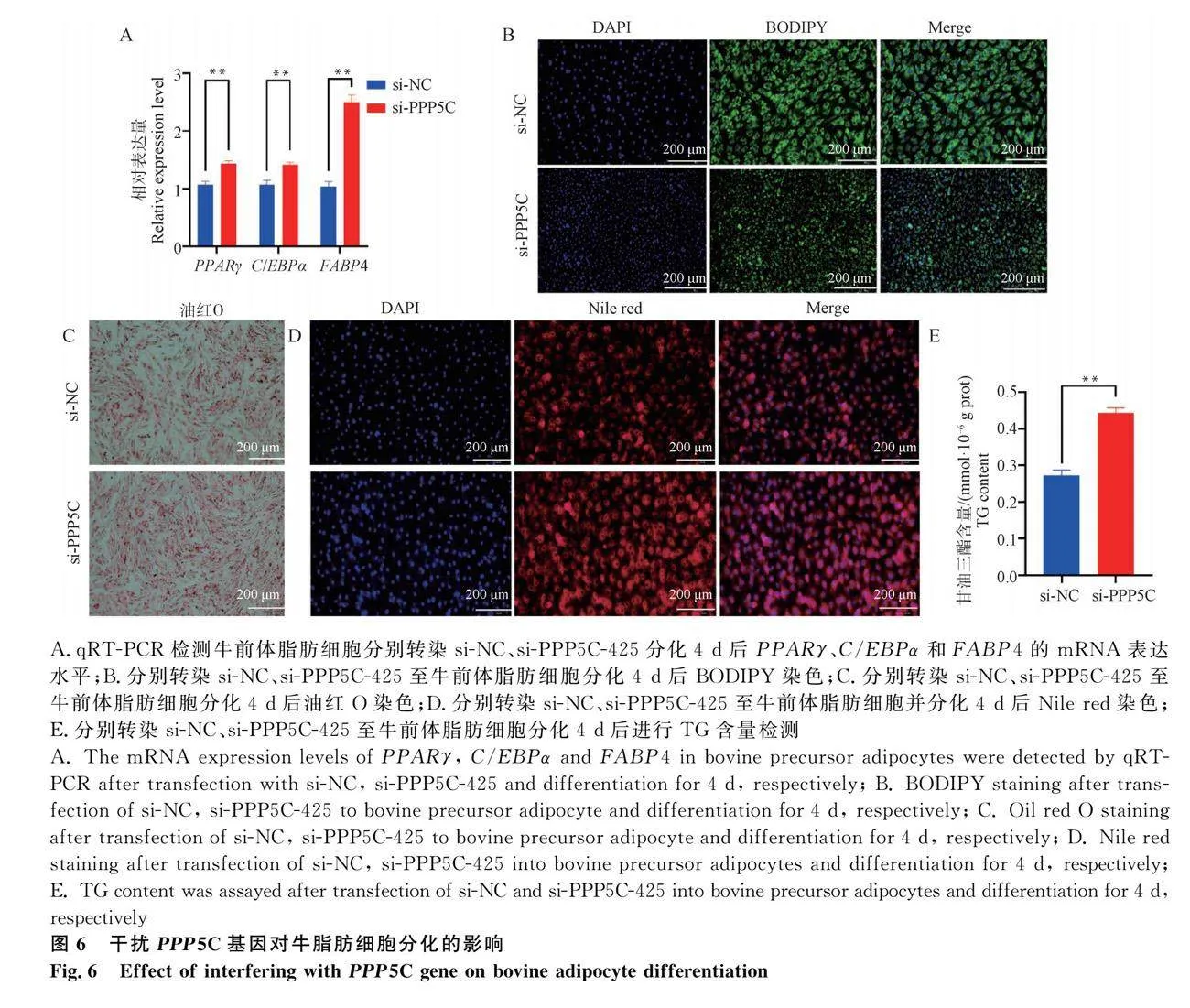
甘油三脂含量(mmol·g-1 pro)=樣本OD值-空白OD值校準OD值-空白OD值×標準品濃度(mmol·L-1)÷細胞數量。
1.10 染色方法
細胞轉染48 h后根據油紅O染色、BODIPY染色、Nile red染色操作說明書分別進行染色,后于倒置熒光顯微鏡下進行成像檢測。
1.11 細胞流式檢測
細胞轉染48 h后,用胰酶消化細胞,加入等體積細胞培養液后1 000 g離心5 min,小心吸取上清后加入1 mL預冷PBS重懸細胞,再次離心沉淀細胞,小心吸取上清,加入1 mL預冷70% 乙醇,輕輕吹打混勻后固定24 h后,用預冷的PBS重懸細胞后吸棄上清后使用0.5 mL碘化丙啶染色液37℃避光孵育30 min,利用流式細胞儀檢測細胞周期(每個處理組有3個重復)。
1.12 統計分析方法
利用2-ΔΔCt法分析qRT-PCR 結果,結果以“平均值±標準差”表示,采用GraphPadPrism9.5.1對試驗數據進行單因素方差分析并作圖,Plt;0.05(*)表示差異顯著;Plt;0.01(**)表示差異極顯著;Pgt;0.05(ns)表示無顯著差異。
2 結 果
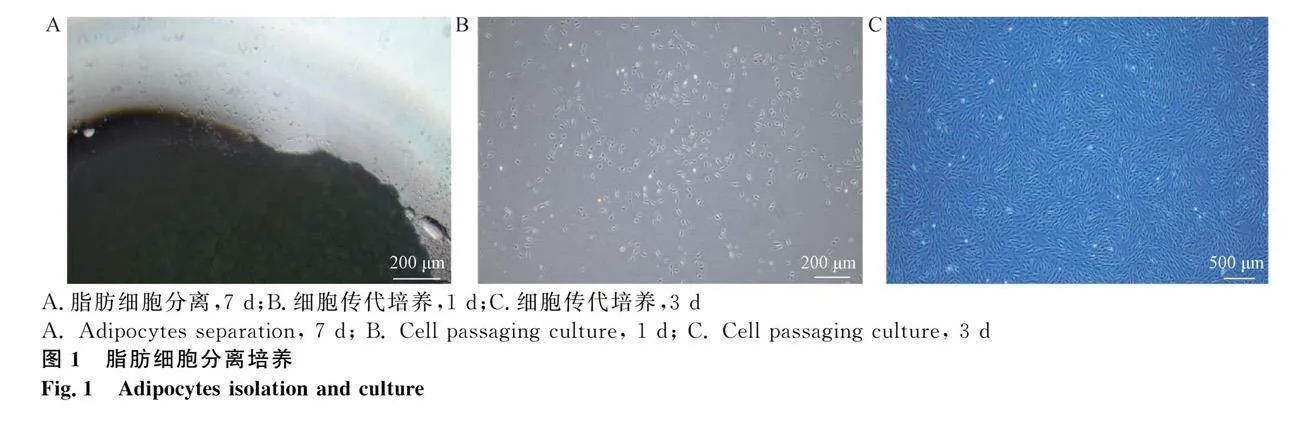
2.1 牛前體脂肪細胞分離培養
利用組織塊法成功分離得到牛脂肪細胞(圖 1A),當細胞生長密度達到80%以上進行傳代培養(圖 1B、C),此時牛脂肪細胞形態良好,形態規則、呈長梭形。
2.2 前體脂肪細胞誘導分化模型的構建
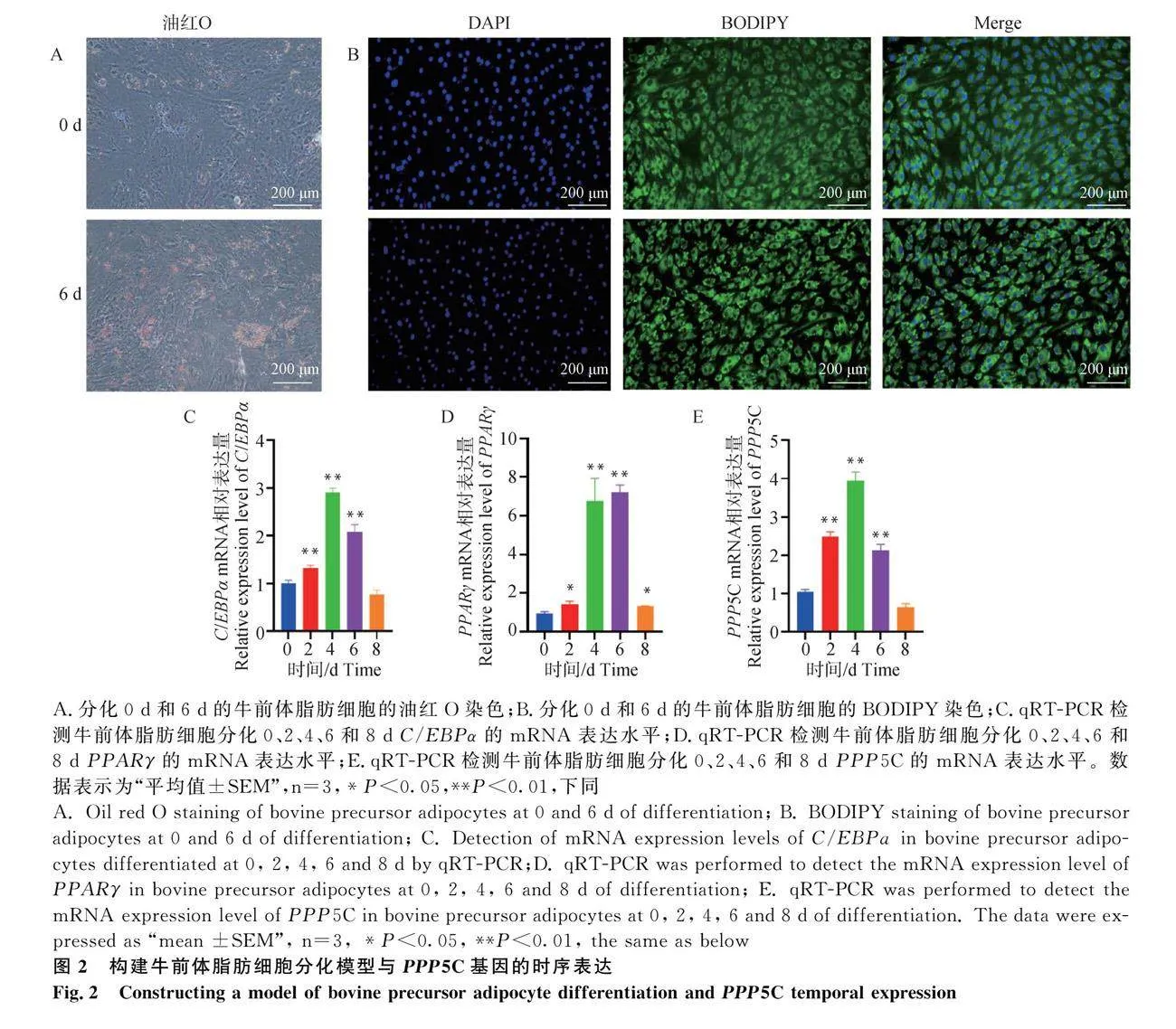
首先,構建牛前體脂肪細胞誘導分化模型。油紅O和BODIPY染色結果表明,相對于分化0 d的前體脂肪細胞,分化6 d后的細胞內脂滴蓄積明顯增多(圖2A,B)。成脂分化標志基因C/EBPα和PPARγ的mRNA表達水平隨著誘導分化時間增加(相對分化0 d),其表達顯著上調(圖2C,D;Plt;0.01)。結果表明,牛前體脂肪細胞誘導分化模型構建成功,模型可用于后續試驗驗證。同時,檢測PPP5C基因在前體脂肪細胞分化過程中的時序表達模式,發現PPP5C在脂肪細胞分化過程中顯著上調,且在分化4 d后的脂肪細胞中表達最高(圖2E;Plt;0.01)。
2.3 PPP5C基因過表達載體的構建、過表達效率以及干擾片段的篩選
由上海生工進行PPP5C基因過表達載體構建,簡單過程即將PPP5C基因CDS區連接到pcDNA3.1載體上,進行雙酶切驗證,凝膠電泳檢測表明pcDNA3.1-PPP5C過表達載體構建成功。qRT-PCR檢測過表達效率結果顯示,相對于OE-NC組,轉染pcDNA3.1-PPP5C過表達質粒后,牛前體脂肪細胞中PPP5C的表達水平顯著上升(圖3A;Plt;0.01)。
將設計的3條siRNA序列轉染至牛前體脂肪細胞中,qRT-PCR檢測結果顯示,相對于si-NC組,3條siRNA片段均使PPP5C基因的表達量顯著下降,其中si-PPP5C-425干擾效果最佳(圖3B;Plt;0.01),因此后續試驗采用si-PPP5C-425進行干擾試驗。
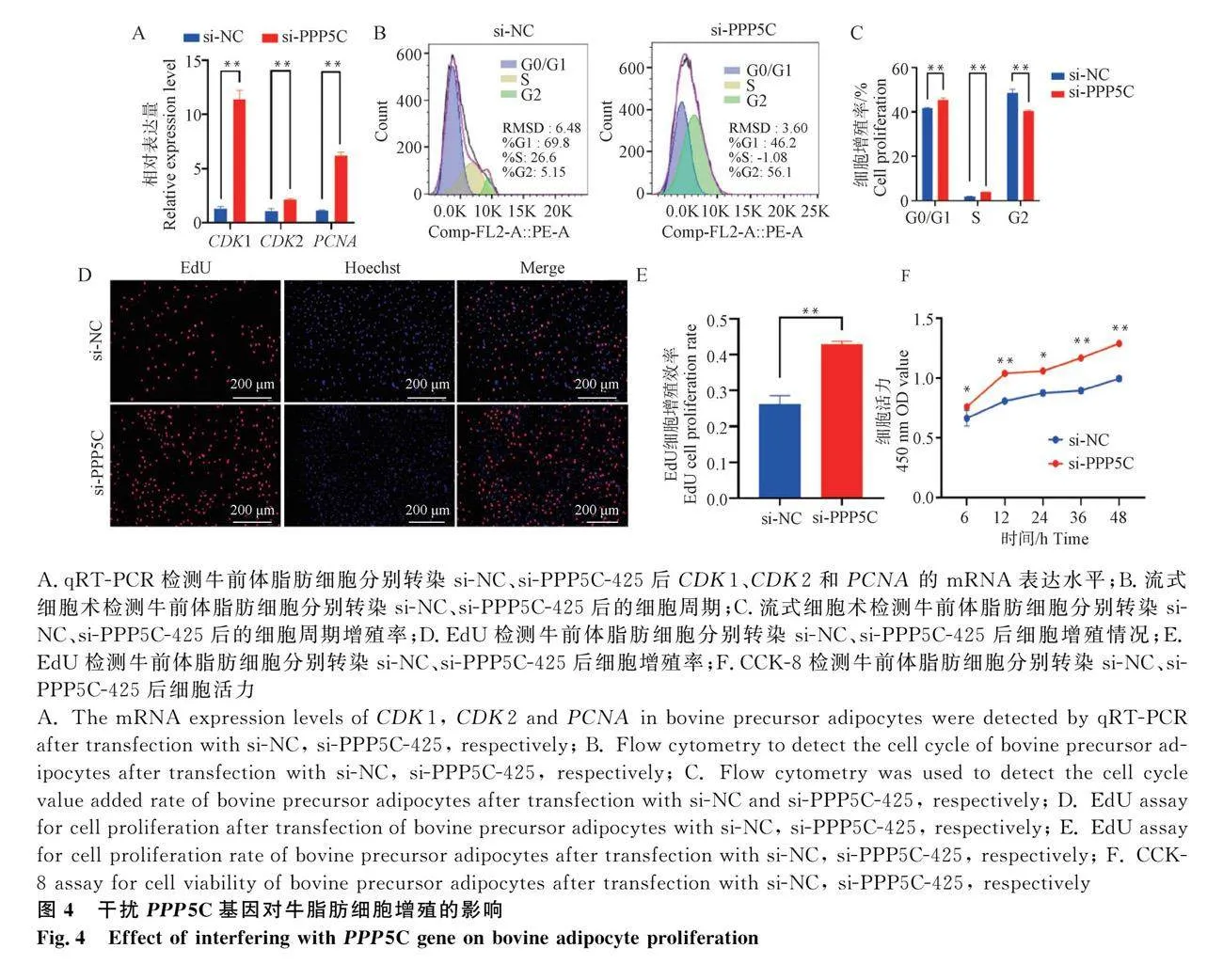
2.4 干擾PPP5C基因調控牛脂肪細胞增殖的作用
通過轉染si-PPP5C-425至細胞中實現PPP5C基因功能缺失,探究PPP5C對牛前體脂肪細胞增殖的影響。qRT-PCR結果表明,與si-NC組相比,干擾PPP5C后導致脂肪增殖標志基因CDK1、CDK2和PCNA的表達量顯著上升(圖4A;Plt;0.01);流式細胞儀檢測細胞周期結果發現,干擾PPP5C基因促進了細胞從S期向G2期轉變(圖4B,C)。EdU染色結果顯示,干擾PPP5C基因后牛脂肪細胞顯著增多(圖4D,E;Plt;0.01);CCK-8檢測細胞活力,結果顯示干擾PPP5C基因后細胞活力顯著增強(圖4F;Plt;0.01)。綜上所述,干擾PPP5C基因后促進牛脂肪細胞的增殖。
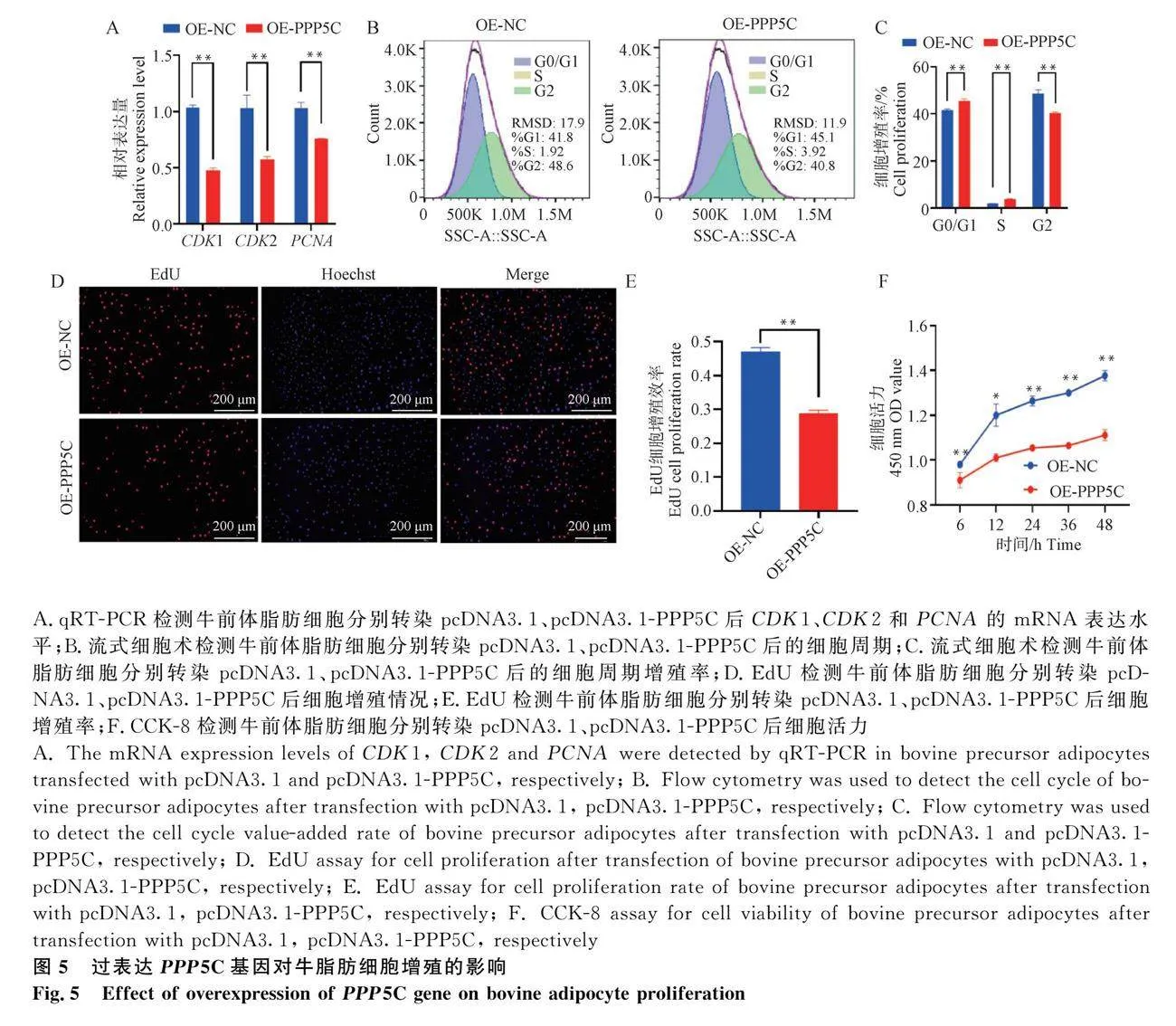
2.5 過表達PPP5C基因調控牛脂肪細胞增殖的作用
通過轉染pcDNA3.1-PPP5C至細胞中實現PPP5C基因功能獲得,探究PPP5C對牛前體脂肪細胞的增殖的影響。qRT-PCR檢測結果表明,相對于pcDNA3.1組,過表達PPP5C顯著下調CDK1、CDK2和PCNA的表達量(圖5A;Plt;0.01)。細胞周期檢測結果發現,過表達PPP5C抑制了細胞從S期向G2期轉變(圖5B ,C;Plt;0.01)。同時,EdU結果顯示,過表達PPP5C基因后牛前體脂肪細胞增殖顯著減少(圖5D,E;Plt;0.01)。CCK-8檢測細胞活力,發現過表達PPP5C基因導致牛脂肪細胞的活力顯著降低(圖5F;Plt;0.01)。綜上,過表達PPP5C基因抑制牛脂肪細胞增殖。
2.6 干擾PPP5C基因對牛脂肪細胞分化的影響
通過轉染si-PPP5C-425至細胞中實現PPP5C基因功能缺失,探究PPP5C對牛前體脂肪細胞的分化的影響。qRT-PCR檢測結果表明,與si-NC組相比,干擾PPP5C后顯著上調脂肪分化標志基因PPARγ、C/EBPα和FABP4的mRNA表達水平(圖6A;Plt;0.01)。BODIPY、油紅O、Nile red染色結果顯示,干擾PPP5C基因明顯促進牛前體脂肪細胞胞質內脂滴蓄積(圖6B,C,D)。同樣,TG含量測定數據與上述結果一致(圖6E;Plt;0.01)。綜上所述,干擾PPP5C基因促進牛前體脂肪細胞的分化。
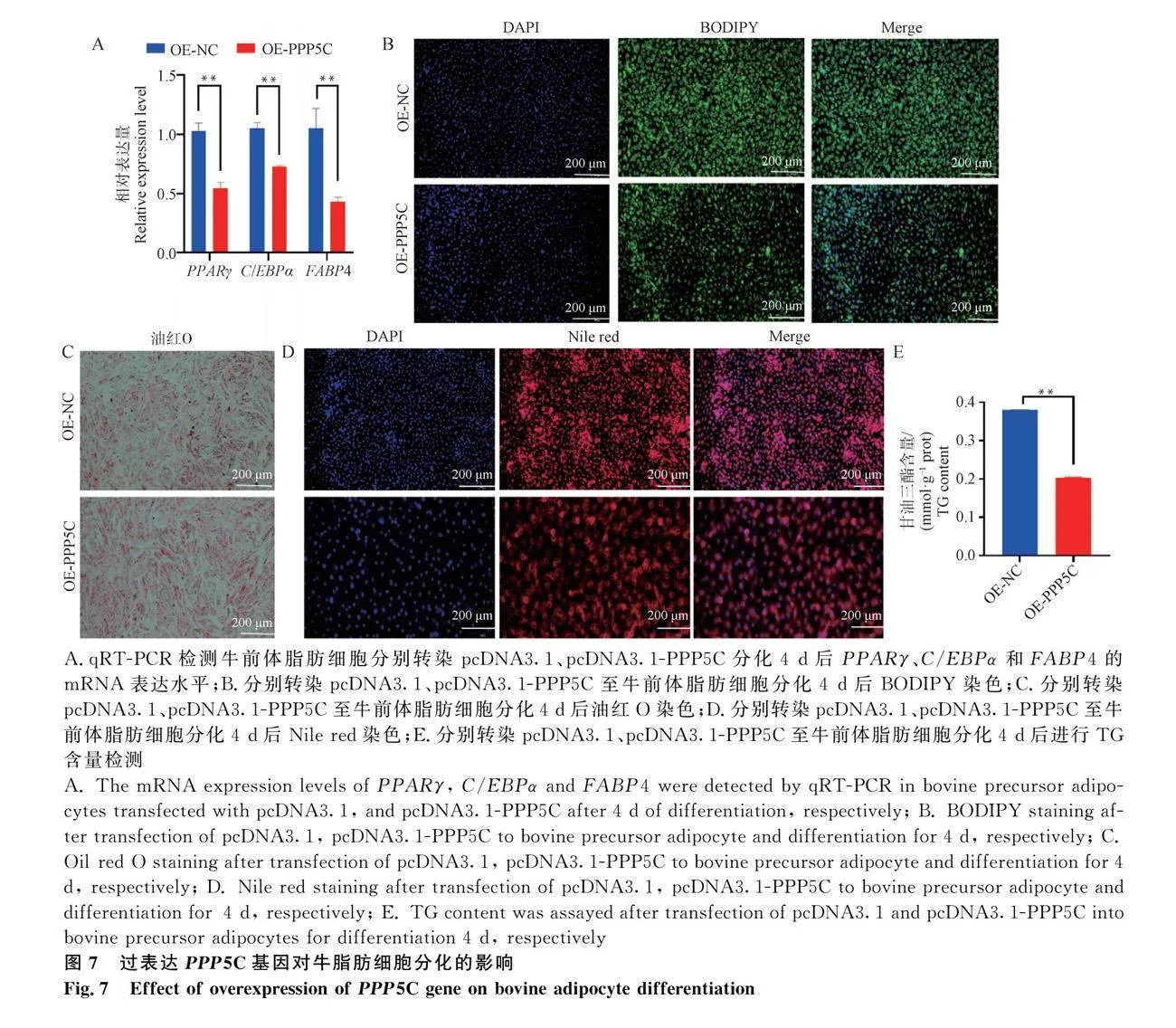
2.7 過表達PPP5C基因對牛脂肪細胞分化的影響
通過轉染pcDNA3.1-PPP5C至細胞中實現PPP5C基因功能獲得,探究PPP5C對牛前體脂肪細胞的分化的影響。結果顯示,相對于pcDNA3.1組,過表達PPP5C顯著下調成脂標志基因PPARγ、C/EBPα和FABP4的mRNA的表達水平(圖7A;Plt;0.01)。BODIPY、油紅O、Nile red染色結果顯示,過表達PPP5C基因明顯下調牛前體脂肪細胞胞質內脂滴蓄積(圖7B,C,D);同樣,TG含量測定數據與上述結果一致(圖7E;Plt;0.01)。綜上所述,過表達PPP5C基因后抑制牛脂肪細胞的分化。
3 討 論
在動物體內,脂肪主要包括內臟脂肪、皮下脂肪、肌間脂肪和肌內脂肪(IMF)[12]。脂肪組織的形成是脂肪細胞數量增加以及體積增大,受轉錄因子和信號通路的精準調控[13]。本研究主要對PPP5C基因在牛脂肪細胞沉積中的作用進行探究。
3.1 PPP5C基因在牛脂肪生成中的作用
脂肪組織是一種復雜且重要的代謝和內分泌器官,主要由前體脂肪細胞發育而來,并以脂質的形式儲存能量。脂肪細胞來源于中胚層中產生的間充質干細胞(MSC),MSC可以分化成多種細胞類型,包括脂肪細胞、肌細胞和成骨細胞等。脂肪生成的初始階段主要涉及脂肪祖細胞向前脂肪細胞的轉化[14],該過程受到多種信號的調節,包括細胞外因子(如成纖維細胞生長因子(FGF)、轉化生長因子β(TGFβ)和細胞外基質 (ECM)等)[15] 。在增殖階段,脂肪細胞的數量顯著增加,并出現一系列激素和生長因子來促進有絲分裂。當增殖的脂肪細胞數量過多而受到抑制時,分化轉錄因子的表達被激活,細胞由梭型變為圓形,細胞內甘油三酯開始大量積累,最終形成脂滴。在脂肪形成的末期,還有一些關鍵的轉錄因子控制前脂肪細胞分化為成熟脂肪細胞,如CAAT/增強子結合蛋白(C/EBPs)[16]、過氧化物酶體增殖物激活受體γ(PPARγ)等,它們誘導許多參與脂質代謝的下游靶基因的表達。
PPP5C是蛋白絲氨酸/蘇氨酸磷酸酶家族的一員,通過調節蛋白絲氨酸/蘇氨酸殘基的磷酸化以及激活或失活相應底物,在生命活動中發揮重要作用。
PPP5C被發現在幾乎所有人體組織中表達,并參與許多細胞過程[17]。PPP5C 可以通過影響絲裂原激活蛋白激酶 (MAPK) 信號通路的活性來干擾細胞增殖和分化[18]。Jeong等[19]的研究發現,PPP5C在酵母增殖細胞中表達水平升高。隨后的幾項研究報告也稱,PPP5C在乳腺癌、套細胞淋巴瘤和肝癌組織以及腹水中表達上調[20]。另一方面,PPP5C基因在脂肪細胞分化中的作用在小鼠中也有相關的研究,比如有研究者發現抑制 PPP5C 活性可能有助于在糖皮質激素治療期間預防肥胖[21]。此外,本課題組前期分析發現,該基因在固原黃牛與和牛中存在的較高的差異表達。綜上,推測該基因在牛脂肪細胞中發揮重要作用,但是目前并未發現該基因在脂肪細胞中的相關研究,因此,深入研究PPP5C基因對牛脂肪細胞增殖、分化的作用,對于改善牛肉質性狀具有重要意義。
3.2 PPP5C基因影響牛脂肪細胞的增殖
PPP5C基因是一種絲氨酸/蘇氨酸磷酸酶,屬于磷蛋白磷酸酶(PPP)家族[22]。與大多數其他PPP家族磷酸酶不同的是,PPP5C是單個亞基酶,利用其N端TPR結構域實現底物識別和活性調節。PPP5C的基礎磷酸酶活性相對較低,這是因為TPR結構域與C端αJ螺旋之間的相互作用產生了分子內自抑制作用[23]。在人體腫瘤研究中,通過慢病毒介導的short hairpin RNA(shRNA)敲除PPP5C基因可明顯抑制細胞增殖[24]。在胰腺癌研究中,發現PPP5C通過促進胰腺癌細胞增殖和侵襲而在胰腺癌中具有預后作用,并發現miR-520-5p與PPP5C之間存在靶向抑制關系[25]。在癌癥方面,PPP5C 在增殖和細胞存活中的作用及其獨特的結構使其成為潛在有吸引力的治療靶點,并且在乳腺癌和腎癌臨床研究中發現 PPP5C 表達升高可促進細胞增殖[26]。如果PPP5C在P位點去磷酸化,其高度保守的催化核心和雙金屬系統(M1/M2)將轉變為底物結合和水解位點,就會導致PPP5C的過度表達,這也是細胞增殖的原因之一[27]。
細胞增殖主要有S期(合成期)和M期(有絲分裂期),這兩者之間還包含兩個中間期:G1(G0)和G2期[28]。CDK的活性是通過與細胞周期蛋白結合來調節,CDK1在G1之前的M期被激活﹐CDK2在G1/S轉化時與CCNE結合,在S期時與CCNA結合[29]。PCNA是DNA聚合酶在復制過程中必不可少的輔助因子,且其可將聚合酶與DNA結合并顯著增加其合成能力[30]。在本研究中,干擾PPP5C后顯著促進了增殖標志基因CDK1、CDK2和PCNA的表達(Plt;0.05),同時,流式細胞術顯示干擾PPP5C顯著增加了S期牛脂肪細胞陽性細胞數量,其可通過縮短G1/S期轉化的時間促進牛脂肪細胞增加,進而正向調控牛脂肪細胞增殖,過表達后結果則與之相反。而本研究與之前的研究結果不符,考慮可能存在物種間及樣本間的差異,這也為后期進一步研究提供了參考。
3.3 PPP5C基因影響牛脂肪細胞的分化
脂肪細胞的分化受到轉錄因子(TFs)、酶、激素和信號通路形成的復雜信號轉導網絡的調控,轉錄因子通過識別特定的DNA序列來調控轉錄過程。有研究者發現,PPP5C基因主要富集在24個與脂肪沉積和脂肪酸合成有關功能分子中[31]。為了更好地了解PPP5C基因在生物學中的作用,研究者們利用PPP5C基因敲除小鼠(PPP5C(-/-))研究其在高脂飲食引起的肥胖和胰島素抵抗中的作用,結果顯示,盡管攝入的熱量相似,但與野生型同窩小鼠(PPP5C(+/+))相比,基因敲除小鼠(PPP5C(-/-))在高脂飲食中的體重明顯減少,而且沒有積累內臟脂肪,血糖控制有明顯改善[8]。在另一項使用小鼠細胞培養物進行的試驗中,PPP5C基因敲除動物顯示出較低的脂質沉積和較低的脂肪酸合成,PPP5C可通過同時抑制GR-α和過氧化物酶體增殖激活受體γ(PPARγ)在分別促進脂肪分解或脂肪生成的位點上的磷酸化,進而促進脂肪生成的作用,這表明PPP5C基因參與了低油酸的調控機制,重申了該基因與脂肪酸的關系[32]。PPP5C 的底物包括糖皮質激素受體 (GR)、腫瘤抑制因子 p53、Hsp90 和共伴侶 Cdc37[33],由于這一特性,PPP5C 與哮喘、心臟病、糖尿病、脂質代謝和肥胖等疾病相關[34]。
成脂標志基因PPAR和C/EBP在脂肪細胞生成過程中相互作用、相互調控,共同調控著成脂基因的表達和胰島素的敏感性,推動著脂肪生成的進程,CEBPB和C/EBP6在早期激活PPAR表達中起重要作用,激活的PPAR誘導CEBPA和其他成脂基因的表達從而促進分化之后CEBPA又通過正反饋回路維持PPAR的表達[35]。FABP4主要參與體內平衡相關的多種代謝功能,通過與激素敏感脂肪酶相互作用進行脂解調節[36]。在本研究中,干擾PPP5C促進了脂肪標志基因PPARγ、C/EBPα和FABP4的表達(Plt;0.05),并增加了脂滴生成和甘油三酯含量(Plt;0.05),過表達PPP5C基因則抑制了脂肪標志基因PPARγ、CEBPα和FABP4的表達(Plt;0.05),減少了脂滴生成和甘油三酯含量(Plt;0.05)。
4 結 論
綜上,本研究構建了PPP5C基因過表達載體并篩選了最佳干擾片段,探究PPP5C基因對牛脂肪細胞增殖和分化的作用。結果表明,干擾PPP5C基因促進牛脂肪細胞的增殖和分化,而過表達后則抑制牛脂肪細胞的增殖和分化。該研究結果為進一步探究PPP5C基因調控牛脂肪細胞的分子機制提供參考。
參考文獻(References):
[1] ALVAREZ-GUAITA A,PATEL S,LIM K,et al.Phenotypic characterization of Adig 1 mice suggests roles for adipogenin in the regulation of fat mass accrual and leptin secretion[J].Cell Rep,2021,34(10):108810.
[2] GWON M H,YUN J M.Phenethyl isothiocyanate improves lipid metabolism and inflammation via mTOR/PPARγ/AMPK signaling in the adipose tissue of obese mice[J].J Med Food,2021,24(6):666-669.
[3] 劉 暢,郝科興,陳 巖,等.干擾PPARγ基因對綿羊滋養層細胞增殖、凋亡、遷移和脂質積累的影響[J].畜牧獸醫學報,2024,55(6):2421-2430.
LIU C,HAO K X,CHEN Y,et al.Effects of interference with PPARγ gene on proliferation,apoptosis,migration and lipid accumulation of trophoblast cells in sheep[J].Acta Veterinaria et Zootechnica Sinica,2024,55(6):2421-2430.(in Chinese)
[4] XIE J L,HAN M,ZHANG M J,et al.PP5 (PPP5C) is a phosphatase of Dvl2[J].Sci Rep,2018,8(1):2715.
[5] MORITA K I,SAITOH M,TOBIUME K,et al.Negative feedback regulation of ASK1 by protein phosphatase 5 (PP5) in response to oxidative stress[J].EMBO J,2001,20(21):6028-6036.
[6] SKARRA D V,GOUDREAULT M,CHOI H,et al.Label-free quantitative proteomics and SAINT analysis enable interactome mapping for the human Ser/Thr protein phosphatase 5[J].Proteomics,2011,11(8):1508-1516.
[7] SILVERSTEIN A M,GALIGNIANA M D,CHEN M S,et al.Protein phosphatase 5 is a major component of glucocorticoid receptor·hsp90 complexes with properties of an FK506-binding immunophilin[J].J Biol Chem,1997,272(26):16224-16230.
[8] GRANKVIST N,HONKANEN RE,SJ?HOLM ,et al.Genetic disruption of protein phosphatase 5 in mice prevents high-fat diet feeding-induced weight gain[J].FEBS Lett,2013,587(23):3869-3874.
[9] HINDS T D JR,SNCHEZ E R.Protein phosphatase 5[J].Int J Biochem Cell Biol,2008,40(11):2358-2362.
[10] GOLDEN T,SWINGLE M,HONKANEN R E.The role of serine/threonine protein phosphatase type 5 (PP5) in the regulation of stress-induced signaling networks and cancer[J].Cancer Metastasis Rev,2008,27(2):169-178.
[11] LI G Y,LIU J Z,ZHANG L,et al.Knockdown of protein phosphatase 5 (PPP5C) suppresses the growth of leukemic cell line U937[J].Cell Mol Biol (Noisy-le-grand),2016,62(11):27-31.
[12] 王中波,劉 爽,賀麗霞,等.固原黃牛不同部位肌肉組織代謝組學分析[J].畜牧獸醫學報,2024,55(4):1565-1578.
WANG Z B,LIU S,HE L X,et al.Metabolomics analysis on different muscle tissues of Guyuan cattle[J].Acta Veterinaria et Zootechnica Sinica,2024,55(4):1565-1578.(in Chinese)
[13] GAO Y H,WANG S Z,MA Y F,et al.Circular RNA regulation of fat deposition and muscle development in cattle[J].Vet Med Sci,2022,8(5):2104-2113.
[14] UEZUMI A,ITO T,MORIKAWA D,et al.Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle[J].J Cell Sci,2011,124(Pt 21):3654-3664.
[15] ZAMANI N,BROWN C W.Emerging roles for the transforming growth factor-β superfamily in regulating adiposity and energy expenditure[J].Endocr Rev,2011,32(3):387-403.
[16] HAUSMAN G J,DODSON M V,AJUWON K,et al.BOARD-INVITED REVIEW:the biology and regulation of preadipocytes and adipocytes in meat animals[J].J Anim Sci,2009,87(4):1218-1246.
[17] XU X L,LAGERCRANTZ J,ZICKERT P,et al.Chromosomal localization and 5′ sequence of the human protein serine/threonine phosphatase 5′ gene[J].Biochem Biophys Res Commun,1996,218(2):514-517.
[18] VON KRIEGSHEIM A,PITT A,GRINDLAY G J,et al.Regulation of the Raf-MEK-ERK pathway by protein phosphatase 5[J].Nat Cell Biol,2006,8(9):1011-1016.
[19] JEONG J Y,JOHNS J,SINCLAIR C,et al.Characterization of Saccharomyces cerevisiae protein Ser/Thr phosphatase T1 and comparison to its mammalian homolog PP5[J].BMC Cell Biol,2003,4:3.
[20] GOLDEN T,ARAGON I V,RUTLAND B,et al.Elevated levels of Ser/Thr protein phosphatase 5 (PP5) in human breast cancer[J].Biochim Biophys Acta,2008,1782(4):259-270.
[21] JACOB W,ROSENZWEIG D,VZQUEZ-MARTIN C,et al.Decreased adipogenesis and adipose tissue in mice with inactivated protein phosphatase 5[J].Biochem J,2015,466(1):163-176.
[22] SHI Y G.Serine/threonine phosphatases:mechanism through structure[J].Cell,2009,139(3):468-484.
[23] YANG J,ROE S M,CLIFF M J,et al.Molecular basis for TPR domain-mediated regulation of protein phosphatase 5[J].EMBO J,2005,24(1):1-10.
[24] CHEN M,LV J M,YE J Q,et al.Disruption of serine/threonine protein phosphatase 5 inhibits tumorigenesis of urinary bladder cancer cells[J].Int J Oncol,2017,51(1):39-48.
[25] FU R B,SHAO Q,YANG B,et al.MiR-520a-5p/PPP5C regulation pattern is identified as the key to gemcitabine resistance in pancreatic cancer[J].Front Oncol,2022,12:903484.
[26] THIJS J L,HERATH A,DE BRUIN-WELLER M S,et al.Multiplex platform technology and bioinformatics are essential for development of biomarkers in atopic dermatitis[J].J Allergy Clin Immunol,2017,139(3):1065.
[27] SALTER E A,WIERZBICKI A,HONKANEN R E.Quantum-based modeling of dephosphorylation in the catalytic site of serine/threonine protein phosphatase-5 (PPP5C)[J].Catalysts,2020,10(6):674.
[28] MATSON J P,COOK J G.Cell cycle proliferation decisions:the impact of single cell analyses[J].FEBS J,2017,284(3):362-375.
[29] 宋雅萍,張久盤,魏大為,等.FOXO1基因調控牛前體脂肪細胞增殖和分化的功能研究[J].中國農業大學學報,2024,29(4):226-238.
SONG Y P,ZHANG J P,WEI D W,et al.Study on the function of FOXO1 gene in regulating the proliferation and differentiation of bovine preadipocytes[J].Journal of China Agricultural University,2024,29(4):226-238.(in Chinese)
[30] CHOE K N,MOLDOVAN G L.Forging ahead through darkness:PCNA,still the principal conductor at the replication fork[J].Mol Cell,2017,65(3):380-392.
[31] SCHETTINI G P,PERIPOLLI E,ALEXANDRE P A,et al.Transcriptomic profile of Longissimus thoracis associated with fatty acid content in Nellore beef cattle[J].Anim Genet,2022,53(3):264-280.
[32] HINDS T D JR,STECHSCHULTE L A,CASH H A,et al.Protein phosphatase 5 mediates lipid metabolism through reciprocal control of glucocorticoid receptor and peroxisome proliferator-activated receptor-γ (PPARγ)[J].J Biol Chem,2011,286(50): 42911-42922.
[33] MA C H,CUI Z L,WANG Y C,et al.Bioinformatics analysis reveals TSPAN1 as a candidate biomarker of progression and prognosis in pancreatic cancer[J].Bosn J Basic Med Sci,2021,21(1):47-60.
[34] WU M Y,LAI T T,LIAO W T,et al.Clinicopathological and prognostic significance and molecular mechanisms governing uveal melanoma[J].Ther Adv Med Oncol,2020,12:1758835920917566.
[35] 高玉紅,馮 雪,汪書哲,等.黃牛circCAP2在前體脂肪細胞分化過程中的功能研究[J].農業生物技術學報,2023, 31(7):1441-1449.
GAO Y H,FENG X,WANG S Z,et al.Function of circCAP2 in the differentiation of cattle (Bos taurus) preadipocytes[J].Journal of Agricultural Biotechnology,2023,31(7):1441-1449.(in Chinese)
[36] PRENTICE K J,SAKSI J,HOTAMISLIGIL G S.Adipokine FABP4 integrates energy stores and counterregulatory metabolic responses[J].J Lipid Res,2019,60(4):734-740.
(編輯 郭云雁)

