基于轉錄組數據挖掘蛋雞產蛋前后骨代謝差異的關鍵候選基因

摘 要: 旨在挖掘影響蛋雞產蛋前后骨代謝差異的調控通路和關鍵候選基因,為進一步研究維持蛋雞骨骼健康的調控機制提供理論依據。本研究選擇15只15周齡和12只22周齡體重相近飼養條件相同的海蘭灰蛋雞,采集血液和脛骨,測定血漿鈣、磷、雌激素、骨代謝相關生化指標,根據雌激素水平選擇每組各6只的脛骨組織構建12個轉錄組文庫并篩選差異表達基因,并對差異表達基因進行GO功能和KEGG富集分析。隨機選擇6個差異表達基因,利用qRT-PCR驗證其相對表達量。15周齡與22周齡相比,蛋雞血漿骨代謝標記物和雌激素水平均呈現顯著變化(P<0.05)。構建的12個脛骨cDNA文庫中得到40 082 240~186 154 554條有效堿基序列數,Q30值最少為92.18%,比對率在76.52%~90.55%之間。對15周齡與22周齡脛骨轉錄組進行比較,鑒定出1 832個差異表達基因,其中914個基因下調,918個基因上調。GO功能注釋發現,差異表達基因主要顯著富集在蛋白加工、對內質網應激的反應和膠原原纖維組織等過程。KEGG富集分析發現,與骨代謝相關的顯著富集通路有類固醇生物合成、甲狀腺激素合成、TGF-β信號通路、MAPK信號通路、PI3K-Akt信號通路,篩選出18個這些通路共有的基因作為調控骨代謝的關鍵候選基因。本研究揭示了產蛋前后蛋雞脛骨組織中基因表達存在差異,篩選到多個影響骨代謝的差異表達基因和通路,為進一步研究蛋雞產蛋前后骨代謝轉換機制提供理論依據。
關鍵詞: 蛋雞;轉錄組;差異表達基因;生理階段;脛骨;骨代謝
中圖分類號:S831.2
文獻標志碼:A
文章編號:0366-6964(2024)10-4455-11
收稿日期:2024-03-25
基金項目:國家自然科學基金項目(32272922);河北省重點研發計劃項目現代種業科技創新專項(22326319D);河北省雞現代種業科技創新團隊(21326303D);河北省現代農業產業技術體系建設專項資金(HBCT2024260204)
作者簡介:張寅梁(1998-),男,山西原平人,碩士生,主要從事畜禽遺傳資源種質特性挖掘、保存與利用研究,E-mail:874197127@.qq.com
*通信作者:周榮艷,主要從事動物遺傳育種與繁殖研究,E-mail: rongyanzhou@126.com
Mining of Key Candidate Genes Involved in Bone Metabolism Differences at Pre- and Post-
laying Stage Based on Transcriptome Data in Laying Hens
ZHANG" Yinliang, ZHANG" Ran, WANG" Wenjun, WANG" Dehe, LI" Lanhui, ZHOU" Rongyan*
(College of Animal Science and Technology, Hebei Agricultural University, Baoding 071001," China)
Abstract:" The study aimed to explore the regulatory pathways and important candidate genes that affect the differences in bone metabolism before and after egg laying in laying hens, providing a theoretical basis for further research on the regulatory mechanisms for maintaining bone health in laying hens. A total of 15 at 15-week-old and 12 at 22-week-old Hyline Grey laying hens with similar body weights and reared under identical conditions were selected. Blood and tibia samples were collected to measure plasma levels of calcium, phosphorus, estrogen, and other biochemical markers related to bone metabolism. Based on estrogen levels, tibia tissues from 6 hens within each age group were selected to construct 12 transcriptome libraries. Differentially expressed genes (DEGs) were then screened from these libraries, and GO functional annotation and KEGG pathway enrichment analyses were performed with DEGs. Additionally, 6 randomly selected DEGs were validated for their relative expression levels using qRT-PCR. When comparing 15-week-old hens to 22-week-old hens, significant changes (Plt;0.05) were observed in plasma bone metabolism markers and estrogen levels in the laying hens. The clean reads of 40 082 240-186 154 554 were obtained from the 12 constructed tibial cDNA libraries, with a minimum Q30 value of 92.18% and a contrast rate between 76.52% and 90.55%. A total of 1 832 DEGs were screened from the tibia of laying hens at 15 and 22 weeks of age. Among them, 914 genes were downregulated and 918 genes were upregulated. GO functional annotation revealed that differentially expressed genes were significantly enriched in protein processing, response to endoplasmic reticulum stress, and collagen fibril organization (P<0.05). KEGG enrichment analysis revealed significant enrichment pathways related to bone metabolism, including steroid biosynthesis, thyroid hormone synthesis, and TGF- β signal pathway, MAPK signaling pathway, PI3K-Akt signaling pathway. Screening out 18 genes were shared by these pathways as key candidate genes for regulating bone metabolism. This study revealed that there are differences in gene expression in the tibia tissue of laying hens, and multiple DEGs and pathways affecting bone metabolism at pre- and post-laying stages were screened in laying hens. These results provide theoretical basis for further research on the mechanism of bone metabolism changes in laying hens before and after egg laying.
Key words: laying hens; transcriptome; differentially expressed genes; physiological stages; tibia; bone metabolism
*Corresponding author: ZHOU Rongyan, E-mail: rongyanzhou@126.com
蛋雞的骨骼健康是限制其延養潛力的關鍵因素,直接關系到蛋雞產業能否實現高質高效的發展[1]。而蛋雞產蛋前后受內分泌信號影響引起的骨代謝轉換和髓質骨沉積是影響蛋雞骨骼健康的主要原因[2]。蛋雞產蛋前骨骼發育以結構骨生成為主,開產后血漿雌激素水平升高,而雌激素是禽類髓質骨形成的關鍵因素[3]。同時,結構骨生成開始向髓質骨生成轉換[4]。在從性成熟開始到完全性成熟的階段內,蛋雞髓質骨會在骨髓腔中大量儲存,以備開產后為蛋殼形成提供鈣源,而骨鈣卻被大量消耗轉化為髓質骨[5],導致蛋雞易發骨質疏松。有研究發現,蛋雞在產蛋前其髓質骨的累積是影響其產蛋后期骨骼健康問題的關鍵[6]。延遲性成熟有助于蛋雞在產蛋前充分地發育骨骼以確保產蛋期骨骼質量[7]。此外,有研究表明,蛋雞產蛋前期骨質量的水平能持續影響生產階段骨質情況,而骨骼質量的提高有助于延長蛋雞的產蛋周期和提高產蛋性能[8]。因此,研究蛋雞產蛋前后骨代謝機制是維持蛋雞產蛋期骨骼健康的關鍵。
近年來,蛋雞骨代謝領域的研究取得了一些進展。蛋雞龍骨骨折所引發的骨代謝異常可能與骨折后愈合相關,這一發現為骨折愈合機制的研究提供了新的視角[9]。蛋雞日常營養物質攝入也會對骨代謝產生一定的影響。低磷飼料對老年蛋雞骨代謝并無不利影響[10],但低鈣條件下蛋雞誘發骨質疏松癥而發病原因與腸道菌群變化有關[11]。蛋雞產蛋高峰后飼喂發酵丁酸鈣可通過增強腸道完整性減少炎癥介導的骨吸收[12]。此外,利用組學研究篩選出的差異代謝物及差異表達基因能闡明一些蛋雞骨質變化的原因。籠養模式對雞的骨質量參數有負面影響,通過非靶向代謝組數據分析發現與氨基酸代謝、脂質代謝和糖代謝等相關[13]。通過對蛋雞脛骨轉錄組數據分析,發現蛋雞脛骨強度與Pax5、TIMP4和KLHL14 等相關[14]。此外,維持骨代謝穩態也被視為動物福利的重要組成部分[15-16]。因此,深入研究與鑒定蛋雞骨代謝相關調控因子具有重要意義。而目前對蛋雞產蛋前后骨代謝變化的血漿代謝物、激素水平和骨代謝差異表達基因的相關研究還鮮有報道。
本研究通過對海蘭灰蛋雞的血漿代謝標記物水平、血漿鈣磷含量以及轉錄組測序數據進行分析,明確不同生理時期蛋雞骨代謝的調控機制,為進一步闡明蛋雞骨骼健康的調控機制提供理論依據。
1 材料與方法
1.1 試驗動物與樣品采集
選擇在相同環境條件下飼養的30只12周齡海蘭灰蛋雞繼續養至15周齡,在15周齡時選擇15只體重相近的個體,采集血液和脛骨;選擇12只體重相近、開產日齡為140天的22周齡蛋雞,記錄每天產蛋時間,在產蛋后3 h內采集血液和脛骨。將EDTA抗凝的血液離心(2 000 r·min-1,15 min),分離血漿,放置于-20 ℃保存用于測定生化指標;將剔除肌肉和軟骨的左側脛骨液氮速凍后置于-80 ℃保存用于轉錄組測定。為篩選出蛋雞性成熟前后與骨代謝相關的差異表達基因,根據血漿雌激素濃度對15和22周齡蛋雞從高到低排序,選擇15周齡(17.92~24.84 pg·mL-1)和22周齡(52.74~61.21 pg·mL-1)的脛骨各6個進行轉錄組測序。
1.2 血漿骨代謝相關標記物、激素水平檢測
血漿生化指標均利用ELISA試劑盒和酶標分析儀(型號:Rayto RT-6100)進行檢測。核因子κB受體活化因子配基(receptor activator of nuclear factor-κb ligand,RANKL)、雞核因子κB受體活化因子(receptor activator of nuclear factor-κb,RANK)、雞骨涎蛋白(bone sialoprotein,BSP)、雞骨鈣素(osteocalcin,OCN)、雞骨保護素(osteoprotegerin,OPG)、雞硫酸角質素(keratan sulfate,KS)、雞硬骨素(sclerostin,SOST)、雞吡啶酚(pyridinoline,PYD)和雌激素(estrogens,E)試劑盒均購于上海江萊生物科技有限公司;蛋雞血漿鈣離子和無機磷試劑盒均購于南京建成生物工程研究院。
1.3 cDNA文庫構建和轉錄組測序
用TRIzol法提取15和22周齡蛋雞脛骨組織總RNA,利用Agilent 2100生物分析儀(安捷倫科技,美國)檢測總RNA完整性。樣品合格后,用帶有Oligo(dT)的磁珠富集mRNA,后用fragmentation將其打碎成小片段,以此為模板,用隨機引物合成cDNA,后合成二鏈cDNA。最后用PCR法富集cDNA,構建海蘭灰蛋雞脛骨cDNA文庫。構建完成后,用Agilent 2100對文庫的insert size進行分析。在Illumina HiSeq平臺上對12個脛骨組織cDNA文庫進行測序。
1.4 脛骨組織差異表達基因篩選
對原始序列進行FastQC質控,將過濾后的高質量堿基序列,使用HISAT2軟件比對到雞基因組(版本號:GRCg6a),利用DESeq2以|Fold Change|≥1.5且FDRlt;0.05作為篩選條件篩選差異表達基因。利用GOseq R包對差異表達基因進行GO功能富集分析。使用KOBAS軟件進行KEGG富集分析。
1.5 差異表達基因qRT-PCR驗證
隨機選擇6個差異表達基因,用Primer 5.0軟件設計引物(表1)。PCR反應體系(20 μL):Forget-Me-Not EvaGreen qPCR Master Mix(上海開放生物科技有限公司)10 μL,ROX 3 μL,上、下游引物(10 μmol·L-1)各0.4 μL,cDNA 2 μL,ddH2O 4.2 μL。反應條件:95 ℃預變性2 min,95 ℃變性5 s,60 ℃退火延伸30 s,共40個循環。內參基因LBR在同等條件下進行反應。用2-ΔΔCt法計算其相對表達量。
1.6 數據分析
對所有試驗數據進行正態性檢驗,對符合正態分布的數據進行獨立樣本t檢驗;對不服從正態分布的數據用Mann-Whitney進行分析。方差分析顯著進行Duncan多重比較,Plt;0.05為顯著標準。數據分析和繪圖均利用OriginPro 2021軟件完成。
2 結 果
2.1 產蛋前后蛋雞血漿指標的變化
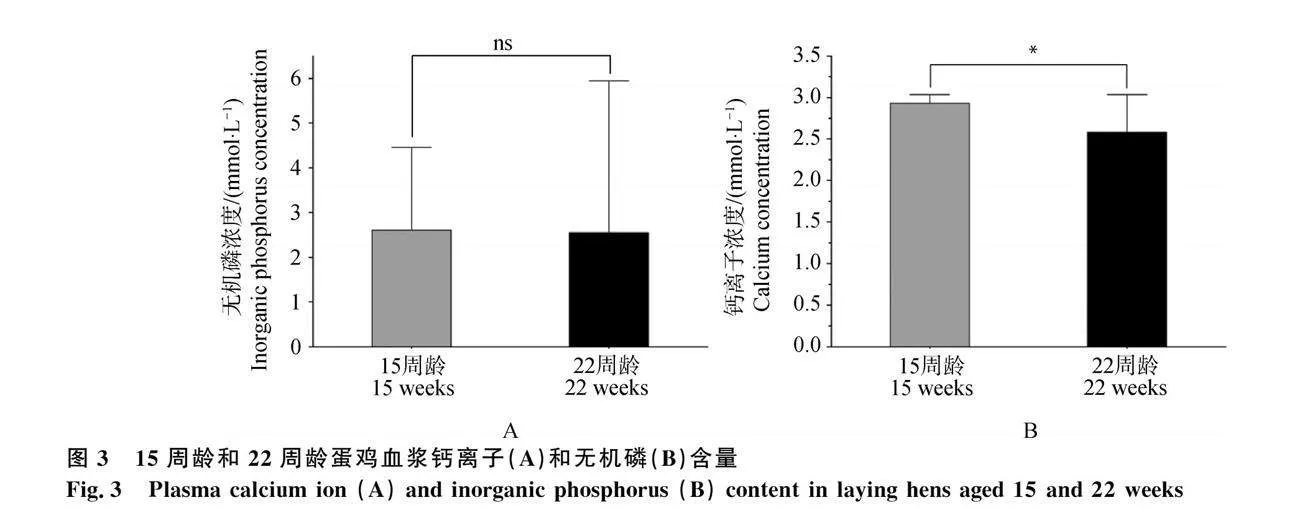
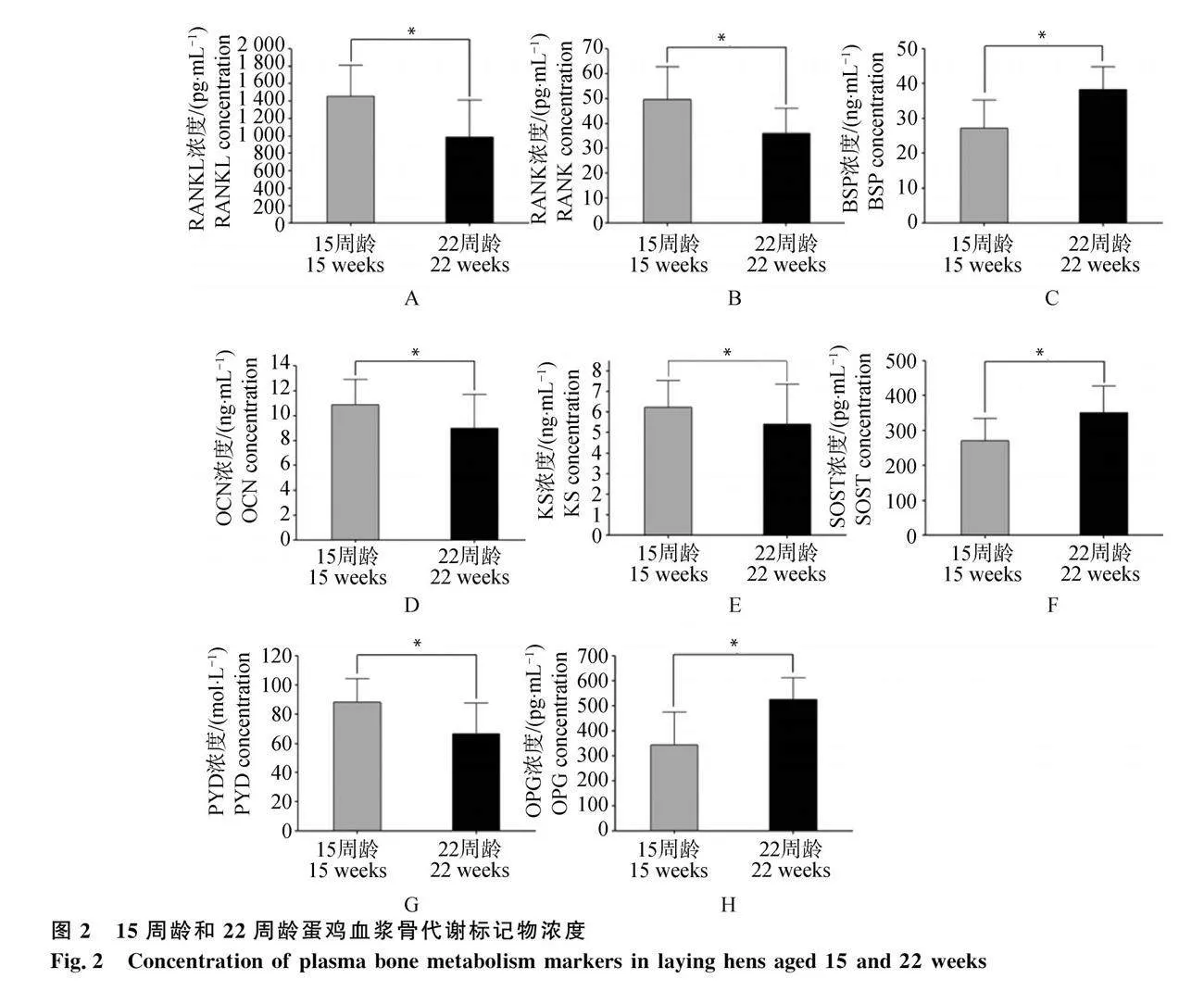
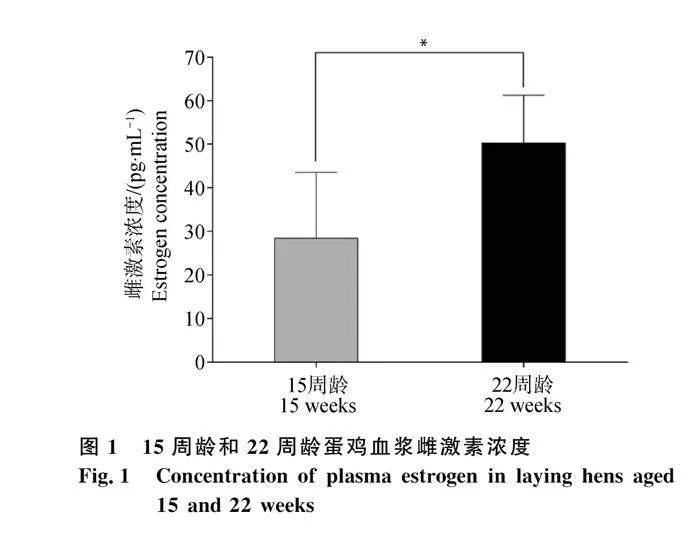
對產蛋前后血漿雌激素水平進行比較,發現15周齡顯著低于22周齡(P<0.05,圖1)。對產蛋前后血漿骨代謝相關指標進行比較 ,發現15周齡骨代謝標記物RANKL、OCN、KS、PYD、RANK水平均顯著高于22周齡(P<0.05,圖2A、B、D、E、G)。15周齡BSP、OPG、SOST水平顯著低于22周齡(P<0.05,圖2C、F、H)。對產蛋前后血漿鈣、磷水平進行比較 ,發現15周齡血漿無機磷含量與22周齡沒有顯著差異(圖3A)。22周齡血漿中的鈣離子水平顯著低于15周齡組(P<0.05,圖3B)。
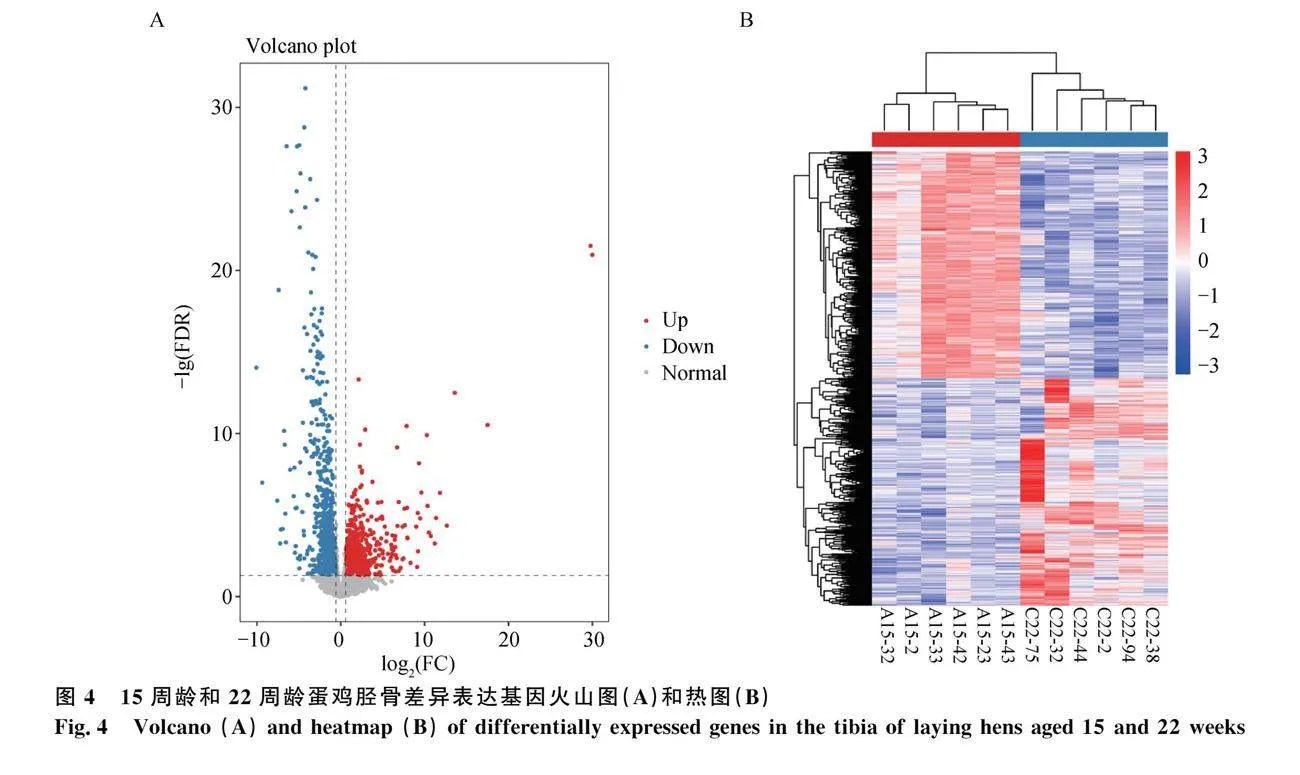
2.2 蛋雞脛骨組織轉錄組測序數據分析
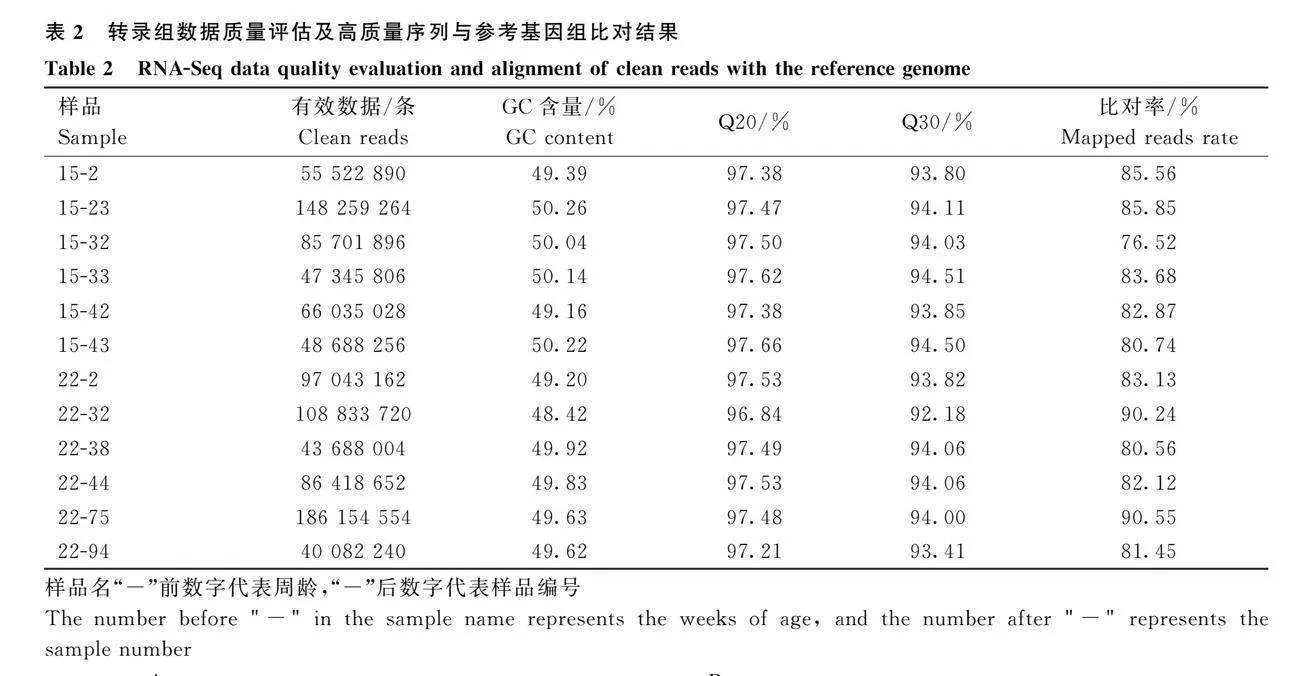
從構建的12個海蘭灰蛋雞脛骨cDNA文庫中得到40 082 240~186 154 554條高質量序列,所有樣本Q30值至少為92.18%(表2),表明測序數據質量優良,可用于后續分析。將高質量序列與雞的參考基因組進行比對,與雞參考基因組的比對率為76.52%~90.55% (表2)。
2.3 蛋雞差異表達基因篩選與富集分析
利用DESeq2對脛骨轉錄組測序數據以|Fold Change|gt;1.5且FDRlt;0.05作為條件篩選差異表達基因。蛋雞性成熟前(15周齡)對比性成熟后(22周齡)脛骨的差異表達基因共有1 832個(圖4),其中914個基因下調,918個基因上調。
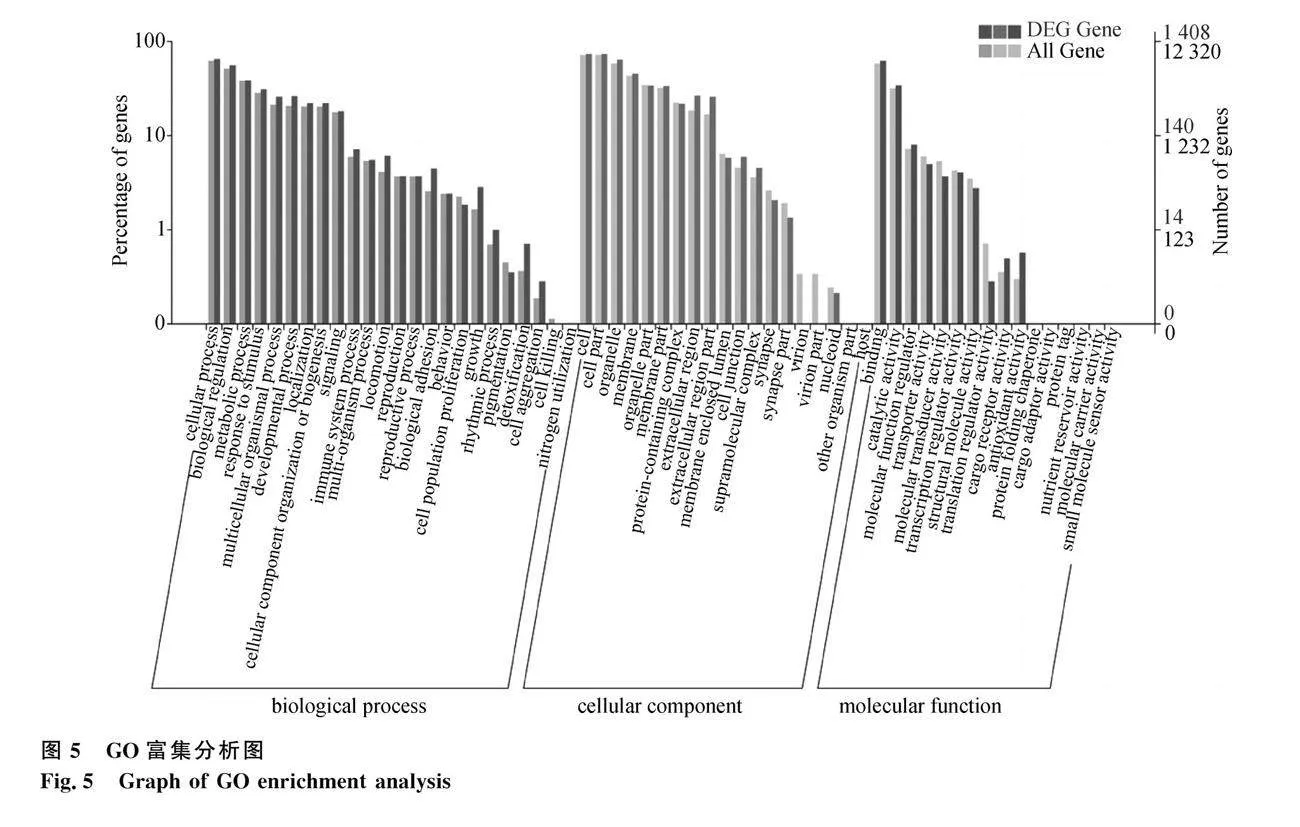
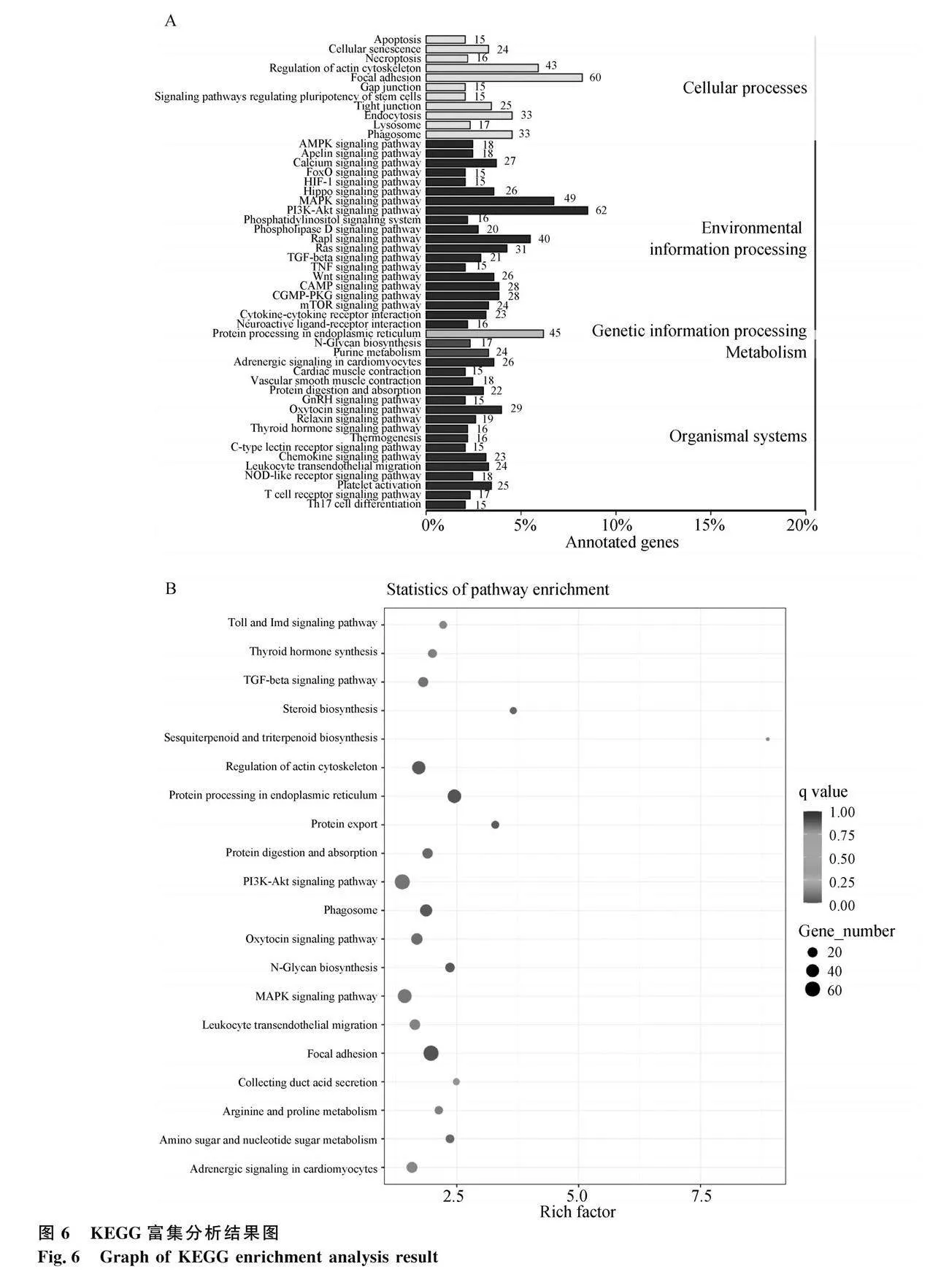
為探究蛋雞15周齡與22周齡脛骨差異基因的功能,對1 832個差異表達基因做GO富集分析,分為了3個主要分支,即生物過程(biological process,BP)、細胞組分(cellular component,CC)和分子功能(molecular function,MF)(圖5)。在BP分類中,差異表達基因在蛋白加工(protein processing)、對內質網應激的反應(response to endoplasmic reticulum stress)和膠原原纖維組織(collagen fibril organization)等條目顯著富集(P<0.05)。在CC功能方面,差異表達基因顯著富集在細胞外泌體(extracellular exosome)、內質網內腔(endoplasmic reticulum lumen)和細胞外基質(extracellular matrix)等條目(P<0.05)。在MF中,差異表達基因顯著富集在肝素結合(heparin binding)、膠原結合(collagen binding)、蛋白質二硫化物異構酶活性(protein disulfide isomerase activity)和鈣離子結合(calcium lon binding)等(P<0.05)。
對差異基因進行KEGG富集分析,將其分為5個生物途徑,其中包括細胞過程(cellular processes)、環境信息處理(environmental information processing)、遺傳信息處理(genetic information processing)、新陳代謝(metabolism)和生物體系統(organismal systems)通路(圖6A)。這些差異表達基因共富集到204個通路,其中30條通路顯著富集(P<0.05, q value<0. 2),包括類固醇生物合成(steroid biosynthesis)、TGF-β信號通路(TGF-beta
signaling pathway)、MAPK信號通路(MAPK signaling pathway)、PI3K-Akt信號通路(PI3K-Akt signaling pathway)和倍半萜及三萜生物合成(sesquiterpenoid and triterpenoid biosynthesis)等(圖6B)。
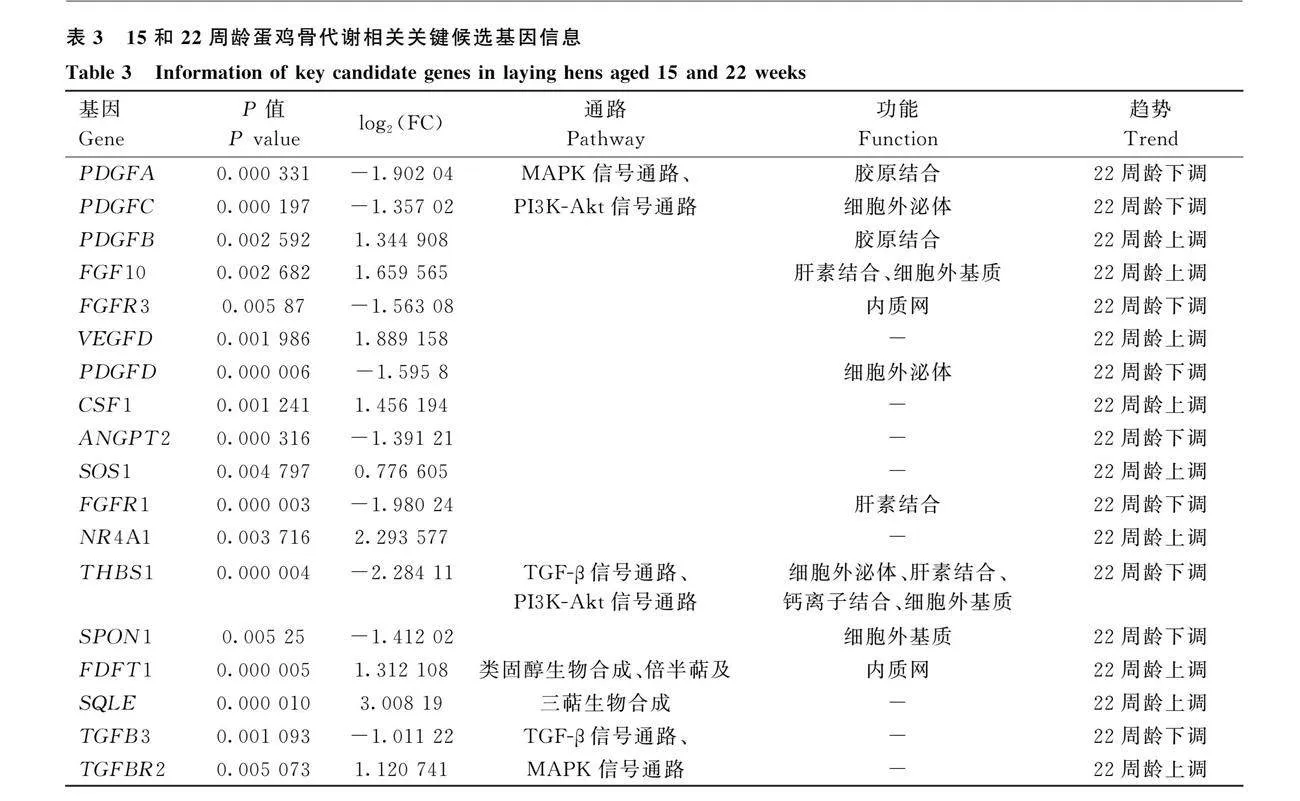
2.4 產蛋前后蛋雞骨代謝差異的候選調控基因篩選
為研究蛋雞產蛋前后脛骨中骨代謝變化的潛在調節機制,從KEGG顯著富集通路中通過文獻篩選與骨代謝相關的通路,分別是類固醇生物合成[6]、TGF-β信號通路、MAPK信號通路、PI3K-Akt信號通路和倍半萜及三萜生物合成[6]。對上述通路中的DEGs根據在各通路間的關聯情況篩選與蛋雞產蛋前后骨代謝變化相關的關鍵候選DEGs(表3)。與膠原合成功能相關的基因有PDGFA和PDGFB,與細胞外泌體功能相關的基因有PDGFC、PDGFD和THBS1,與細胞外基質相關的DEGs為FGF10和THBS1,與肝素結合相關的DEGs有FGF10、FGFR1和THBS1,與內質網相關的DEGs有FGFR3和FDFT1,與鈣離子結合相關的DEGs僅有THBS1(表3)。
2.5 差異表達基因的qRT-PCR驗證
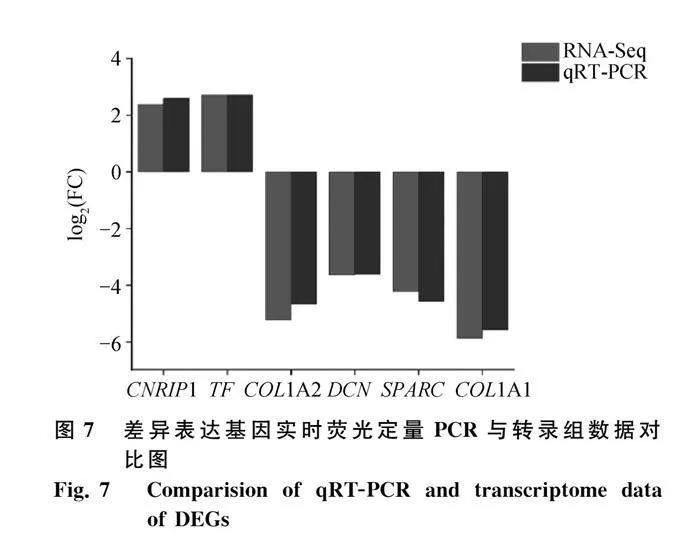
隨機選擇DEGs中的6個差異表達基因,利用qRT-PCR進行表達水平檢測,LBR為內參基因,與15周齡相比,22周齡脛骨中COL1A1、COL1A2、SPARC和DCN表達水平下調,TF和CNRIP1表達水平上調(圖7)。通過比較分析發現,6個基因的qRT-PCR表達規律與轉錄組數據表達規律(圖7)完全一致。
3 討 論
蛋雞的骨骼發育受到多個因素的影響,如日糧配比、飼養管理和遺傳因素等。這些因素不僅直接關系到蛋雞骨代謝狀態,還影響蛋殼質量,進而決定蛋雞產業的經濟效益和動物福利。目前,盡管已經對蛋雞骨代謝的調控因子[10]和骨組織結構[17]等開展了初步研究,但多數研究仍聚焦于血漿代謝物、鈣磷檢測、骨代謝相關基因以及相關因子對骨代謝的影響等方面。相對而言,蛋雞骨組織的轉錄組學方面的研究仍顯不足。
蛋雞開產前后骨代謝發生轉換,伴隨著血漿骨代謝相關指標濃度變化。為進一步了解蛋雞在產蛋前后骨代謝的變化情況,對雌激素和多種骨代謝標記物進行檢測。隨著周齡的增加,蛋雞22周齡組雌激素含量顯著高于15周齡組,雌激素的增加會導致雞體內骨骼的改建和鈣的儲存,特別是在產蛋周期中會促進雞體內鈣的沉積停止,開始形成骨髓骨,為未來的蛋殼形成提供鈣源[18]。RANK和RANKL水平相較于15周齡組均顯著下降,而OPG含量卻顯著上調。RANKL與其受體RANK結合,促進成骨細胞前體的分化和活化,從而調節破骨細胞的形成,而OPG則是RANKL的拮抗受體,通過阻止RANKL與RANK的結合,抑制破骨細胞的成熟過程[19]。由此可知,蛋雞在產蛋前后骨吸收過程發生了顯著變化。此外,骨鈣素和硬骨素都作為成骨細胞所分泌的蛋白,但在功能方面存在不同,骨鈣素主要調節骨代謝過程,而硬骨素主要作為骨基質蛋白參與骨骼形成和骨質礦化[20]。22周齡蛋雞血漿中的骨鈣素水平顯著降低,而血漿中硬骨素水平顯著升高,這進一步證實蛋雞在產蛋前后骨代謝活躍。髓質骨是蛋雞骨骼的重要組成部分,而KS作為髓質骨的重要成分[21-22],在22周齡時顯著下降。這表明蛋雞22周齡時可能利用血漿KS進行髓質骨的生成,從而導致血漿KS水平下降。PYD水平作為機體骨質吸收時產生的代謝物,可作為破骨細胞活性的標志物[23],PYD水平22周齡時顯著下降,表明破骨活動減弱,這與RANK和RANKL的結果保持一致。BSP作為細胞外基質蛋白有促進成骨和誘導骨吸收的功能,可以調控骨代謝[24],22周齡蛋雞BSP水平顯著升高,表明開產后蛋雞骨代謝變得更活躍。綜上所述,蛋雞骨代謝在22周齡時整體增強,而出現骨吸收減弱和成骨增強的原因可能與采樣時間是蛋雞產蛋后3 h內有關,此時蛋雞成骨活性增加[25]。
此外,通過對血漿中鈣離子和無機磷濃度的檢測,發現隨著蛋雞周齡的增加,鈣離子濃度呈現明顯的下降趨勢,可能是由于蛋雞開始排卵后,對鈣離子的需求顯著增加。排卵過程是一個高度依賴鈣離子的生理過程,隨著蛋雞進入產蛋期,其對鈣離子的攝取和利用效率可能發生改變,以滿足蛋殼形成的需要[26-27]。相比之下,血漿無機磷含量在蛋雞周齡增加的過程中并未出現顯著變化,這與Habig等[28]的研究結果相一致。而Yan等[29]發現產蛋后蛋雞在短期內血漿無機磷水平會發生顯著變化。表明血漿鈣離子與無機磷相比,鈣離子平衡濃度由于需要量增加而降低,但無機磷只在短期內有顯著降低后又恢復正常水平。因此推斷蛋雞無機磷獲得途徑較為穩定,而鈣離子容易缺乏。
為研究產蛋前后蛋雞骨代謝轉換的分子機制,基于脛骨轉錄組數據篩選差異表達基因,從KEGG顯著富集的通路中篩選與骨代謝相關的代謝通路。類固醇生物合成和倍半萜及三萜生物合成與雌激素的前體物質膽固醇合成緊密相關,而雌激素在骨代謝中發揮著重要的調節作用,能夠刺激髓質骨的形成[6]。此外,雌激素還通過抑制TGFβ1的作用影響骨代謝[30]。MAPK通路發揮促進破骨細胞形成的關鍵作用,且該作用受RANKL誘導[31]。SOD3通過PI3K-Akt和MAPK信號通路途徑調節FLT1影響骨代謝抑制脂肪形成[32]。這些通路共同構成了蛋雞骨代謝過程中復雜的調控網絡。此外,本研究還從參與蛋雞骨代謝的膠原結合、肝素結合、細胞外泌體、細胞外基質、內質網和鈣離子結合功能的信號通路中篩選到關鍵候選基因。FGF10作為成纖維細胞生長因子家族的一員,其表達水平與骨質疏松癥有關[33]。THBS1的表達能通過激活PI3K和Akt磷酸化水平促進bFGF表達促進骨形成[34]。血小板衍生生長因子家族中的PDGFA、PDGFC、PDGFB、PDGFD均對骨骼發育和修復有重要調節作用[35]。這些基因在蛋雞骨代謝過程中都可能發揮著重要作用。本研究篩選的這些關鍵候選基因將有助于深入控究蛋雞產蛋前后骨代謝轉換機制及維持產蛋期骨骼健康問題奠定理論基礎。
4 結 論
蛋雞在15周齡和22周齡血漿骨代謝標記物和雌激素水平均呈現顯著變化,基于脛骨轉錄組數據篩選出1 832個差異表達基因,基于顯著富集的信號通路篩選出18個影響骨代謝的關鍵候選基因,為進一步深入研究蛋雞產蛋前后骨代謝變化機制提供理論依據。
參考文獻(References):
[1] WEI H D,CHEN Y Q,NIAN H Y,et al.Abnormal bone metabolism may be a primary causative factor of keel bone fractures in laying hens[J].Animals (Basel),2021,11(11):3133.
[2] ALFONSO-CARRILLO C,BENAVIDES-REYES C,DE LOS MOZOS J,et al.Relationship between bone quality,egg production and eggshell quality in laying hens at the end of an extended production cycle (105 Weeks)[J].Animals,2021,11(3):623.
[3] YUE Q X,HUANG C X,ZHOU R Y,et al.Integrated transcriptomic and metabolomic analyses reveal potential regulatory pathways regulating bone metabolism pre- and postsexual maturity in hens[J].Poult Sci,2024,103(4):103555.
[4] BAIN M M,NYS Y,DUNN I C.Increasing persistency in lay and stabilising egg quality in longer laying cycles.What are the challenges?[J].Brit Poult Sci,2016,57(3):330-338.
[5] CRANSBERG P H,PARKINSON G B,WILSON S,et al.Sequential studies of skeletal calcium reserves and structural bone volume in a commercial layer flock[J].Brit Poult Sci,2001,42(2):260-265.
[6] DUNN I C,DE KONING D J,MCCORMACK H A,et al.No evidence that selection for egg production persistency causes loss of bone quality in laying hens[J].Genet Sel Evol,2021,53(1):11.
[7] HESTER P Y,WILSON D A,SETTAR P,et al.Effect of lighting programs during the pullet phase on skeletal integrity of egg-laying strains of chickens[J].Poult Sci,2011,90(8):1645-1651.
[8] XIN Q,MA N,JIAO H C,et al.Dietary energy and protein levels during the prelay period on production performance,egg quality,expression of genes in hypothalamus-pituitary-ovary axis,and bone parameters in aged laying hens[J].Front Physiol,2022,13: 887381.
[9] WEI H D,BI Y J,WANG Y L,et al.Serum bone remodeling parameters and transcriptome profiling reveal abnormal bone metabolism associated with keel bone fractures in laying hens[J].Poult Sci,2023,102(4):102438.
[10] REN Y C,LIU Y P,JIANG K X,et al.Effects of low-phosphorus diets supplemented with Phytase on the production performance,phosphorus-calcium metabolism,and bone metabolism of aged Hy-line Brown laying hens[J].Animals,2023,13(6):1042.
[11] JIANG S,ZOU X Y,MAO M,et al.Low Ca diet leads to increased Ca retention by changing the gut flora and ileal pH value in laying hens[J].Anim Nutr,2023(13):270-281.
[12] ZHANG H Y,WANG Y S,WANG Y L,et al.Fermented calcium butyrate supplementation in post-peak laying hens improved ovarian function and tibia quality through the “gut-bone” axis[J].Anim Nutr,2024,16:350-362.
[13] LI D F,WU Y F,SHI K,et al.Untargeted metabolomics reveals the effect of rearing systems on bone quality parameters in chickens[J].Front Genet,2023,13:1071562.
[14] YUE Q X,CHEN Y,CHEN H,et al.Transcriptome profile reveals novel candidate genes associated with bone strength in end-of-lay hens[J].Anim Biotechnol,2023,34(7):3099-3107.
[15] Farm Animal Welfare Council.Opinion on osteoporosis and bone fractures in laying hens[R].2010:14.
[16] RIBER A B,CASEY-TROTT T M,HERSKIN M S.The influence of keel bone damage on welfare of laying hens[J].Front Vet Sci,2018(5):6.
[17] YAMADA M,CHEN C X,SUGIYAMA T,et al.Effect of age on bone structure parameters in laying hens[J].Animals,2021, 11(2):570.
[18] HANLON C,ZIEZOLD C J,BéDéCARRATS G Y.The diverse roles of 17β-estradiol in non-gonadal tissues and its consequential impact on reproduction in laying and broiler breeder hens[J].Front Physiol,2022,13:942790.
[19] YASUDA H.Discovery of the RANKL/RANK/OPG system[J].J Bone Miner Metab,2021,39(1):2-11.
[20] WANG J S,MAZUR C M,WEIN M N.Sclerostin and osteocalcin:candidate bone-produced hormones[J].Front Endocrinol,2021(12): 584147.
[21] CANOVILLE A,ZANNO L E,ZHENG W X,et al.Keratan sulfate as a marker for medullary bone in fossil vertebrates[J].J Anat, 2021, 238(6):1296-1311.
[22] WANG X B,FORD B C,PRAUL C A,et al.Characterization of the non-collagenous proteins in avian cortical and medullary bone[J].Comp Biochem Phys B:Biochem Molecul Biol,2005,140(4):665-672.
[23] 郭軍鵬,張兆鵬,孟慶楠,等.人參總皂苷對老年性骨質疏松大鼠血清吡啶酚和骨鈣素水平的影響[J].中國老年學雜志,2020, 40(3):614-615.
GUO J P,ZHANG Z P,MENG Q N,et al.Effect of the total ginsenoside on pyridine and OPG levels in serum of aged osteoporosis rats[J].Chinese Journal of Gerontology,2020,40(3):614-615.(in Chinese)
[24] 曾俊銘,賀小寧.骨涎蛋白在破骨細胞分化和骨吸收中的研究進展[J].海南醫學院學報,2023,29(18):1425-1429.
ZENG J M,HE X N.Research progress of bone sialoprotein in osteoclast differentiation and bone resorption[J].Journal of Hainan Medical University,2023,29(18):1425-1429.(in Chinese)
[25] TAYLOR A C,HORVAT-GORDON M,MOORE A,et al.The effects of melatonin on the physical properties of bones and egg shells in the laying hen[J].PLoS One,2013,8(2):e55663.
[26] BAR A.Calcium homeostasis and vitamin D metabolism and expression in strongly calcifying laying birds[J].Comp Biochem Physiol A: Mol Integr Physiol,2008,151(4):477-490.
[27] GLOUX A,LE ROY N,EZAGAL J,et al.Possible roles of parathyroid hormone,1.25(OH)2D3,and fibroblast growth factor 23 on genes controlling calcium metabolism across different tissues of the laying hen[J].Domest Anim Endocrinol,2020(72):106407.
[28] HABIG C,WEIGEND A,BAULAIN U,et al.Influence of age and phylogenetic background on blood parameters associated with bone metabolism in laying hens[J].Front Physiol,2021(12):678054.
[29] YAN J K,WANG J J,CHEN J,et al.Adjusting phosphate feeding regimen according to daily rhythm increases eggshell quality via enhancing medullary bone remodeling in laying hens[J].J Anim Sci Biotechnol,2023,14(1):17.
[30] FARAONI E Y,CAMILLETTI M A,ABELEDO-MACHADO A,et al.Sex differences in the development of prolactinoma in mice overexpressing hCGβ:role of TGFβ1[J].J Endocrinol,2017,232(3):535-546.
[31] MA C,WANG Z Z,MO L,et al.Tanshinone I attenuates estrogen-deficiency bone loss via inhibiting RANKL-induced MAPK and NF-κB signaling pathways[J].Int Immunopharmacol,2024,127:111322.
[32] XU K,FEI W C,GAO W X,et al.SOD3 regulates FLT1 to affect bone metabolism by promoting osteogenesis and inhibiting adipogenesis through PI3K/AKT and MAPK pathways[J].Free Radical Biol Med,2024,212:65-79.
[33] CHO H W,JIN H S,EOM Y B.FGFRL1 and FGF genes are associated with height,hypertension,and osteoporosis[J].PLoS One,2022,17(8):e0273237.
[34] LIAO F C,LIAO Z Q,ZHANG T,et al.ECFC-derived exosomal THBS1 mediates angiogenesis and osteogenesis in distraction osteogenesis via the PI3K/AKT/ERK pathway[J].J Orthop Translat,2022,37:12-22.
[35] BRUN J,ANDREASEN C M,EJERSTED C,et al.PDGF receptor signaling in osteoblast lineage cells controls bone resorption through upregulation of Csf1 expression[J].J Bone Miner Res,2020,35(12):2458-2469.
(編輯 郭云雁)

