T6SS效應蛋白Tae4對金黃色葡萄球菌和產單核細胞李氏桿菌的抑菌作用

摘 要: 旨在探究Ⅵ型分泌系統(Type Ⅵ secretion systems,T6SS)的毒力效應蛋白Tae4酰胺酶對金黃色葡萄球菌(Staphylococcus aureus,S. aureus)及產單核細胞李氏桿菌(Listeria monocytogenes,L. monocytogenes)的抑菌作用。將pET-28a-Tae4重組質粒轉化至大腸桿菌表達菌株BL21(Escherichia coli BL21,E. coli BL21)進行目的蛋白誘導表達,優化IPTG的誘導時間、濃度、溫度,最后純化后的Tae4蛋白通過瓊脂孔擴散試驗、最小抑菌濃度測定、抗生素聯用抑菌試驗分別作用于S. aureus和 L. monocytogenes。SDS-PAGE電泳結果顯示,本試驗中重組蛋白誘導表達最佳條件為:IPTG終濃度為0.5 mmol·L-1,16 ℃誘導16 h。重組蛋白大小約為21 ku,可溶性表達于培養上清中。瓊脂孔擴散試驗結果顯示,Tae4蛋白濃度500 μg·mL-1時S. aureus菌株均出現13mm以上抑菌圈,效果與菌株血清型有關,L. monocytogenes菌株均出現18mm以上抑菌圈;最小抑菌濃度試驗結果顯示,Tae4蛋白對S. aureus的MIC約為 250 μg·mL-1,對L. monocytogenes的MIC約為125 μg·mL-1,點板法和微量肉湯稀釋法結果一致;抗生素聯用抑菌試驗結果顯示,Tae4蛋白與青霉素(penicillin,PG)聯合使用均比單獨使用的抑菌效果要好,且對 L. monocytogenes的抑菌效果優于S. aureus。綜上,Tae4蛋白對金黃色葡萄球菌和產單核細胞李氏桿菌具有抑菌效果,與青霉素聯用抑菌效果得到了增強,為后續抗生素替代提供理論依據。
關鍵詞: Tae4;Ⅵ型分泌系統;金黃色葡萄球菌;產單核細胞李氏桿菌;抗生素替代
中圖分類號:S859.796
文獻標志碼:A
文章編號:0366-6964(2024)10-4660-10
收稿日期:2023-11-24
基金項目:2022年國家級大學生創新創業訓練計劃項目(S202210364039;S202210364026);2023年安徽農業大學省級大學生創新創業訓練計劃項目(X202310364040)
作者簡介:占樂楊(2003-),女,安徽屯溪人,本科生,主要從事禽致病性大腸桿菌研究,E-mail:13705593713@163.com;茍婧萱(2003-),女,青海城中人,本科生,主要從事禽致病性大腸桿菌研究,E-mail: 1492648151@qq.com。占樂楊和茍婧萱是同等貢獻作者
*通信作者:宋祥軍,主要從事禽致病性大腸桿菌研究,E-mail: sxj@ahau.edu.cn
Study on the Antibacterial Effect of T6SS Effector Protein Tae4 on S. aureus
and L. monocytogenes
ZHAN" Leyang, GOU "Jingxuan, ZHANG" Manqi, FU" Weixuan, LAN" Shouxin, TU" Jian, WANG" Zhenyu,
SHAO" Ying, SONG Xiangjun*
(College of Animal Science and Technoogy,Anhui Agricultural University, Hefei 230000, China)
Abstract:" The aim of this study was to investigate the antibacterial effect of Tae4 amidase, a virulent effector protein of Type VI secretion systems, on Staphylococcus aureus (S. aureus) and Listeria monocytogenes (L.monocytogenes). The recombinant plasmid pET-28a-Tae4 was transformed into E. coli expression strain BL21 to induce expression, and the induction time, concentration and temperature of IPTG were optimized. Finally, the purified Tae4 protein was tested by Agar pore diffusion test, minimal inhibitory concentration test and antibacterial test combining with antibiotic on S. aureus and L. monocytogenes, respectively. SDS-PAGE results showed that the optimal expression conditions were as follows: the final concentration of IPTG was 0.5 mmol·L-1 at 16 ℃ for 16 h,the size of the recombinant protein was about 21 ku, and existed in the form of soluble supernatant. The results of Agar pore diffusion test showed that when the concentration of Tae4 protein was 500 μg·mL-1 , S. aureus strains showed bacteriostatic zones above 13mm, and the effect was related to the serotype of strains, and L. monocytogenes strains showed bacteriostatic zones above 18 mm. Minimum inhibitory concentration test showed that MIC of Tae4 against S.aureus was about 250 μg·mL-1, MIC of Tae4 against L. monocytogenes was about 125 μg·mL-1, which were consistent with spot plate method and microbroth dilution method. The combination test showed that the bacteriostatic effect of Tae4 protein combined with penicillin was better than that of penicillin alone. Furthermore, the antibacterial effect of L. monocytogenes was better than that of S. aureus. In summary, Tae4 protein has bacteriostatic effect on S.aureus and L. monocytogenes, and the bacteriostatic effect combined with penicillin has been enhanced,which provides a theoretical basis for subsequent antibiotic substitution.
Key words: Tae4; type Ⅵ secretion system; S. aureus; Listeria monocytogenes; alternative to antibiotics
*Corresponding author:SONG Xiangjun,E-mail:sxj@ahau.edu.cn英文通信作者
金黃色葡萄球菌和產單核細胞李氏桿菌屬于革蘭陽性菌,是常見的人畜共患病原菌[1-2]。在抗生素減抗禁抗背景下,尋找有效的生物制品將減緩細菌耐藥性的產生。有研究發現,細菌在有限資源競爭中進化出多種抗菌途徑,這些途徑通常針對保守的結構,如細菌的細胞壁[3]。而相較于革蘭陰性菌,陽性菌的細胞壁肽聚糖層較厚且覆蓋在外層,缺乏外膜的保護易受到外界環境的影響甚至導致菌體死亡[4-5]。
T6SS是一種主要存在于革蘭陰性菌中的跨膜結構,通過跨膜通道直接將效應蛋白從胞質轉運到靶細胞或胞外環境中[6]。T6SS除了與細菌的致病性有關外,還可以增強細菌適應環境的能力,參與細菌的種內和種間競爭,這是因為T6SS分泌一些能夠抑制競爭菌的生長,甚至將其殺死的毒性蛋白[7,8]。2012年Russell等[9]發現了一類具有酰胺酶活性的效應蛋白,并通過生信學分析分為4個超家族,命名為Tae1-4。研究表明這些效應蛋白作用于肽聚糖的多肽部分,但因切割特異性而不同,其中Tae4裂解多肽鏈中c-D-谷氨酰基-L-Meso-二氨基戊二酸酰胺鍵,即有望通過破壞細菌細胞壁以達到抑菌作用[9]。隨著革蘭陽性菌引起的感染率逐漸升高,獸用抗生素廣泛使用甚至濫用,導致細菌的耐藥性不斷增強[10]。目前對于T6SS中的抗菌效應蛋白著重在其蛋白結構的探索,較少文獻報道其應用于具體菌株中的抗菌能力。鑒于Tae4酰胺酶有抑菌活性,本研究擬通過原核表達載體pET-28a-Tae4表達及純化Tae4蛋白,通過體外抑菌試驗與青霉素聯用試驗來驗證該重組蛋白對兩種典型革蘭陽性菌是否有抑菌效果,為減少或替代抗生素在防治革蘭陽性菌感染中的使用提供科學依據 。
1 材料與方法
1.1 重組質粒的轉化
將由安徽通用生物有限公司合成的5 μL pET-28a-Tae4重組質粒(Tae4基因根據鼠傷寒沙門菌LT2 NCBI Reference Sequence: NC_003197.2 設計)熱激法轉化至100 μL大腸桿菌 DH5α感受態細胞中。放入37 ℃ 恒溫搖床上180 r·min-1震蕩培養45 min。在5 000 r·min-1離心10 min后,丟棄多余的上清液,將約100 μL上清液留在EP管中用以重懸細菌,在超凈臺中將懸浮液均勻地涂覆在含濃度為100 μg·mL-1卡那霉素(kanamycin,Kana)的Luria-Bertani(LB)固體培養基上,并在37℃恒溫培養箱中培養過夜。
1.2 重組質粒的篩選
挑取上述平板中表面光滑、邊緣平整的圓形菌落接種到 1 mL的含 Kana(100 μg·mL-1)的LB 液體培養基,溫度37℃震蕩培養 4~6 h,根據NCBI數據庫公布的基因序列(NC_003197.2),設計Tae4基因的特異引物,上游引物Tae4-F:5′-AAGTTAATCATAGCGTTGCCGATGT-3′,下游引物Tae4-R:5′-CTCTGTTTCGGATTATTCAC-3′,取 1 μL 的菌液作為模板進行聚合酶鏈式反應(polymerase chain reaction,PCR)驗證,將PCR 產物經 1.2%的瓊脂糖核酸凝膠電泳,使用紫外照膠儀成像,觀察有無目的片段;將 PCR 結果為陽性的菌液送去上海生工生物工程技術服務有限公司測序,用snapgene軟件對測序結果進行分析。
1.3 重組蛋白的可溶性分析
將篩選出的陽性重組質粒的菌液用 SanPrep 柱式質粒 DNA 小量抽提試劑盒抽提質粒,并轉化到E. coli BL21感受態細胞(轉化方法同“1.1”),將篩選出的含陽性質粒的菌液37℃振蕩培養至OD600 nm =0.6誘導。設置16、37 ℃兩種溫度組進行誘導,完成后收集菌體,磷酸緩沖鹽溶液(phosphate buffer saline,PBS)重懸菌體沉淀,超聲裂解至液體清亮,離心后收集上清和沉淀進行SDS -PAGE 電泳驗證。
1.4 重組蛋白Tae4的誘導表達條件的優化
不同蛋白的最優表達條件不相同,通過優化誘導時間、誘導溫度和IPTG終濃度來摸索重組蛋白Tae4的最佳表達條件,將目的蛋白大量表達于上清液。試驗中,僅改變其中一個影響因素而保持其他影響因素不變,來分析各影響因素對重組蛋白表達的影響,主要包括IPTG的誘導時間和終濃度。設置誘導時間和溫度分別為37 ℃、5 h和16 ℃、16 h,設置IPTG誘導終濃度分別為0.25、0.5、1 mmol·L-1。誘導后收集菌體,離心清洗后收集上清進行SDS-PAGE電泳驗證。分析Tae4蛋白的表達量,確定IPTG最佳終濃度和誘導表達最佳時間。
1.5 重組蛋白Tae4的純化
Tae4和His-Tag以融合蛋白的形式表達,用His磁珠進行純化。選擇最佳表達條件下的可溶性上清加入到預處理好的磁珠中,顛倒混勻放置在混合儀上,室溫孵育30 min 。將離心管置于磁分離器,待溶液變澄清后,用移液器移出上清液。向離心管中加入 2 倍懸浮液體積的 Wash Buffer(50 mmol·L-1 NaH2PO4,300 mmol·L-1 NaCl,20 mmol·L-1 imidazole,pH 8.0),使用槍頭反復吹打,將離心管置于磁分離器上,待溶液變澄清后,用移液器吸取上清液,重復步驟次數視洗雜情況而定,吸取的上清液保留備用以便檢測。將 3倍磁珠體積的 Elution Buffer(50 mmol·L-1 NaH2PO4,300 mmol·L-1 NaCl,250 mmol·L-1 imidazole,pH 8.0)加入到離心管中,使用移液器輕輕吹打 3~5 次,混勻,將離心管置于磁分離器上,待溶液變澄清后,用移液器吸取上清液,即為目的蛋白。純化后的蛋白采用SDS-PAGE電泳進行純化驗證。
1.6 重組蛋白Tae4的抗菌譜測定
1.6.1 重組蛋白Tae4的瓊脂孔擴散抑菌試驗
測定重組蛋白Tae4的蛋白濃度,并將其濃度調整至500 μg·mL-1,選取本實驗室分離保存的S. aureus(ATCC 25923)、S. aureus(ATCC 6538)、S. aureus(CMCC 26003)、S. aureus 77、L.monocytogenes 26 、L.monocytogenes 32 、L.monocytogenes 36培養至對數生長期,用高溫滅菌的LB液體培養基將其稀釋至1×105 CFU·mL-1。配制10個20 mL濃度為1%的固體培養基,121 ℃高壓滅菌20 min,取各稀釋菌液20 μL分別加入LB固體培養基中,混合后分別倒入滅菌的平皿中,凝固后用打孔器打孔(4孔·板-1),在相應的孔中加入200 μL重組蛋白質,并設立陰性對照組。將平板放在4℃冰箱中過夜,然后在37 ℃培養14~18 h,取出平板觀察抑菌圈,并測量抑菌圈直徑。一般認為抑菌圈直徑小于10 mm為不敏感;10~14 mm為中等敏感;15~20 mm為高度敏感;大于20 mm為極敏感。
1.6.2 點板法測定重組蛋白的Tae4的最小抑菌濃度
調整重組蛋白濃度至500 μg·mL-1,將重組蛋白Tae4加入定量水解酪蛋白瓊脂(Mueller-Hinton Agar,MHA)中,制成濃度梯度的抗菌藥物平板:500、250、125、62.5、31.25 μg·mL-1。將配制好的藥物 MHA 平板放置4℃ 48 h后進行試驗。選取本實驗室分離保存的S. aureus(ATCC 25923)、S. aureus(ATCC 6538)、S. aureus(CMCC 26003)、S. aureus 77、L. monocytogenes 26、L. monocytogenes 32、L. monocytogenes 36培養至對數生長后稀釋10倍倒入比色皿,用胰蛋白胨大豆肉湯(Tryptone Soy Broth,TSB)校正濃度(即菌終濃度為1~2×108CFU·mL-1),將菌液梯度稀釋 101、102、103、104、105倍后,5 個稀釋倍數分別用移液槍吸取2μL接種到平板上,設置一組不加Tae4蛋白的平板做陽性對照。37 ℃孵育16h,觀察試驗結果。
1.6.3 微量肉湯稀釋法測定重組蛋白Tae4的最小抑菌濃度
將上述2 種病原菌接種至LB培養基,振蕩培養至 OD600nm=1.0(即菌濃度約為 109 CFU·mL-1),然后用MH無菌肉湯以10倍梯度稀釋至終濃度約為 106 CFU·mL-1,充分混勻后待用。取無菌 96 孔板,所需孔均加入 100 μL 無菌肉湯培養基。第 3 列每孔加入 100 μL Tae4蛋白(500 μg·mL-1)用移液槍充分吹打(至少3次以上),從第3列吸100 μL 加到第 4 列吹打均勻,以此類推,直到第 8 列混勻后吸出 100 μL 棄掉,最后除第二列外每孔加入100 μL病原菌稀釋液,一列作為陰性對照(只含MH無菌肉湯和菌液)。37℃孵育每隔 2 h 測其 OD600 nm值,連續測10 h,記錄結果。
1.7 重組蛋白Tae4與PG聯合抑菌試驗
將青霉素鈉配制成8個梯度(分別為1 600、800、400、200、100、50、25、12.5 μg·mL-1),進行瓊脂孔擴散抑菌試驗來測定PG對2種病原菌大致的MIC范圍,試驗方法同“1.6.1”。選取實驗室保存的對PG耐藥的8株菌株分別是S. aureus(ATCC 6538)、S. aureus 76、S. aureus 92、S. aureus 93、 L. monocytogenes 36 培養至OD600 nm=1.0時(即菌濃度約為 109 CFU·mL-1),分別將8種病原菌十倍梯度稀釋3次(即菌終濃度約為 105~106 CFU·mL-1)充分混勻待用。將上述備好的每株菌液都分成4組,分別加入PBS、Tae4(125.0 μg·mL-1)、PG(200 μg·mL-1)、 Tae4(125.0 μg·mL-1)及PG(200 μg·mL-1)聯合使用,加入PBS的菌液組做陰性對照。常溫下作用30 min后放入37℃恒溫箱培養10 h,測其OD600nm值,記錄結果。
1.8 數據分析
數據以“平均值±標準誤差(x-±sx-)”表示。采用 GraphPad Prism 8.0 軟件試驗結果進行單因素方差分析,顯著性用 P 值表示,P<0.05 代表差異顯著,本研究所有試驗均重復 3 次。*表示 Plt;0.05 即差異顯著,**表示 Plt;0.01 即差異極顯著。
2 結 果
2.1 重組質粒的篩選
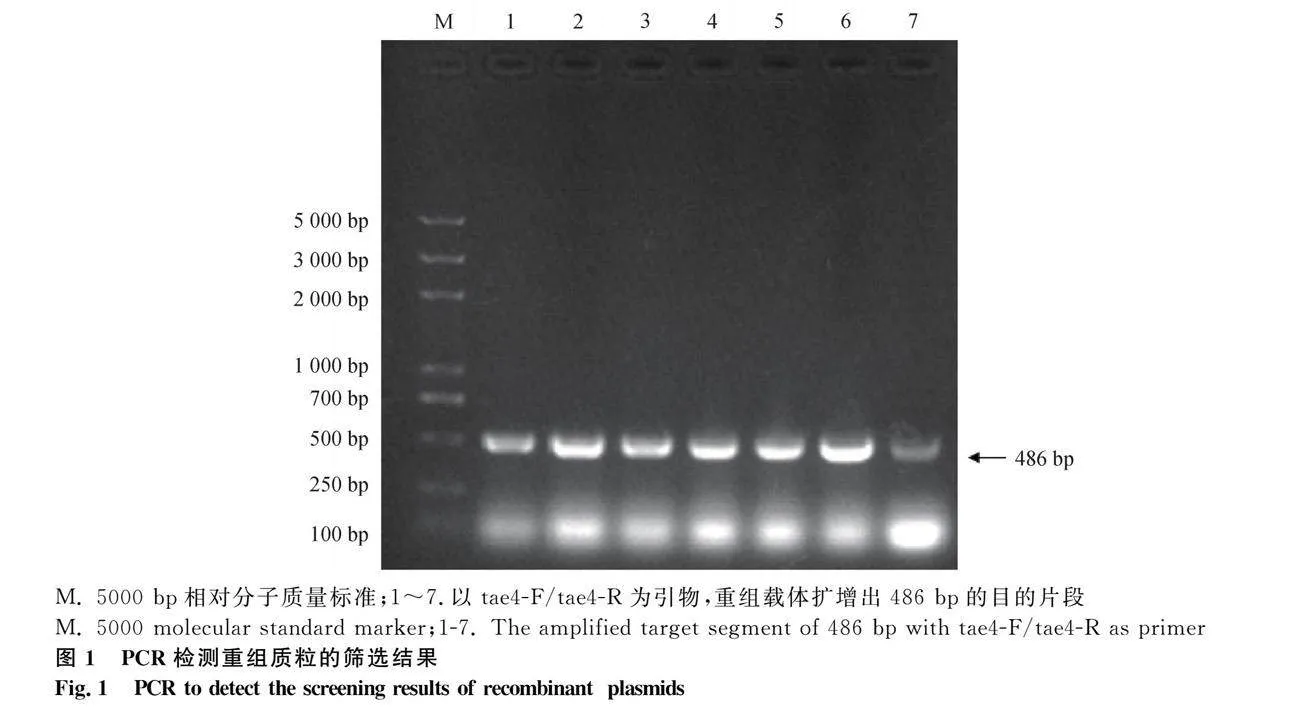
挑取生長良好的陽性菌落至含Kana的LB液體培養基培養,取1 μL菌液作為模板進行PCR擴增,含重組質粒的菌液經1.2%瓊脂糖凝膠電泳鑒定(圖1),發現在486 bp處特異性條帶,與預期目的條帶大小一致,表明重組質粒篩選成功。
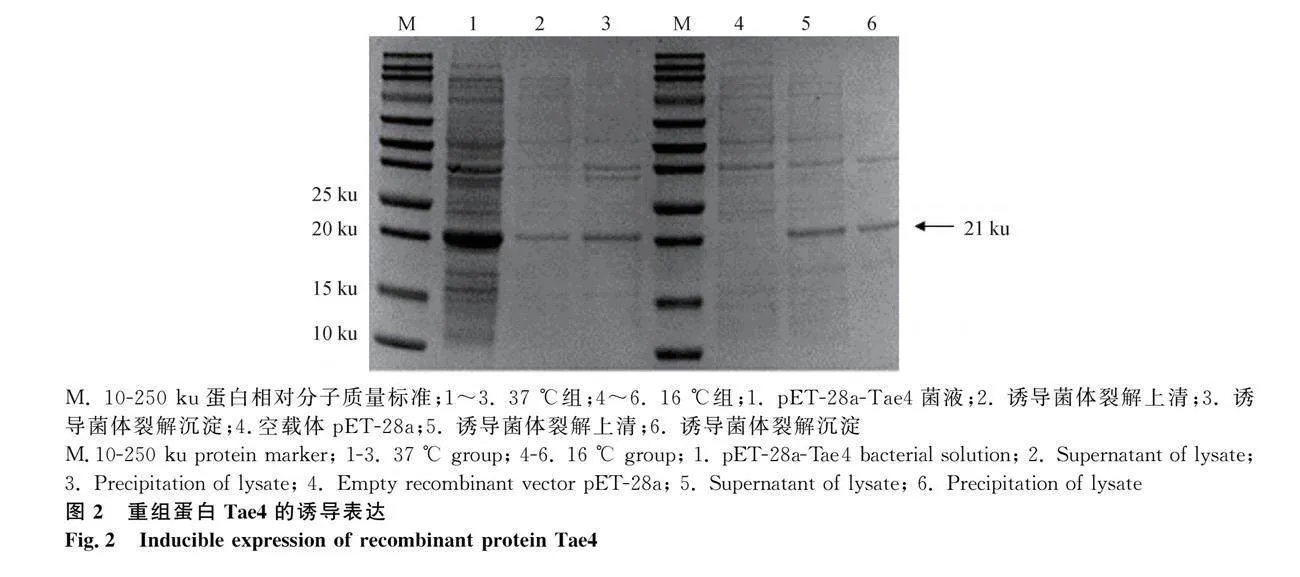
2.2 重組蛋白Tae4可溶性分析
將 pET-28a-Tae4重組菌株誘導后的菌液進行超聲震碎,離心收集上清和沉淀進行 SDS-PAGE 電泳分析。結果如圖2所示,第1孔的重組菌株表達的蛋白在 21 ku處有明顯條帶,與預期蛋白大小一致。在37℃條件下上清處條帶較包涵體處條帶更淺,但在16℃下上清的條帶寬度及顏色深于包涵體條帶,說明Tae4蛋白表達產物在低溫時主要以可溶性上清的形式存在,因此選擇低溫誘導組進行后續的試驗。
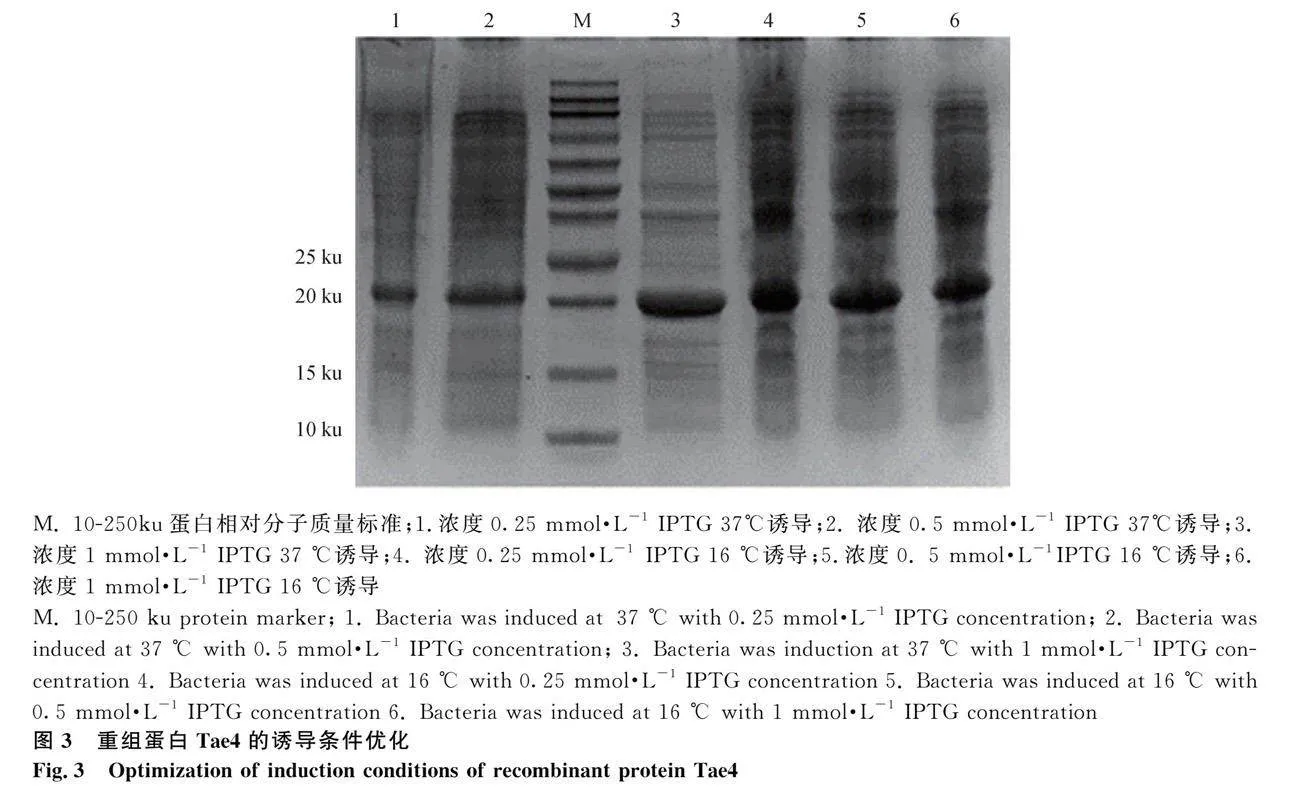
2.3 重組蛋白Tae誘導條件的優化
不同的誘導溫度、濃度、時間影響目的蛋白的表達。為了提高 Tae4融合蛋白的表達量,對誘導條件進行優化,主要包括 IPTG 的終濃度和誘導表達時間,誘導后收集菌體進行SDS-PAGE電泳分析。觀察下圖發現Tae4在16 ℃、IPTG 濃度為0.5 mmol·L-1誘導16 h的條件下,表達量最佳(圖3)。
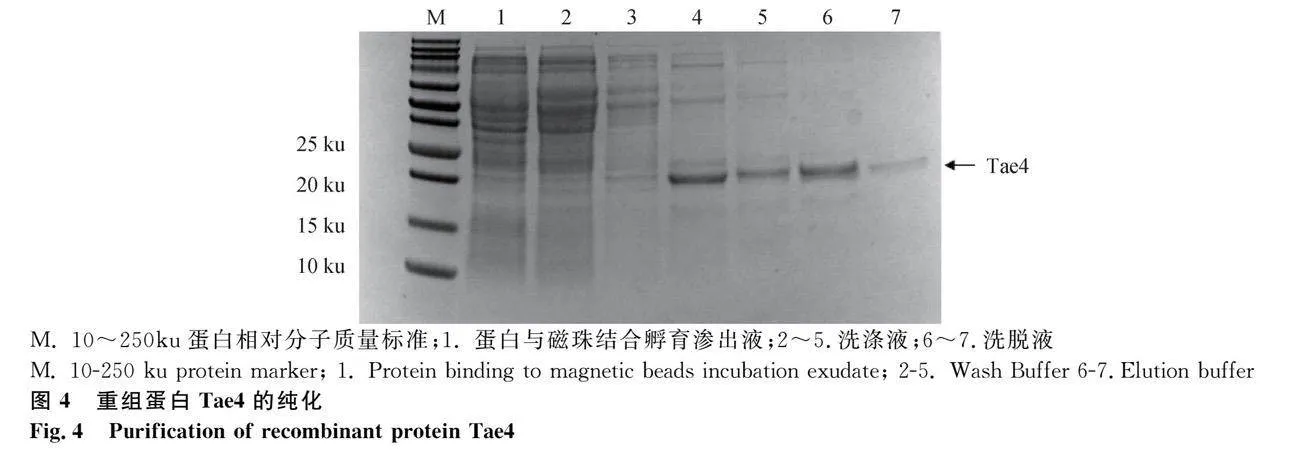
2.4 重組蛋白Tae4的純化
選擇重組質粒最優表達的上清進行純化,SDS-PAGE 電泳分析純化效果。第1~7孔為重組蛋白Tae4破碎上清純化后洗脫7次的目的蛋白,在凝膠跑道上顯示與目的蛋白大小相符的單一條帶,無明顯雜帶,結果表示純化結果良好(圖4)。
2.5 重組蛋白Tae4對金黃色葡萄球菌的抑菌作用
2.5.1 重組蛋白Tae4單獨抑制試驗S. aureus試驗
瓊擴試驗結果顯示,重組蛋白Tae4對所選試驗菌株均有抑菌效果,試驗組出現抑菌圈,而陰性對照組未出現抑菌圈。其中,Tae4蛋白抑制CMCC26003、ATCC25926、ATCC6538的平均抑菌圈直徑分別為13.8、22.3、20.0 mm,與CMCC26003組的抑菌圈直徑相比,ATCC25926、ATCC6538對Tae4蛋白有更高的敏感性。
點板法試驗結果顯示,當Tae4添加濃度為31.25 μg·mL-1 時,3株菌的生長狀態較陽性對照有減弱現象。當Tae4濃度為62.5 μg·mL-1 時,ATCC6538的生長受到明顯抑制,CMCC26003和ATCC25923基本無變化。當添加的Tae4濃度為250 μg·mL-1 時,3株菌的生長均受到了明顯的抑制。
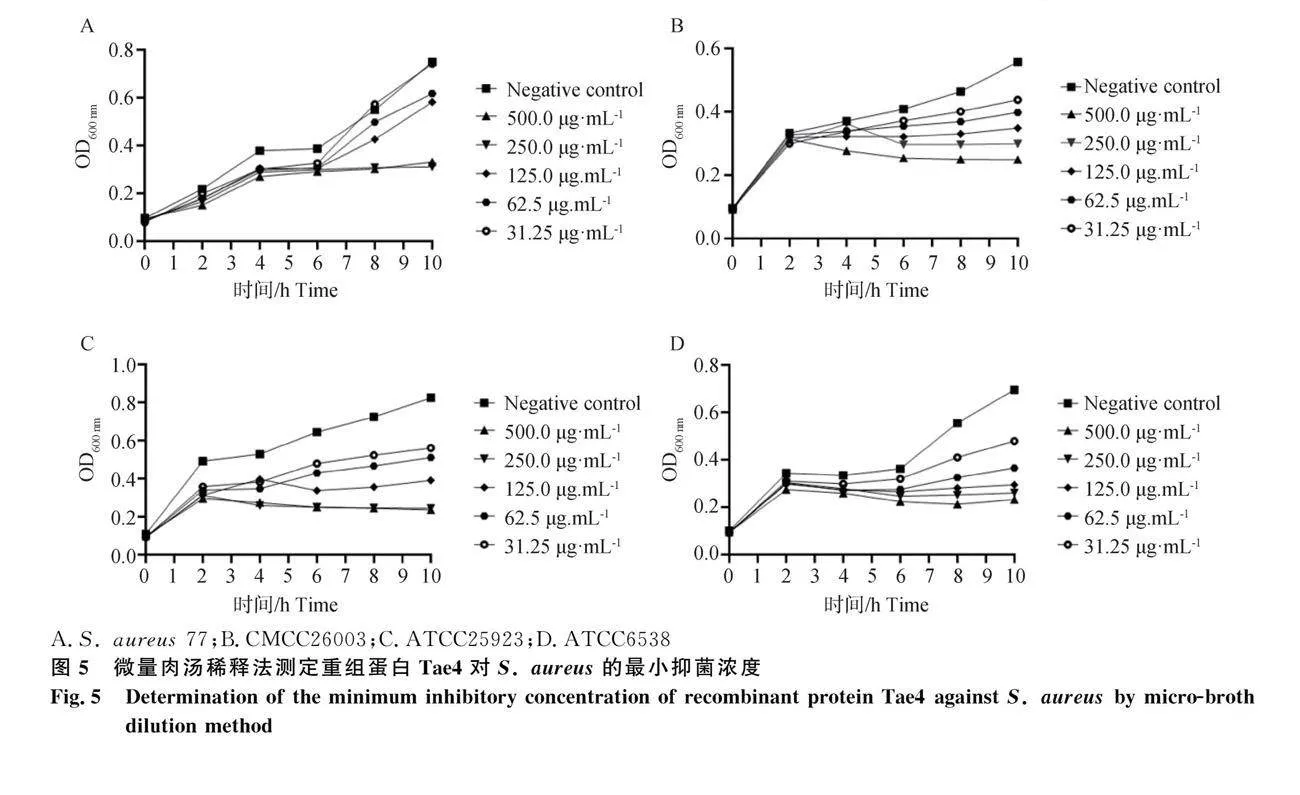
微量肉湯稀釋法結果顯示,重組蛋白Tae4為125 μg·mL-1時,S. aureus(ATCC25923)和S. aureus(ATCC6538)生長曲線平緩,低于125 μg·mL-1時生長曲線有向上趨勢,大致估計Tae4對S. aureus(ATCC25923)和S. aureus(ATCC6538)的MIC為125 μg·mL-1。同樣的方法估計Tae4對S. aureus(野生株77)和S. aureus(CMCC26003)的MIC為250" μg·mL-1(圖5)。
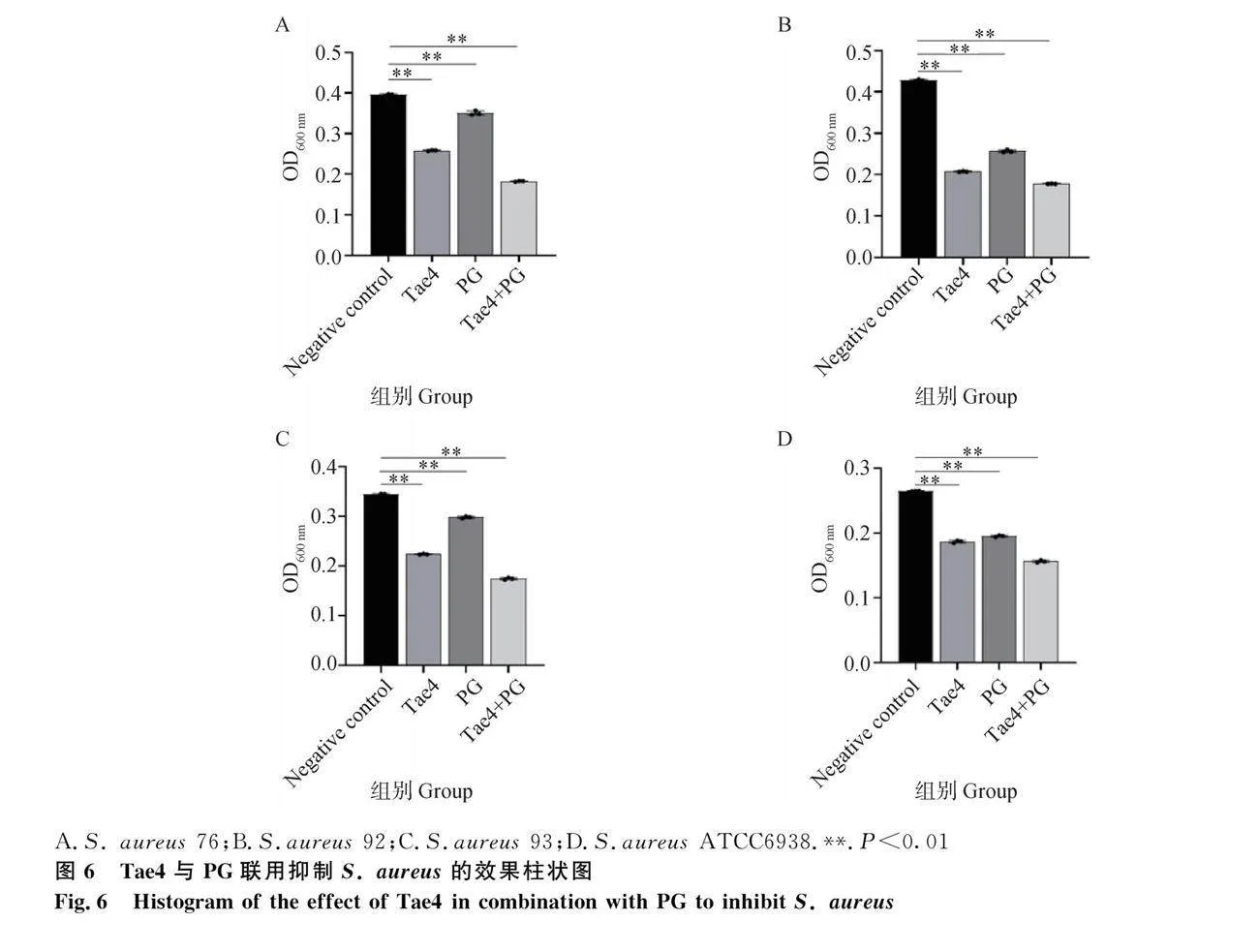
2.5.2 重組蛋白Tae4與PG聯合抑制S. aureus試驗" 聯用抑菌試驗結果顯示:與對照組相比,抑菌效果都有一定的提升,特別是對于野生株S. aureus 76和S. aureus 93有較大提升,抑菌效果明顯(圖6)。
2.6 重組蛋白Tae4對產單核細胞李氏桿菌的抑菌效果
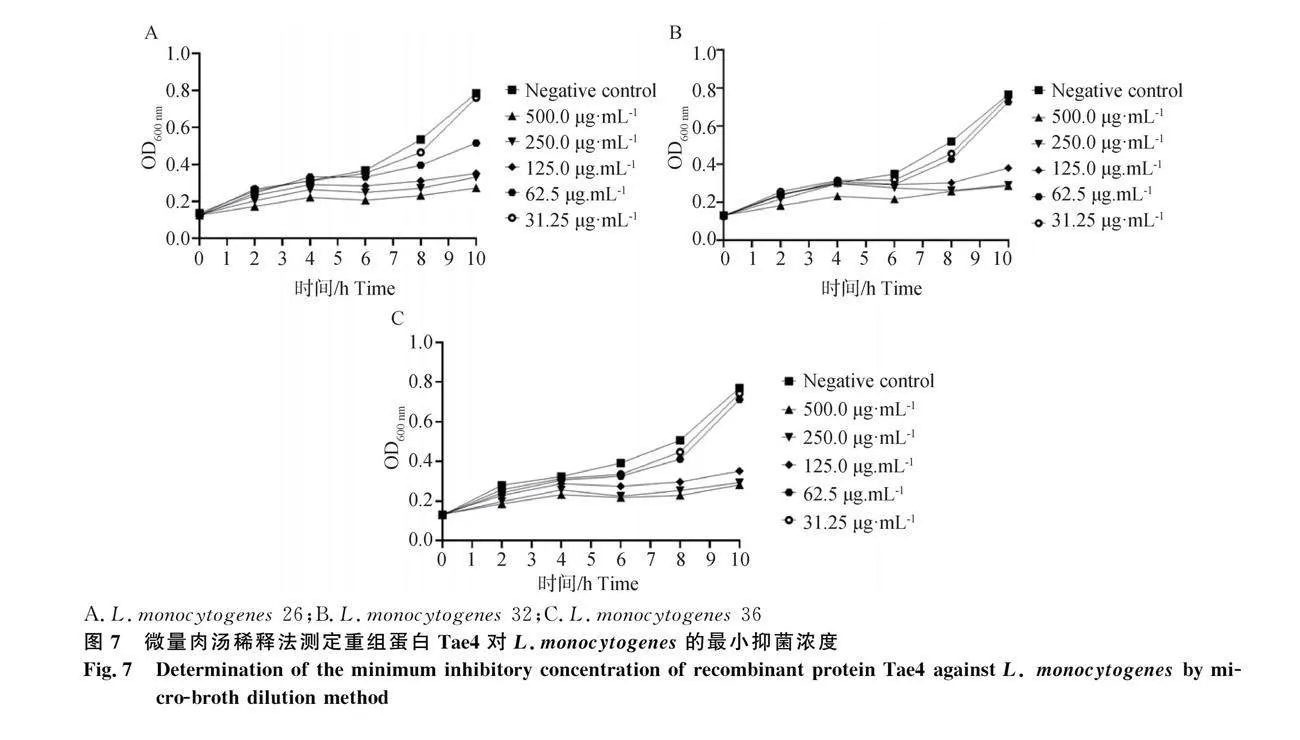
2.6.1 重組蛋白Tae4單獨抑制L.monocytogenes試驗
瓊擴試驗結果顯示,重組蛋白Tae4對L.monocytogenes 26、L.monocytogenes 32、L.monocytogenes 36均有抑菌效果,試驗組出現抑菌圈,而陰性對照組未出現抑菌圈。其中,Tae4蛋白抑制L.m-26、L.m-32、L.m36的平均抑菌圈直徑分別為21.0、19.0、21.0 mm,三株菌均一致表現出較高的敏感性。
點板法試驗結果顯示,當Tae4添加濃度為31.25 μg·mL-1 時,觀察平板,發現5個梯度的菌落生長狀態良好,與陽性對照組相差不大,3株菌的生長狀態良好。當Tae4濃度為62.5 μg·mL-1 時,3株菌在稀釋到104倍時,發現菌株生長受到了明顯抑制,而當添加的Tae4濃度到達125 μg·mL-1 時,3株菌的生長均受到了明顯的抑制,觀察平板發現 無肉眼可見的菌落。該濃度為后續試驗提供指導。
微量肉湯稀釋法結果顯示,4 h左右Tae4蛋白對細菌生長的影響逐漸增強,當Tae4濃度為125 μg·mL-1時,細菌生長曲線較為平緩,Tae4濃度62.5 μg·mL-1時細菌生長曲線有向上趨勢。可以判斷重組蛋白Tae4對L.monocytogenes 26、L.monocytogenes 32、L.monocytogenes 36的MIC均約為125 μg·mL-1(圖7)。
2.6.2 重組蛋白Tae4與PG聯合抑制L. monocytogenes試驗
聯用抑菌試驗結果顯示:當重組蛋白Tae4與PG聯合使用時,OD600nm值比單獨使用時下降,表明抑菌效果有一定的提升(圖8)。
3 討 論
革蘭陰性菌T6SS能夠分泌效應因子,在種內和種間競爭中發揮重要作用,Russell等人已經鑒定出三種主要的效應因子:酰胺酶[9]、磷脂酶[11]和肽聚糖水解酶[12]。而Tae家族是T6SS中近幾年新發現的一類具有酰胺酶活性的抗菌效應因子,Benz團隊[19]在研究鼠傷寒沙門菌T6SS的效應蛋白時發現,當Tae4輸出到大腸桿菌胞質中不干擾細菌增殖,但定位于細菌周圍后細胞生長受到損害。后續發現Tae4蛋白能作用于細胞壁通過裂解c-D-谷氨酰基-L-Meso-二氨基戊二酸酰胺鍵且特異性地水解鼠多肽的受體莖以降解肽聚糖,最終消滅細菌,有望其作為一種綠色安全的抗生素替代品應用于臨床治療[13]。
由于包涵體中表達的蛋白沒有生物活性,且有研究表明通過異源表達系統表達目的蛋白Tae4時,包涵體表達較多或與上清液持平,因此進行重組蛋白的表達與純化時應摸索條件使Tae4表達于上清液[13]。考慮到目的蛋白可溶性和表達量會受到誘導條件的影響,誘導劑IPTG會根據情況進行濃度、溫度、時間的調整[14]。柴政斌等[15]發現在16 ℃時可溶重組蛋白明顯比37 ℃時比例高,在本試驗的Tae4蛋白可溶性分析中顯示表達產物在16℃時主要以可溶性上清液形式存在,而在37 ℃時包涵體大量表達。研究發現 IPTG濃度也起到了重要的作用,當IPTG濃度較低時,會導致誘導效率的降低,但當IPTG濃度過高時,也會引起蛋白濃度的下降,包涵體積累過大[16,17]。故設置了三個不同的IPTG濃度試驗組,發現終濃度為0.5mmol·L-1利于上清液的高效表達。經過上述摸索,最終發現在16 ℃、IPTG 濃度為0.5 mmol·L-1誘導16 h的條件下,目的蛋白Tae4表達量最佳。此外,通過大腸桿菌表達系統表達目的蛋白時,載體標簽蛋白的存在有利于重組蛋白的純化,故使用His標簽純化蛋白[18]。
本試驗使用可溶性的上清表達來進行抑菌效果測試,結果表明Tae4對所選試驗菌均有抑菌作用。瓊擴試驗表示,Tae4蛋白對金葡菌受試菌種均有抑菌圈,其抑菌作用與菌株血清型有關;產單核細胞李氏桿菌的抑菌效果優于金葡菌,3株受試菌均有明顯的抑菌圈。點板法測定最小抑菌濃度試驗結果顯示金葡菌MIC為250 μg·mL-1,該結果與微量肉湯稀釋法接近,產單核細胞李氏桿菌來MIC為125 μg·mL-1,該結果也與微量肉湯稀釋法接近。Tae4效應蛋白具有抑菌活性,這與Benz團隊[19]所研究的結果相符。進一步證實了革蘭陰性菌中T6SS效應蛋白Tae4有抑制革蘭陽性菌的效果。
由于抗生素的濫用,有研究表明幾種常用于治療葡萄球菌感染的抗生素殺菌效果已不理想,可能是由于滲透性改變或作用環境改變[1]。張馨元等[20]發現抗菌肽和酰胺酶聯合應用時,酰胺酶彌補了抗菌肽對較厚細胞壁無穿透力的缺陷,對治療糞腸球菌感染有提升效果。青霉素作為β-內酰胺類抗生素,其β-內酰胺環中的羧基和細菌相應 PBPs 結合,使細胞壁中的肽聚糖無法交聯,網狀細胞壁無法形成,同時Tae家族有切割短肽鏈破壞肽聚糖層結構使靶細胞細胞壁破裂的抗菌效應,因此本研究試探究Tae4蛋白和青霉素聯合作用是否可以對這兩種菌產生協同作用以有效增強殺菌效果,從而降低抗生素用量減少細菌耐藥性的產生[21-22]。首先用瓊脂擴散法大致測出PG對兩種菌的最小抑菌濃度,后續選用對PG耐藥的八株菌株進行試驗,從結果來看聯合使用Tae4和PG比單獨使用產生了更好的效果,且從結果上看產單核細胞李氏桿菌組比金葡組抑菌效果要好,綜上所述,兩種菌均一致表現出Tae4蛋白與PG的聯合使用具有協同抑菌作用。
本研究表明利用大腸桿菌表達菌株BL21在低溫條件下誘導表達獲得了可溶性重組蛋白Tae4,體外抑菌試驗表明Tae4重組蛋白對所選的兩種革蘭陽性菌均有抑菌作用,聯合青霉素使用時抑菌效果得到不同程度的提升。本研究為后續利用大腸桿菌原核表達系統來研發Tae4蛋白類抗生素替代物提供理論依據,為動物性食品安全和人類健康展現廣闊的前景。
4 結 論
本研究完成了重組蛋白Tae4的上清表達與純化,發現在16℃、IPTG 濃度為0.5 mmol·L-1誘導16 h的條件下,蛋白表達量最佳。經抑菌試驗表明其對金黃色葡萄球菌和產單核細胞李氏桿菌均具有抗菌作用,和PG聯用時具有協同抗菌作用,且對產單核細胞李氏桿菌的抑菌效果優于金黃色葡萄球菌。
參考文獻(References):
[1] 韓塔拉, 王俊瑞. 金黃色葡萄球菌異質性耐藥機制及實驗室檢測技術[J]. 中國感染控制雜志, 2022, 21(12):1249-1256.
HAN T L, WANG J R. Mechanisms and laboratory detection technologies of heteroresistance in Staphylococcus aureus[J]. Chinese Journal of Infection Control, 2022, 21(12):1249-1256. (in Chinese)
[2] 張 旭. 單核細胞增生李斯特菌(Listeria monocytogenes)分型及檢測新方法探究[D]. 廣州:華南理工大學, 2021.
ZHANG X. Research on new methods for typing and detection of Listeria monocytogenes[D]. Guangzhou:South China University of Technology, 2021. (in Chinese)
[3] VOLLMER W, BERTSCHE U. Murein (peptidoglycan) structure, architecture and biosynthesis in Escherichia coli[J]. Biochim Biophys Acta (BBA)-Biomembr, 2008, 1778(9):1714-1734.
[4] 王增航, 董 濤. 霍亂弧菌Ⅵ型分泌系統的效應蛋白對細菌細胞壁的降解機制[J]. 微生物學通報, 2021, 48(1):135-144.
WANG Z H, DONG T. Bacterial cell wall degradation by type Ⅵ secretion system effector proteins in Vibrio cholerae[J]. Microbiology China, 2021, 48(1):135-144. (in Chinese)
[5] TONG G, PAN Y, DONG H, et al. Structure and dynamics of pentaglycyl bridges in the cell walls of Staphylococcus aureus by13C-15N REDOR NMR[J]. Biochemistry, 1997, 36(32):9859-9866.
[6] BOYER F, FICHANT G, BERTHOD J, et al. Dissecting the bacterial type VI secretion system by a genome wide in silico analysis: what can be learned from available microbial genomic resources?[J]. BMC Genomics, 2009, 10(1):104.
[7] HOFER U. T6SS: shoot and scrub[J]. Nat Rev Microbiol, 2020, 18(8):412-413.
[8] SANA T G, BERNI B, BLEVES S. The T6SSs of Pseudomonas aeruginosa strain PAO1 and their effectors: beyond bacterial-cell targeting[J]. Front Cell Infect Microbiol, 2016, 6:61.
[9] RUSSELL A B, SINGH P, BRITTNACHER M, et al. A widespread bacterial type VI secretion effector superfamily identified using a heuristic approach[J]. Cell Host Microbe, 2012, 11(5):538-549.
[10] NAYLOR N R, SILVA S, KULASABANATHAN K, et al. Methods for estimating the burden of antimicrobial resistance:a systematic literature review protocol[J]. Syst Rev, 2016, 5(1):187.
[11] RUSSELL A B, LEROUX M, HATHAZI K, et al. Diverse type VI secretion phospholipases are functionally plastic antibacterial effectors[J]. Nature, 2013, 496(7446):508-512.
[12] WHITNEY J C, CHOU S, RUSSELL A B, et al. Identification, structure, and function of a novel type vi secretion peptidoglycan glycoside hydrolase effector-immunity pair[J]. J Biol Chem, 2013, 288(37):26616-26624.
[13] LU D F, ZHENG Y S, LIAO N S, et al. The structural basis of the Tle4-Tli4 complex reveals the self-protection mechanism of H2-T6SS in Pseudomonas aeruginosa[J]. Acta Crystallogr D Biol Crystallogr, 2014, 70(Pt 12):3233-3243.
[14] MATSUMOTO T, TAKAHASHI S, UEDA M, et al. Preparation of high activity yeast whole cell bioctalysts by optimization of intracellular production of recombinant Rhizopus oryzae lipase[J]. J Mol Catal B Enzym, 2002, 17(3/5):143-149.
[15] 柴政斌, 張更林, 王學政, 等. 融合蛋白GST-PADI4可溶性表達條件的優化及純化[J]. 中國生物制品學雜志, 2014, 27(3):404-408, 411.
CHAI Z B, ZHANG G L, WANG X Z, et al. Optimization of condition for soluble expression of GST-PADI4 fusion protein and purification of expressed product[J]. Chinese Journal of Biologicals, 2014, 27(3):404-408, 411. (in Chinese)
[16] RAMíREZ O T, ZAMORA R, ESPINOSA G, et al. Kinetic study of penicillin acylase production by recombinant E." coli in batch cultures[J]. Process Biochem, 1994, 29(3):197-206.
[17] PENNA T C V, ISHII M, DE SOUZA L C, et al. Expression of green fluorescent protein (GFPuv) in Escherichia coli DH5-a, under different growth conditions[J]. Afr J Biotechnol, 2004, 3(1):105-111.
[18] 狄志欣. 人胰島素原基因的克隆以及在大腸桿菌中的高效表達、質譜鑒定[D]. 蘭州:蘭州理工大學, 2015.
DI Z X. Gene cloning, prokaryotic expression, purification and MS identification of human proinsulin[D]. Lanzhou:Lanzhou University of Technology, 2015. (in Chinese)
[19] BENZ J, REINSTEIN J, MEINHART A. Structural Insights into the Effector-Immunity System Tae4/Tai4 from Salmonella typhimurium[J]. PLoS One, 2013, 8(6):e67362.
[20] 張馨元. 抗菌肽LL-37與酰胺酶聯合應用治療糞腸球菌感染的研究[D]. 呼和浩特:內蒙古農業大學, 2021.
ZHANG X Y. The effect of the combined use of antimicrobial peptide LL-37 and amidase on Enterococcus faecalis[D]. Hohhot:Inner Mongolia Agricultural University, 2021. (in Chinese)
[21] SPRATT B G. Distinct penicillin binding proteins involved in the division, elongation, and shape of Escherichia coli K12[J]. Proc Natl Acad Sci U S A, 1975, 72(8):2999-3003.
[22] WISE E M Jr, PARK J T. Penicillin:its basic site of action as an inhibitor of a peptide cross-linking reaction in cell wall mucopeptide synthesis[J]. Proc Natl Acad Sci U S A, 1965, 54(1):75-81.
(編輯 白永平)

