不同pH值對木瓜蛋白酶活性的影響及分子機制

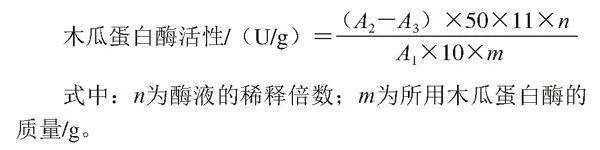

摘 要:為探究不同pH值對木瓜蛋白酶活性的影響及分子機制,采用分子模擬和熒光光譜分析等技術,對不同pH值條件下(4、5、6、7、8)木瓜蛋白酶的酶活性、均方根誤差(root mean square deviation,RMSD)、蛋白質殘基的波動、回旋半徑、蛋白間氫鍵、蛋白質二級結構和溶劑可及表面積等進行分析。結果表明:pH 7時木瓜蛋白酶活性最高,pH 4和pH 8時比pH 7時活性分別降低約5.00%和5.35%;分子模擬結果顯示,不同pH值下木瓜蛋白酶的回旋半徑波動不大,pH 8時RMSD有較大波動;pH 4和pH 8時蛋白酶活性中心的3 個氨基酸殘基有較大波動;隨著pH值的增加,木瓜蛋白酶間氫鍵數量逐漸增加,但pH 8的氫鍵數量較pH 7下降3.4 個;pH 7條件下木瓜蛋白酶活性中心與底物結合緊密,酶蛋白內部結構更致密,而pH 4條件下酶活性中心與底物結合部位縫隙較大,酶蛋白內部結構疏松;pH 4和8時活性下降與該條件下木瓜蛋白酶的結構變化有關,如氫鍵的破壞、活性中心殘基的波動、疏水表面積的改變、β-折疊等二級結構的變化等。本研究從分子模擬角度明確了pH值對木瓜蛋白酶活性的影響。
關鍵詞:木瓜蛋白酶;酶活性;pH值;分子模擬
Effect of Different pH on Papain Activity and Its Molecular Mechanism
DAI Wen, HUANG Yechuan*, HAN Jiayu, HU Xiao, LI Diandian, GUAN Sitong
(College of Food and Biology, Jingchu University of Technology, Jingmen 448000, China)
Abstract: In order to investigate the impact of different pH levels on papain activity and its molecular mechanism, molecular simulation and fluorescence spectroscopy were employed to analyze the enzyme activity, root mean square error (RMSE), root mean square fluctuation (RMSF), radius of gyration (Rg), inter-protein hydrogen bonding, protein secondary structure, and solvent accessible surface area at various pH values (4, 5, 6, 7, and 8). The results revealed that papain activity was highest at pH 7 and decreased by approximately 5.00% at pH 4 and 5.35% at pH 8 compared to pH 7, respectively. Molecular simulation results indicated that the Rg of papain exhibited minimal fluctuations across different pH levels; RMSD fluctuated greatly at pH 8, and three amino acid residues in the active center displayed significant fluctuations at both pH 4 and pH 8. As the pH value increased gradually, the number of hydrogen bonds in papain also increased except for a decrease by 3.4 atpH 8 compared to pH 7. Under a neutral condition (pH 7), the active center of papain tightly bound to its substrate with a denser internal protein structure; whereas under acidic conditions (pH 4), there was a larger gap between protease’s active center and its substrate binding site along with a looser internal protein structure. The decline in the activity observed at low pH (pH 4) and high pH (pH 8) could be attributed to structural changes protease such as disruption of hydrogen bonds, fluctuations in active center residues, alterations in hydrophobic surface area, and modifications in secondary structures such as β-sheet. This study clarified the effect of pH on papain activity from a molecular simulation perspective.
Keywords: papain; enzyme activity; pH value; molecular simulation
DOI:10.7506/rlyj1001-8123-20240618-151
中圖分類號:TS201.1 文獻標志碼:A 文章編號:1001-8123(2024)10-0009-06
引文格式:
代雯, 黃業傳, 韓佳鈺, 等. 不同pH值對木瓜蛋白酶活性的影響及分子機制[J]. 肉類研究, 2024, 38(10): 9-14. DOI:10.7506/rlyj1001-8123-20240618-151. http://www.rlyj.net.cn
DAI Wen, HUANG Yechuan, HAN Jiayu, et al. Effect of different ph on papain activity and its molecular mechanism[J]. Meat Research, 2024, 38(10): 9-14. DOI:10.7506/rlyj1001-8123-20240618-151. http://www.rlyj.net.cn
木瓜蛋白酶是一種半胱氨酸蛋白酶,也被稱為巰基蛋白酶,最早于19世紀從未成熟的番木瓜乳膠中分離獲得,是第1種確定晶體結構的蛋白酶[1]。隨著生活水平的不斷提高,人們對肉類口感的追求也不斷提升,目前市場上流通的嫩肉粉的主要成分是木瓜蛋白酶,其能將結締組織、肌纖維中的膠原蛋白及彈性蛋白分解,使氨基酸間的連接鍵斷裂,破壞肉類結構,使肉質口感細膩、嫩滑[2]。在肉類嫩化和加工過程中,加工手段或加工環境中的一些物理或化學因素會影響木瓜蛋白酶結構,進而影響蛋白酶充分發揮其酶活性,從而影響嫩化效果。如張瓊[3]研究超聲波功率及時間對木瓜蛋白酶活性的影響,結果表明,隨超聲波功率增加,木瓜蛋白酶的活力呈先上升后下降趨勢。張艷梅等[4]發現,金屬Hg2+濃度的增加會破壞木瓜蛋白酶的活性中心,導致酶的催化活性降低。
pH值在食品體系中是一個重要影響因素,也是影響酶活性的主要因素之一。不同pH值條件下酶分子的很多極性基團解離狀態不同,各極性基團所帶電荷的數量和種類也不相同,因此pH值的變化對酶與底物的親和力具有影響。除此之外,酶活性中心的空間構象也會受到pH值的影響,從而影響酶的活性。目前有許多學者就pH值對酶的活性影響進行了深入研究。陳維[5]發現,不同的pH值環境對不同生物材料中的過氧化氫酶活性有一定影響,pH值在6.2~8.0范圍內時,酶的活性會呈現先上升后下降的趨勢。彭青等[6]觀察pH 5.8~9.0條件下L1型金屬β-內酰胺酶活性的變化,發現其最適pH值為8.2,當pH 5.8時,相對酶活性僅為14.64%。狄荻等[7]發現,菠蘿蛋白酶的最適pH值為7左右,偏酸或偏堿都會影響其活性,當pH 11時,其活性幾乎完全喪失。雖然目前的實驗方法能夠評估各種因素對蛋白酶活性的影響,但無法在微觀水平上闡明蛋白酶活性變化的根本原因,而分子動力學模擬能進一步分析蛋白酶結構的具體變化。如Li Yinli等[8]利用分子手段探究堿性磷酸酶的結構變化;帥雨桐等[9]模擬不同加熱溫度對肌動蛋白結構及其對酚類物質吸附的影響;高進[2]模擬高壓下木瓜蛋白酶的分子動力學變化規律;黃業傳等[10]從分子模擬角度論證高壓條件下木瓜蛋白酶活性變化的機理,分子模擬能將蛋白酶內部結構的變化直觀地顯示出來。雖然部分研究者也探究了不同pH值對木瓜蛋白酶活性的影響,但并未具體研究其分子機制;鑒于木瓜蛋白酶在食品中應用廣泛,經常處于不同的pH值體系中,為更好地促進木瓜蛋白酶在食品中的應用,本研究考察5 組不同pH值(4、5、6、7、8)對木瓜蛋白酶活性的影響,并通過分子動力學方法探究其分子機制,同時采用ROSETTA 3.7軟件模擬探究不同條件下酶與蛋白結合位點的差異及可能的酶解機制差異。
1 材料與方法
1.1 材料與試劑
木瓜蛋白酶(>200 U/mg)、十二水合磷酸氫二鈉、三氯乙酸、L-酪氨酸、干酪素 上海麥克林生化科技有限公司;乙二胺四乙酸二鈉 天津市天力化學試劑有限公司;L-半胱氨酸鹽酸鹽 北京博奧拓達科技有限公司;鹽酸 湖南匯虹試劑有限公司;氫氧化鈉國藥集團化學試劑有限公司;以上試劑均為分析純。
1.2 儀器與設備
TP-1901紫外分光光度計 北京普析通用儀器有限責任公司;F98熒光分光光度計 上海棱光技術有限公司。
1.3 方法
1.3.1 樣品處理
配制不同pH值(4、5、6、7、8)的酶緩沖液:稱取0.528 g L-半胱氨酸鹽酸鹽和0.223 6 g乙二胺四乙酸二鈉,用磷酸氫二鈉溶液(0.05 mol/L)分別溶解,合并混勻后,用氫氧化鈉和鹽酸溶液(均為1 mol/L)調節pH值并定容至100 mL。取適量木瓜蛋白酶溶于不同pH值的酶緩沖液(5 mL)中,常溫下靜置20 min后定容至100 mL,再吸取1 mL至25 mL容量瓶中,加酶緩沖液定容,得到5 組終質量濃度為0.5 mg/mL的不同pH值木瓜蛋白酶溶液。配制完成后測定木瓜蛋白酶活性。
1.3.2 木瓜蛋白酶活性測定
酪氨酸標準溶液的吸光度測定:配制50 μg/mL L-酪氨酸標準溶液,用純水做空白,于280 nm處測定吸光度(A1)。
木瓜蛋白酶活性測定:取6 支具塞試管并編號(a、b、c、d、e、空白管),分別取1 mL不同pH值木瓜蛋白酶溶液于對應的具塞試管中,再另取1 mL pH 6的木瓜蛋白酶溶液于空白具塞試管中。將6 支具塞試管放置在40 ℃水浴鍋中水浴10 min后,在a、b、c、d、e管中迅速加入5 mL 6 mg/mL酪蛋白溶液,搖勻后進行水浴10 min,再向每個管中加入5 mL 65.4 g/L三氯乙酸溶液,搖勻并過濾后,在280 nm處測定濾液吸光度(A2)。空白管中則先加入三氯乙酸溶液5 mL,振蕩混勻后水浴10 min,再加入酪蛋白溶液5 mL,搖勻后繼續水浴加熱10 min,過濾后在280 nm處測定溶液吸光度(A3)。木瓜蛋白酶活性按下式計算:
式中:n為酶液的稀釋倍數;m為所用木瓜蛋白酶的質量/g。
1.3.3 分子動力學模擬
在RCSB網站上下載木瓜蛋白酶結構(ID號:1ppn),然后使用PyMOL軟件手動去除結晶水。采用Gromacs(2019.6)軟件[11]進行模擬,選擇GROMOS54a7力場[12]和SPC水模型。提前根據蛋白酶氨基酸側鏈的pKa和模擬的不同pH值條件關系設定好質子化狀態,將其放置于立方體水盒子中,并設置蛋白酶與盒子邊緣最短距離為1 nm。通過增補適量的Na+或Cl-使體系達到電中性。使用最速下降法對體系能量進行最小化處理,先在NVT和NPT系統下分別進行400 ps的平衡,然后進行150 ns的分子動力學模擬,模擬步長為2 fs,每10 ps儲存1 次數據,每個處理平行模擬3 次[13]。
模擬完畢后,先移除周期性邊界,再使用蛋白分子模擬命令分析不同pH值條件下木瓜蛋白酶的均方根誤差(root mean square deviation,RMSD)、均方根漲落(root mean square fluctuation,RMSF)、回旋半徑(radius of gyration,Rg)、氫鍵數量、蛋白質二級結構、蛋白溶劑可及表面積。其中分析RMSD時使用全部150 ns的數據,而分析其他指標時只使用結構基本穩定后的數據。分析時每個數據點間隔100 ps。
分子模擬結束后,用ROSETTA軟件模擬不同條件下酶與蛋白結合位點的差異,取2 組酶活有較大差異的樣本,提取勢能最低的結構進行對接,對接底物采用β-酪蛋白。再采用I-TASSER在線服務器構建β-酪蛋白結構,使用ROSETTA 3.7軟件進行分子對接。共進行10 次獨立對接,每次對接產生一個對接打分。
1.3.4 木瓜蛋白酶內源性熒光光譜測定
將不同pH值(4、5、6、7、8)的木瓜蛋白酶溶液分別放入1.0 cm寬度的石英池中進行熒光光譜分析。熒光光譜條件為激發波長280 nm,掃描波長范圍250~320 nm,激發和發射狹縫寬度5 nm[14]。
1.4 數據處理
采用Microsoft Excel 2016軟件對數據進行計算和整理;使用PyMOL軟件繪制木瓜蛋白酶與底物對接結構圖,使用Origin 2018軟件繪制其余圖,所有測定均進行
3 次重復,數據以平均值±標準差表示。
2 結果與分析
2.1 不同pH值對木瓜蛋白酶活性的影響
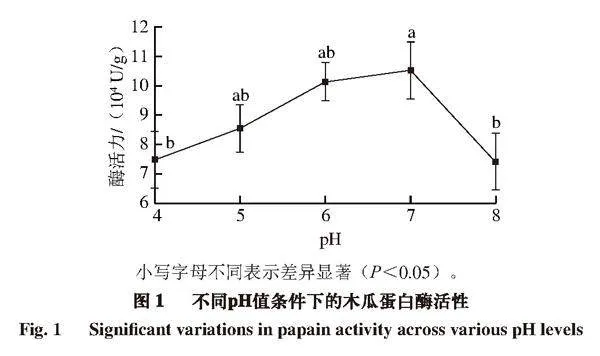
木瓜蛋白酶的等電點為8.75。如圖1所示,隨著pH值的增加,木瓜蛋白酶的活性先增大后減小。在pH 7時活性最高,pH 6時次之。pH為4和8時活性與pH 7時相比有顯著差異(P<0.05),活性分別下降5.00%、5.35%。朱新儒[15]在雙水相萃取木瓜蛋白酶的研究中,發現系統pH值保持在7.0~8.0之間時,木瓜蛋白酶有較高活性。
王偉濤[16]認為酸性和堿性環境對酶活性有一定的影響,但影響都在一定范圍內;余壘[17]發現隨著pH值的升高,木瓜蛋白酶活性保留率、蛋白回收率逐漸提高,純化因子逐漸增加,但當pH值超過6時,蛋白酶的電荷會隨溶液
pH值的改變而變化,因為蛋白質的電荷狀態會受到pH值及其等電點的影響[18]。因此,偏中性環境更有利于木瓜蛋白酶發揮其催化活性。
2.2 不同pH值下木瓜蛋白酶分子動力學模擬結果
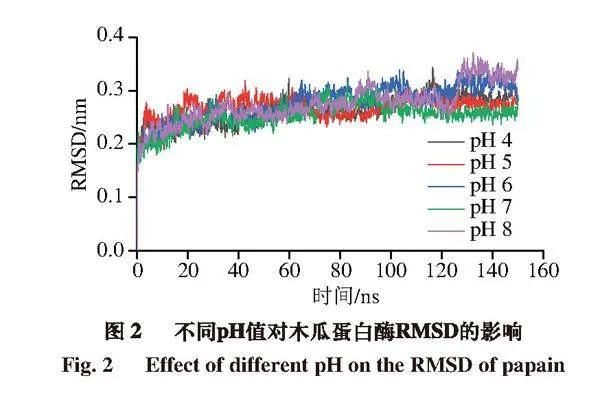
2.2.1 RMSD在模擬中的變化
RMSD體現了蛋白質原始構象與在特定時間其結構的平均偏差[19]。如圖2所示,5 組RMSD數據在模擬過程中波動幅度不大,均在130 ns后穩定在某一恒定數值附近。130 ns后pH 4~8條件下的RMSD平均值分別為0.29、0.27、0.31、0.26、0.33 nm,其中pH 8時RMSD平均值比pH 7時增加0.07 nm,波動較明顯。說明pH值的改變會對木瓜蛋白酶結構穩定性產生影響,但影響不大,該結論與孔慶新等[20]研究結果相似。他們在將β-乳球蛋白與茶多酚表沒食子兒茶素沒食子酸酯(epigallocatechin gallate,EGCG)結合的分子模擬中發現,結合過程中EGCG只在有限的pH值范圍內波動,不會對蛋白質結構造成較大影響。
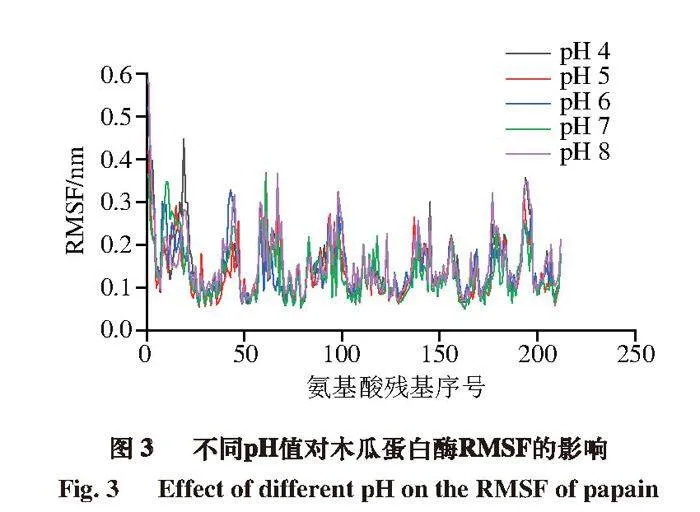
2.2.2 RMSF在模擬中的變化
RMSF反映的是蛋白質各原子坐標與平均位置坐標的漲落情況,能夠衡量原子運動幅度大小[21]。經計算,pH 4~8條件下平均RMSF分別為0.149、0.139、0.142、0.136、0.157 nm。總體上隨pH值增大,RMSF會略微減小,但在pH 8時波動明顯,這與酶活性和RMSD分析結果具有一定相關性。如圖3所示,pH 4~8條件下25位殘基RMSF分別為0.135、0.119、0.127、0.106、0.151 nm;158號位殘基分別為0.125、0.155、0.134、0.138、0.161 nm;159號位殘基分別為0.176、0.127、0.146、0.107、0.142 nm。在pH 4時,木瓜蛋白酶活性中心的25位和159位氨基酸殘基表現出較大的波動,pH 8時,酶活性中心的25、158、159位氨基酸殘基均有較大波動。表明環境偏酸和偏堿可能會導致酶的活性中心結構穩定性下降,這與酶活性結果一致。
2.2.3 Rg在模擬中的變化
Rg表示蛋白質結構的松緊程度,Rg越小,表明蛋白質結構越致密,Rg越大,則表明蛋白質結構越疏松。由圖4可知,所有組均在80 ns后趨于穩定。計算模擬后80 ns的平均Rg,pH 4~8條件下木瓜蛋白酶的平均Rg分別為1.669、1.673、1.676、1.664、1.675 nm。可以看出各組Rg基本一致,無較大波動。pH 7時Rg最小,說明此時木瓜蛋白酶結構較致密,這也與上述RMSD、RMSF分析基本一致。
2.2.4 木瓜蛋白酶蛋白間氫鍵數量在模擬中的變化
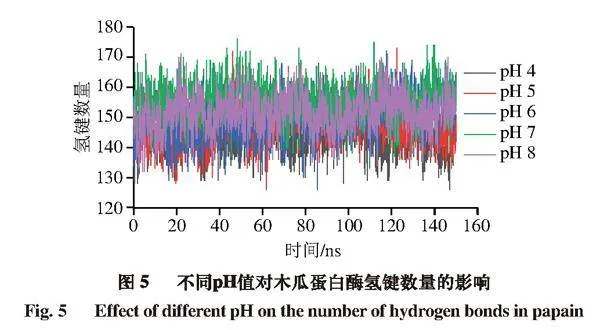
氫鍵是一種對蛋白結構穩定性具有重要作用的非共價結合力。圖5顯示,隨著pH值的增加,木瓜蛋白酶蛋白間氫鍵數量逐漸增加。以模擬后50 ns進行計算,在pH 4~8范圍內,木瓜蛋白酶平均氫鍵數量分別為144.6、148.3、151.3、155.6、152.2 個。其中pH 8時的氫鍵數量比pH 7時減少3.4 個,可能導致部分蛋白結構受損,這可能是木瓜蛋白酶活性隨著pH值的上升而逐漸升高、當pH值上升至7后酶活性又降低的主要原因之一。
2.2.5 木瓜蛋白酶蛋白溶劑可及表面積在模擬中的變化
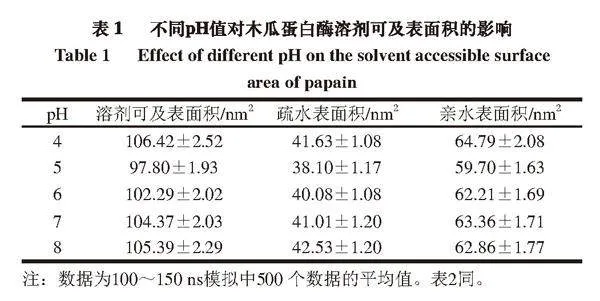
由表1可知,隨著pH值的上升,木瓜蛋白酶溶劑總可及表面積和疏水表面積均呈先減小后增大的趨勢,其原因可能是過酸或過堿的環境導致木瓜蛋白酶結構疏松,水分子更容易滲透進入木瓜蛋白酶分子內部,從而使更多的疏水區域暴露,這與曾琪等[22]的研究結果相似。在本研究過程中,親水表面積總是大于疏水表面積,說明木瓜蛋白酶在不同pH值下均為水溶性,這與孔慶新等[20]得到的結論一致。
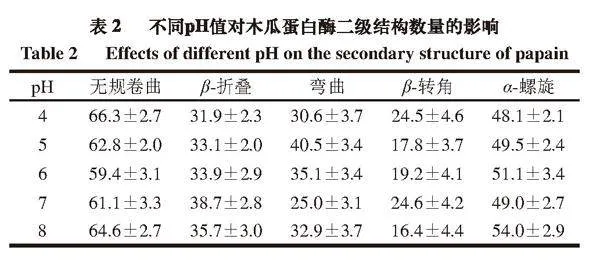
2.2.6 木瓜蛋白酶蛋白二級結構在模擬中的變化
如表2所示,隨著pH值的升高,木瓜蛋白酶蛋白的β-折疊數量先增多后減少,在pH 7時β-折疊數量明顯高于其他4 個pH條件,可推測β-折疊數量與酶活性有一定的關聯性,β-折疊數量越高,酶活性相對越高。而無規卷曲的數量明顯先減小后增加,在pH 6時降至最低,pH 7時次之,說明隨著pH值的增加,木瓜蛋白酶的二級結構會從無序狀態逐漸轉變為有序狀態,當pH值超過7時,蛋白酶的二級結構又會由有序轉變為無序狀態。因此可推測偏酸或偏堿的pH值會導致蛋白酶空間結構呈現無規則狀態,進而影響其活性。同時隨pH值的增加,α-螺旋呈增加趨勢,這與前面對蛋白間氫鍵分析基本一致,因為α-螺旋的穩定與氫鍵有關[23]。一些學者研究了不同pH值對蛋白二級結構的影響,但結果并不一致。郭洪偉[24]在研究pH值對芽孢皮層裂解酶的活力及結構的影響時發現,體系pH值大于7時,蛋白質大分子因堿性而聚集的現象導致β-折疊結構減少,這與本研究結果相似;而韓玲[25]在pH值對溶菌酶分子機制的研究中發現,隨著體系pH值的降低,溶菌酶結構中α-螺旋向β-折疊結構轉變的趨勢變大,Zhu Junxiang等[26]發現β-乳球蛋白的二級結構在不同pH值條件下無顯著變化,Abdollahi等[27]研究β-乳球蛋白與阿魏酸的結合時發現,隨著pH值升高,α-螺旋和β-折疊的比例均降低。
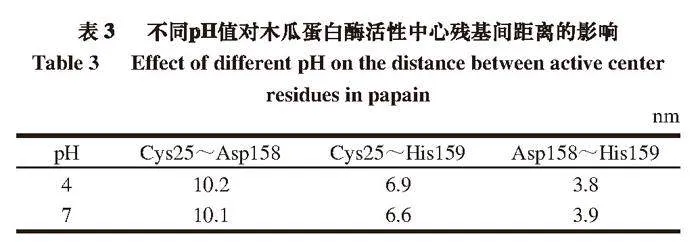
2.2.7 木瓜蛋白酶蛋白活性中心殘基間距離的變化
有研究[28]表明,木瓜蛋白酶活性部位由25位的半胱氨酸(Cys25)、158位的天冬酰胺(Asp158)和159位的組氨酸(His159)3 個氨基酸組成。據2.1節所述,pH 4和7時的木瓜蛋白酶活性差距較大,取這2 組樣品結構勢能最低時的活性中心殘基距離進行對比,pH 4條件下,114 ns結構勢能最低,pH 7條件下,110 ns結構勢能最低。由表3可知,pH 7條件下,Cys25到Asp158和His159的距離均減小,而Asp158到His159的距離略微增大。由此可推斷不同的pH值可能會影響木瓜蛋白酶活性,這種影響可能與活性中心殘基之間的距離變化有關,pH值接近中性時,氨基酸之間距離減小會使蛋白酶內部結構更加緊密,從而能夠更好地發揮其酶活性。
2.2.8 木瓜蛋白酶分子與底物結合分析
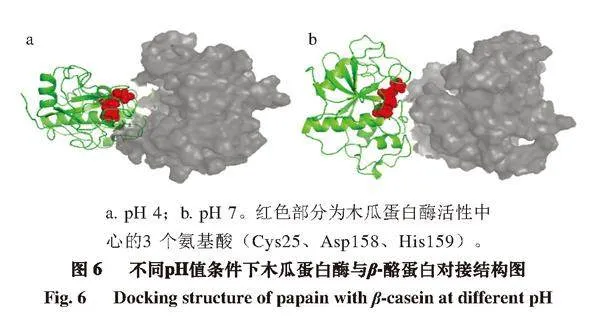
10 次獨立分子對接的打分中,pH 7條件下的10 次對接打分平均值為-222.140,pH 4條件下的10 次對接打分平均值為-124.155,對接打分越低,表明結合越牢固。結果表明,pH 7條件下的最低能量結構與β-酪蛋白對接,其對接打分明顯低于pH 4條件下,說明pH 7條件下木瓜蛋白酶與β-酪蛋白結合更為緊密,提示催化活性更高,這與酶活性的測定結果一致。
由圖6可知,pH 4條件下底物與木瓜蛋白酶結合部位有較大空腔,二者結合并不緊密,而pH 7條件下蛋白結合部位基本無縫隙,結合緊密且均勻,這與對接打分結果一致,說明pH 7條件下木瓜蛋白酶催化活性更高,催化效果更好。
a. pH 4;b. pH 7。紅色部分為木瓜蛋白酶活性中心的3 個氨基酸(Cys25、Asp158、His159)。
2.3 不同pH值條件下木瓜蛋白酶的熒光光譜分析
熒光光譜是研究水溶液中蛋白質分子構象的一種有效方法[29],具有選擇性好、靈敏性高的特點。研究[30]
表明,蛋白質中能提供熒光的氨基酸主要是酪氨酸、色氨酸和苯丙氨酸,激發波長280 nm下的蛋白質分子熒光光譜圖能有效反映蛋白質三級結構的變化情況。由圖7可知,隨著pH值的增加,木瓜蛋白酶的熒光峰位置基本沒有發生藍移或紅移,說明熒光基團在親水環境中以相對穩定的形式存在[24]。出現波峰的最大激發波長均為281 nm,但熒光強度明顯不同。其中pH 8時的熒光強度最強,這可能是由于該pH值下疏水表面積最大,無規卷曲數量相對較多,空間結構松散,從而蛋白鏈斷開或分解,導致游離的熒光氨基酸含量大增[31]。
pH 4時熒光強度最低,可能由于是熒光基團過度暴露而發生猝滅[32]。pH 7時的熒光強度位于中間值,說明蛋白空間結構比較緊密,這與Rg、酶蛋白二級結構和活性中心殘基距離分析結果一致。
3 結 論
考察5 組pH(4、5、6、7、8)對木瓜蛋白酶活性的影響,發現隨著pH值的增加,木瓜蛋白酶的活性先增大后減小,pH 7條件下的木瓜蛋白酶活性最高。分子模擬結果顯示,pH 4和8時木瓜蛋白酶活性中心的3 個氨基酸殘基有較大波動,此外,在pH 4和8條件下,木瓜蛋白酶結構發生變化,包括氫鍵的破壞、疏水表面積的改變及β-折疊等二級結構的變化等因素導致活性下降。在pH 7時,木瓜蛋白酶活性中心與β-酪蛋白結合緊密,酶蛋白內部結構更致密,在pH 4時,木瓜蛋白酶活性中心與β-酪蛋白結合部位縫隙較大,且酶蛋白內部結構較松散,因此pH 7時更有利于酶的催化作用。本研究綜合實驗和分子模擬技術結果,探討不同pH值對木瓜蛋白酶活性產生的影響,為促進木瓜蛋白酶在食品加工中的應用及提高產品品質提供了一定理論和實踐基礎。
參考文獻:
[1] Kamphuis I G, Kalk K H, Swarte M, et al. Structure of papain refined at 1.65 ? resolution[J]. Journal of Molecular Biology, 1984, 179(2): 233-256. DOI:10.1016/0022-2836(84)90467-4.
[2] 高進. 木瓜蛋白酶加工過程中的性質及結構研究[D]. 天津: 天津科技大學, 2018.
[3] 張瓊. 超聲波協同半胱氨酸促進木瓜蛋白酶嫩化肉塊的應用研究[D].成都: 成都大學, 2021. DOI:10.27917/d.cnki.gcxdy.2021.000131.
[4] 張艷梅, 曾虹燕, 蔡西玲, 等. 汞離子對木瓜蛋白酶結構的影響及抑制機理的研究[J]. 中國生物工程雜志, 2012, 32(1): 87-91. DOI:10.13523/j.cb.20120112.
[5] 陳維. 探究pH值對3 種生物材料中過氧化氫酶活性的影響[J]. 生物學通報, 2014, 49(6): 53-56.
[6] 彭青, 侯冰, 姚芬, 等. pH值、溫度、底物濃度對L1型金屬β-內酰胺酶活性的影響[J]. 中國抗生素雜志, 2010, 35(1): 69-71; 76. DOI:10.13461/j.cnki.cja.004517.
[7] 狄荻, 周詠新, 張新燁, 等. 探究影響菠蘿蛋白酶活性的條件[J]. 生物學通報, 2020, 55(11): 58-60. DOI:10.3969/j.issn.0006-3193.2020.11.019.
[8] LI Y L, ZHANG S Y, BAO Z J, et al. Exploring the activation mechanism of alcalase activity with pulsed electric field treatment: effects on enzyme activity, spatial conformation, molecular dynamics simulation and molecular docking parameters[J]. Innovative Food Science and Emerging Technologies, 2022, 76: 102918. DOI:10.1016/j.ifset.2022.102918.
[9] 帥雨桐, 黃業傳, 何元琪, 等. 分子動力學模擬加熱對肌動蛋白結構及酚類物質吸附的影響[J]. 肉類研究, 2021, 35(3): 8-13. DOI:10.7506/rlyj1001-8123-20210309-057.
[10] 黃業傳, 張喜才, 曾奕秀, 等. 高壓處理對木瓜蛋白酶活性的影響及分子動力學模擬[J]. 食品工業科技, 2023, 44(12): 102-107. DOI:10.13386/j.issn1002-0306.2022090241.
[11] ABRAHAM M J, MURTOLA T, SCHULZ R, et al. GROMACS: high performance molecular simulations through multi-level parallelism from laptops to supercomputers[J]. SoftwareX, 2015, 1/2: 19-25. DOI:10.1016/j.softx.2015.06.001.
[12] SCHMID N, EICHENBERGER A P, CHOUTKO A, et al. Definition and testing of the GROMOS force-field versions 54A7 and 54B7[J]. European Biophysics Journal, 2011, 40(7): 843-856. DOI:10.1007/s00249-011-0700-9.
[13] 簡清梅, 索化夷, 張喜才, 等. 分子動力學模擬超高壓結合熱處理對β-乳球蛋白結構的影響[J]. 食品科學, 2021, 42(23): 57-63. DOI:10.7506/spkx1002-6630-20210427-378.
[14] Mehta S K, Bhawna, Rekha, et al. The effect of the presence of sodium bis-(2-ethylhexyl) sulfosuccinate (AOT) on the interactions between sodium dodecyl sulfate (SDS) and protein papain[J]. Journal of Molecular Liquids, 2017, 248: 751-758. DOI:10.1016/j.molliq.2017.10.083.
[15] 朱新儒. [CnPy]Cl(n=2,4,6)吡啶離子液體的合成及雙水相萃取木瓜蛋白酶的研究[D]. 海口: 海南大學, 2019. DOI:10.27073/d.cnki.ghadu.2019.000896.
[16] 王偉濤. 木瓜蛋白酶的雙水相萃取研究[D]. 海口: 海南大學, 2014.
[17] 余壘. PEG/無機鹽/離子液體、離子液體/無機鹽雙水相分離純化木瓜蛋白酶的研究[D]. 海口: 海南大學, 2019. DOI:10.27073/d.cnki.ghadu.2019.000737.
[18] LI F F, LI Q, WU S G, et al. Salting-out extraction of sinomenine from Sinomenium acutum by an alcohol/salt aqueous two-phase system using ionic liquids as additives[J]. Journal of Chemical Technology & Biotechnology, 2018, 93: 1925-1930. DOI:10.1002/jctb.5318.
[19] OCKERMAN H, HARNSAWAS S, YETIM H. Papain in meat is inhibited by potato protein or ascorbic acid[J]. Food Science, 1993, 58: 1265-1268. DOI:10.1111/j.1365-2621.1993.tb06162.x.
[20] 孔慶新, 黃業傳, 徐偉平, 等. β-乳球蛋白與EGCG結合規律的分子動力學探究[J]. 食品與生物技術學報, 2022, 41(1): 51-59. DOI:10.3969/j.issn.1673-1689.2022.01.007.
[21] 邵冬青, 張群, 姜舟婷. 分子動力學模擬研究溫度對蛋白質結構穩定性的影響[J]. 中國計量大學學報, 2022, 33(1): 44-48; 130. DOI:10.3969/j.issn.2096-2835.2022.01.007.
[22] 曾琪, 胡淼, 王歡, 等. pH值處理對黑豆分離蛋白結構、流變特性及乳化性能的影響[J]. 食品科學, 2020, 41(22): 15-21. DOI:10.7506/spkx1002-6630-20190906-080.
[23] Mozhaev V V, Lange R, Kudryashova E V, et al. Application of high hydrostatic pressure for increasing activity and stability of enzymes[J]. Biotechnology & Bioengineering, 1996, 52(2): 320-331. DOI:10.1002/(sici)1097-0290(19961020)52:23.0.CO;2-N.
[24] 郭洪偉. 超高壓、pH值對芽孢皮層裂解酶的活力及二、三級結構影響的研究[D]. 銀川: 寧夏大學, 2019. DOI:10.27257/d.cnki.gnxhc.2019.000569.
[25] 韓玲. 溫度及pH對氯化鈉誘導的溶菌酶聚集的影響及其分子機制的研究[D]. 沈陽: 遼寧大學, 2011.
[26] ZHU J X, LI K J, WU H, et al. Multi-spectroscopic, conformational, and computational atomic-level insights into the interaction of β-lactoglobulin with apigenin at different pH levels[J]. Food Hydrocolloids, 2020, 105: 105810. DOI:10.1016/j.foodhyd.2020.105810.
[27] ABDOLLAHI K, INCE C, CONDICT L, et al. Combined spectroscopic and molecular docking study on the pH dependence of molecular interactions between β-lactoglobulin and ferulic acid[J]. Food Hydrocolloids, 2019, 101: 105461. DOI:10.1016/j.foodhyd.2019.105461.
[28] Drenth J, Jansonius J N, Koekoek R, et al. The structure of papain[J]. Advances in Protein Chemistry, 1971, 25: 79-115. DOI:10.1016/S0065-3233(08)60279-x.
[29] 楊家祥, 張玉慧, 許興友, 等. 熒光光譜在蛋白質分子構象研究中的應用[J]. 淮海工學院學報(自然科學版), 1999, 8(4): 28-31.
[30] Bhuiya S, Chowdhury S, Das S. Molecular insight into the binding aspects of benzo[c]phenanthridine alkaloid nitidine with bovine hemoglobin: a biophysical exploration[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2019, 223: 117293. DOI:10.1016/j.saa.2019.117293.
[31] 曾新安, 于淑娟, 徐婭莉. 脈沖電場對木瓜蛋白酶影響的熒光光譜分析[J]. 光譜學與光譜分析, 2007, 27(12): 2558-2561. DOI:10.3964/j.issn.1000-0593.2007.12.044.
[32] 郭雁. 駝乳血清白蛋白的分離純化及其結構與穩定性研究[D]. 呼和浩特: 內蒙古農業大學, 2018.
收稿日期:2024-06-18
基金項目:荊楚理工學院校級創新創業項目(KC2023052);荊門市重點科技計劃項目(2022YFZD058)
第一作者簡介:代雯(2003—)(ORCID: 0009-0003-3284-2974),女,本科生,研究方向為食品科學。E-mail: 2382701094@qq.com
*通信作者簡介:黃業傳(1975—)(ORCID: 0000-0002-1931-9017),男,教授,博士,研究方向為食品加工工程。E-mail: huangyc@juct.edu.cn

