基于“四重表征”對酸堿中和反應的實驗探究


摘 要: 基于“四重表征”教學模式,借助數字化傳感器,從pH、離子濃度和能量變化三個角度,設計多組對比實驗,對酸堿中和反應體系進行全面探究。將傳感器所呈現的微觀圖像與指示劑的宏觀變色現象相結合進行分段式數據分析,并進行符號表征,幫助學生全面理解和掌握酸堿中和反應的變化本質,旨在發展學生的科學思維、落實化學學科核心素養。
關鍵詞: 酸堿中和反應; 四重表征; 數字化傳感器
文章編號: 1005-6629(2024)11-0075-06
中圖分類號: G633.8
文獻標識碼: B
1 問題的提出
酸堿中和反應是中學化學中的重要反應類型,反應過程中存在較復雜的物質變化與能量變化。傳統的課堂教學往往只局限于宏觀指示劑的變色現象,對反應的本質沒有進行深入的剖析,加上由于學生自身的實驗設計、分析和推理能力欠佳等問題,導致其無法正確理解酸堿中和反應的微觀本質[1,2]。
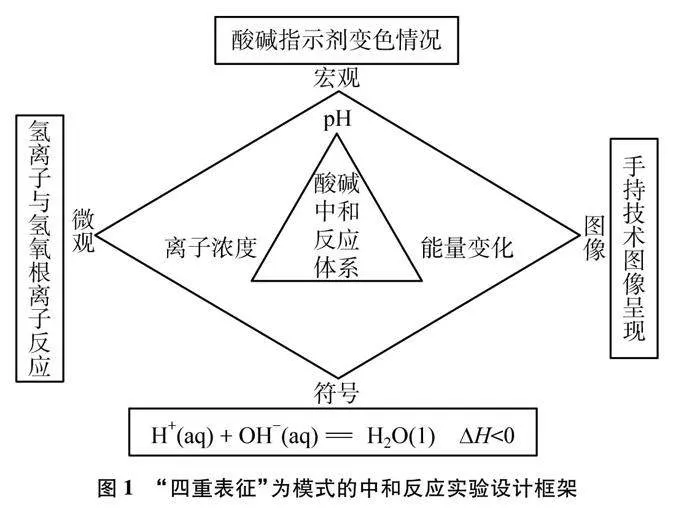
手持技術實驗具有實時、準確、直觀、便攜等特點[3],能將實驗中的微觀變化以圖像的形式呈現,有效解決傳統實驗的教學難點、突破化學知識的認知難點、提升概念認知的發展水平[4]。為了更好地發揮手持技術的作用,錢揚義等[5]提出“四重表征”教學模式,從 “宏觀-微觀-符號-圖像”四個維度對化學反應進行表征,將化學反應的宏觀現象與傳感器的圖像相結合,分析反應的微觀本質。該模式有利于培養學生基于實驗事實進行證據推理、建構模型并推測物質及其變化的思維能力。
目前,已有不少教師利用手持技術數字化實驗對酸堿中和反應進行了研究。如王曉芳等[6]對手持技術在我國近20年的研究進展及現狀作了分析,為數字化實驗在化學中的應用提供參考;鄒麗丹、馬慧、李文良等[7~9]運用手持技術對酸堿中和反應體系的pH變化進行了探討和相應的教學設計,幫助學生從微觀層面理解酸堿中和反應;彭豪、陳德權等[10,11]有效運用“四重表征”的教學模式,結合手持技術對酸堿中和反應中的pH變化進行探究,進一步提升了教學效果。但現有
研究大多只從pH這一角度進行探討,
對反應本質的分析尚不全面。
基于此,本文將以“四重表征”為教學模式,利用手持技術傳感器,選擇學生最熟悉的NaOH和HCl反應為研究對象,利用紫色石蕊試液提供反應時的宏觀現象,從pH、離子濃度、能量變化三個角度出發,設計多組適合教師演示的對比實驗,旨在讓學生多角度全方位地對酸堿中和反應的本質進行理解和掌握,提升課堂教學效果。
2 實驗設計
酸堿中和反應中存在較復雜的物質變化與能量變化。物質變化主要體現在氫離子與氫氧根離子結合生成水,這會導致體系的pH和離子濃度發生變化;能量變化主要體現在該反應是一個典型的放熱反應。本研究將從pH、離子濃度和能量變化三個角度,設計多組對比實驗,揭示該反應的本質。
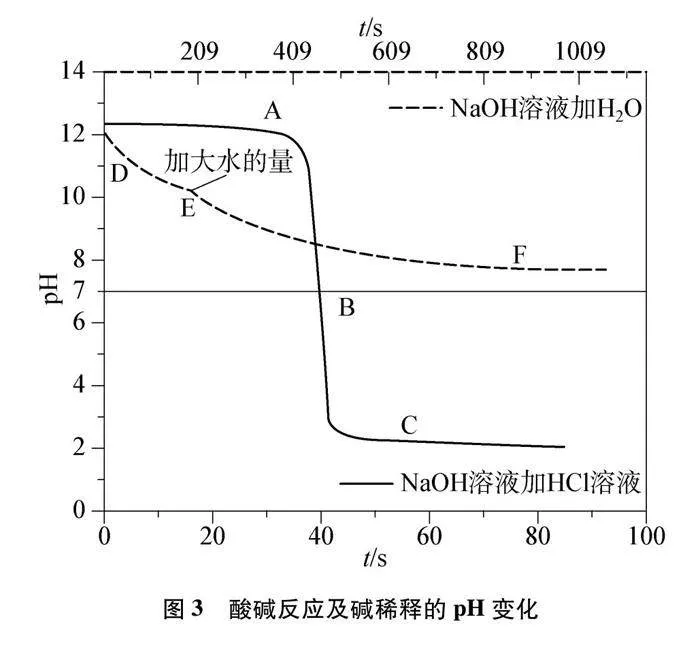
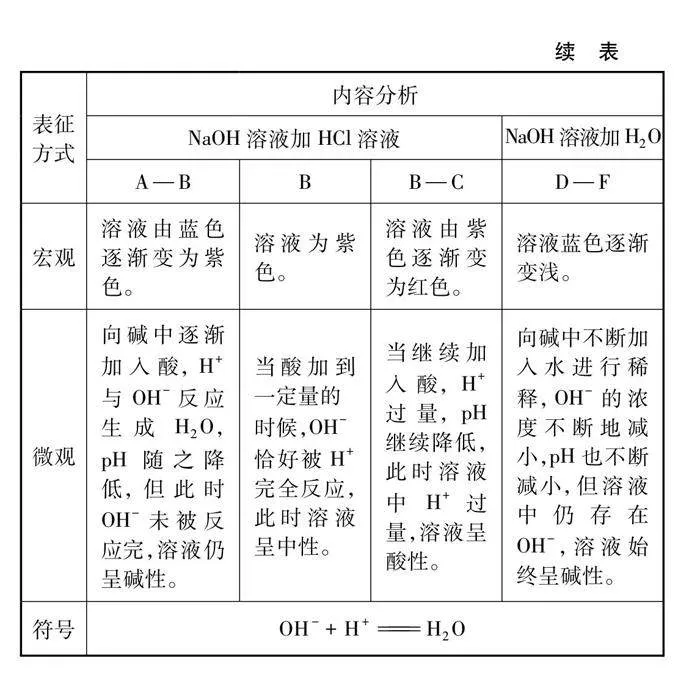
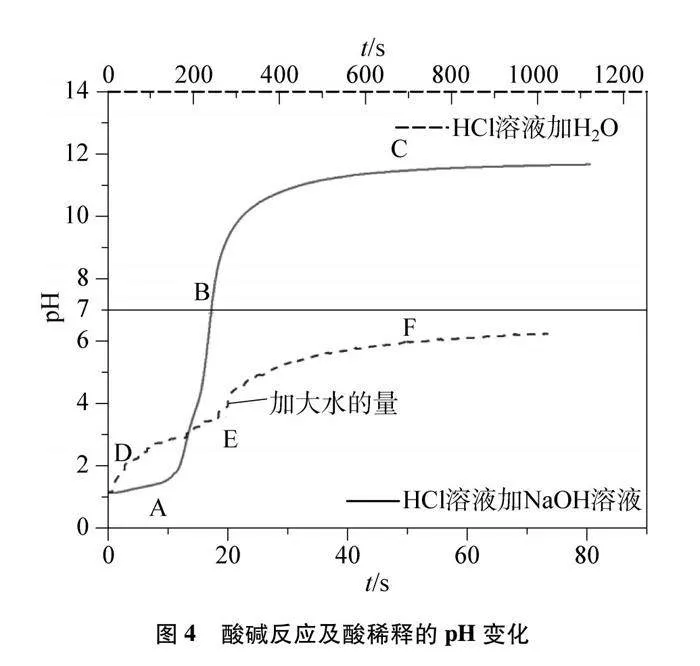
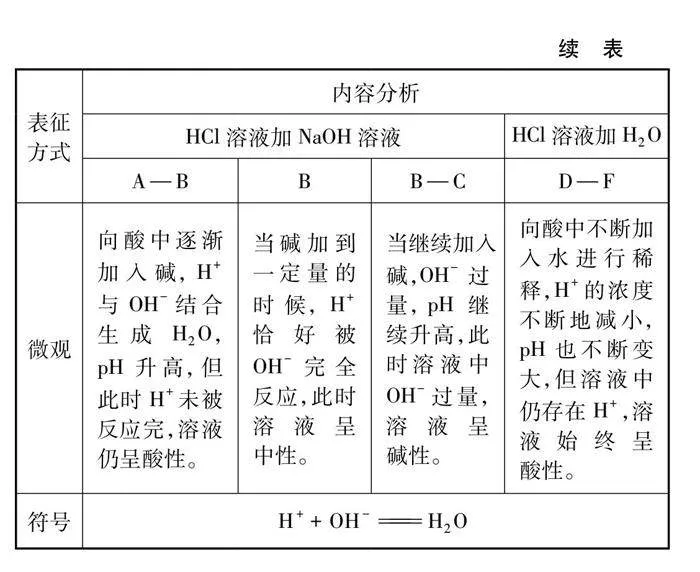
角度一:酸堿中和反應體系pH變化的探究實驗設計。借助pH傳感器,記錄反應時pH的變化規律。同時設計酸與堿稀釋時pH的變化作為對照實驗,比較酸堿反應與稀釋作用對體系pH影響的差異。
角度二:酸堿中和反應體系離子濃度變化的探究實驗設計。溶液的離子濃度與其導電性呈正相關,利用電導率傳感器可反映離子濃度的變化規律。同時設計對比實驗,探究體系中水的生成以及離子的增加對溶液導電性的影響。
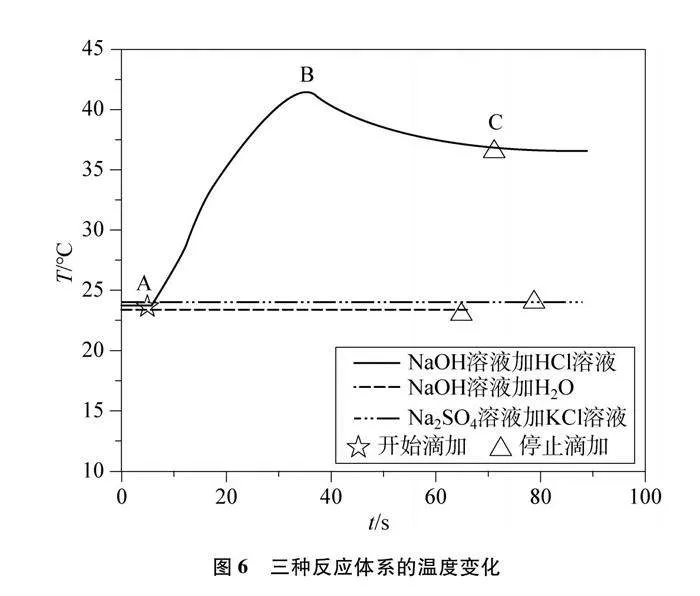
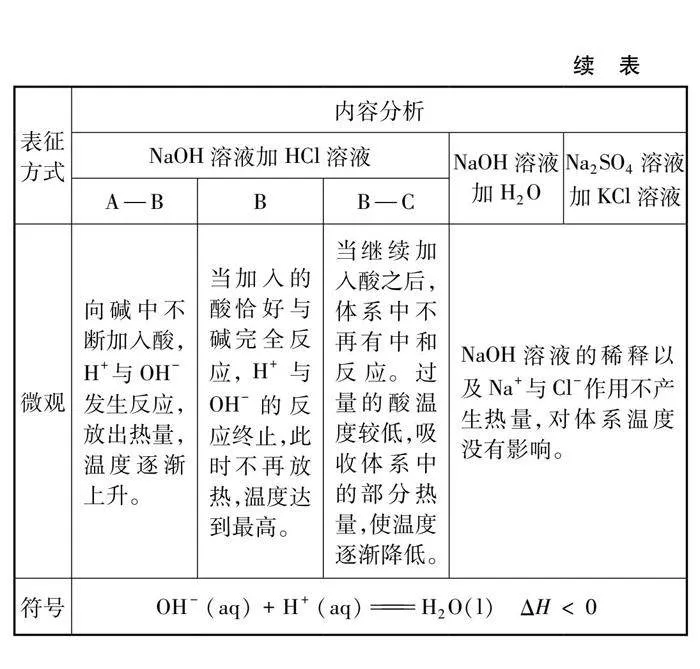
角度三:酸堿中和反應體系能量變化的探究實驗設計。借助溫度傳感器,記錄反應時溫度的變化規律。同時設計對比實驗,排除因稀釋作用以及Na+與Cl-之間的作用而導致溫度變化的可能性。
實驗中,HCl與NaOH溶液的濃度均為0.1mol/L,考慮到此濃度的酸和堿反應放出熱量并不明4crP3CdG84XL9yj7rhN3lQ==顯,故選擇溶質質量分數為10%的兩種溶液來探究溫度的變化。整體的實驗設計以“四重表征”為教學模式,其設計框架如圖1所示。
3 實驗藥品與裝置
實驗藥品:0.1mol/L HCl溶液、0.1mol/L NaOH溶液、0.1mol/L NaCl溶液、10% Na2SO4溶液、10% KCl溶液、10% HCl溶液、10% NaOH溶液、紫色石蕊試劑、去離子水
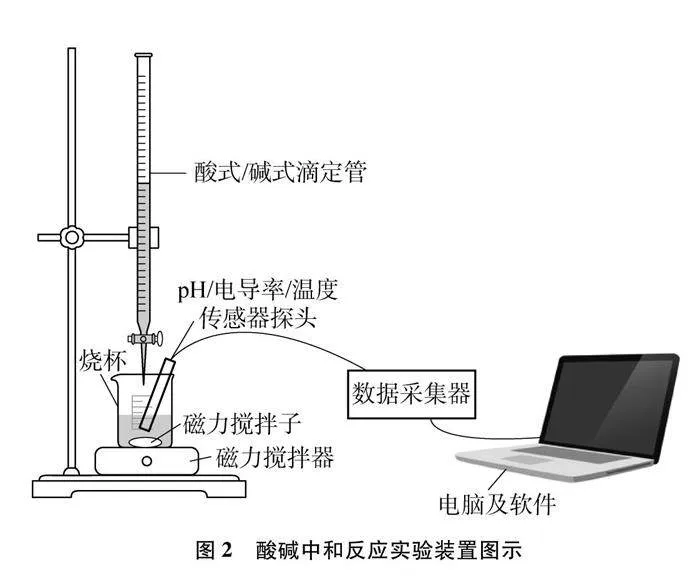
實驗儀器:100mL燒杯×2、250mL燒杯×2、50mL酸式滴定管、50mL堿式滴定管、10mL量筒、50mL量筒、磁力攪拌器、磁力攪拌子、膠頭滴管、朗威傳感器(pH、電導率、溫度)、數據采集器、電腦及配套軟件(DISLab 8.0)
裝置如圖2所示。
4 實驗步驟
按圖2所示組裝好實驗儀器、對應的傳感器、數據采集器及電腦軟件,設置采樣參數,添加圖像坐標以及數據表格。反應過程中利用磁力攪拌裝置,轉速為300rpm。
4.1 酸堿中和反應體系pH的變化
4.1.1 酸堿反應pH的變化
(1) 選擇pH傳感器;
(2) 向燒杯中加入20mL 0.1mol/L NaOH溶液、5滴紫色石蕊試液,向滴定管中加入30mL 0.1mol/L HCl溶液;
(3) 運行軟件采集數據,打開滴定管,觀察pH圖像變化;
(4) 將燒杯與滴定管中的物質對調,重復步驟(1)至(3)。
4.1.2 pH變化的對比實驗
(1) 同4.1.1中的步驟(1);
(2) 向燒杯中加入2mL 0.1mol/L NaOH溶液;
(3) 運行軟件采集數據,用量筒分多次量取50mL去離子水加入燒杯,觀察pH圖像變化;
(4) 待pH變化非常緩慢,用燒杯分多次量取250mL去離子水加入,觀察pH圖像變化;
(5) 將燒杯中換成2mL 0.1mol/L HCl溶液,重復步驟(1)至(4)。
4.2 酸堿中和反應體系離子濃度的變化
4.2.1 酸堿反應電導率的變化
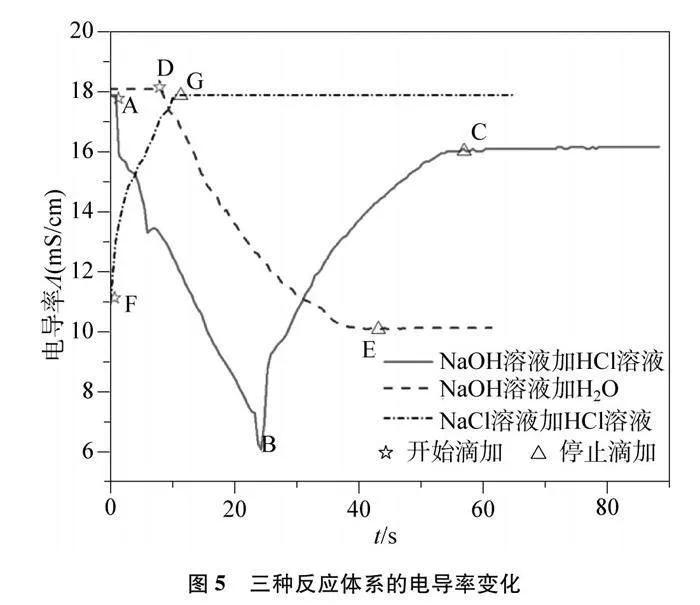
選擇電導率傳感器,步驟與4.1.1中的步驟(1)至(3)基本相同,觀察電導率圖像的變化。
4.2.2 電導率變化的對比實驗
(1) 選擇電導率傳感器;
(2) 向燒杯中加入20mL 0.1mol/L NaOH溶液、5滴紫色石蕊試液,用滴定管向燒杯中滴加30mL的去離子水,觀察電導率圖像的變化;
(3) 將上述步驟中20mL 0.1mol/L NaOH換成20mL 0.1mol/L NaCl溶液,30mL去離子水換成30mL 0.1mol/L HCl溶液,重復步驟(1)和(2)。
4.3 酸堿中和反應體系能量的變化
4.3.1 酸堿反應溫度的變化
(1) 選擇溫度傳感器;
(2) 向燒杯中加入20mL 10% NaOH溶液、5滴紫色石蕊試液,向滴定管中加入30mL 10% HCl溶液;
(3) 運行軟件采集數據,打開滴定管,觀察溫度圖像變化。
4.3.2 溫度變化的對比實驗
(1) 將滴定管中的HCl溶液換成等量的去離子水,重復4.3.1的步驟;
(2) 將4.3.1中的20mL 10% NaOH溶液換成20mL 10% Na2SO4溶液,30mL 10% HCl溶液換成30mL 10% KCl溶液,重復4.3.1的步驟。
5 實驗結果與分析
實驗中的宏觀現象能夠通過指示劑的變色情況直觀地反映。將實驗中采集的數據進行作圖,結果如下。
5.1 酸堿反應pH的變化及對比實驗
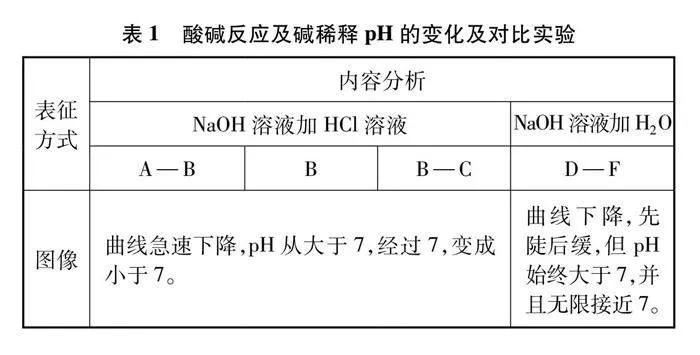
酸堿反應pH變化及對比實驗如圖3、圖4及表1、表2所示。
5.2 酸堿反應電導率的變化及對比實驗
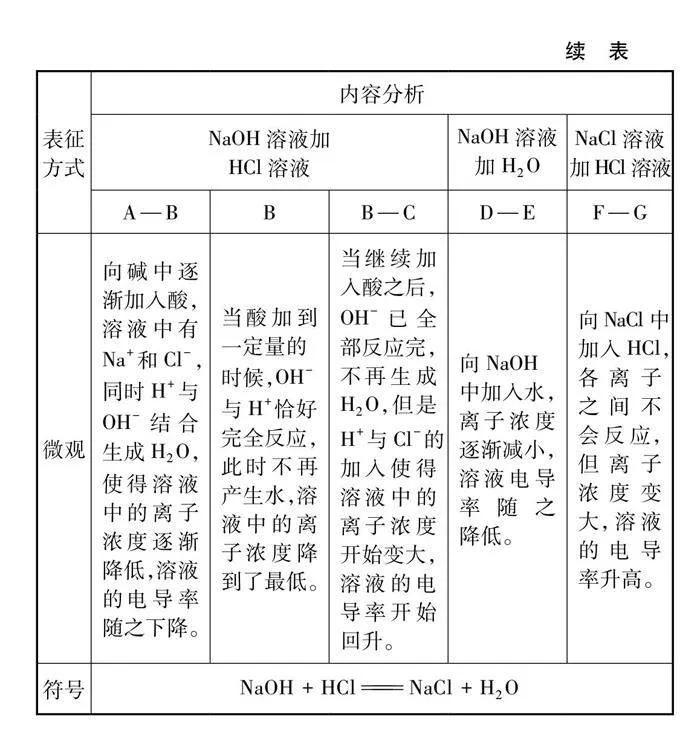
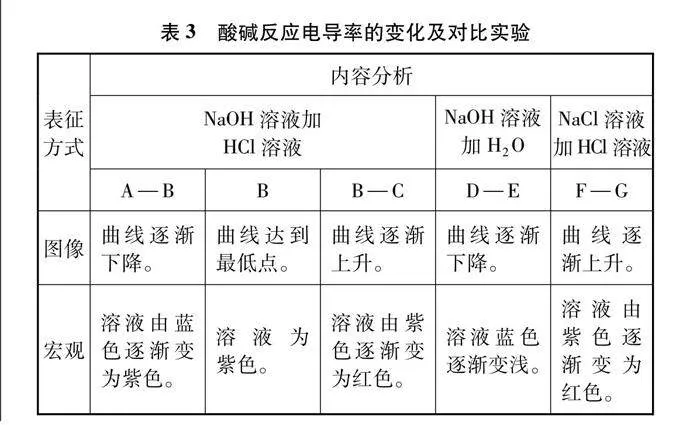
酸堿反應電導率變化及對比實驗如圖5及表3所示。
5.3 酸堿反應溫度的變化及對比實驗
酸堿反應溫度變化及對比實驗如圖6及表4所示。
6 小結
本文在“四重表征”教學模式框架下,借助數字傳感器,從三個不同角度設計了多組對比實驗,對酸堿中和反應的本質進行了探究。實驗中選擇了NaOH和HCl作為研究對象,利用紫色石蕊試液提供宏觀變色現象,借助pH、電導率、溫度傳感器呈現微觀變化圖像,將宏觀現象與變化圖像相結合分析酸堿反應的微觀本質,同時還設計了多組對照實驗,排除反應過程中可能會對學生理解反應本質造成干擾的因素,有助于學生更好地掌握反應本質。本實驗操作簡單、邏輯清晰、可重復性高,便于教師演示。
參考文獻:
[1]劉雁明. 基于大概念的科學探究與化學實驗教學——以“酸和堿的中和反應”為例[A]. 廣東教育學會2023年度學術討論會論文集(一)[C]. 廣州: 廣東教育學會, 2023: 9.
[2]徐立堂, 張賢金, 鄭婷婷. 基于科學推理與論證的初中化學教學實踐——以“酸和堿的中和反應”為例[J]. 化學教學, 2024, (2): 53~57.
[3]錢揚義, 杜永鋒, 李佳等. 掌上實驗室(Lab in Hand)的特點及其功能[J]. 電化教育研究, 2003, (10): 59~62.
[4]麥裕華, 錢揚義. “中學化學手持技術數字化實驗案例”的多維分析——以錢揚義工作室20年研究的期刊論文為例[J]. 化學教育(中英文), 2020, 41(19): 83~89.
[5]錢揚義, 張積家, 羅秀玲等. 化學概念與化學“學科關鍵詞”的學習與認知[M]. 北京: 科學出版社, 2009: 168~172.
[6]王曉芳, 鹿鈺鋒, 夏建華. 手持技術數字化實驗在我國近20年的研究進展及現狀——基于CiteSpace可視化分析[J]. 化學教學, 2021, (4): 32~34.
[7]鄒麗丹. 初中化學課堂數字化手持技術的應用——以“酸堿中和反應”為例[J]. 黑龍江教育(教育與教學), 2024, (2): 60~61.
[8]馬慧. 化學核心素養導向下的教學設計——以基于手持技術的“酸堿中和反應”為例[J]. 新課程導學, 2023, (2): 77~80.
[9]李文良, 張麗芳. 建構基本觀念豐富學生的科學素養——以基于手持技術的“中和反應”教學為例[J]. 中小學教學研究, 2017, (9): 26~29.
[10]彭豪. 基于信息技術的“四重表征”圖形化教學設計——以《酸與堿之間會發生什么反應》為例[J]. 中小學信息技術教育, 2010, (9): 58~60.
[11]陳德權. 多重表征理論下初中化學酸堿中和反應教學實踐[J]. 智力, 2023, (24): 111~114.

