用鈣離子濃度傳感器探究硫酸鈣沉淀的轉化

摘 要: 分析傳統實驗在“沉淀的轉化”教學中的薄弱之處,運用鈣離子濃度傳感器探究硫酸鈣沉淀轉化為碳酸鈣沉淀的過程。通過軟件將鈣離子濃度變化的數據繪制成曲線,展現硫酸鈣沉淀溶解平衡的破壞、移動、建立新平衡的全過程,揭示沉淀溶解平衡移動和沉淀轉化的原理,并為該內容的教學提出建議。
關鍵詞: 實驗探究; 鈣離子濃度傳感器; 沉淀溶解平衡
文章編號: 1005-6629(2024)11-0080-03
中圖分類號: G633.8
文獻標識碼: B
1 問題的提出
目前正在使用的四個版本(人教版、魯科版、蘇教版、滬科版)《化學選擇性必修1·化學反應原理》教材中,都按照可逆反應的化學平衡、弱電解質的電離平衡、鹽類的水解平衡和沉淀溶解平衡的順序編排。學生在學習沉淀溶解平衡之前,已經能運用平衡移動原理對一些簡單的平衡問題進行分析和解釋,具備了一定的平衡思想。
在沉淀溶解平衡的學習過程中,學生容易理解難溶電解質在水溶液中形成沉淀溶解平衡體系的過程,但當需要應用沉淀溶解平衡移動的原理時,便會遇到困難,比如解釋“沉淀的轉化”問題。教師常會演示AgCl轉化為AgI的實驗,試圖提供實驗現象為依據,幫助學生進行推理,但教學效果不很明顯。這可能是由于學生從該實驗的現象中容易得知平衡移動的結果(白色的AgCl沉淀變為黃色的AgI沉淀),但不易獲取破壞平衡的因素(溶液中銀離子濃度的減少),導致無法順利地將化學平衡移動原理遷移至沉淀溶解平衡中來。
本文設計CaSO4沉淀轉化為CaCO3沉淀的實驗,即在CaSO4懸濁液中滴加Na2CO3溶液,運用鈣離子濃度傳感器測出沉淀轉化過程中鈣離子濃度的變化,直觀地展示出CaSO4沉淀溶解平衡破壞、平衡移動、達到新的平衡直至CaSO4完全轉化為CaCO3等過程,提供給學生完整的證據鏈,幫助學生運用平衡移動的原理進行分析、推理和解釋,深化認識沉淀溶解平衡的移動導致沉淀轉化的原理。
2 問題解決的思路
在難溶電解質的沉淀平衡體系中,用傳統實驗的手段觀察到破壞平衡的因素是有難度的,因為難溶電解質在水中的溶解度本身就很小,對應的離子濃度非常小,難以呈現出明顯的實驗現象。因此借助傳感器和運用數字化技術可以將原本“看不見”的量轉化為數字或曲線,是解決該難點的思路。
錢揚義等基于數字化實驗實時收集數據及自動生成曲線的技術背景,提出了化學“曲線表征”的定量分析方法,構建了“四重表征”教學模式,包括宏觀表征、微觀表征、符號表征、曲線表征[1]。運用數字化實驗的教學,在原有的“宏-微-符”的基礎上加入了“曲線表征”后,能夠更好地引導學生從本質上理解概念、原理和反應,促進學生認知方式的提升。
杜博等運用pH傳感器探究氫氧化鎂處理印染廢水的原理,以此為情境設計了沉淀溶解平衡的教學案例。案例中教師用pH傳感器測出硫酸滴入氫氧化鎂懸濁液過程中pH的變化并繪制pH變化曲線,學生從曲線中觀察到加入硫酸后pH先減小后增大,然后推理得出氫氧化鎂溶解平衡正向移動,深化了對于沉淀溶解平衡的理解[2]。
受上述案例的啟發,數字化技術改進沉淀溶解平衡實驗用于教學,需要繪制出一條有教學價值的曲線。其中改進實驗的關鍵點是“選擇怎樣的沉淀溶解平衡體系”。該體系中難溶電解質解離出的離子應是常見的,才能被常用的傳感器測出,如pH、鈣離子、氯離子濃度傳感器等。該難溶電解質的溶度積常數不能太小,否則解離出的離子濃度太小也無法被傳感器測得。此外該難溶電解質最好符合安全易得等條件。這些考慮都是為了能夠將改進的實驗融入教學中。基于以上考慮,本研究選擇CaSO4沉淀溶解平衡體系,通過滴加Na2CO3溶液將CaSO4轉化為CaCO3。該過程中鈣離子濃度的變化能被傳感器測得,詳見下文實驗原理和可行性分析。本實驗中的CaSO4、 Na2CO3、 CaCO3均為常見試劑,適合課堂實驗教學。
3 實驗原理和可行性分析
查閱教材[3]中提供的常見難溶電解質的溶度積常數(25℃):Ksp(CaCO3)=2.8×10-9和Ksp(CaSO4)=4.9×10-5。
依據CaCO3(s)Ca2+(aq)+CO2-3(aq),可知Ksp(CaCO3)=c(Ca2+)·c(CO32-)。
由此可計算出25℃的碳酸鈣懸濁液中鈣離子的濃度為:
c(Ca2+)=Ksp(CaCO3)=2.8×10-9=5.3×10-5mol/L(折合為2.1mg/L)
同理可計算出25℃的硫酸鈣懸濁液中鈣離子的濃度為:
c(Ca2+)=Ksp(CaSO4)=4.9×10-5=7×10-3mol/L(折合為280mg/L)
采用Vernier公司生產的無線鈣離子濃度傳感器,其量程為1~40000mg/L(或ppm),校準后的精確度為10mg/L(或ppm)。由理論計算和傳感器的指標可知:當硫酸鈣沉淀轉化為碳酸鈣沉淀時,溶液中的鈣離子濃度會明顯變小且能夠被傳感器測得。
4 實驗用品
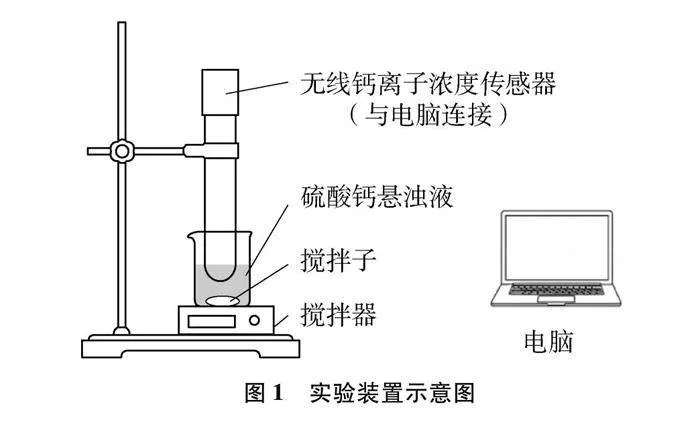
儀器:Vernier無線鈣離子濃度傳感器、電腦、磁力攪拌器(帶攪拌子)、100mL燒杯、鐵架臺、電子天平、100mL量筒等
試劑:蒸餾水、二水合硫酸鈣(AR)、飽和碳酸鈉溶液
5 實驗內容
5.1 傳感器的準備
先用蒸餾水清洗鈣離子濃度傳感器的探頭,用濾紙吸干探頭上殘留的蒸餾水。然后用10mg/L和1000mg/L的氯化鈣標準溶液通過兩點法校準鈣離子濃度傳感器。最后再用蒸餾水清洗鈣離子濃度傳感器的探頭,用濾紙吸干探頭上殘留的蒸餾水,待用。
5.2 設置鈣離子物質的量濃度的計算欄
Vernier無線鈣離子濃度傳感器配套軟件Vernier Graphical Analysis中鈣離子濃度傳感器讀數的單位是mg/L,可通過設置新的計算欄將讀數單位換算為mol/L,計算欄中的換算公式:鈣離子物質的量濃度=0.000025×鈣離子濃度傳感器讀數。
5.3 配制硫酸鈣懸濁液
用電子天平稱量0.5g二水合硫酸鈣,加入100mL燒杯中,加入攪拌子。用量筒量取100mL蒸餾水,加入燒杯中。
5.4 測量鈣離子濃度的變化
搭建實驗裝置如圖1所示。打開攪拌器,待電腦上所示讀數穩定后,開始采集數據繪制鈣離子濃度變化的曲線。向硫酸鈣懸濁液中滴加3滴飽和碳酸鈉溶液,觀察鈣離子濃度的變化。待讀數穩定后,再滴加足量碳酸鈉溶液(1滴管),觀察鈣離子濃度的變化。
6 實驗結果與討論
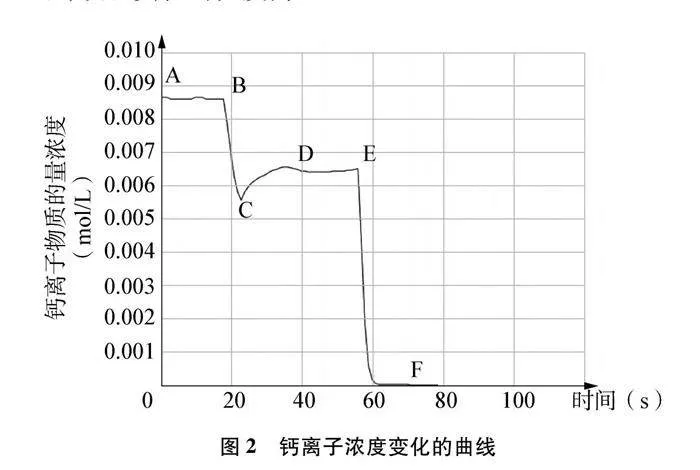
實驗中測得一組鈣離子濃度變化的曲線如圖2所示,該組實驗的溫度為22℃。
AB段是硫酸鈣懸濁液中鈣離子濃度,平均值為0.0086mol/L(347.62mg/L)。B點時刻為向硫酸鈣懸濁液中滴加3滴飽和碳酸鈉溶液,由于鈣離子和碳酸根離子結合生成更難溶的碳酸鈣,鈣離子濃度大幅下降。CD段由于硫酸鈣溶解平衡被打破,溶解平衡正向移動,鈣離子濃度逐漸增大,至DE段達到新的平衡狀態。E點時刻為向該懸濁液中加入足量碳酸鈉溶液,鈣離子濃度大幅下降,F點時鈣離子濃度為0.00003mol/L(1.25mg/L),此時硫酸鈣幾乎完全轉化為碳酸鈣。實驗后肉眼可見燒杯中白色沉淀的量明顯比實驗前有所增加。
曲線中AB段和DE段理應是平直的,但大量實驗中得到數據都略有波動,推測是由于攪拌懸濁液對傳感器讀數造成的影響。
7 教學中的運用
人教版教材中提供了沉淀轉化在實際生產中應用的情境:為了除去鍋爐水垢中含有的硫酸鈣,可以先用碳酸鈉溶液處理,使硫酸鈣轉化為疏松、易溶于酸的碳酸鈣,然后用酸除去[4]。在教學中以此為情境,布置活動任務——解釋該除垢方法的原理。活動中可結合本實驗的數據和曲線(圖2中AB段硫酸鈣達到沉淀溶解平衡、BC段平衡破壞、CD段平衡移動、DE段達到新的平衡,EF段平衡完全破壞),設計以下六個問題供學生思考和交流:(1)AB段硫酸鈣懸濁液是否達到了沉淀溶解平衡狀態?(2)BC段鈣離子的濃度為什么下降?發生了什么反應?(3)BC段硫酸鈣的沉淀溶解平衡是否被破壞?(4)CD段鈣離子的濃度為什么會上升?(5)DE段沉淀的組成是什么?(6)F點時沉淀的組成是什么?其中問題(2)和(3)能夠引導學EOvvA6CBboyR94WOWmfokFKgxa+pVnzH3cSz7pMOFrk=生分析BC段曲線變化的原因,找到破壞該平衡的因素——鈣離子濃度的減小,遷移解決了AgCl轉化為AgI的實驗中銀離子濃度變化不能可視化的難點。EF段的圖像既能解決學生常提出的疑惑:硫酸鈣能否完全轉化為碳酸鈣?還能讓學生感悟到平衡移動是有條件的,極端改變條件會導致平衡完全破壞。
本實驗測定的硫酸鈣沉淀轉化為碳酸鈣沉淀過程中鈣離子的濃度數據,能幫助學生運用離子反應、沉淀溶解平衡移動的原理解釋鈣離子濃度發生變化的原因,突破了“沉淀轉化”教學中的難點,達成了理解沉淀轉化原理的教學目標,有益于促進學生“變化觀念與平衡思想”等學科核心素養的提升。
參考文獻:
[1]王立新, 錢揚義, 蘇華虹, 陳博殷, 梁宏宇. 手持技術數字化實驗與化學教學的深度融合: 從“研究案例”到“認知模型”——概念認知模型的建構[J]. 遠程教育雜志, 2018, (4): 104~112.
[2]杜博, 沈子稚, 肖艷. 基于“證據推理”素養的沉淀溶解平衡教學設計[J]. 化學教學, 2021, (6): 61~62.
[3]
北京師范大學等. 無機化學(第五版上冊)[M]. 北京: 高等教育出版社, 2020: 9.
[4]
王晶主編.普通高中教科書·化學選擇性必修1·化學反應原理[M]. 北京: 人民教育出版社, 2020: 5.

