ACSBG2基因通過類固醇激素合成和細胞黏附相關通路介導鵝肝組織對營養狀態變化的響應



摘 要: 旨在探究酰基輔酶A合成酶家族成員ACSBG2基因在鵝肝組織響應營養狀態變化中的作用及相關機制。本研究將10日齡健康朗德鵝(n=8)用于禁食/再飼喂模型,將65日齡朗德鵝(n=6)用于過量飼喂模型。首先,利用上述動物模型檢測鵝肝及胸肌中ACSBG2的mRNA表達對營養狀態變化的響應;其次體外培養鵝原代肝細胞及肌細胞,檢測營養相關因子(葡萄糖、胰島素、油酸鈉、棕櫚酸)對ACSBG2 mRNA表達水平的影響;然后通過在鵝原代肝細胞中過表達ACSBG2基因并進行轉錄組測序分析,以篩查ACSBG2調控的下游基因與通路;最后在體外培養細胞和動物模型中檢測ACSBG2下游基因的mRNA表達水平。結果發現:1)禁食可抑制肝中ACSBG2的表達(Plt;0.01),再飼喂和過量飼喂可誘導肝中ACSBG2的表達(Plt;0.001);再飼喂(Plt;0.001)和過量飼喂(Plt;0.01)可誘導胸肌中ACSBG2的表達。2)油酸鈉(Plt;0.05)和棕櫚酸(Plt;0.001)可抑制鵝原代肝細胞中ACSBG2的表達;葡萄糖(Plt;0.01)和胰島素(Plt;0.001)可誘導鵝原代肝細胞中ACSBG2的表達;葡萄糖(Plt;0.05)和棕櫚酸(Plt;0.05)可抑制鵝原代肌細胞中ACSBG2的表達,油酸鈉可誘導鵝原代肌細胞中ACSBG2的表達(Plt;0.001)。3)ACSBG2過表達所影響的差異表達基因主要富集于類固醇激素合成和細胞黏附相關的通路。4)在體外和動物模型中ACSBG2可能介導了營養狀態變化對STX1A基因表達的影響。本研究表明,ACSBG2基因主要通過類固醇激素合成與細胞黏附等通路調控糖脂代謝和炎癥相關因子的表達,從而介導營養/能量變化所造成的影響。
關鍵詞: 鵝;ACSBG2 基因;能量代謝;類固醇激素;細胞黏附
中圖分類號:S835.2
文獻標志碼:A
文章編號:0366-6964(2024)11-5018-17
收稿日期:2024-01-16
基金項目:國家自然科學基金(32172717);中國博士后面上項目(2023M742960);國家自然科學基金青年基金(32302754)
作者簡介:王婉昕(1998-),女,江蘇鹽城人,碩士生,主要從事家禽營養調控研究,E-mail:1263210729@qq.com
*通信作者:耿拓宇,主要從事家禽遺傳與育種研究,E-mail:tygeng@yzu.edu.cn
ACSBG2 Gene Mediates the Response of Goose Liver to Nutritional Changes through
Steroid Hormone Synthesis and Cell Adhesion-related Pathways
WANG" Wanxin, YUAN" Zijin, ZHU" Gongquan, WANG" Yuqing, XUE" Ying, GE" Jing, ZHAO" Minmeng,
LIU" Long, GONG" Daoqing, GENG" Tuoyu*
(College of Animal Science and Technology,Yangzhou University, Yangzhou 225009, China)
Abstract:" The aim of this study was to explore the role and related mechanism of ACSBG2 gene, a member of acyl-CoA synthetase family, in the response of goose liver to changes in nutritional status. In this study, 10-day-old healthy Landes geese (n=8) were used in the fasting/refeeding model, and 65-day-old Landes geese (n=6) were used in the overfeeding model. Firstly, these animal models were used to determine the response of ACSBG2 mRNA expression in goose liver and pectoral muscle to changes in nutritional status. Secondly, the effects of nutrition-related factors (glucose, insulin, sodium oleate, palmitic acid) on the mRNA expression level of ACSBG2 in goose primary hepatocytes and pectoral myocytes were determined. Then, ACSBG2 gene was overexpressed in goose primary hepatocytes and transcriptome sequencing analysis was performed to identify the downstream genes and pathways regulated by ACSBG2, which was followed by determining the mRNA expression level of ACSBG2 downstream genes in vitro and in animal models. The results showed that: 1) The expression of ACSBG2 in the liver was inhibited by fasting (Plt;0.01) and induced by refeeding and overfeeding (Plt;0.001). The expression of ACSBG2 in pectoral muscle was induced by refeeding (Plt;0.001) and overfeeding (Plt;0.01). 2) The expression of ACSBG2 in goose primary hepatocytes was inhibited by sodium oleate (Plt;0.05) and palmitic acid (Plt;0.001), but induced by glucose (Plt;0.01) and insulin (Plt;0.001). The expression of ACSBG2 in goose primary pectoral cells was inhibited by glucose (Plt;0.05) and palmitic acid (Plt;0.05), but induced by sodium oleate (Plt;0.001). 3) The differentially expressed genes affected by ACSBG2 overexpression were mainly enriched in steroid hormone synthesis and cell adhesion-related pathways. 4) ACSBG2 may mediate the effect of changes in nutritional status on STX1A gene expression in vitro and animal models. In summary, ACSBG2 gene mainly regulates glycolipid metabolism and the expression of inflammation-related factors through steroid hormone synthesis and cell adhesion-related pathways, thereby mediating the effects of nutritional/energy changes.
Key words: goose; ACSBG2 gene; energy metabolism; steroid hormone; cell adhesion
*Corresponding author: GENG Tuoyu,E-mail:tygeng@yzu.edu.cn
肝是動物體內調節脂肪代謝的中心臟器,對維持脂肪的合成、轉運和代謝間的平衡至關重要,此外在動物采食或禁食狀態下,肝在營養和能量調配過程中扮演不可替代的角色。動物營養和能量代謝研究中,禁食/再飼喂模型和高糖/高脂飲食模型被廣泛應用。禁食會導致動物的營養和能量水平降低,此時,肝通過糖原分解和糖異生提供葡萄糖,并激活脂肪分解,提高脂肪酸的氧化水平來為機體供能,這一過程使得機體的能量供應從依賴葡萄糖代謝轉向脂肪代謝,而再飼喂會引起營養和能量水平的急劇增加,導致血糖迅速升高,促進肝的脂肪合成和儲存,這不僅會影響脂質代謝途徑,還會影響葡萄糖和氨基酸的代謝[1]。
作為動物禁食和再飼喂時維持代謝穩態的關鍵樞紐,肝的能量代謝受血液中激素和營養代謝相關因子的調控,如胰島素、胰高血糖素、葡萄糖、脂肪酸(油酸、棕櫚酸)等。葡萄糖可調節脂肪合成相關酶而影響動物的脂質沉積[2]。胰島素可調節葡萄糖代謝的重要靶器官——肝,抑制肝中的糖原分解和糖異生,促進肝、肌肉和脂肪組織對葡萄糖的吸收,從而調控機體的葡萄糖代謝[3]。脂肪酸不僅是能量來源和生物膜的重要組成成分,還具備調節生物膜結構的功能,此外還參與調節細胞內的信號通路、轉錄因子活性及脂質代謝等[4]。棕櫚酸和油酸是血液和膳食中的主要飽和與不飽和脂肪酸,過多的葡萄糖供給會促進其轉化為脂肪,非酒精性脂肪肝常伴有血液中游離脂肪酸含量的升高。脂肪酸對一些細胞生物學過程也具有調控作用。有研究表明,飽和脂肪酸-棕櫚酸與小鼠3T3-L1前體脂肪細胞共孵育,可調節脂肪的分解和脂肪酶的表達[5];棕櫚酸也可通過激活NOX4基因影響肝細胞對胰島素的敏感性[6]和通過促進IL-8釋放誘導肝細胞發生炎癥反應[7]。再者,楊林輝和陳東風[8]用單不飽和脂肪酸-油酸處理HepG2細胞,發現細胞內甘油三酯(Triglyceride,TG)含量會升高而引起肝細胞脂肪變性;在雞前體脂肪細胞的分化培養基中加入油酸,也同樣促進細胞內脂滴的沉積[9]。總之,營養/能量相關因子可影響細胞內許多生物學過程,而營養/能量代謝狀況的變化可通過這些因子調控動物的生理狀態等。
酰基輔酶A合成酶(ACSs)作為調節脂肪代謝的關鍵酶之一,能夠促進脂肪酸與CoA結合生成酰基輔酶A,因而與能量代謝密切相關[10]。人類基因組存在26種酰基輔酶A合成酶,根據底物脂肪酸的長度特異性和它們的氨基酸序列相似性,可劃分為6個亞家族[11],其中的乙酰輔酶A合成酶亞家族有兩個成員,即ACSBG1(Acyl-CoA synthetase bubblegum family member 1)和ACSBG2(Acyl-CoA synthetase bubblegum family membe 2)。ACSBG1基因是1999年首次在果蠅中發現的[12]。研究發現,ACSBG1基因突變會導致X連鎖的腎上腺腦白質營養不良癥[13]。ACSBG1基因在小鼠的大腦、腎上腺皮質和睪丸組織中表達量較高,其蛋白質可活化長鏈脂肪酸,具有很強的酰基輔酶A合成酶活性。ACSBG1將長鏈脂肪酸活化為長鏈脂肪酰基輔酶A而參與脂肪酸的分解代謝,不僅通過氧化磷酸化產生ATP,而且參與磷脂、TG和膽固醇酯等分子的合成[14]。通過與果蠅ACSBG1氨基酸序列的同源性比對,相繼在小鼠、人類和兔中發現了ACSBG2基因。人類ACSBG1與ACSBG2蛋白質的氨基酸序列同源性約50%。目前針對ACSBG2基因的研究較少,現有研究主要集中在ACSBG2對大腦的發育[15]和精子發生的影響。有報道稱ACSBG2與男性不育有關[16],也有研究發現,ACSBG2與能量和糖脂代謝存在密切的關聯[17]。對人體20種組織進行RNA測序,發現ACSBG2基因在睪丸、腎、大腦組織中表達量最高,在肝和胸腺中也有表達[18]。利用免疫組化和原位雜交技術對不同組織中ACSBG2基因表達進行精細定位分析,結果顯示ACSBG2主要在睪丸、延髓和頸脊髓的支持細胞和大運動神經元中表達[15]。ACSBG2和ACSBG1一樣,能夠活化長鏈脂肪酸為長鏈脂酰輔酶A。ACSBG2蛋白質不僅參與脂肪酸的生物合成與降解,而且通過PPAR信號通路及脂肪細胞因子信號通路參與其他細胞生物學過程[1]。過表達試驗證實,ACSBG2基因可促進C18∶1和C18∶2脂肪酸的活化[15]。亞細胞定位分析顯示,ACSBG2蛋白質主要分布于細胞漿和線粒體[19]。研究發現,ACSBG2基因與雞的腹脂重有關,在雞的肝脂質代謝中起重要作用[20]。與此相一致,關聯分析表明,ACSBG2外顯子和內含子中的某些SNP與腹脂重存在極顯著的關聯,而且肝中ACSBG2的表達量在快速生長的隱性白洛克雞和慢速生長的杏花雞間存在差異[20]。類似地,ACSBG2基因與奶牛乳脂性狀也存在密切關聯,能影響乳脂的合成與代謝[17]。綜上所述,ACSBG2基因可參與動物營養/能量代謝的調控,特別是脂肪酸的合成代謝。
鵝的ACSBG2基因位于NW_025928006.1∶231 265~248 728處,全長17 464個核苷酸,由19個外顯子和18個內含子組成,共編碼731個氨基酸。鵝的ACSBG2蛋白質基因序列與人、小鼠ACSBG2蛋白質基因序列的一致性分別達到58.58%和56.64%。目前有關鵝的ACSBG2基因功能,特別是在營養/能量變化中的表達情況以及作用尚無報道。本研究旨在利用不同的動物模型闡述鵝肝中ACSBG2在營養/能量變化過程中的作用及機制,為依據生產需要調節鵝的營養或能量水平提供理論指導。
1 材料與方法
1.1 試驗動物
本研究中的動物試驗方案符合動物福利與使用的相關準則,并獲得揚州大學動物福利與使用委員會的批準。
鵝胚蛋購自國家水禽基因庫(泰州)。選大小相似的朗德鵝種蛋經消毒處理后在全自動孵化器中孵化23 d。孵化條件按常規操作規程進行。
在禁食/再飼喂試驗中,將體重相近的24只10日齡朗德鵝(國家水禽基因庫)隨機分為對照、禁食和再飼喂3組(n=8)。對照組自由采食和飲水;禁食組禁食24 h,但可自由飲水;再飼喂組在同樣禁食24 h后,恢復自由采食2 h。采用福利屠宰法(將試驗鵝放在充滿二氧化碳的密閉空間致昏后迅速斷頭),將試驗鵝安樂死后采集肝和胸肌組織,用液氮速凍后保存于-80℃。
在過量飼喂試驗中,將體重相近的12只雄性朗德鵝(江蘇省淮安市笠誠畜禽有限公司)隨機分為對照組和過量飼喂組(n=6)。對照組自由采食和飲水,過量飼喂組采用填飼槍進行食管灌注,飼料主要成分為添加1%植物油、0.8%食鹽及其他營養添加劑的熟制玉米。在過量飼喂的第24天采用福利屠宰法(同上)將試驗鵝安樂死。采集肝和胸肌組織,用液氮速凍后保存于-80℃。
1.2 試劑
總RNA提取試劑盒、HiScriptⅢ RT SuperMix for qPCR(+ gDNA wiper)反轉錄試劑盒、AceQ qPCR SYBR Green Master Mix熒光定量PCR試劑盒購自上海翌圣生物科技有限公司;引物由安升達(南京)生命科學技術公司合成;ACSBG2過表達質粒購自吉瑪基因公司(蘇州)合成;jetPRIME通用型DNA/RNA轉染試劑購自法國Polyplus公司;葡萄糖、油酸鈉和胰島素購自美國Sigma公司;胎牛血清(FBS)和DMEM培養基購自美國GIBCO公司;紅細胞裂解液、青霉素鏈霉素混合液、表皮生長因子(EGF)購自北京索萊寶科技公司;Ⅳ型膠原酶購自美國Worthington公司;油紅O染色試劑盒購自上海碧云天公司。
1.3 試驗方法
1.3.1 鵝原代肝細胞和肌細胞的分離培養
取孵化23 d的朗德鵝胚胎,處死后采集肝,并在剪碎后使用Ⅳ型膠原酶進行消化處理。鵝原代肝細胞分離參照范翔[21]的方法進行,分離鵝原代肝細胞并以每孔1×106個細胞接種12孔板。采集鵝胚胎的左右側胸肌,并在剪碎后使用Ⅳ型膠原酶進行消化處理。鵝原代肌細胞的分離培養方法與鵝原代肝細胞一致。兩種細胞的培養基均為含10%FBS、1%青霉素鏈霉素和0.1%EGF的DMEM高糖培養基培養。
1.3.2 營養相關因子對鵝原代肝細胞及肌細胞的處理
葡萄糖溶液:稱取0.36 g葡萄糖溶于10 mL完全培養基中,除菌過濾后配制成400 mmol·L-1葡萄糖溶液。繼續以完全培養基8倍稀釋成50 mmol·L-1葡萄糖溶液,用以處理鵝原代細胞,溶液現配現用。對照組為完全培養基。
胰島素溶液:取1 μL濃度為1 mmol·L-1的胰島素溶液母液,加入999 μL ddH2O混勻后除菌過濾,配制成1 μmol·L-1胰島素溶液,繼續以完全培養基稀釋該溶液,分別配制成4 nmol·L-1和16 nmol·L-1的胰島素溶液,用以處理鵝原代細胞,溶液現配現用。對照組為完全培養基。
油酸鈉溶液:稱取0.0608 g油酸鈉溶于1 mL完全培養基中,使油酸鈉溶液濃度為100 mmol·L-1,除菌過濾后放入37℃水浴鍋中,繼續以完全培養基稀釋該溶液,分別配制成0.125 mmol·L-1和0.25 mmol·L-1油酸鈉溶液,用以處理鵝原代細胞,溶液現配現用。對照組為完全培養基。
棕櫚酸溶液:稱取0.0225 g棕櫚酸(片狀固體),加入877.5 μL無水乙醇,配制成100 mmol·L-1棕櫚酸溶液,除菌過濾后放入37℃水浴鍋中,繼續以完全培養基稀釋該溶液,分別配制成0.125 mmol·L-1和0.25 mmol·L-1棕櫚酸溶液,用以處理鵝原代細胞,溶液現配現用。對照組除不加棕櫚酸外,其他步驟相同。
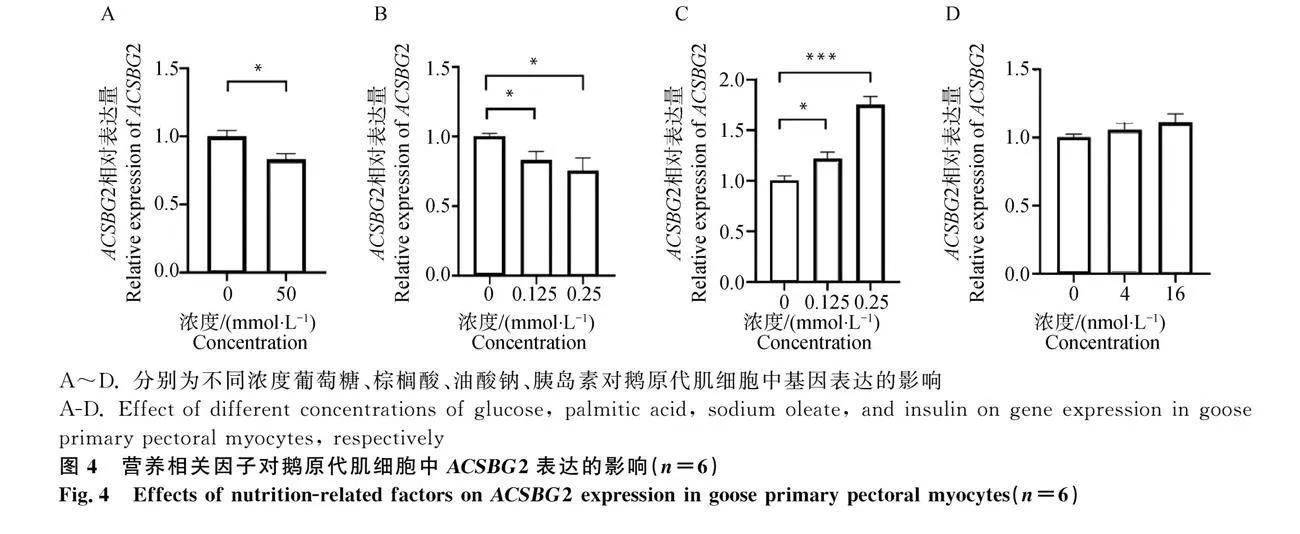
用不同濃度的葡萄糖(0、50 mmol·L-1)、油酸鈉(0、0.125和0.25 mmol·L-1)、棕櫚酸(0、0.125和0.25 mmol·L-1)和胰島素(0、4和16 nmol·L-1)分別處理鵝原代肝細胞和肌細胞16 h后,收集細胞樣備用。濃度為0時,表示該組為對照組。
1.3.3 ACSBG2基因過表達試驗
將鵝ACSBG2基因的編碼序列構建到空載體pcDNA 3.1后,使用jetPRIME通用型DNA/RNA轉染試劑,具體操作步驟為:將0.8 μg的pcDNA 3.1/ACSBG2質粒DNA加入至1.6 μL轉染試劑jetPRIME reagent中,渦旋10 s混勻,瞬離后加入到75 μL jetPRIME buffer中。渦旋5 s后瞬離,室溫孵育10 min,將轉染試劑混合液加入培養的細胞中,十字搖晃混勻后放入培養箱,繼續培養細胞24 h,提取RNA并檢驗轉染效率。
1.3.4 RNA提取、cDNA合成以及熒光定量PCR(qPCR)分析
按照RNA-easy Isolation Reagent(RNA-easy)的使用說明書,從組織或細胞中提取總RNA。用HiScript Ⅲ RT Super Mix for qPCR(+ gDNA wiper)反轉錄試劑盒合成cDNA,用AceQ qPCR SYBR Green Master Mix試劑盒進行qPCR。內參基因為UBC和ACTB。采用2-△△Ct法計算基因的相對表達量。參照NCBI數據庫中基因的mRNA參考序列,用Primer3在線軟件設計引物,序列見表1。
1.3.5 轉錄組測序分析
高通量轉錄組測序分析和數據分析由北京諾禾致源科技公司完成。根據使用說明書,用RNA-easy從細胞中提取總RNA后,將Oligo(dT)磁珠吸附帶polyA的mRNA用于cDNA合成。在檢測cDNA質量和含量后構建cDNA文庫。在Illumina平臺上使用PE150測序策略進行測序分析。從原始數據中去除接頭和低質量reads。對clean data進行Q20和Q30計算以檢測測序錯誤率。采用HISAT2軟件對clean reads進行從頭組裝,用FPKM(Fragments Per Kilobase per Million fragments)法進行基因表達分析。隨后,用DESeq2方法進行組間差異表達分析,再用Benjamini和Hochberg方法校正P值,獲得校正后的P值(Padj)。Padjlt;0.05,Foldchange>1作為篩選差異表達基因(DEG)的標準,最后通過GO(gene ontology)分析進行DEG功能注釋,以及KEGG(Kyoto encyclopedia of genes and genomes)分析篩選DEG富集的通路。
1.3.6 油紅O染色及定量分析
根據油紅O染色試劑盒使用說明書,將貼壁細胞用PBS洗滌1次后,用4%多聚甲醛固定細胞10 min,加入染色洗滌液洗滌細胞后,加入油紅O染色工作液染色20 min,用染色洗滌液及PBS洗滌細胞,加入適量蒸餾水,顯微鏡下拍照。然后每孔加入1 mL異丙醇萃取10 min,移除染液,在分光光度計500 nm波長下測定吸光度。在12孔板中分別加入PMSF+RIPA裂解液150 μL裂解細胞,用刮板刮下后收集細胞,并測定細胞蛋白質含量。用獲取的蛋白質含量對500 nm波長下的吸光度進行校正,從而獲得油紅O染色的定量分析結果。
1.4 統計分析
數據以“平均值±標準差”表示,統計分析采用SPSS 16.0軟件。兩組均值間的差異顯著性采用獨立樣本t檢驗法(雙尾)。Plt;0.05表示差異顯著,Plt;0.01表示差異極顯著,0.05≤Plt;0.1表示有差異趨勢。
2 結 果
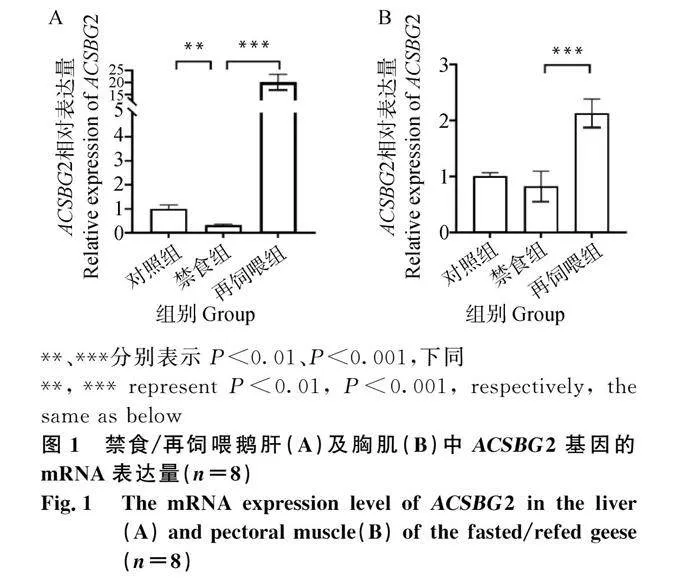
2.1 禁食/再飼喂模型中鵝肝和胸肌中ACSBG2的表達量
與對照組相比,禁食24 h后鵝肝中ACSBG2的mRNA表達量顯著降低(圖1A),再飼喂2 h后鵝肝及胸肌中ACSBG2的mRNA表達量較禁食組顯著升高(圖1A、1B)。
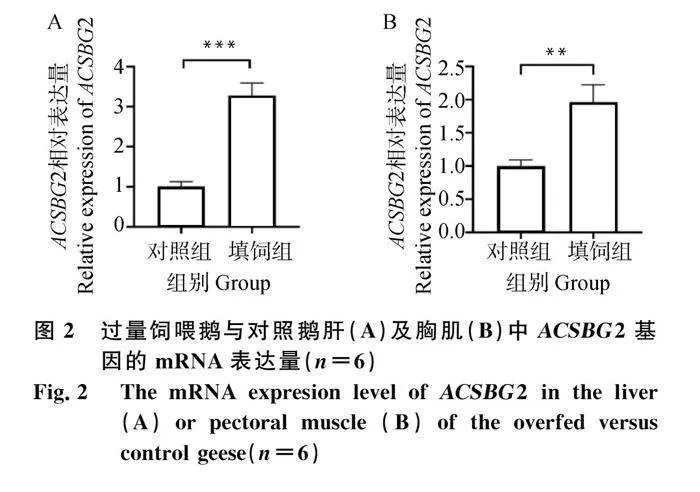
2.2 鵝過量飼喂中肝和胸肌中ACSBG2的表達量
由圖 2可知,與對照組相比,過量飼喂24 d后鵝肝及胸肌中ACSBG2的mRNA表達量均顯著上升。
2.3 營養相關因子對鵝原代肝細胞中ACSBG2表達的影響
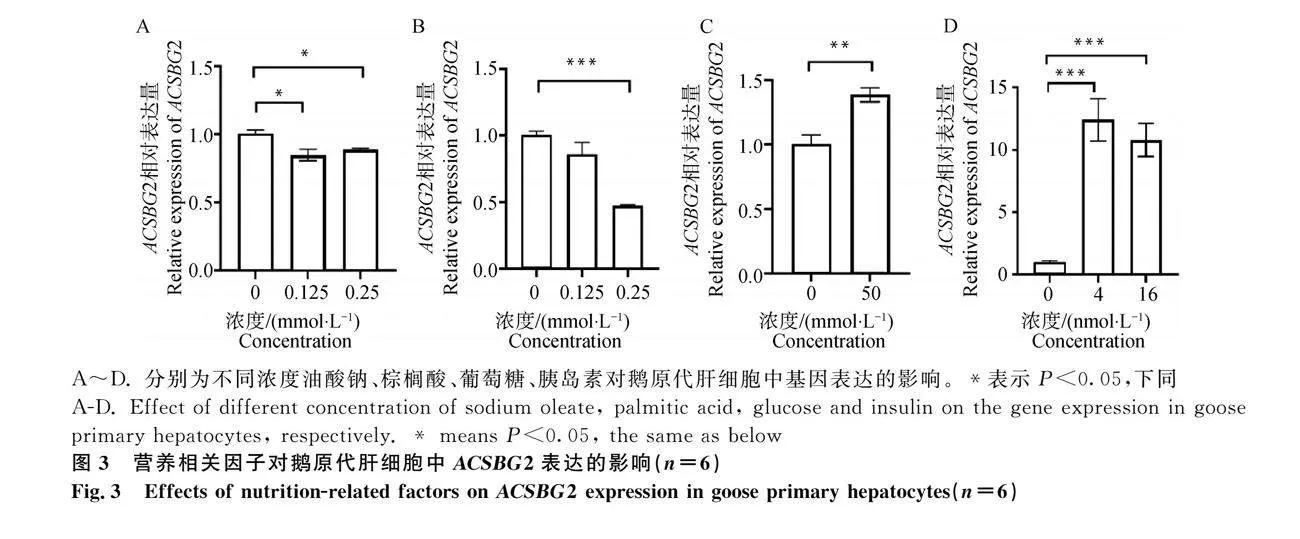
用不同濃度的葡萄糖、胰島素、油酸鈉及棕櫚酸處理鵝原代肝細胞16 h后,RT-qPCR分析表明,與對照組相比,0.125、0.25 mmol·L-1油酸鈉及0.25 mmol·L-1棕櫚酸均能顯著抑制ACSBG2的表達(圖 3A、3B),而50 mmol·L-1葡萄糖及4、16 nmol·L-1胰島素均能顯著誘導ACSBG2的表達(圖 3C、3D)。以上結果說明營養相關因子(油酸鈉、棕櫚酸、葡萄糖、胰島素)均能影響鵝原代肝細胞中ACSBG2的表達。
2.4 營養相關因子對鵝原代肌細胞中ACSBG2表達的影響
用不同濃度的葡萄糖、胰島素、油酸鈉及棕櫚酸處理鵝原代肌細胞16 h后,RT-qPCR分析表明,與對照組相比,50 mmol·L-1葡萄糖及0.125、0.25 mmol·L-1棕櫚酸均能顯著抑制ACSBG2的表達(圖 4A、4B),而0.125、0.25 mmol·L-1油酸鈉均能顯著誘導ACSBG2的表達(圖 4C)。此外,4、16 nmol·L-1胰島素對ACSBG2的表達無明顯影響(圖4D)。以上結果說明營養相關因子(葡萄糖、油酸鈉及棕櫚酸)能影響鵝原代肌細胞中ACSBG2的表達。
2.5 ACSBG2過表達對鵝肝細胞中基因表達和通路的影響
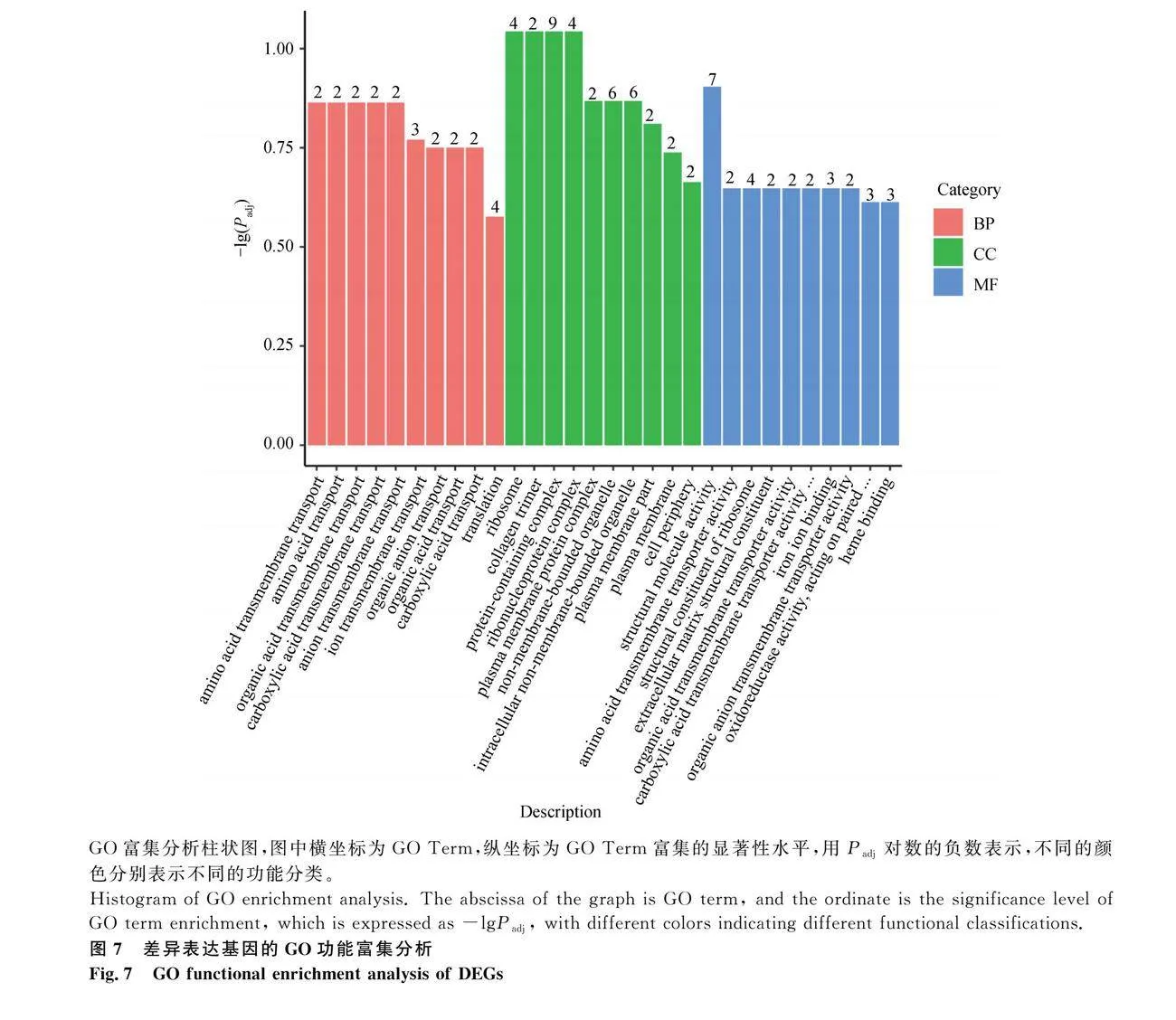
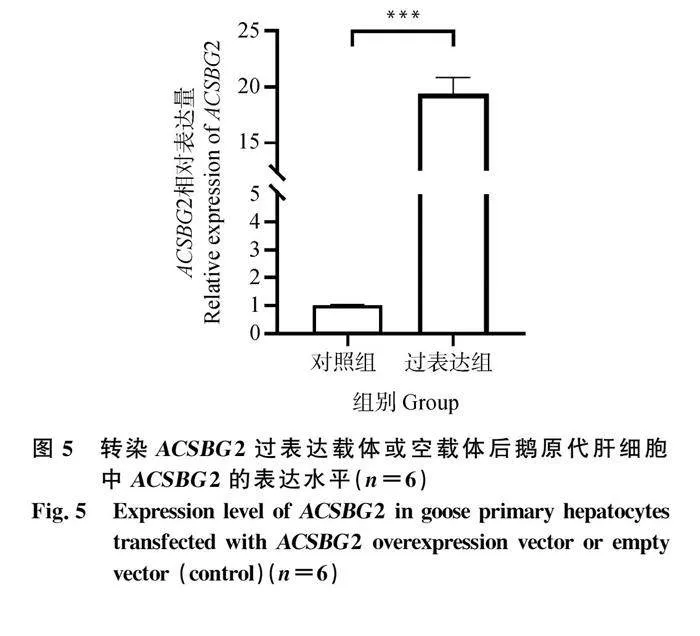
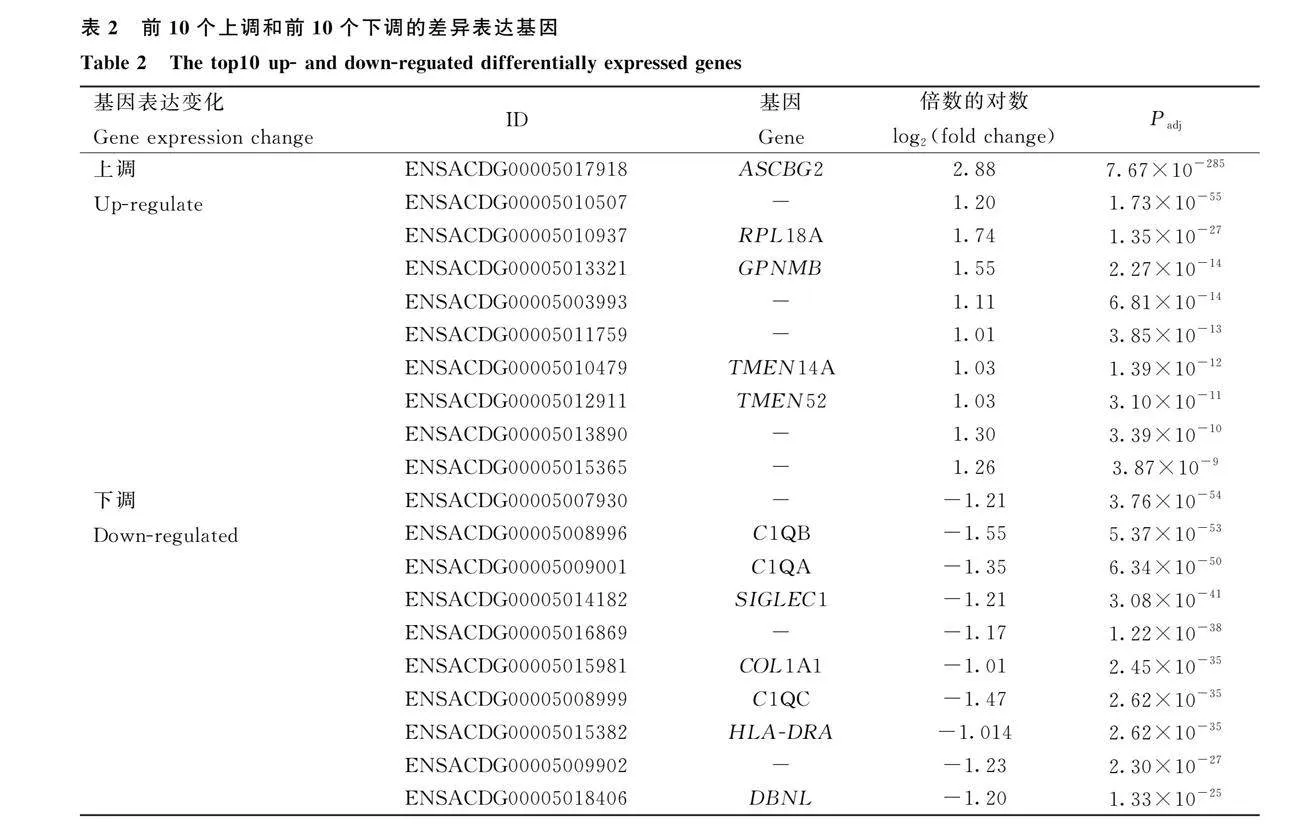
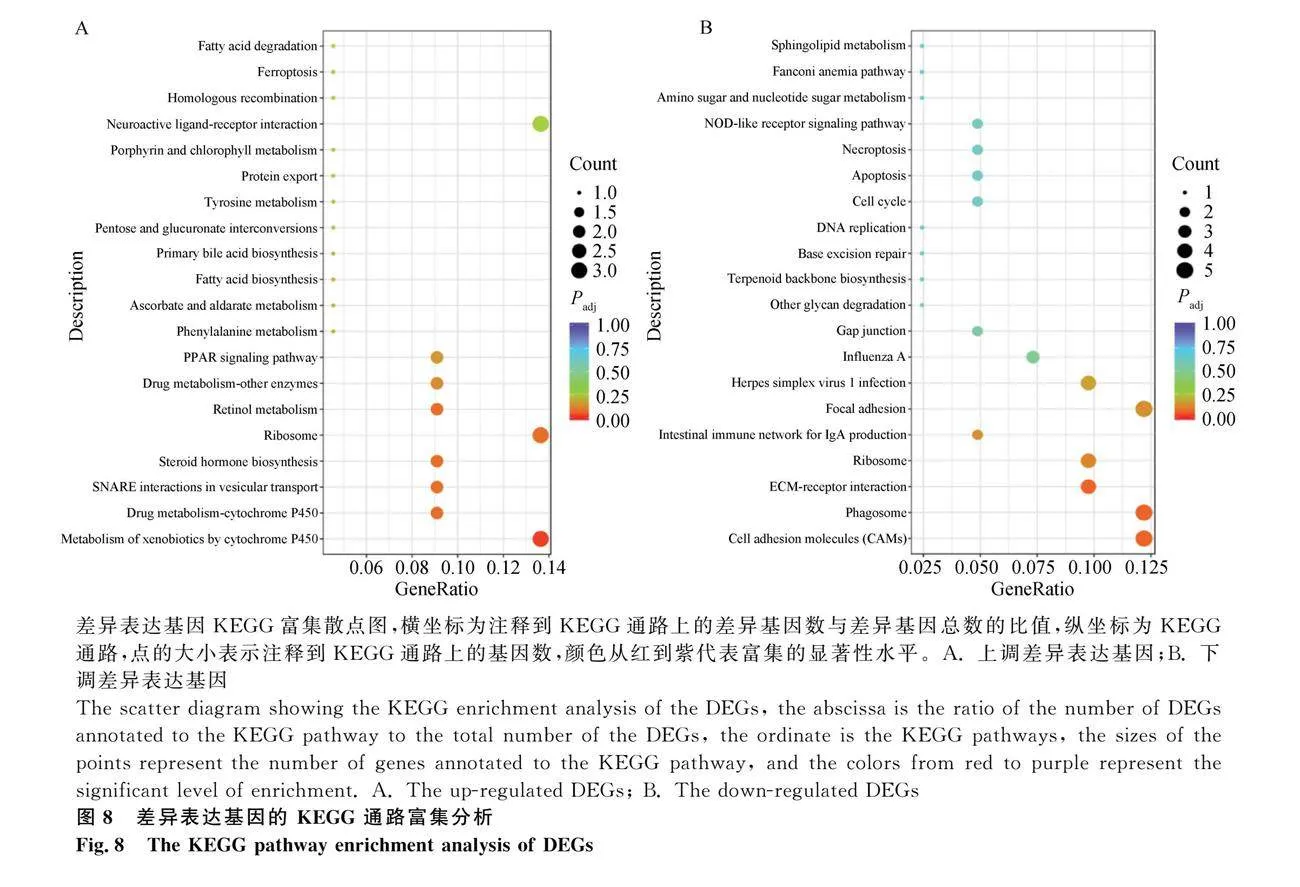
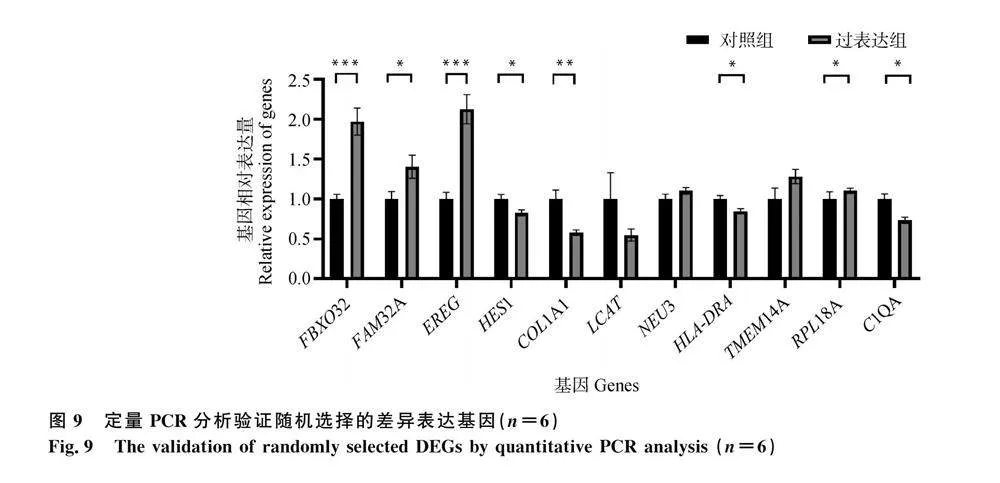
ACSBG2過表達(圖 5)會顯著影響187個基因的表達,其中47個基因的表達被ACSBG2過表達誘導,140個基因的表達被抑制(圖 6)。根據P值大小,表達差異最顯著的10個上調基因和10個下調基因列于表2。GO富集分析表明,DEG主要集中在230個GO通路上,其中109個通路屬于生物過程(BP),27個通路屬于細胞組成(CC),94個通路屬于分子功能(MF)。圖 7列出了不同GO類別中最顯著富集的10個通路。KEGG通路富集分析顯示,上調差異表達基因(DEG)主要富集在Metabolism of xenobiotics by cytochrome P450、Drug metabolism-cytochrome P450、SNARE interactions in vesicular transport、Steroid hormone biosynthesis、Ribosome、Retinol metabolism、Drug metabolism-other enzymes、PPAR signaling pathway等通路;下調DEG主要富集在Cell adhesion molecules、Phagosome、ECM-receptor interaction、Ribosome、Intestinal immune network for IgA production、Focal adhesion、Herpes simplex virus 1 infection、Influenza A等通路(圖 8)。為驗證轉錄組測序分析結果的可靠性,隨機選取10個DEGs,并用RT-qPCR測定這些基因的表達量,結果表明,在10個基因中,僅NEU3基因與RNA-seq結果不完全一致(圖 9),這說明RNA-seq的分析結果總體上是可靠的。
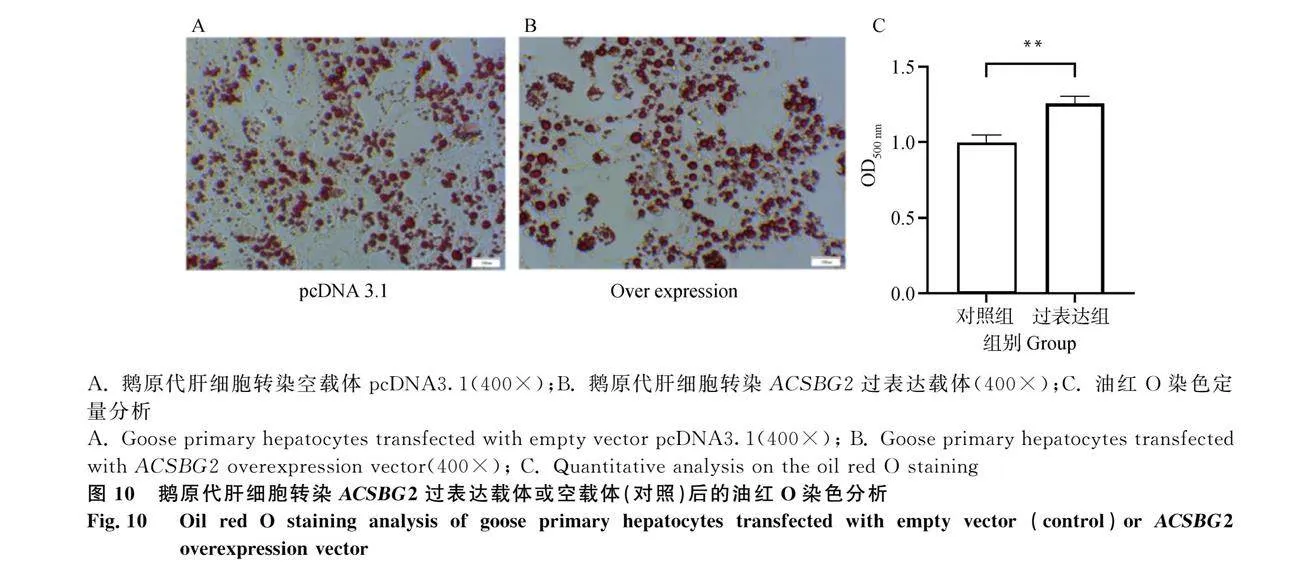
2.6 過表達ACSBG2對肝細胞內脂質沉積的影響
過表達ACSBG2后的油紅O染色及定量分析,結果表明,與對照組(圖 10A)相比,過表達ACSBG2后,細胞內脂滴積聚增多,脂滴變大,脂滴顏色加深(圖 10B)。油紅O染色定量結果也表明,過表達ACSBG2促進肝細胞中脂滴沉積(Plt;"" 0.01,圖 10C)。
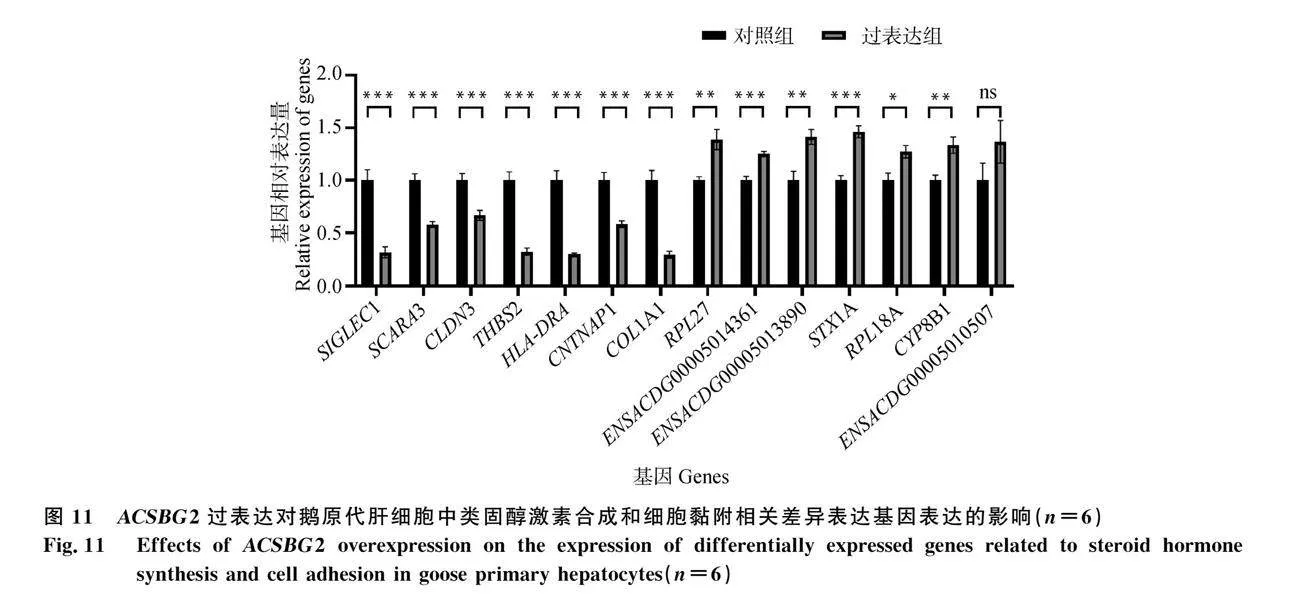
2.7 驗證ACSBG2過表達對類固醇激素合成和細胞黏附相關基因表達的影響
通過RT-qPCR測定了ACSBG2過表達的鵝原代肝細胞中類固醇激素合成和細胞黏附相關DEG(SIGLEC1(Sialic acid binding Ig like lectin 1)、SCARA3(Scavenger receptor class A member 3)、CLDN3(Claudin 3)、THBS2(Thrombospondin 2)、HLA-DRA(Major histocompatibility complex, class II, DR alpha)、CNTNAP1(Contactin associated protein 1)、COL1A1(Collagen type I alpha 1 chain)、RPL27(Ribosomal Protein L27)、ENSACDG00005014361(Anser cygonoides unconvent-ional SNAPE in the ER1, LOC106045006)、ENSACDG00005013890(Anser cygonoides cytochrome P450 A4-like, LOC106044188)、STX1A(Syntaxin 1A)、RPL18A(Ribosomal Protein L18a)、CYP8B1(Cytochrome P450 family 8 subfamily B member 1)、ENSACDG00005010507(Anser cygonoides glututhine S-transferase-like, LOC106030438)的mRNA表達量。數據表明,ACSBG2過表達可誘導鵝原代肝細胞中與類固醇激素合成相關基因(RPL27、ENSACDG-00005014361、ENSACDG00005013890、STX1A、RPL18A、CYP8B1、ENSACDG00005010507)的表達,抑制與細胞黏附相關基因(SIGLEC1、SCARA3、CLDN3、THBS2、HLA-DRA、CNTNAP1、COL1A1)的表達(圖 11),這與轉錄組測序結果相一致。
2.8 胰島素對鵝肝細胞中類固醇激素合成和細胞黏附相關基因表達的影響
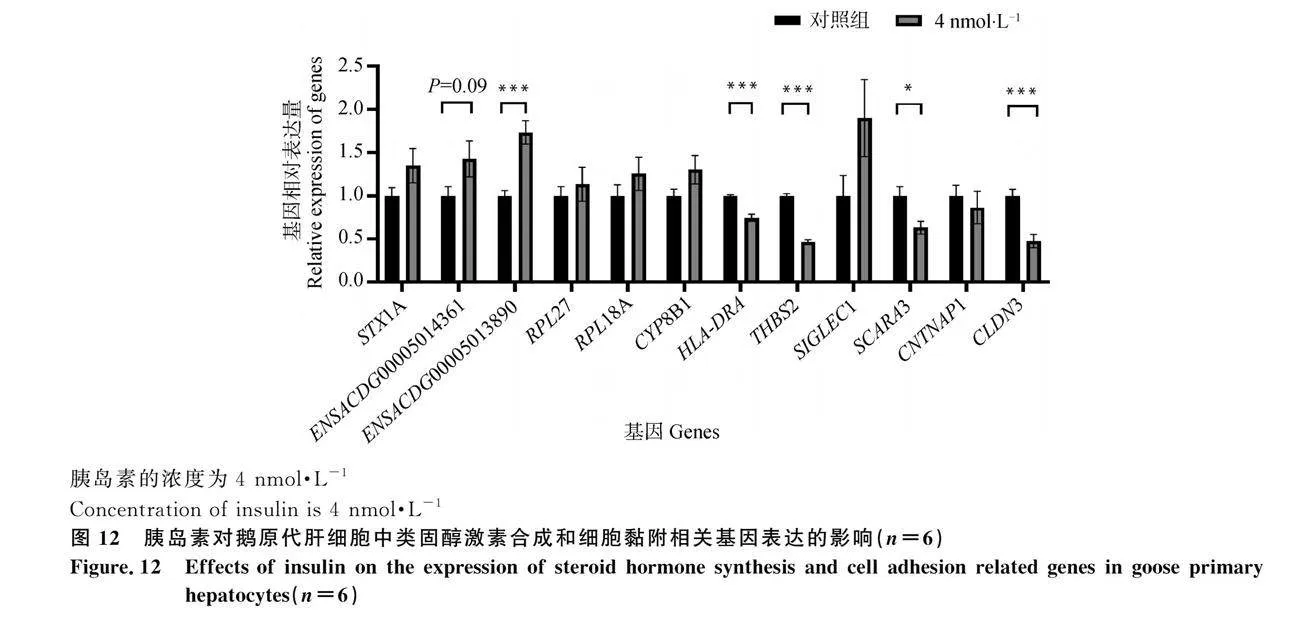
通過RT-qPCR測定了4 nmol·L-1胰島素處理的鵝原代肝細胞中類固醇激素合成和細胞黏附相關基因(STX1A、ENSACDG00005014361、ENSACDG00005013890、RPL27、RPL18A、CYP8B1、HLA-DRA、THBS2、SIGLEC1、SCARA3、CNTNAP1、CLDN3)的mRNA表達量。數據表明,4 nmol·L-1胰島素可誘導鵝原代肝細胞中類固醇激素合成相關基因(ENSACDG00005014361、ENSACDG00005013-890)的表達,抑制細胞黏附相關基因(HLA-DRA、THBS2、SCARA3、CLDN3)的表達(圖 12)。其中,4 nmol·L-1胰島素對ENSACDG00005014361基因表達的誘導效應未達到統計學上的顯著水平,但呈現表達增加的趨勢(P=0.09)。
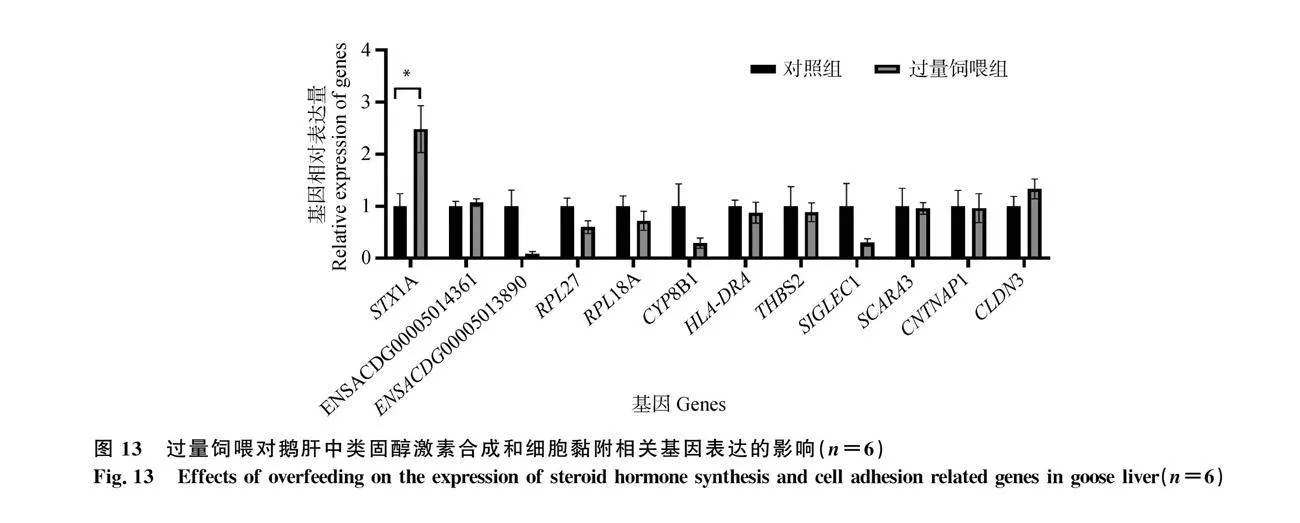
2.9 過量飼喂對鵝肝中類固醇激素合成和細胞黏附相關基因表達的影響
通過RT-qPCR測定了過量飼喂對鵝肝中類固醇激素合成和細胞黏附相關基因(STX1A、ENSACDG00005014361、ENSACDG00005013890、RPL27、RPL18A、CYP8B1、HLA-DRA、THBS2、SIGLEC1、SCARA3、CNTNAP1、CLDN3)的mRNA表達量。數據表明,過量飼喂僅顯著誘導了鵝肝中STX1A基因的表達(圖13)。
2.10 禁食/再飼喂對鵝肝中類固醇激素合成和細胞黏附相關基因表達的影響
通過RT-qPCR檢測了禁食/再飼喂對鵝肝中類固醇激素合成和細胞黏附相關基因(STX1A、ENSACDG00005014361、ENSACDG00005013890、RPL27、RPL18A、CYP8B1、HLA-DRA、THBS2、SIGLEC1、SCARA3、CNTNAP1、CLDN3)的mRNA表達量。數據表明,再飼喂可顯著誘導鵝肝中STX1A基因的表達,抑制了與細胞黏附相關的SIGLEC1、SCARA3、CNTNAP1基因的表達(圖14)。此外,再飼喂對HLA-DRA和THBS2基因表達的抑制作用未達到統計學上的顯著水平,僅呈現表達減少的趨勢(分別為P=0.07、P=0.09)。
3 討 論
適當的營養/能量供給對于動物的生長發育、健康的維持和生產性能的發揮至關重要。比如營養/能量供給超過動物的需要會引起動物肥胖,不僅降低飼料的利用率,而且影響動物的繁殖性能并引起非酒精性脂肪肝等代謝性疾病。為防止動物發生肥胖而造成的不良影響,生產中常常采取限制措施來減少營養/能量的供給,例如:控制動物所采食飼料的數量或品質。相反,對于肥肝生產,則需要鵝或鴨大量采食獲得過多的營養/能量,從而促進脂肪的合成和肝脂的沉積。因此,根據動物的營養需要,合理配制飼料,控制動物采食量,對于提高動物生產效益具有重要意義。
以往的研究表明,營養/能量供給的變化會顯著影響肝中許多基因的表達和相關信號通路,并通過這些基因和通路發揮生物學作用,調控動物的生長發育、健康和生產性能。Liu等[22]研究發現,過量飼喂在早期可誘導鵝肝中脂肪酸合成相關基因(如ACLY、FASN)的表達,而抑制脂質沉積與釋放的基因(如APOB26、LPL27)以及免疫和炎癥相關基因(如補體基因、促炎因子TNFα)的表達;但在過量飼喂后期,不僅脂代謝相關基因的表達發生變化,而且細胞生長相關的基因也發生表達水平的變化。Chen等[1]通過鵝肝轉錄組的測序分析表明,禁食會通過PPAR信號通路影響脂代謝,而再飼喂則會影響到葡萄糖及氨基酸代謝信號通路。Wang等[23]研究發現,禁食可導致20日齡雞肝中AMPK的激活,并抑制糖原合成酶、脂肪酸合成酶(FASN)和甾醇調節元件結合蛋白1(SREBP1)的表達。Fujita等[24]發現禁食6 h可顯著增加8日齡雞肝中胰島素樣生長因子結合蛋白1和2(IGFBP1、IGFBP2)的mRNA表達水平,而再飼喂6 h后,這種增加可被逆轉。由此可見,營養/能量供給的變化能影響家禽肝中許多基因和通路,特別是與脂質合成代謝、細胞生長以及炎癥反應相關的基因與通路,從而調控動物的生長發育與生產性能等。
有關營養/能量變化影響鵝生理機能的分子機制,目前尚不十分清楚。利用鵝的禁食/再飼喂模型和過量飼喂模型進行研究將有助于闡明相關分子機制,從而為鵝生產中的營養調控提供有益參考。本研究結果顯示營養/能量供給不足會抑制鵝肝中ACSBG2基因的表達,而再飼喂或過量飼喂均可誘導鵝肝中ACSBG2基因的表達。這表明營養/能量供給水平的變化可調控鵝肝中ACSBG2基因的表達。禁食時,鵝血糖降低,動物的能量來源逐漸從糖代謝轉向脂代謝,而當再飼喂或過量飼喂時,鵝血糖和胰島素水平升高,糖代謝又成為動物供能的主要來源,同時肝脂合成和沉積增加,血脂水平也隨之升高。在本研究中,數據表明營養相關因子(葡萄糖、胰島素、脂肪酸)處理可影響鵝原代肝細胞中ACSBG2的表達,上述血液中葡萄糖和脂肪酸水平的變化或可部分解釋鵝禁食/再飼喂模型和過量飼喂模型中肝ACSBG2基因的表達變化。ACSBG2基因在肌肉或肌細胞中的表達情形與肝臟或肝細胞不完全一樣,表現出一定的組織細胞類型特異性,可能的原因至少包括以下幾點:ACSBG2基因上游調控序列的表觀遺傳修飾在肌細胞與肝細胞間存在差異,這可能導致兩種類型的細胞對營養因子干預的響應不同;其他基因特別是ACSBG2基因的轉錄因子在肌細胞與肝細胞中的表達存在差異,這也會導致肌細胞與肝細胞對營養因子干預的響應有所不同;肌細胞與肝細胞上轉運營養相關因子的蛋白質(如葡萄糖轉運蛋白GLUT4)或結合營養相關因子的受體(如胰島素受體)含量存在差異或激活狀態不一樣,可能也會導致細胞內營養相關因子的濃度不同或信號上的強弱,進而造成肌細胞與肝細胞處理存在差異。另外,油酸鈉和棕櫚酸干預肌細胞后ACSBG2的表達的水平是相反的原因可能是由于棕櫚酸是飽和脂肪酸,而油酸是不飽和脂肪酸所致。飽和脂肪酸和不飽和脂肪酸的生物學效應常常存在差異,這已為不少研究所報道[25-26]。
以往的研究表明,ACSBG1和ACSBG2作為ACS家族的亞家族成員具有酰基輔酶A合成酶的活性,可活化長鏈脂肪酸。因此,它們不僅會參與細胞的氧化磷酸化,而且會參與磷脂、TG和膽固醇酯等分子的合成,因而與能量和糖脂代謝密切關聯。的確,本研究發現過表達ACSBG2可促進脂肪在鵝原代肝細胞中的沉積。與此相一致,過表達ACSBG2后的轉錄組測序分析表明,ACSBG2可影響鵝原代肝細胞中與類固醇激素、糖脂代謝相關的基因(STX1A、CYP8B1、ENSACDG00005003993、ENSACDG00005013890等)與通路(Metabolism of xenobiotics by cytochrome P450、Drug metabolism-cytochrome P450、SNARE interactions in vesicular transport、Steroid hormone biosynthesis、Retinol metabolism、PPAR signaling pathway、Primary bile acid biosynthesis等)。已知類固醇激素中的糖皮質激素(或腎上腺皮質激素)及性激素(特別是雌激素)與糖脂的合成與代謝密切相關[27]。比如,糖皮質激素具有抑制糖的氧化,促進蛋白質轉化為糖以及促進脂肪合成的作用,從而對糖、脂肪和蛋白質的生物合成和代謝發揮調控作用[28]。膽固醇是類固醇激素的合成原料,而膽固醇可以通過激活轉錄因子SREBP促進脂肪合成相關基因的表達而促進脂肪的合成,因此推斷ACSBG2過表達可能通過誘導細胞色素P450家族基因-CYP8B1基因和ENSACDG00005013890基因而參與膽固醇的代謝和類固醇激素的生物合成過程,進而影響肝中糖脂的合成代謝。再者,研究發現膽固醇可在細胞色素P450家族蛋白催化作用下氧化生成膽汁酸,從而促進腸道對脂質的吸收[29]。這與本研究中過表達ACSBG2可影響初級膽汁酸生物合成通路的結果相吻合。此外,囊泡運輸中SNARE相互作用通路可能在類固醇激素轉運中扮演重要角色[30-31]。另一方面,過表達ACSBG2除了通過影響類固醇的生物合成通路和膽固醇的代謝通路影響糖脂代謝外,還可通過視黃醇代謝通路和PPAR通路影響糖脂代謝。有研究表明,視黃醇與類固醇激素相似,同樣能促進脂肪酸的合成和血糖的調節[32]。PPAR信號通路則能通過調節脂質合成代謝相關基因的表達影響脂肪在肝臟中的沉積[33]。PPAR信號通路的激活還能刺激CYP8B1等細胞色素P450家族基因的表達[34]。總之,ACSBG2基因可能通過影響類固醇激素和脂肪合成代謝相關基因與通路來介導動物對營養/能量變化的響應。
本研究還發現,過表達ACSBG2可影響鵝原代肝細胞中與細胞黏附和免疫炎癥反應相關的基因(SIGLEC1、HLA-DRA、CLDN3、CNTNAP1、SCARA3、THBS2)和通路(Cell adhesion molecules (CAMs)、Phagosome、ECM-receptor interaction、Intestinal immune network for IgA production)。細胞黏附分子是參與細胞與細胞之間及細胞外基質間相互作用的分子,在炎癥反應中,細胞黏附分子的主要作用是使白細胞同炎癥部位中的其他細胞相互黏附,形成炎癥反應需要的細胞聚集,從而加重炎癥病變,其中E-鈣黏素可抑制細胞遷移[35];E-選擇素可在炎癥部位堆積白細胞,激活損傷組織[36]。免疫球蛋白A(IgA)能抑制微生物附著,抵御病原體的侵染[37]。研究發現,SIGLEC1基因是巨噬細胞的限制性黏附分子,參與動物的先天免疫反應;HLA-DRA基因可參與抗體介導的免疫反應和巨噬細胞的活化[38];CLDN3基因可參與免疫細胞的遷移;而CNTNAP1基因可充當免疫治療的靶點。再者,本研究測序結果顯示,HLA-DRA、SCARA3、THBS2基因均參與炎癥反應中的重要過程——吞噬作用。本研究中,過表達ACSBG2可抑制這些基因的表達和相關通路,這表明ACSBG2可能具有抗炎作用。與此一致,由于糖皮質激素具有抗炎作用,因此前述中過表達ACSBG2促進類固醇激素(糖皮質激素)合成可能也是ACSBG2的一種抗炎機制。總之,ACSBG2基因可能通過影響細胞黏附和免疫炎癥反應相關的基因與通路來介導動物對營養/能量變化的響應。
本研究利用細胞模型、禁食/再飼喂模型和鵝過量飼喂模型對上述類固醇激素合成和細胞黏附相關基因進行了檢測,發現這些模型中STX1A基因與ACSBG2基因表達量的關聯與過表達ACSBG2的試驗結果相一致,表明動物和細胞模型中ACSBG2基因可能介導了營養狀態變化對STX1A基因表達的調控。STX1A蛋白質由高爾基體分泌,參與囊泡轉運中SNARE相互作用,在胰島素或胰高血糖素樣肽1(GLP-1)等激素的胞吐作用中扮演重要角色,然而該蛋白質是否參與類固醇激素的胞吐作用仍有待明確。此外,本研究結果顯示,在這些模型中其他基因(RPL27和RPL18A、ENSACDG00005013890和CYP8B1)的表達情況并不與預期相一致。可能的解釋至少包括以下幾點:在ACSBG2過表達的細胞中,這些基因的表達主要受ACSBG2過表達的影響,而在活體模型中這些基因的表達不僅受到ACSBG2基因表達的影響,還可能受到這些基因的轉錄因子調控;活體動物是多細胞生物,因此在動物模型中存在著不同細胞間的通信互作,這種通信互作可能會影響這些基因的表達,從而有別于體外細胞模型中的表達模式;活體動物體內含有各種激素、細胞因子和代謝物等,這些因子可能對這些基因的表達造成顯著影響,從而有別于體外細胞模型中的表達模式。總之,活體模型中的情況更為復雜,在過表達細胞模型中這些基因的表達主要受ACSBG2基因過表達的影響,而在活體模型中,這些基因的表達除了受到ACSBG2表達的影響外,可能還受到這些基因轉錄因子和其他因素的影響,這導致活體模型與細胞模型間存在不一致的情況。
4 結 論
ACSBG2基因在動物的營養狀態變化過程中主要通過對類固醇激素合成與細胞黏附等通路的影響,調控糖脂代謝和炎癥相關基因的表達,尤其是STX1A基因的表達,從而介導鵝肝對營養/能量變化的響應。
參考文獻(References):
[1] CHEN Z Z,XING Y,FAN X,et al.Fasting and refeeding affect the goose liver transcriptome mainly through the PPAR signaling pathway[J].J Poult Sci,2021,58(4):245-257.
[2] 趙 星.胰島素樣生長因子結合蛋白2(IGFBP2)在鵝肥肝形成中的作用及相關機制研究[D].揚州:揚州大學,2017.
ZHAO X.Study on the role of IGFBP2 in the development of goose fatty liver and related mechanism[D].Yangzhou:Yangzhou University,2017.(in Chinese)
[3] SALTIEL A R,KAHN C R.Insulin signalling and the regulation of glucose and lipid metabolism[J].Nature,2001,414(6865):799-806.
[4] 許 超.棕櫚酸、油酸對肝細胞脂質代謝影響的初步研究[D].南京:南京農業大學,2020.
XU C.The primary study of lipid matebolism influenced by palmitic acid,oleic acid in hepatocytes[D].Nanjing:Nanjing Agricultural University,2020.(in Chinese)
[5] KOKTA T A,STRAT A L,PAPASANI M R,et al.Regulation of lipid accumulation in 3T3-L1 cells:insulin-independent and combined effects of fatty acids and insulin[J].Animal,2008,2(1):92-99.
[6] OH J M,CHOI J M,LEE J Y,et al.Role of NADPH oxidase-4 in saturated fatty acid-induced insulin resistance in SK-Hep-1 cells[J].Food Chem Toxicol,2014,63:128-135.
[7] GANJI S H,KASHYAP M L,KAMANNA V S.Niacin inhibits fat accumulation,oxidative stress,and inflammatory cytokine IL-8 in cultured hepatocytes:Impact on non-alcoholic fatty liver disease[J].Metabolism,2015,64(9):982-990.
[8] 楊林輝,陳東風.TNF-α對脂肪變性肝細胞SREBP-1c的表達及甘油三酯含量的影響[J].第三軍醫大學學報,2006,28(23):2354-2357.
YANG L H,CHEN D F.Effects of TNF alpha on expression of SREBP-1c mRNA and triglyceride contents in cultured steatosis hepatocytes[J].Acta Academiae Medicinae Militaris Tertiae,2006,28(23):2354-2357.(in Chinese)
[9] 牟彥雙,王宇祥,李 輝.油酸對雞前脂肪細胞分化過程中基因表達的影響[J].東北農業大學學報,2013,44(12):46-51.
MU Y S,WANG Y X,LI H.Effect of oleate on gene expression during differentiation of chicken preadipocyte[J].Journal of Northeast Agricultural University,2013,44(12):46-51.(in Chinese)
[10] WATKINS P A.Fatty acid activation[J].Prog Lipid Res,1997,36(1):55-83.
[11] OHKUNI A,OHNO Y,KIHARA A.Identification of acyl-CoA synthetases involved in the mammalian sphingosine 1-phosphate metabolic pathway[J].Biochem Biophys Res Commun,2013,442(3-4):195-201.
[12] MIN K T,BENZER S.Preventing neurodegeneration in the Drosophila mutant bubblegum[J].Science (NewYork,N.Y.),1999,284(5422):1985-1988.
[13] PEI Z T,OEY N A,ZUIDERVAART M M,et al.The acyl-CoA synthetase “bubblegum” (lipidosin):further characterization and role in neuronal fatty acid β-oxidation[J].J Biol Chem,2003,278(47):47070-47078.
[14] STEINBERG S J,MORGENTHALER J,HEINZER A K,et al.Very long-chain acyl-CoA synthetases:Human “bubblegum” represents a new family of proteins capable of activating very long-chain fatty acids[J].J Biol Chem,2000,275(45):35162-35169.
[15] PEI Z T,JIA Z Z,WATKINS P A.The Second member of the human and murine “Bubblegum” family is a testis- and brainstem-specific Acyl-CoA Synthetase[J].J Biol Chem,2006,281(10):6632-6641.
[16] ZHENG Y,ZHOU Z M,MIN X,et al.Identification and characterization of the BGR-like gene with a potential role in human testicular development/spermatogenesis[J].Asian J Androl,2005,7(1):21-32.
[17] 姜建萍.中國荷斯坦牛全基因組indel分析及產奶性狀關鍵基因鑒定[D].北京:中國農業大學,2019.
JIANG J P.Studies on genome wide indels and identification of key genes for milk production traits in Chinese Holstein[D].Beijing:China Agricultural University,2019.(in Chinese)
[18] DUFF M O,OLSON S,WEI X T,et al.Genome-wide identification of zero nucleotide recursive splicing in Drosophila[J].Nature,2015,521(7552):376-379.
[19] WATKINS P A,MAIGUEL D,JIA Z Z,et al.Evidence for 26 distinct acyl-coenzyme A synthetase genes in the human genomes[J].J Lipid Res,2007,48(12):2736-2750.
[20] D’ANDRE H C,PAUL W,SHEN X,et al.Identification and characterization of genes that control fat deposition in chickens[J].J Anim Sci Biotechnol,2013,4(1):43.
[21] SIEWERT K M,VOIGHT B F.BetaScan2:Standardized statistics to detect balancing selection utilizing substitution data[J].Genome Biol Evol,2020,12(2):3873-3877.
[21] 范 翔.MAP3K7CL在鵝肥肝形成中的作用及機理研究[D].揚州:揚州大學,2022.
FAN X.Study on the role and mechanism of MAP3K7CL in the formation of goose fatty liver[D].Yangzhou:Yangzhou University,2022.(in Chinese)
[22] LIU L,ZHAO X,WANG Q,et al.Prosteatotic and protective components in a unique model of fatty liver:Gut microbiota and suppressed complement system[J].Sci Rep,2016,6:31763.
[23] WANG Y F,BUYSE J,COUROUSSE N,et al.Effects of sex and fasting/refeeding on hepatic AMPK signaling in chickens (Gallus gallus)[J].Comp Biochem Physiol Part A Mol Integr Physiol,2020,240:110606.
[24] FUJITA S,YAMAGUCHI M,HIRAMOTO D,et al.Effects of fasting and refeeding on the mRNA levels of insulin-like growth factor-binding proteins in chick liver and brain[J].J Poult Sci,2018,55(4):269-273.
[25] GENG T,HU W,BROADWATER M H,et al.Fatty acids differentially regulate insulin resistance through endoplasm reticulum stress-mediated induction of tribbles homologue 3:a potential link between dietary fat composition and the pathophysiological outcomes of obesity[J].Diabetologia,2013,56(9):2078-2087.
[26] WEI Y R,WANG D,TOPCZEWSKI F,et al.Saturated fatty acids induce endoplasmic reticulum stress and apoptosis independently of ceramide in liver cells[J].Am J Physiol Endocrinol Metab,2006,291(2):E275-E281.
[27] 趙 冉,袁中尚,鞏光平,等.性激素對脂代謝的影響及其臨床應用進展[J].山東醫藥,2015,55(37):98-100.
ZHAO R,YUAN Z S,GONG G P,et al.Effect of sex hormones on lipid metabolism and its clinical application progress[J].Shandong Medical Journal,2015,55(37):98-100.(in Chinese)
[28] 顏光美.藥理學[M].北京:高等教育出版社,2009.
YAN G M.Pharmacology[M].Beijing:Higher Education Press,2009.(in Chinese)
[29] 郭悅承,陸倫根.肝星狀細胞儲存的視黃醇對慢性肝病的影響[J].國際消化病雜志,2020,40(5):291-293,297.
GUO Y C,LU L G.Effect of retinol stored in hepatic stellate cells on chronic liver disease[J].International Journal of Digestive Diseases,2020,40(5):291-293,297.(in Chinese)
[30] SARASTE J,GOUD B.Functional symmetry of endomembranes[J].Mol Biol Cell,2007,18(4):1430-1436.
[31] 金紅敏,李立新.擬南芥SNARE因子在膜泡運輸中的功能[J].植物學報,2010,45(4):479-491.
JIN H M,LI L X.Role of Arabidopsis SNARE proteins in vesicle trafficking[J].Chinese Bulletin of Botany,2010,45(4):479-491.(in Chinese)
[32] 劉 名,楊捍宇,謝秋實,等.視黃酸在糖脂代謝和胰島素抵抗中的作用研究進展[J].藥學進展,2020,44(11):846-853.
LIU M,YANG H Y,XIE Q S,et al.Advances in research on the role of retinoic acid in glycolipid metabolism and insulin resistance[J].Progress in Pharmaceutical Sciences,2020,44(11):846-853.(in Chinese)
[33] 馮帥霞,徐 瑩,韓 涵.過氧化物酶體增殖物激活受體(PPAR)在肝臟疾病中的作用及潛在意義[J].臨床肝膽病雜志,2023,39(7):1747-1753.
FENG S X,XU Y,HAN H.Role and potential significance of peroxisome proliferator-activated receptors in liver diseases[J].Journal of Clinical Hepatology,2023,39(7):1747-1753.(in Chinese)
[34] FISSLTHALER B,POPP R,KISS L,et al.Cytochrome P450 2C is an EDHF synthase in coronary arteries[J].Nature,1999,401(6752):493-497.
[35] 楊娜娜,王 莉.E-鈣粘素與子癇前期相關性研究進展[J].臨床軍醫雜志,2018,46(3):369-372.
YANG N N,WANG L.Research progress on the correlation between E-cadherin and preeclampsia[J].Journal of Clinical Military Medicine,2018,46(3):369-372.(in Chinese)
[36] WANG H,ZHU L S,CHENG J W,et al.CD40 ligand induces expression of vascular cell adhesion molecule 1 and E-selectin in orbital fibroblasts from patients with Graves’ orbitopathy[J].Graefes Arch Clin Exp Ophthalmol,2015,253(4):573-582.
[37] LAMM M E.Interaction of antigens and antibodies at mucosal surfaces[J].Annu Rev Microbiol,1997,51:311-340.
[38] KROPSHOFER H,ARNDT S O,MOLDENHAUER G,et al.HLA-DM acts as a molecular chaperone and rescues empty HLA-DR molecules at lysosomal pH[J].Immunity,1997,6(3):293-302.
(編輯 范子娟)

