不同發(fā)情階段水牛唾液的DIA定量蛋白組學(xué)分析


摘 要: 旨在利用高通量DIA定量蛋白組學(xué)分析不同發(fā)情階段水牛唾液中蛋白的差異。本研究將15頭體況相近(平均體重為650~750 kg),發(fā)情正常,健康狀態(tài)良好的2~5胎次的尼里-拉菲母水牛作為研究對(duì)象,在相同的管理?xiàng)l件下,對(duì)其注射氯前列醇并計(jì)為第0天,分別在發(fā)情前期(第1天)、發(fā)情期(第3天)、發(fā)情后期(第6天)早上飼喂之前(08:00-11:00)進(jìn)行唾液的采集,唾液樣本每個(gè)發(fā)情時(shí)期分組相同,每3頭牛分為一組,共分為5組,樣品處理后進(jìn)行DIA定量蛋白組學(xué)檢測(cè)。結(jié)果顯示,不同發(fā)情階段水牛的唾液中共定量到1 982個(gè)蛋白質(zhì),分別在發(fā)情期/發(fā)情前期和發(fā)情期/發(fā)情后期比較組中鑒定到59和38個(gè)差異豐度蛋白。功能分析發(fā)現(xiàn),CBL、SOD1、SPP1和ARPC1B等蛋白質(zhì)可能在細(xì)胞調(diào)控和抗氧化、維持細(xì)胞間相互作用等方面發(fā)揮作用。KEGG通路分析顯示,發(fā)情前期、發(fā)情期和發(fā)情后期水牛唾液差異豐度蛋白被富集到mTOR信號(hào)通路、孕酮介導(dǎo)的卵母細(xì)胞成熟等通路上。綜上,通過不同發(fā)情階段的對(duì)比,獲得與繁殖相關(guān)的差異蛋白4個(gè),CBL、ARPC1B、SOD1和SPP1。這些唾液中的差異豐度蛋白可能作為水牛發(fā)情生物標(biāo)志物的關(guān)鍵蛋白,進(jìn)而為開發(fā)水牛發(fā)情檢測(cè)診斷試劑盒提供數(shù)據(jù)支撐。
關(guān)鍵詞: 水牛;發(fā)情鑒定;唾液;蛋白組學(xué)
中圖分類號(hào): S823.83
文獻(xiàn)標(biāo)志碼: A
文章編號(hào):0366-6964(2024)11-5072-13
收稿日期:2024-05-09
基金項(xiàng)目:國家重點(diǎn)研發(fā)計(jì)劃政府間重點(diǎn)專項(xiàng)(2022YFE0100200);國家自然科學(xué)基金國際合作項(xiàng)目(32161143032);農(nóng)業(yè)農(nóng)村部和財(cái)政部資助:現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系資助(CARS-36);國家家養(yǎng)動(dòng)物種質(zhì)資源庫;中國農(nóng)業(yè)科學(xué)院科技創(chuàng)新工程(ASTIP-IAS06)
作者簡介:余 洲(1998-),男,陜西山陽人,碩士生,主要從事動(dòng)物繁殖研究,E-mail: yz.zhouyu@qq.com
*通信作者:趙學(xué)明,主要從事家畜胚胎生物技術(shù)研究,E-mail: zhaoxueming@caas.cn
DIA Quantitative Proteomics Analysis of Buffalo Saliva at Different Estrus Stages
YU" Zhou1, YANG" Baigao1, LI" Chongyang1, ZHANG" Peipei1, CAO" Jianhua1, NIU" Yifan1, QIN" Guangsheng2, ZHAO" Xueming1*
(1.Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193,
China;
2.Buffalo Research Institute of Guangxi Zhuang Nationality Autonomous Region,
Chinese Academy of Agricultural Sciences, Nanning 530001," China)
Abstract:" This study aimed to analyze the differences in proteins in the saliva of buffaloes at different estrous stages using data-independent acquisition (DIA) proteomics. Fifteen Nili-Ravi buffaloes of similar body condition (average weight of 650-750 kg), in normal oestrus and in good health condition with 2-5 lactations were injected with chloroprostenol on day 0 of the experiment. Saliva samples were collected during proestrus (day 1), estrus (day 3), and metestrus (day 6) before morning feeding (08:00-11:00 am) under the same management conditions and subjected to data-independent acquisition proteomics analysis. Saliva samples were grouped identically for each estrous period, with every 3 cows divided into one group and a total of 5 groups. The results showed that a total of 1 982 proteins were quantified in the saliva of buffaloes at different oestrus stages. Additionally, 59 differentially abundant proteins were identified in the estrus vs proestrus comparison group, and 38 differentially abundant proteins were identified in the estrus vs metestrus comparison group. Functional analyses revealed that proteins such as CBL, SOD1, SPP1, and ARPC1B might play roles in cellular regulation, antioxidant functions, and maintenance of intercellular interactions. KEGG pathway analyses revealed that during proestrus, estrus and metestrus buffalo salivary differential abundance proteins were enriched into the mTOR signalling pathway, progesterone-mediated oocyte maturation and other pathways. In conclusion, significant differentially abundant proteins were present in the saliva of buffaloes at different estrous stages. Additionally, 4 differential proteins associated with reproduction, CBL, ARPC1B, SOD1 and SPP1, were obtained by comparing different oestrus phases. These differential proteins in saliva may serve as key proteins for estrus biomarkers in buffaloes, potentially providing a reference for the development of estrus detection diagnostic kits.
Key words: Bubalus bubalis; estrus detection; salivary; proteomics
*Corresponding author: ZHAO Xueming, E-mail: zhaoxueming@caas.cn
水牛抗病力強(qiáng),適應(yīng)性好,耐粗飼且耐高溫高濕,因此在我國南方地區(qū)成為經(jīng)濟(jì)價(jià)值高的主要飼養(yǎng)動(dòng)物[1]。然而,在現(xiàn)代化規(guī)模養(yǎng)殖模式下,水牛發(fā)情不明顯的問題逐漸凸顯,成為需要關(guān)注的養(yǎng)殖挑戰(zhàn)。研究表明,在夏季,水牛安靜發(fā)情的現(xiàn)象尤為顯著,占總數(shù)的29%,這一特點(diǎn)給發(fā)情檢測(cè)工作帶來了極大的挑戰(zhàn)[2]。此外,水牛還面臨發(fā)情識(shí)別問題,由于缺乏準(zhǔn)確的發(fā)情檢測(cè)方法,50%的發(fā)情沒有被及時(shí)發(fā)現(xiàn),進(jìn)而影響了配種計(jì)劃的實(shí)施。在生產(chǎn)中,約有20%的水牛因人工授精時(shí)機(jī)不當(dāng)而未能受孕,這不僅降低了牛群的生產(chǎn)力,也對(duì)水牛產(chǎn)業(yè)的經(jīng)濟(jì)效益產(chǎn)生了重大影響[3-4]。研究表明,自然發(fā)情水牛的懷孕率僅為60%,凍精輸精的受孕率僅為45%左右[5]。因此,精準(zhǔn)識(shí)別水牛發(fā)情對(duì)水牛生產(chǎn)至關(guān)重要。利用發(fā)情鑒定技術(shù),能夠準(zhǔn)確判斷水牛的發(fā)情時(shí)期,進(jìn)而優(yōu)化配種時(shí)間規(guī)劃,提升繁殖效率,并最大限度地提升生產(chǎn)的經(jīng)濟(jì)效益。在當(dāng)前的生產(chǎn)實(shí)踐中,水牛發(fā)情鑒定主要依賴于3種方法:人工觀察法、人工涂蠟法以及自動(dòng)化監(jiān)測(cè)法[6-8]。然而,這些方法各自存在一定的限制,尚不能完全滿足水牛規(guī)模化生產(chǎn)中精確、高效、低成本的發(fā)情鑒定需求。當(dāng)前亟待開發(fā)一種操作簡單、成本更低、精度更高的水牛發(fā)情監(jiān)測(cè)手段。這將有助于提高水牛規(guī)模化生產(chǎn)的繁殖效率和經(jīng)濟(jì)效益,推動(dòng)水牛產(chǎn)業(yè)的持續(xù)發(fā)展。
隨著高通量技術(shù)的迅猛進(jìn)步,數(shù)據(jù)非依賴采集(data-independent acquisition,DIA)技術(shù)作為質(zhì)譜領(lǐng)域的新一代蛋白組學(xué)技術(shù)嶄露頭角。該技術(shù)以其廣泛的蛋白質(zhì)覆蓋范圍、卓越的重復(fù)性和準(zhǔn)確性而備受矚目[9]。如今,DIA技術(shù)已經(jīng)廣泛地應(yīng)用于各類蛋白質(zhì)組學(xué)研究中,展現(xiàn)出了強(qiáng)大的應(yīng)用潛力和價(jià)值。
唾液是一種由腮腺、下頜骨和舌下腺等腺體分泌的生物液體,并包含牙齦液和口腔微生物群[10]。其成分多樣,涵蓋了緩沖液、鹽類、核酸、有機(jī)化合物和蛋白質(zhì)等組分[11-12]。唾液相較于尿液、血液和宮頸陰道液等體液,具備易采集、低成本、高穩(wěn)定性、非侵入性以及對(duì)動(dòng)物造成的應(yīng)激小等優(yōu)勢(shì)[13]。近年來,唾液檢測(cè)發(fā)情成為研究的新焦點(diǎn)。賈銀海等[14]成功利用水牛唾液中的生殖激素來評(píng)估其發(fā)情狀態(tài)。董智豪等[15]則通過對(duì)比安靜發(fā)情與正常發(fā)情荷斯坦母牛的唾液,探討了兩者在特異性化合物含量上的差異。
本研究旨在利用DIA定量蛋白組學(xué)技術(shù),對(duì)不同發(fā)情階段水牛唾液中的差異蛋白進(jìn)行全面分析,以期發(fā)現(xiàn)與水牛發(fā)情狀態(tài)密切相關(guān)的候選分子標(biāo)記,為水牛發(fā)情監(jiān)測(cè)提供新的科學(xué)依據(jù)。
1 材料與方法
1.1 試驗(yàn)材料
試驗(yàn)在中國廣西壯族自治區(qū)南寧市的中國農(nóng)業(yè)科學(xué)院水牛研究所進(jìn)行,試驗(yàn)牛為15頭體況相近(平均體重為650~750 kg),發(fā)情正常,健康狀態(tài)良好的2~5胎次的尼里-拉菲母水牛。
1.2 試驗(yàn)儀器與試劑
iRT kit (Biognosys),Bradford蛋白定量試劑盒(碧云天),二硫蘇糖醇(DTT)(Sigma),碘代乙酰胺(IAM)(Sigma),十二烷基硫酸鈉(SDS)(國藥),尿素(國藥),質(zhì)譜級(jí)胰酶(Promega),碳酸氫銨(Sigma),LC-MS級(jí)超純水(Thermo Fisher Chemical),三乙基碳酸氫銨緩沖液(TEAB)(Sigma),LC-MS級(jí)乙腈(Thermo Fisher Chemical),LC-MS級(jí)甲酸(Thermo Fisher Scientific),丙酮(北京化工廠),氨水(Sigma),ProteoMiner低豐度蛋白富集試劑盒(Bio-Rad、NP),三氟乙酸(TFA)(Sigma),液相(Thermo Fisher),質(zhì)譜(Thermo),低溫離心機(jī)(Scilogex),冷凍干燥機(jī)(Labogene),電泳儀(Bio-Rad),電泳槽(Bio-Rad),電子天平(Sartorius),渦旋混合器(光合),酶標(biāo)儀(Thermo),制冰機(jī)(雪科),組織研磨儀(上海凈信),超聲波細(xì)胞破碎儀(寧波新芝),氯前列醇(齊魯動(dòng)保),鹽酸塞拉挫(華牧)。
1.3 試驗(yàn)方法
在相同的管理?xiàng)l件下,對(duì)18頭試驗(yàn)水牛注射氯前列醇(4 mL·頭-1)并計(jì)為第0天,分別在發(fā)情前期(第1天)、發(fā)情期(第3天)、發(fā)情后期(第6天)早上飼喂之前(08:00-11:00)進(jìn)行唾液的采集工作。采集時(shí)間參考Singha等[2]的試驗(yàn),水牛所進(jìn)行同期發(fā)情預(yù)試驗(yàn),確定采集時(shí)間準(zhǔn)確性,在發(fā)情期當(dāng)天使用B超觀察是否存在優(yōu)勢(shì)卵泡(≥10 mm),來進(jìn)一步確定是否進(jìn)入發(fā)情期,篩選后共15頭水牛符合試驗(yàn)條件。將所有水牛趕至保定架內(nèi),進(jìn)行樣本的采集,并進(jìn)行DIA定量蛋白質(zhì)組學(xué)分析。
1.4 水牛唾液處理與樣本收集
因?qū)ν僖盒枰^濾處理且需求量較大,出于動(dòng)物福利考慮,在血液采集后對(duì)水牛使用鹽酸賽拉嗪(2 mL·頭-1),并使用自然采集法收集唾液,采集的唾液立刻使用0.22 μm除菌濾器過濾至2 mL凍存管中,對(duì)凍存管進(jìn)行標(biāo)記后立刻投入液氮速凍,樣品采集結(jié)束后運(yùn)至實(shí)驗(yàn)室-80℃保存。唾液樣本每個(gè)發(fā)情時(shí)期分組相同,每3頭牛分為一組,共分為5組。
1.5 總蛋白提取
從-80℃冰箱取樣本至1.5 mL離心管,加DB蛋白溶解液(8 mol·L-1尿素、100 mol·L-1 TEAB,pH8.5)混勻。4℃、12 000 g離心15 min取上清,加1 mol·L-1 DTT,56℃反應(yīng)1 h后冰浴2 min。再加IAM,室溫避光反應(yīng)1 h。
1.6 蛋白質(zhì)檢
在本研究中,采用Bradford蛋白質(zhì)定量試劑盒來精確測(cè)定樣品的蛋白濃度。首先,嚴(yán)格遵循試劑盒說明書,制備了一系列濃度梯度為0~0.5 μg·μL-1的牛血清白蛋白(BSA)標(biāo)準(zhǔn)蛋白溶液。隨后,將不同濃度的BSA標(biāo)準(zhǔn)蛋白和稀釋的待測(cè)樣品分別加入96孔板,每孔20 μL,每個(gè)濃度重復(fù)3次,以確保數(shù)據(jù)的準(zhǔn)確性和可靠性。
迅速向每個(gè)孔中加入180 μL的G250染色液,并將96孔板置于室溫下靜置5 min,以使染色液與樣品充分反應(yīng)。隨后,用分光光度計(jì)測(cè)各孔595 nm波長下的吸光度。根據(jù)標(biāo)準(zhǔn)蛋白液的吸光度繪制標(biāo)準(zhǔn)曲線,計(jì)算待測(cè)樣品的蛋白濃度。
為了進(jìn)一步驗(yàn)證蛋白的存在及其分子量分布,選取20 μg的蛋白待測(cè)樣品進(jìn)行12% SDS-PAGE凝膠電泳分析。在電泳過程中,設(shè)置不同的電泳條件以適應(yīng)濃縮膠和分離膠的不同特性。具體而言,濃縮膠電泳條件為80 V電壓下運(yùn)行20 min,而分離膠電泳條件則為120 V電壓下運(yùn)行90 min。電泳結(jié)束后,對(duì)凝膠進(jìn)行考馬斯亮藍(lán)R-250染色,并通過適當(dāng)?shù)拿撋幚恚沟玫鞍讞l帶清晰可見。
1.7 蛋白酶解
取適量蛋白樣品,加入DB蛋白溶解液(8 mol·L-1尿素和100 mol·L-1 TEAB,pH調(diào)至8.5),將總體積調(diào)整至100 μL,以確保樣品完全溶解于適宜的溶液中。接下來加入胰酶和100 mol·L-1 TEAB緩沖液,充分混合后,將混合物置于37℃條件下進(jìn)行酶切反應(yīng),持續(xù)時(shí)間為4 h。為了進(jìn)一步促進(jìn)蛋白質(zhì)的酶解,再次加入胰酶和CaCl2,并繼續(xù)酶切反應(yīng)至過夜。
酶切完成后,加入甲酸調(diào)節(jié)溶液的pH小于3,混合均勻后,在室溫條件下以12 000 g的離心力進(jìn)行離心,持續(xù)5 min。此步驟旨在去除不溶性的雜質(zhì)。隨后取上清液緩慢通過C18除鹽柱,以去除溶液中的鹽分。使用清洗液(0.1%甲酸和3%乙腈)對(duì)除鹽柱進(jìn)行連續(xù)清洗,重復(fù)3次,以確保徹底去除殘余鹽分和雜質(zhì)。
最后加入適量洗脫液(由0.1%甲酸和70%乙腈組成),收集經(jīng)過除鹽柱的濾液。為了便于后續(xù)分析,將收集到的濾液進(jìn)行凍干處理,得到純凈的蛋白樣品。通過這一系列的處理步驟,成功地實(shí)現(xiàn)蛋白樣品的溶解、酶切、除鹽和純化,為后續(xù)的試驗(yàn)分析奠定了堅(jiān)實(shí)的基礎(chǔ)。
1.8 DDA譜圖庫構(gòu)建
1.8.1 餾分分離
配制2%乙腈、98%水,氨水調(diào)至pH=10的流動(dòng)相A液和98%乙腈、2%水,氨水調(diào)至pH=10的B液。用A液溶解混合凍干粉末,室溫下12 000 g離10 min。使用L-3000 HPLC系統(tǒng),色譜柱為Waters BEH C18,柱溫設(shè)為45℃。每分鐘收集1管,合并為4個(gè)或6個(gè)餾分,凍干后各加入0.1%甲酸溶解。
1.8.2 DDA模式液質(zhì)檢測(cè)
配制流動(dòng)相A液(100%水、0.1%甲酸)和B液(80%乙腈、0.1%甲酸)。每個(gè)餾分分別取上清4 μg,加入iRT試劑0.8 μL,之后各取一半體積樣品上機(jī)檢測(cè)。使用EASY-nLCTM1200納升級(jí)UHPLC系統(tǒng),預(yù)柱為自制預(yù)柱(4.5 cm×75 μm, 3 μm),分析柱為自制分析柱(15 cm×150 μm, 1.9 μm)。使用Q ExactiveTM HF-X 質(zhì)譜儀,Nanospray FlexTM(ESI)離子源,設(shè)定離子噴霧電壓為2.1 kV,離子傳輸管溫度為320℃,質(zhì)譜采用數(shù)據(jù)依賴型采集(DDA)模式,質(zhì)譜全掃描范圍為350~1 500 m·z-1,一級(jí)質(zhì)譜分辨率設(shè)為120 000(200 m·z-1),C-trap最大容量為3×106,C-trap最大注入時(shí)間為80 ms;選取全掃描中離子強(qiáng)度TOP 40的母離子使用高能碰撞裂解(HCD)方法碎裂,進(jìn)行二級(jí)質(zhì)譜檢測(cè),二級(jí)質(zhì)譜分辨率設(shè)為15 000(200 m·z-1),C-trap最大容量為5×104,C-trap最大注入時(shí)間為45 ms,肽段碎裂碰撞能量設(shè)為27%,閾強(qiáng)度設(shè)為1.1×104,動(dòng)態(tài)排阻范圍設(shè)為20 s,生成質(zhì)譜檢測(cè)原始數(shù)據(jù),用于構(gòu)建DDA譜圖庫。
1.9 DIA模式液質(zhì)檢測(cè)
為了進(jìn)行精確的蛋白質(zhì)組學(xué)分析,A液配制:水(100%)+甲酸的流動(dòng)相(0.1%),B液配制:乙腈(80%)+甲酸(0.1%)。隨后從每個(gè)樣本中取上清液4 μg,并加入0.8 μL的iRT試劑。為確保數(shù)據(jù)的全面性和可靠性,分別將處理后的樣品一分為二,并各自上機(jī)進(jìn)行檢測(cè)。
在試驗(yàn)過程中,采用EASY-nLCTM1200納升級(jí)UHPLC系統(tǒng),以確保樣品的高效分離。嚴(yán)格遵循液相色譜洗脫條件進(jìn)行操作。
配備Nanospray FlexTM(ESI)離子源的Q ExactiveTM HF-X質(zhì)譜儀進(jìn)行質(zhì)譜分析。非數(shù)據(jù)依賴型采集模式(DIA)采集質(zhì)譜數(shù)據(jù)(范圍:350~1500 m·z-1)。一級(jí)質(zhì)譜分辨率:60 000(在200 m·z-1處);C-trap最大容量:5×105,最大注入時(shí)間:20 ms。
為深入挖掘樣品的信息,對(duì)肽段進(jìn)行碎裂,研究中采用了高能碰撞裂解(HCD)方法,并進(jìn)行了二級(jí)質(zhì)譜檢測(cè)。在二級(jí)質(zhì)譜中,C-trap的最大容量被設(shè)定為1×106,同時(shí)分辨率設(shè)定為30 000(在200 m·z-1處),以確保數(shù)據(jù)的完整性和準(zhǔn)確性。此外還將肽段碎裂碰撞能量設(shè)為27%,以優(yōu)化碎裂效果。
1.10 數(shù)據(jù)分析
1.10.1 蛋白質(zhì)的鑒定和定量
根據(jù)NCBI蛋白數(shù)據(jù)庫使用搜庫軟件Spectronaut-Pulsar(Biognosys)搜索DDA掃描模式下機(jī)數(shù)據(jù)。
在提升分析結(jié)果質(zhì)量的過程中,Spectronaut-Pulsar軟件發(fā)揮著至關(guān)重要的作用。該軟件對(duì)檢索結(jié)果進(jìn)行了嚴(yán)格的過濾,具體流程如下:首先,篩選出可信度超過99%的譜肽(peptide spectrum matches,PSMs),這些高可信度的PSMs對(duì)于后續(xù)的蛋白鑒定至關(guān)重要。其次,進(jìn)一步篩選出至少含有一個(gè)特有肽段(unique peptide)的蛋白質(zhì),以確保這些蛋白質(zhì)的獨(dú)特性和可靠性。最后,為確保數(shù)據(jù)的準(zhǔn)確性和可信度,只保留了經(jīng)過上述篩選流程確認(rèn)的可信譜肽和蛋白,并對(duì)這些結(jié)果進(jìn)行FDR(1 discovery rate)驗(yàn)證。經(jīng)過FDR驗(yàn)證后,排除FDR大于1%的肽段和蛋白,從而進(jìn)一步提升了數(shù)據(jù)的可靠性。通過這一系列嚴(yán)謹(jǐn)?shù)倪^濾和驗(yàn)證步驟,Spectronaut-Pulsar軟件有效地提高了分析結(jié)果的質(zhì)量,為后續(xù)的生物信息學(xué)分析和蛋白質(zhì)組學(xué)研究提供了堅(jiān)實(shí)的基礎(chǔ)。將DIA數(shù)據(jù)導(dǎo)入Spectronaut軟件,根據(jù)pulsar構(gòu)建DDA數(shù)據(jù)庫,實(shí)現(xiàn)對(duì)肽段的同時(shí)定性和定量,常常需要提取離子對(duì)色譜峰,并進(jìn)行子離子匹配以及峰面積計(jì)算。通過iRT(樣品中)保留時(shí)間校正分析準(zhǔn)確性。前體離子Qvalue cutoff值:0.01。對(duì)蛋白質(zhì)定量結(jié)果進(jìn)行T檢驗(yàn),Plt;0.05,log2FCgt;*(FCgt;* or FClt;*[fold change,F(xiàn)C]表示試驗(yàn)組與對(duì)照組間蛋白質(zhì)差異顯著,為差異表達(dá)蛋白。
1.10.2 蛋白質(zhì)和差異表達(dá)蛋白的功能分析
首先,對(duì)所鑒定的蛋白質(zhì)序列進(jìn)行GO功能注釋(InterProScan軟件),為了揭示相關(guān)蛋白質(zhì)的生物學(xué)功能及其參與的分子過程。隨后,對(duì)比KEGG數(shù)據(jù)庫識(shí)別分類研究中鑒定的蛋白質(zhì),包括蛋白質(zhì)功能和代謝通路識(shí)別。本研究采用了火山圖方法來可視化表達(dá)量的變化和統(tǒng)計(jì)學(xué)意義,從而鑒定出具有顯著表達(dá)差異的蛋白。此外,為了進(jìn)一步探究這些蛋白在生物學(xué)過程中的作用和相互作用,本研究還構(gòu)建了聚類熱圖,以展示蛋白質(zhì)表達(dá)模式的相似性和差異性。為了解這些差異表達(dá)蛋白在生物學(xué)過程中的富集情況,本研究還進(jìn)行了GO和KEGG富集分析。
2 結(jié) 果
2.1 差異表達(dá)蛋白定量分析
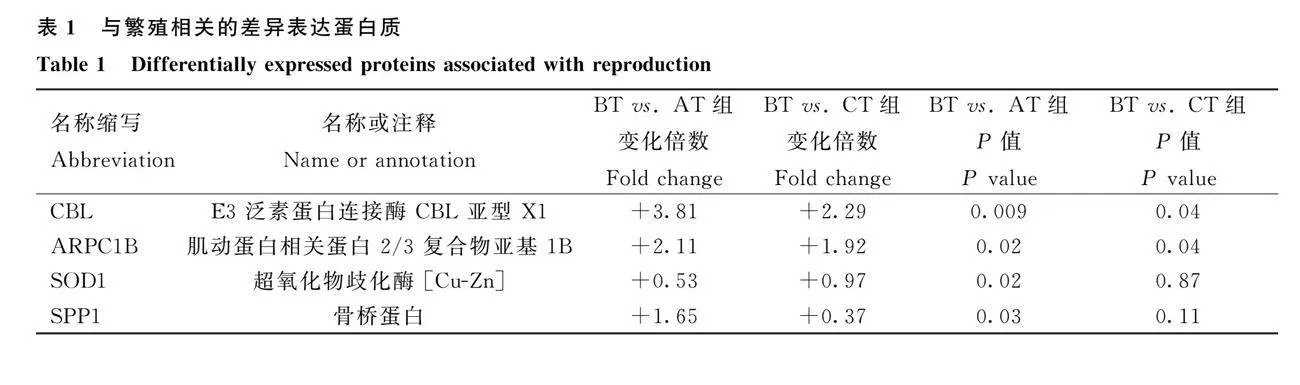
本試驗(yàn)在水牛整個(gè)發(fā)情階段共鑒定到1 982個(gè)蛋白質(zhì),其中在水牛發(fā)情期和發(fā)情前期的唾液蛋白組中,共篩選出59個(gè)差異表達(dá)蛋白,其中32個(gè)上調(diào)表達(dá)、27個(gè)下調(diào)表達(dá)(圖1A);發(fā)情期和發(fā)情后期組中,共篩選出38個(gè)差異表達(dá)蛋白,其中27個(gè)上調(diào)表達(dá),11個(gè)下調(diào)表達(dá)(圖1B)。在水牛的唾液中與繁殖相關(guān)具有代表性的蛋白有CBL、SOD1、SPP1和ARPC1B(蛋白縮寫對(duì)應(yīng)的全稱或注釋詳見表1)。
進(jìn)一步對(duì)差異表達(dá)蛋白進(jìn)行聚類分析,結(jié)果以熱圖形式呈現(xiàn),顯示了發(fā)情期與發(fā)情前期比較組(圖1C)和發(fā)情期與發(fā)情后期比較組(圖1D)水牛唾液差異表達(dá)蛋白的表達(dá)模式。結(jié)果顯示,每組內(nèi)數(shù)據(jù)的表達(dá)模式相似度高,且組間的相似度低,有效區(qū)分了各組差異表達(dá)蛋白。這些結(jié)果說明,不同發(fā)情階段水牛唾液有不同的表達(dá)趨勢(shì)。
2.2 差異表達(dá)蛋白的GO功能注釋
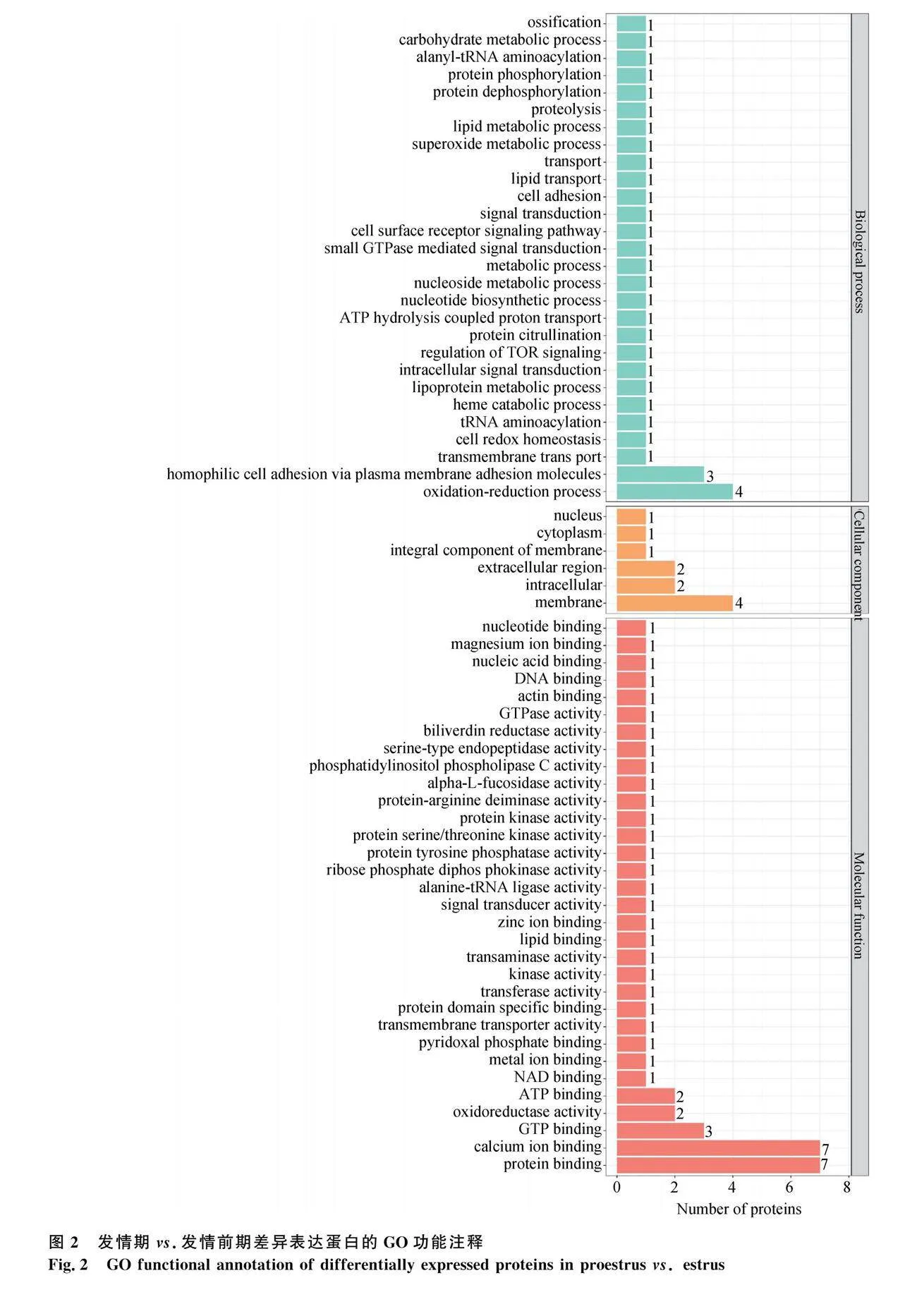
對(duì)發(fā)情期和發(fā)情前期比對(duì)發(fā)現(xiàn)的59個(gè)差異蛋白進(jìn)行GO分析,結(jié)果涉及28種生物學(xué)過程(biological process, BP)、6種細(xì)胞組分(cellular component, CC)和32種分子功能(molecular function, MF)(圖2)。參與生物學(xué)過程的蛋白分別涉及氧化還原反應(yīng)(12%)、通過質(zhì)膜粘附分子實(shí)現(xiàn)同親細(xì)胞粘附(9%)、超氧化物代謝過程(3%)和脂質(zhì)代謝過程(3%)等;參與細(xì)胞組分的蛋白質(zhì)分別位于膜(36%)、胞內(nèi)(18%)、胞外區(qū)(18%)等;參與分子功能的蛋白質(zhì)分別涉及蛋白質(zhì)結(jié)合(14.58%)、鈣離子結(jié)合(14.58%)、GTP 結(jié)合(6.25%)、氧化還原酶活性(4.17%)等。
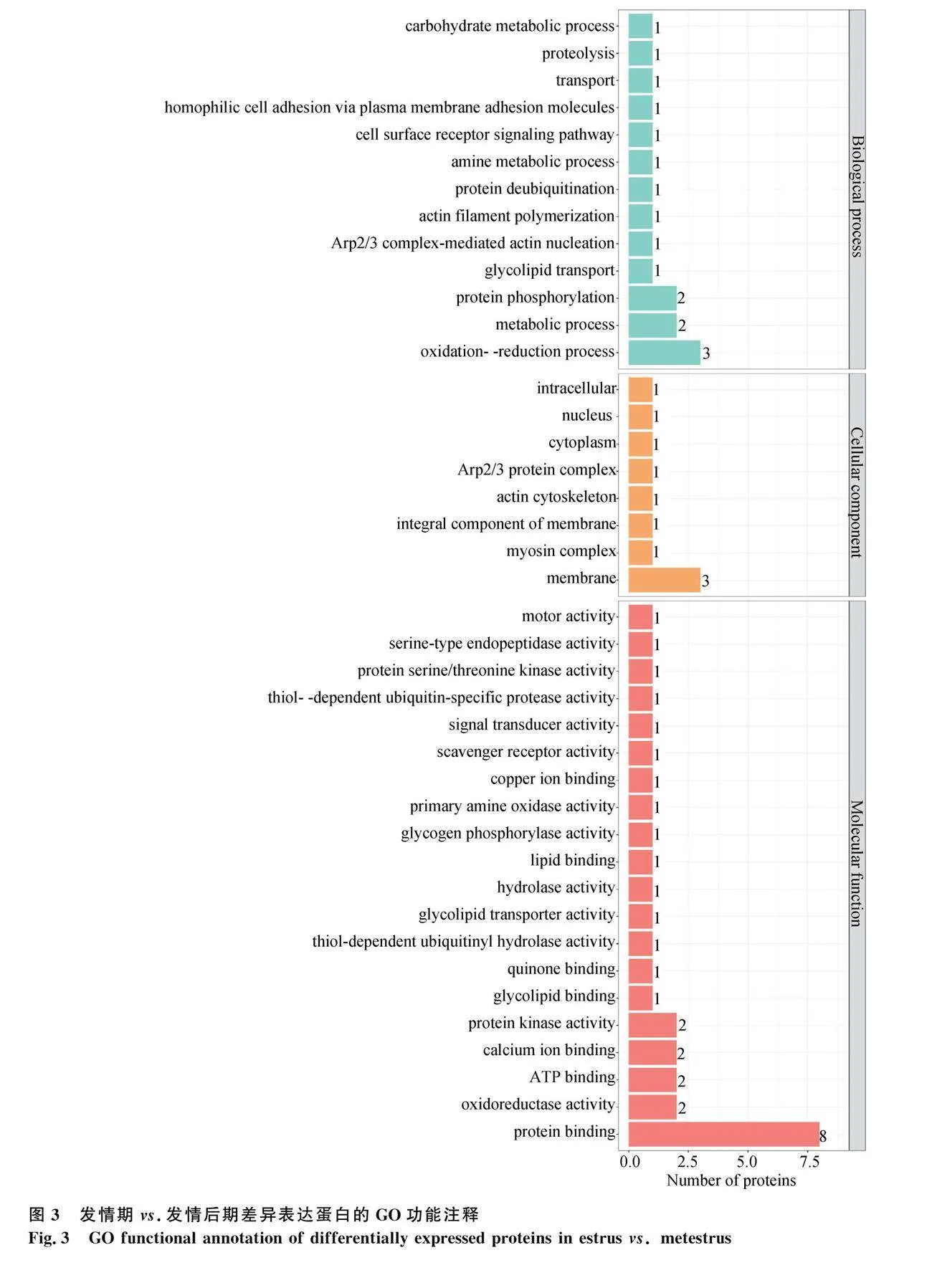
對(duì)發(fā)情期和發(fā)情后期比對(duì)發(fā)現(xiàn)的38個(gè)差異蛋白進(jìn)行GO分析,結(jié)果涉及13種生物學(xué)過程、8種細(xì)胞組分和20種分子功能(圖3)。參與生物學(xué)過程的蛋白分別涉及氧化還原反應(yīng)(17.65%)、代謝過程(11.76%)、蛋白質(zhì)磷酸化(11.76%)和糖脂轉(zhuǎn)運(yùn)(5.89%)等;參與細(xì)胞組分的蛋白質(zhì)分別位于膜(30%)、肌球蛋白復(fù)合體(10%)、肌動(dòng)蛋白細(xì)胞骨架(10%)等;參與分子功能的蛋白質(zhì)分別涉及蛋白質(zhì)結(jié)合(25.8%)、氧化還原酶活性(6.45%)、蛋白激酶活性(6.45%)、鈣離子結(jié)合(6.45%)等。
2.3 差異表達(dá)蛋白的KEGG通路注釋與富集分析
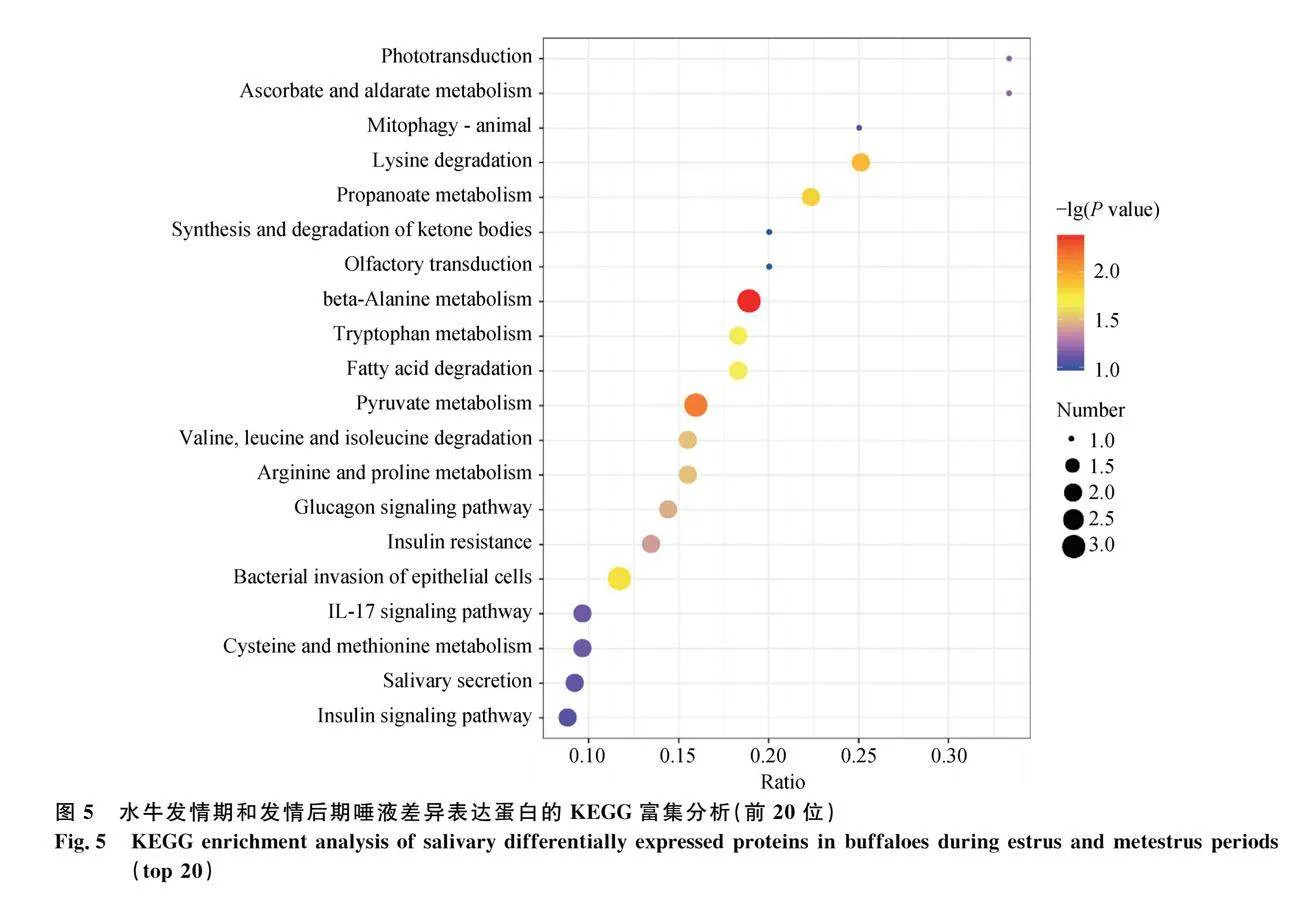
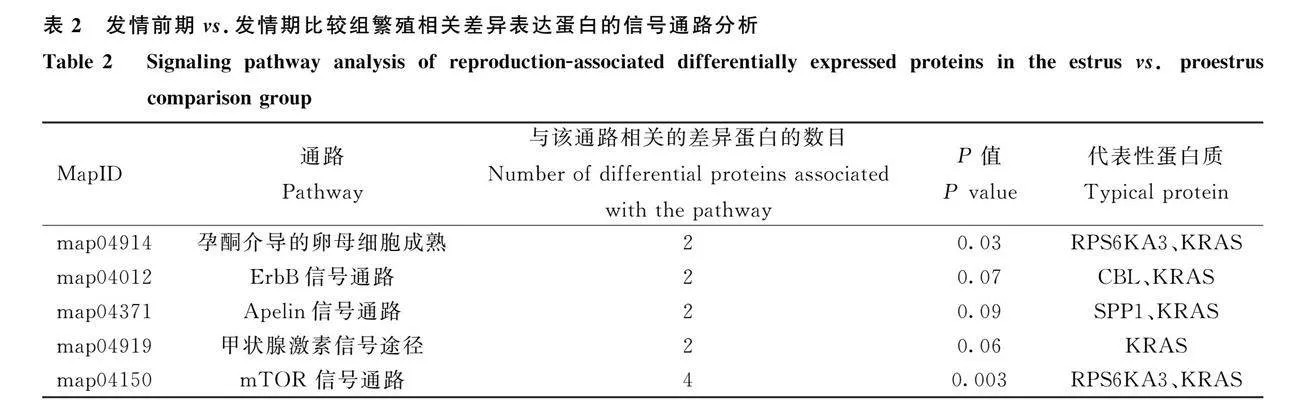
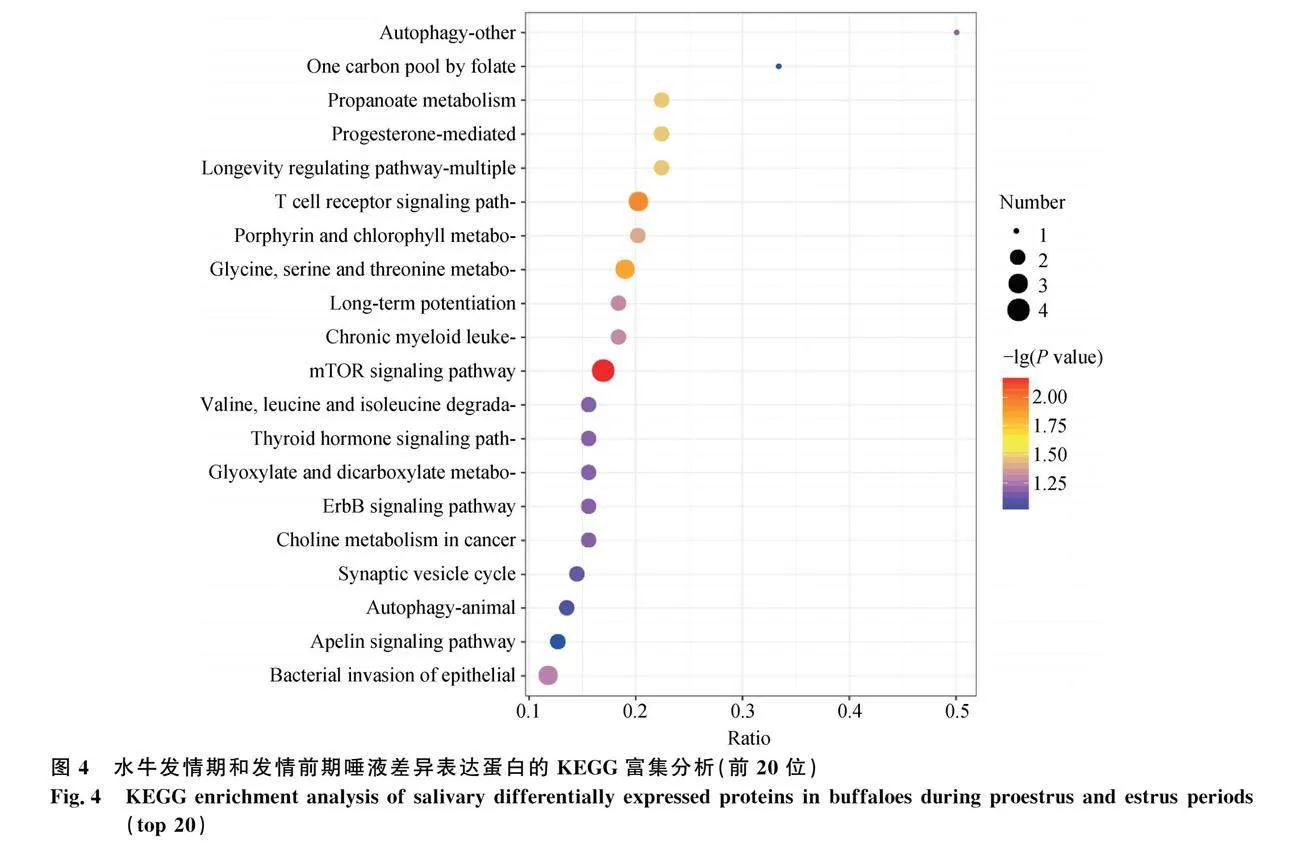
對(duì)水牛發(fā)情期和發(fā)情前期唾液的差異表達(dá)蛋白進(jìn)行KEGG通路分析,共涉及135條信號(hào)通路,其中顯著富集排名前20位的有mTOR信號(hào)通路、孕酮介導(dǎo)的卵母細(xì)胞成熟、甘氨酸、絲氨酸和蘇氨酸代謝等通路(圖4),與繁殖相關(guān)的信號(hào)通路有5條(表2)。對(duì)水牛發(fā)情期和發(fā)情后期唾液的差異表達(dá)蛋白進(jìn)行KEGG通路分析,共涉及69條信號(hào)通路,其中顯著富集排名前20位的有丙酮酸代謝、精氨酸和脯氨酸代謝、賴氨酸降解等通路(圖5),與繁殖相關(guān)的信號(hào)通路有2條(表3)。
3 討 論
目前,蛋白組學(xué)已被廣泛應(yīng)用于研究母畜發(fā)情周期唾液蛋白的種類,成為研究篩選和鑒定母畜唾液發(fā)情期特異表達(dá)蛋白的新研究思路和方法手段。本研究通過DIA定量蛋白組學(xué)在水牛發(fā)情期和發(fā)情前期的唾液蛋白組中共篩選出59個(gè)差異表達(dá)蛋白,發(fā)情期和發(fā)情后期組中共篩選出38個(gè)差異表達(dá)蛋白,其中水牛的唾液中與繁殖相關(guān)的差異蛋白共有4個(gè):CBL、ARPC1B、SOD1和SPP1。Muthukumar等[10]采用凝膠電泳結(jié)合LC-MS /MS建立了水牛整個(gè)發(fā)情周期的全唾液蛋白表達(dá)譜。質(zhì)譜結(jié)果顯示,在水牛整個(gè)發(fā)情周期內(nèi)共發(fā)現(xiàn)37種發(fā)情期特異表達(dá)蛋白,經(jīng)過免疫熒光驗(yàn)證后,篩選發(fā)現(xiàn)β-烯醇酶和TLR-4在發(fā)情期特異表達(dá)。而Shashikumar等[16]研究發(fā)現(xiàn),在水牛整個(gè)發(fā)情周期中共發(fā)現(xiàn)62種發(fā)情期特異表達(dá)蛋白。雖然兩個(gè)團(tuán)隊(duì)在發(fā)情期差異表達(dá)蛋白種類中發(fā)現(xiàn)一些共同之處,但大多數(shù)蛋白種類仍存在很多差異,辛海云等[13]認(rèn)為這可能是因?yàn)閮烧咴诎l(fā)情階段劃分和質(zhì)譜分析方法上存在差異所致。
本研究中,水牛唾液中的ARPC1B在發(fā)情期含量呈現(xiàn)出高表達(dá),而發(fā)情前期及發(fā)情后期則出現(xiàn)低表達(dá)。Kumar等[17]發(fā)現(xiàn),對(duì)成年雄性大鼠使用雌激素會(huì)導(dǎo)致精子發(fā)生失敗,原因是輸精管復(fù)合物被破壞,伴隨著睪丸內(nèi)睪酮水平的降低和睪丸內(nèi)雌激素水平的升高,參與細(xì)胞骨架重塑的ARPC1B等基因也發(fā)生了變化,研究發(fā)現(xiàn)ARPC1B的轉(zhuǎn)錄物對(duì)雌激素有反應(yīng),雌激素對(duì)ARPC1B的調(diào)控是通過雌激素受體β進(jìn)行的,Kumar等[17]推斷ARPC1B可能參與了精子的形成。相關(guān)研究發(fā)現(xiàn),在雌激素誘導(dǎo)的大鼠精子畸形模型中,ARPC1B表達(dá)下調(diào),在曲細(xì)精管培養(yǎng)中還發(fā)現(xiàn)ARPC1B可以通過雌激素受體β對(duì)雌激素產(chǎn)生反應(yīng),用siRNA敲除成年大鼠睪丸中的ARPC1B會(huì)導(dǎo)致精子發(fā)生障礙。此外,ARPC1B的基因敲除還干擾了生殖細(xì)胞進(jìn)入G2/M期的能力[18]。Zhu等[19]發(fā)現(xiàn)干擾ARPC1B基因的表達(dá)會(huì)導(dǎo)致胚胎頂端結(jié)構(gòu)域形成缺陷。綜上,可能是因?yàn)樗_M(jìn)入發(fā)情期后機(jī)體內(nèi)激素水平的變化會(huì)引起細(xì)胞骨架的重建和細(xì)胞運(yùn)動(dòng)的增加,從而導(dǎo)致ARPC1B的表達(dá)水平升高,因此可以考慮將ARPC1B作為水牛唾液發(fā)情標(biāo)志物。
本研究中,水牛唾液中的CBL在發(fā)情期含量呈現(xiàn)出高表達(dá),而發(fā)情前期及發(fā)情后期則出現(xiàn)低表達(dá)。CBL蛋白是一個(gè)高度保守的E3家族,在許多途徑中調(diào)節(jié)酪氨酸激酶的信號(hào)轉(zhuǎn)導(dǎo)[20-21]。CBL蛋白作為信號(hào)轉(zhuǎn)導(dǎo)通路的調(diào)控因子,其功能主要基于其E3活性[20-22]。E3活性的調(diào)控對(duì)細(xì)胞的功能和發(fā)育至關(guān)重要[23]。研究發(fā)現(xiàn),E3泛素連接酶CBL在調(diào)節(jié)細(xì)胞增殖和遷移中起重要作用[24]。綜上,可能是因?yàn)樗_M(jìn)入發(fā)情期后,機(jī)體內(nèi)激素水平的變化會(huì)引起多種信號(hào)通路的激活,從而導(dǎo)致CBL的表達(dá)水平升高,因此可以考慮將CBL作為水牛唾液發(fā)情標(biāo)志物。
本研究中,水牛唾液中SPP1在發(fā)情前期呈現(xiàn)低表達(dá),在發(fā)情期和發(fā)情后期皆呈現(xiàn)高表達(dá)。研究發(fā)現(xiàn),SPP1在竇狀卵泡發(fā)育過程中會(huì)增加,并在顆粒細(xì)胞中表達(dá),Skinner等[25]研究結(jié)果表明,調(diào)節(jié)因子的局部產(chǎn)生和作用對(duì)竇狀卵泡發(fā)育和卵巢功能所必需的細(xì)胞-細(xì)胞相互作用起著關(guān)鍵作用。Denhardt和Guo[26]認(rèn)為SPP1可能介導(dǎo)卵巢竇狀卵泡中細(xì)胞基質(zhì)的相互作用。Kuwabara等[27]用孕馬血清促性腺激素和人絨毛膜促性腺激素處理未成熟雌性小鼠,模擬卵泡成熟和排卵,發(fā)現(xiàn)人絨毛膜促性腺激素處理3 h后,SPP1轉(zhuǎn)錄水平顯著上調(diào),16 h達(dá)高峰,并定位于顆粒細(xì)胞。Poole等[28]研究發(fā)現(xiàn),在黃體的發(fā)育過程中,SPP1最初被激活,以建立和維持類固醇生成細(xì)胞和非類固醇生成細(xì)胞之間的細(xì)胞相互作用。Craig和Denhardt[29]研究發(fā)現(xiàn),P4會(huì)上調(diào)小鼠子宮內(nèi)膜中的SPP1的表達(dá)。綜上,可能是因?yàn)樗_M(jìn)入發(fā)情期后,機(jī)體內(nèi)性激素水平的變化會(huì)影響SPP1的表達(dá)水平的升高,因此可以考慮將SPP1作為水牛唾液發(fā)情標(biāo)志物。
本研究中,水牛唾液中SOD1在發(fā)情前期呈現(xiàn)高表達(dá),在發(fā)情期和發(fā)情后期皆呈現(xiàn)低表達(dá)。SOD1酶通過將超氧陰離子自由基轉(zhuǎn)化為O2和H2O2來抵消氧化應(yīng)激[30]。研究發(fā)現(xiàn),補(bǔ)充褪黑激素不僅通過減少活性氧生成和早期細(xì)胞凋亡來恢復(fù)線粒體功能,而且通過增強(qiáng)SOD1等的mRNA表達(dá)水平來增加ATP和總GSH水平,從而減輕相關(guān)的氧化應(yīng)激對(duì)卵母細(xì)胞減數(shù)分裂成熟和早期胚胎發(fā)育的損害[31-32]。Zhao等[33]研究發(fā)現(xiàn),10-7 mol·L-1褪黑素組的ROS水平最低,但SOD1表達(dá)水平顯著高于其他組。Abbasi等[34]研究發(fā)現(xiàn),白藜蘆醇可以通過降低ROS水平來增加抗氧化基因的表達(dá),其強(qiáng)大的抗凋亡作用可以對(duì)抗衰老卵母細(xì)胞線粒體膜電位的下降。相關(guān)研究發(fā)現(xiàn),在體外成熟過程中補(bǔ)充鋅通過增加GSH和SOD的活性和降低ROS來促進(jìn)牦牛卵母細(xì)胞的成熟[35]。Khan等[36]研究發(fā)現(xiàn),在熱應(yīng)激條件下,SOD1的低表達(dá)會(huì)促進(jìn)細(xì)胞凋亡和ROS的產(chǎn)生而進(jìn)一步弱化顆粒細(xì)胞的功能,并抑制細(xì)胞的增殖。綜上,可能是因?yàn)樗_M(jìn)入發(fā)情期后,機(jī)體隨著激素水平的變化進(jìn)入應(yīng)激狀態(tài),這可能導(dǎo)致氧化應(yīng)激增加,抗氧化能力降低,使水牛唾液中SOD1的表達(dá)降低,因此可以考慮將SOD1作為水牛唾液發(fā)情標(biāo)志物。
本研究對(duì)差異表達(dá)蛋白進(jìn)行KEGG通路分析,發(fā)現(xiàn)發(fā)情期與發(fā)情前期對(duì)照組差異表達(dá)蛋白共涉及135條信號(hào)通路,發(fā)情期與發(fā)情后期對(duì)照組差異表達(dá)蛋白共涉及69條信號(hào)通路,其中顯著富集排名前20的信號(hào)通路中與繁殖相關(guān)的信號(hào)通路共有7條。Fan等[37]的研究結(jié)果表明,黃芩苷通過mTOR途徑提高了顆粒細(xì)胞的活力,從而改善了卵巢功能。Chen等[38]的研究結(jié)果表明,CREBZF通過調(diào)節(jié)ERK1/2和mTOR信號(hào)通路,在顆粒細(xì)胞的細(xì)胞凋亡中發(fā)揮促凋亡作用。Sun等[39]對(duì)人類卵巢的研究發(fā)現(xiàn),mTOR刺激劑能促進(jìn)原始卵泡的活化。Kanehisa等[40]研究發(fā)現(xiàn),ErbB信號(hào)通路可能是LH機(jī)制的主要協(xié)調(diào)者。Zielak-Steciwko等[41]研究發(fā)現(xiàn),一些miRNA可能通過對(duì)ErbB、胰島素等信號(hào)通路的全局調(diào)控,成為牛卵巢卵泡發(fā)育的調(diào)控因子。Huo等[42]研究發(fā)現(xiàn),HSPCA可調(diào)控牦牛產(chǎn)后發(fā)情,控制發(fā)情狀態(tài),其在孕酮介導(dǎo)的卵母細(xì)胞成熟過程中上調(diào)。研究發(fā)現(xiàn),胰島素信號(hào)通路包含不同的調(diào)節(jié)節(jié)點(diǎn),可確保適當(dāng)?shù)男盘?hào)持續(xù)時(shí)間和強(qiáng)度,胰島素在卵巢中具有促性腺激素效應(yīng),這種效應(yīng)是由各自信號(hào)通路在關(guān)鍵節(jié)點(diǎn)上的相互作用介導(dǎo)的[43]。Sekulovski等[44]研究發(fā)現(xiàn),子宮中表達(dá)孕酮受體的細(xì)胞中胰島素信號(hào)的缺失會(huì)影響接受能力。Li等[45]研究發(fā)現(xiàn),豬下丘腦循環(huán)RNAs的功能主要集中在孕酮介導(dǎo)的卵母細(xì)胞成熟、胰島素、ErbB和mTOR等信號(hào)通路上,這些信號(hào)通路被認(rèn)為與青春期的時(shí)間有關(guān)。
4 結(jié) 論
本研究基于DIA定量蛋白組學(xué)來分析不同發(fā)情階段水牛唾液蛋白的變化,共定量到1 982個(gè)蛋白質(zhì)。通過對(duì)發(fā)情前期、發(fā)情期和發(fā)情后期的對(duì)比,獲得與繁殖相關(guān)的差異蛋白4個(gè):CBL、ARPC1B、SOD1和SPP1。本研究確定了唾液中可能作為水牛發(fā)情生物標(biāo)志物的關(guān)鍵蛋白,并為開發(fā)水牛發(fā)情檢測(cè)診斷試劑盒提供了數(shù)據(jù)支撐。
參考文獻(xiàn)(References):
[1] 劉演景,朱 婧,劉 暢.論廣西水牛奶產(chǎn)業(yè)發(fā)展路徑[J].中國奶牛,2021(7):61-64.
LIU Y J,ZHU J,LIU C.Development path of Guangxi buffalo milk industry[J].China Dairy Cattle,2021(7):61-64.(in Chinese)
[2] SINGHA S,PANDEY M,JAISWAL L,et al.Salivary cell-free HSD17B1 and HSPA1A transcripts as potential biomarkers for estrus identification in buffaloes (Bubalus bubalis)[J].Anim Biotechnol,2023,34(7):2554-2564.
[3] SINGH P,GOLLA N,SINGH P,et al.Salivary miR-16,miR-191 and miR-223:intuitive indicators of dominant ovarian follicles in buffaloes[J].Mol Genet Genomics,2017,292(5):935-953.
[4] ACHIRAMAN S,ARCHUNAN G,SANKARGANESH D,et al.Biochemical analysis of female mice urine with reference to endocrine function:a key tool for estrus detection[J].Zoolog Sci,2011,28(8):600-605.
[5] 賈銀海.基于唾液蛋白組學(xué)開發(fā)鑒定水牛發(fā)情方法的研究[D].南寧:廣西大學(xué),2018.
JIA Y H.Research on the estrus identification method of the development based on the salivary proteomics in the buffalo[D]. Nanning:Guangxi University,2018.(in Chinese)
[6] 張春梅,席 麗,李志強(qiáng),等.奶牛的發(fā)情鑒定方法比較[J].當(dāng)代畜禽養(yǎng)殖業(yè),2019(1):4-7.
ZHANG C M,XI L,LI Z Q,et al.Comparison of estrus identification methods of dairy cows[J].Modern Animal Husbandry,2019(1): 4-7.(in Chinese)
[7] 秦博文.淺談奶牛的發(fā)情鑒定與人工授精操作[J].農(nóng)業(yè)開發(fā)與裝備,2019(5):238-239.
QIN B W.Discussion on estrus Identification and artificial insemination of dairy cows[J].Agricultural Development amp; Equipments,2019(5):238-239.(in Chinese)
[8] 蔣曉新,劉 煒,魏星遠(yuǎn),等.運(yùn)用計(jì)步器鑒定泌乳盛期荷斯坦奶牛的發(fā)情效果研究[J].安徽農(nóng)業(yè)科學(xué),2013,41(15):6728-6729,6732.
JIANG X X,LIU W,WEI X Y,et al.Study on the effects of identifying the estrus of Holstein cows during peak lactation by using pedometer[J].Journal of Anhui Agricultural Sciences,2013,41(15):6728-6729,6732.(in Chinese)
[9] 魏倩倩.基于DIA蛋白質(zhì)組學(xué)探究牦牛妊娠早中期胎盤組織中CTNNB1/CDH1的表達(dá)定位及功能[D].蘭州:甘肅農(nóng)業(yè)大學(xué), 2023.
WEI Q Q.Study on the expression and function of CTNNB1/CDH1 in placenta of yak during early and middle pregnancy based on DIA proteomics[D].Lanzhou:Gansu Agricultural University,2023.(in Chinese)
[10] MUTHUKUMAR S,RAJKUMAR R,RAJESH D,et al.Exploration of salivary proteins in buffalo:an approach to find marker proteins for estrus[J].FASEB J,2014,28(11):4700-4709.
[11] LAMKIN M S,OPPENHEIM F G.Structural features of salivary function[J].Crit Rev Oral Biol Med,1993,4(3-4):251-259.
[12] LEVINE M J.Salivary macromolecules.A structure/function synopsis[J].Ann N Y Acad Sci,1993,694:11-16.
[13] 辛海云,孟繁明,胡 斌,等.唾液在家畜發(fā)情鑒定中的應(yīng)用進(jìn)展[J].畜牧與獸醫(yī),2020,52(7):136-139.
XIN H Y,MENG F M,HU B,et al.Application of saliva in animal estrus detection[J].Animal Husbandry amp; Veterinary Medicine,2020,52(7):136-139.(in Chinese)
[14] 賈銀海,李芳芳,蔣世強(qiáng),等.水牛發(fā)情周期生殖激素變化規(guī)律及唾液結(jié)晶的分析[J].中國畜牧獸醫(yī),2019,46(4):1101-1107.
JIA Y H,LI F F,JIANG S Q,et al.The variations and correlation analysis of saliva reproduction hormones and crystallization patterns during estrus cycle in buffaloes[J].China Animal Husbandry amp; Veterinary Medicine,2019,46(4):1101-1107.(in Chinese)
[15] 董智豪,時(shí)玉新,郭冠華,等.母牛不同發(fā)情階段唾液化合物的比較分析[J].畜牧獸醫(yī)學(xué)報(bào),2023,54(11):4636-4652.
DONG Z H,SHI Y X,GUO G H,et al.Comparative analysis of salivary compounds in different estrous stages of cows[J].Acta Veterinaria et Zootechnica Sinica,2023,54(11):4636-4652.(in Chinese)
[16] SHASHIKUMAR N G,BAITHALU R K,BATHLA S,et al.Global proteomic analysis of water buffalo (Bubalus bubalis) saliva at different stages of estrous cycle using high throughput mass spectrometry[J].Theriogenology,2018,110:52-60.
[17] KUMAR A,DUMASIA K,GAONKAR R,et al.Estrogen and androgen regulate actin-remodeling and endocytosis-related genes during rat spermiation[J].Mol Cell Endocrinol,2015,404:91-101.
[18] KUMAR A,DUMASIA K,DESHPANDE S,et al.Actin related protein complex subunit 1b controls sperm release,barrier integrity and cell division during adult rat spermatogenesis[J].Biochim Biophys Acta,2016,1863(8):1996-2005.
[19] ZHU M,CORNWALL-SCOONES J,WANG P Z,et al.Developmental clock and mechanism of de novo polarization of the mouse embryo[J].Science,2020,370(6522):eabd2703.
[20] DIKIC I,SZYMKIEWICZ I,SOUBEYRAN P.Cbl signaling networks in the regulation of cell function[J].Cell Mol Life Sci,2003, 60(9): 1805-1827.
[21] DUAN L,REDDI A L,GHOSH A,et al.The Cbl family and other ubiquitin ligases:destructive forces in control of antigen receptor signaling[J].Immunity,2004,21(1):7-17.
[22] THIEN C B,LANGDON W Y.Cbl:many adaptations to regulate protein tyrosine kinases[J].Nat Rev Mol Cell Biol,2001,2(4): 294-307.
[23] RYAN P E,DAVIES G C,NAU M M,et al.Regulating the regulator:negative regulation of Cbl ubiquitin ligases[J].Trends Biochem Sci,2006,31(2):79-88.
[24] YANG X B,HAO D J,HE B R.The regulation of E3 ubiquitin ligases Cbl and its cross-talking in bone homeostasis[J].Curr Stem Cell Res Ther,2021,16(6):683-687.
[25] SKINNER M K,SCHMIDT M,SAVENKOVA M I,et al.Regulation of granulosa and theca cell transcriptomes during ovarian antral follicle development[J].Mol Reprod Dev,2008,75(9):1457-1472.
[26] DENHARDT D T,GUO X J.Osteopontin:a protein with diverse functions[J].FASEB J,1993,7(15):1475-1482.
[27] KUWABARA Y,KATAYAMA A,TOMIYAMA R,et al.Gonadotropin regulation and role of ovarian osteopontin in the periovulatory period[J].J Endocrinol,2015,224(1):49-59.
[28] POOLE D H,NDIAYE K,PATE J L.Expression and regulation of secreted phosphoprotein 1 in the bovine corpus luteum and effects on T lymphocyte chemotaxis[J].Reproduction,2013,146(6):527-537.
[29] CRAIG A M,DENHARDT D T.The murine gene encoding secreted phosphoprotein 1 (osteopontin):promoter structure,activity,and induction in vivo by estrogen and progesterone[J].Gene,1991,100:163-171.
[30] ESKANDARI-NASAB E,KHARAZI-NEJAD E,NAKHAEE A,et al.50-bp Ins/Del polymorphism of SOD1 is associated with increased risk of cardiovascular disease[J].Acta Med Iran,2014,52(8):591-595.
[31] QU J W,HU H R,NIU H Y,et al.Melatonin restores the declining maturation quality and early embryonic development of oocytes in aged mice[J].Theriogenology,2023,210:110-118.
[32] TRIPATHI S K,NANDI S,GUPTA P S P,et al.Antioxidants supplementation improves the quality of in vitro produced ovine embryos with amendments in key development gene expressions[J].Theriogenology,2023,201:41-52.
[33] ZHAO X M,WANG N,HAO H S,et al.Melatonin improves the fertilization capacity and developmental ability of bovine oocytes by regulating cytoplasmic maturation events[J].J Pineal Res,2018,64(1):e12445,doi:10.1111/jpi.12445.
[34] ABBASI B,DONG Y,RUI R.Resveratrol hinders postovulatory aging by modulating oxidative stress in porcine oocytes[J].Molecules,2021,26(21):6346.
[35] XIONG X R,LAN D L,LI J,et al.Effects of zinc supplementation during in vitro maturation on meiotic maturation of oocytes and developmental capacity in yak[J].Biol Trace Elem Res,2018,185(1):89-97.
[36] KHAN A,KHAN M Z,DOU J H,et al.SOD1 gene silencing promotes apoptosis and suppresses proliferation of heat-stressed bovine granulosa cells via induction of oxidative stress[J].Vet Sci,2021,8(12):326.
[37] FAN H Y,HE J H,BAI Y C,et al.Baicalin improves the functions of granulosa cells and the ovary in aged mice through the mTOR signaling pathway[J].J Ovarian Res,2022,15(1):34.
[38] CHEN F L,WEN X,LIN P F,et al.Activation of CREBZF increases cell apoptosis in mouse ovarian granulosa cells by regulating the ERK1/2 and mTOR signaling pathways[J].Int J Mol Sci,2018,19(11):3517.
[39] SUN X H,SU Y P,HE Y L,et al.New strategy for in vitro activation of primordial follicles with mTOR and PI3K stimulators[J].Cell Cycle,2015,14(5):721-731.
[40] KANEHISA M,GOTO S,SATO Y,et al.KEGG for integration and interpretation of large-scale molecular data sets[J].Nucleic Acids Res,2012,40(D1):D109-D114.
[41] ZIELAK-STECIWKO A E,BROWNE J A,MCGETTIGAN P A,et al.Expression of microRNAs and their target genes and pathways associated with ovarian follicle development in cattle[J].Physiol Genomics,2014,46(19):735-745.
[42] HUO S D,CHEN Z,LI S Y,et al.A comparative transcriptome and proteomics study of post-partum ovarian cycle arrest in yaks (Bos grunniens)[J].Reprod Domest Anim,2022,57(3):292-303.
[43] TANIGUCHI C M,EMANUELLI B,KAHN C R.Critical nodes in signalling pathways:insights into insulin action[J].Nat Rev Mol Cell Biol,2006,7(2):85-96.
[44] SEKULOVSKI N,WHORTON A E,SHI M X,et al.Periovulatory insulin signaling is essential for ovulation,granulosa cell differentiation,and female fertility[J].FASEB J,2020,34(2):2376-2391.
[45] LI C L,SONG C L,QI K L,et al.Identification of estrus in sows based on salivary proteomics[J].Animals,2022,12(13):1656.
(編輯 郭云雁)

