葉酸和鈷胺素對圍產期奶牛泌乳性能、養分消化和肝脂質含量的影響
摘 要: 旨在研究包被葉酸(CFA)和包被鈷胺素(CCA)對圍產期奶牛泌乳性能、養分消化、瘤胃發酵和肝脂質含量的影響。選取48頭胎次、上一泌乳期產奶量和體重相近的圍產期荷斯坦奶牛,按2×2因子、隨機區組設計分為4組,對照組飼喂基礎日糧,其余3組分別在基礎日糧中添加CFA 6.75 g·d-1、CCA 0.6 g·d-1和CFA 6.75 g·d-1+CCA 0.6 g·d-1。試驗從奶牛產前21 d開始,產后21 d結束。奶牛產后,測定體重變化(BWC)、產奶性能,采集血液、瘤胃液和肝樣品。結果發現:1)補充CFA,奶牛BWC顯著降低(Plt;0.05),飼料效率顯著提高(Plt;0.05)。補充CFA或CCA,實際乳、乳脂校正乳(FCM)、乳脂肪和乳蛋白質產量顯著提高(Plt;0.05)。2)補充CFA,干物質(DM)和中性洗滌纖維(NDF)表觀消化率顯著提高(Plt;0.05)。補充CCA,DM、有機物(OM)、粗蛋白質(CP)、NDF和酸性洗滌纖維(ADF)表觀消化率顯著提高(Plt;0.05)。3)補充CFA或CCA,瘤胃pH無顯著變化(Pgt;0.05),總揮發性脂肪酸(TVFA)濃度顯著增加(Plt;0.05)。補充CFA,瘤胃乙酸濃度和乙酸/丙酸顯著增加(Plt;0.05)。補充CCA,瘤胃丙酸濃度顯著增加(Plt;0.05),乙酸/丙酸顯著降低(Plt;0.05)。4)補充CFA,血液非酯化脂肪酸、β-羥丁酸(BHB)和同型半胱氨酸(Hcy)濃度顯著降低,血液葡萄糖濃度無顯著變化(Pgt;0.05),葉酸(FA)濃度顯著增加(Plt;0.05)。補充CCA,血液葡萄糖和鈷胺素(CA)濃度顯著增加(Plt;0.05)。5)補充CFA,奶牛肝中FA含量顯著提高,總脂和甘油三酯(TG)含量顯著降低(Plt;0.05);補充CCA,肝中CA含量顯著提高,總脂和TG含量無顯著變化(Pgt;0.05)。6)與單獨補充CFA或CCA相比,二者聯合補充,奶牛FCM產量、NDF消化率和瘤胃TVFA濃度較高(Plt;0.05),血液Hcy和肝TG含量較低(Plt;0.05)。綜上表明,CFA和CCA聯合補充對改善圍產期奶牛泌乳性能和降低肝脂質含量比單獨補充更有效。
關鍵詞: 葉酸;鈷胺素;泌乳性能;脂質代謝;圍產期奶牛
中圖分類號:S823.911.5
文獻標志碼:A
文章編號:0366-6964(2024)11-5114-10
收稿日期:2024-01-05
基金項目:國家自然科學基金項目(32272824);中央引導地方科技發展資金項目(YDZJSX2022A039);山西省現代農業牛產業技術體系建設項目(2024CYJSTX13-07)
作者簡介:楊巧麗(1999-),女,山西運城人,碩士生,主要從事反芻動物營養研究,E-mail: 1215775808@qq.com
*通信作者:劉 強,主要從事反芻動物營養研究,E-mail: liuqiangabc@163.com
Effects of Folic Acid and Cobalamin on Lactation Performance,Nutrient Digestion and
Hepatic Lipid Content in Dairy Cows during Perinatal Period
YANG" Qiaoli1, LI" Fugang1, YAN" Guojun2, LIU" Qiang1*, GUO" Gang1, WANG" Cong1
(1.College of Animal Science, Shanxi Agricultural University, Taigu 030801," China;
2.China
Development Center of Rural Industry Integration, Department of Agriculture and
Rural Affairs of Shanxi Province, Taiyuan 030001," China)
Abstract:" The study evaluated the effects of coated folic acid (CFA) and coated cobalamin (CCA) on the lactation performance, nutrient digestion, rumen fermentation and hepatic lipid content of dairy cows during perinatal period. Forty-eight Holstein dairy cows during perinatal period with similar parity, previous 305-d milk yield and body weight were assigned in a 2×2 factorial and randomized block design to 4 groups: cows in the control group were fed a basal diet, and those in other 3 groups were fed basal diets supplemented with CFA 6.75 g·d-1, CCA 0.6 g·d-1, and CFA 6.75 g·d-1+CCA 0.6 g·d-1, respectively. The study started at 21 days before the excepted calving date and ended at 21 days after calving. During the postpartum 21 days, body weight change (BWC) and lactation performance were determined, and samples of blood, rumen fluid and liver tissue were collected. The results showed as follows: 1) CFA addition significantly decreased the BWC (Plt;0.05) and significantly increased feed efficiency (Plt;0.05). The yields of actual milk, 4% fat-corrected milk (FCM), milk fat and milk protein significantly increased (Plt;0.05) with CFA or CCA addition. 2) The apparent digestibility of dry matter (DM) and neutral detergent fiber (NDF) increased significantly (Plt;0.05) with CFA addition. The apparent digestibility of DM, organic matter (OM), crude protein (CP), NDF and acid detergent fiber (ADF) significantly increased with CCA addition (Plt;0.05). 3) Rumen pH was not significantly changed (Pgt;0.05), but total volatile fatty acids (TVFA) concentration increased (Plt;0.05) with CFA or CCA addition. Rumen acetate concentration and acetate to propionate ratio increased significantly (Plt;0.05) with CFA addition. Rumen propionate concentration increased significantly (Plt;0.05), while acetate to propionate ratio decreased significantly (Plt;0.05) with CCA addition. 4) Blood nonesterified fatty acids, β-hydroxybutyrate (BHB) and homocysteine (Hcy) contents decreased (Plt;0.05) with CFA addition. Blood glucose content was not significantly changed (Pgt;0.05), but folate (FA) content increased significantly (Plt;0.05) with CFA addition. Blood glucose and cobalamin (CA) contents increased significantly (Plt;0.05) with CCA addition. 5) Hepatic FA content increased significantly (Plt;0.05), and total lipid and triglyceride (TG) contents decreased significantly (Plt;0.05) with CFA addition. Hepatic CA content increased significantly (Plt;0.05), but total lipid and TG contents were not significantly changed (Pgt;0.05) with CCA addition. 6) When compared with CFA or CCA addition alone, the FCM yield, NDF digestibility and rumen TVFA concentration were greater (Plt;0.05), and blood Hcy and hepatic TG contents were lower for cows receiving CFA and CCA together. In conclusion, addition of CFA and CCA together is more effective in improving lactation performance and reducing hepatic lipid content compared with CFA or CCA addition alone.
Key words: folic acid; cobalamin; lactation performance; lipid metabolism; dairy cows during perinatal period
*Corresponding author: LIU Qiang,E-mail: liuqiangabc@163.com
奶牛產后采食的能量不能滿足泌乳需要,分解體儲備供能,血液非酯化脂肪酸(NEFA)和肝臟甘油三酯(TG)含量增加,對產奶、健康和繁殖造成負面影響[1]。葉酸(FA)和鈷胺素(CA)是一碳代謝的必需因子,對奶牛能量與脂質代謝有重要調控作用[2]。研究發現,奶牛產后血液NEFA和β-羥丁酸(BHB)含量與血液中FA含量呈負相關[3];補充包被FA(CFA),圍產期奶牛乳、乳脂肪和乳蛋白質產量提高,血液NEFA和BHB含量降低[4];荷斯坦公牛肝中總脂和TG含量降低[5]。另外,補充FA能促進泌乳早期奶牛肝組織再生,減少體脂分解[6]。一碳代謝中,CA依賴的蛋氨酸合成酶(MS)催化FA活性形式四氫葉酸的形成,保障FA代謝的正常運行[2]。已有報道,圍產期奶牛補充CA,泌乳早期產奶量和乳成分產量增加,體重損失減少、血液NEFA和BHB含量降低[7]。FA對圍產期奶牛脂質代謝的調控可能受CA供應的影響。研究發現,奶牛產后血液NEFA和BHB含量與血液中CA/FA呈正相關[3]。聯合補充FA和CA,圍產期奶牛肝脂質含量減少[8]。但是,也有研究發現,FA和CA聯合補充,泌乳早期奶牛體重損失增加,血液NEFA濃度有增加的趨勢[9-10](該研究沒有設計單獨補充FA的試驗組)。因此,需要探究單獨補充FA或CA以及聯合補充FA與CA對圍產期奶牛泌乳性能和脂質代謝的影響。飼糧中添加的FA或CA在瘤胃中約98%或62.9%被微生物降解[11],因此,本研究選用CFA和包被CA(CCA)添加劑,探究CFA或/和CCA對圍產期奶牛產奶性能、養分消化、瘤胃發酵、血液指標和肝脂質含量的影響,以明確CFA或/和CCA對奶牛產奶性能和肝脂質含量的調控特點,為營養調控技術在奶牛健康養殖中的應用提供依據。
1 材料與方法
1.1 試驗設計
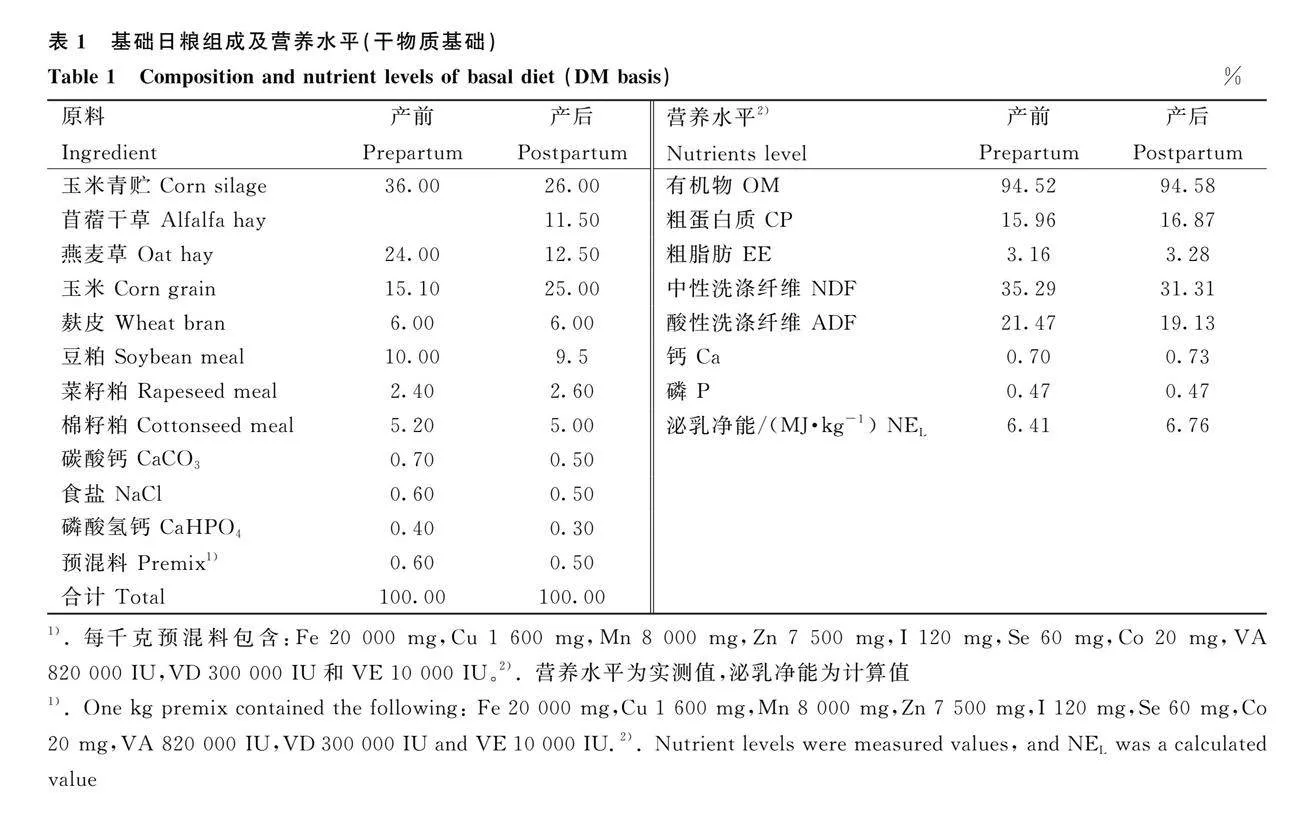
試驗于2023年4~7月在山西忻州市繁峙縣銀河牧業有限公司進行,該公司飼養成年奶牛2 896頭。選取48頭妊娠日齡(248±6.9)d、胎次(3.07±0.48)胎、上一泌乳期產奶量(9 580±96.7)kg和體重(BW)(815.7±42.9)kg的荷斯坦奶牛,依據隨機區組設計分為4組,每組12頭。試驗采用2×2因子設計,CFA-CCA-組飼喂基礎日糧,CFA+CCA-、CFA-CCA+和CFA+CCA+組分別在基礎日糧中添加CFA 6.75 g·d-1、CCA 0.6 g·d-1和CFA 6.75 g·d-1+CCA 0.6 g·d-1。基礎日糧依據NRC(2001)[12]配制(表1),CFA和CCA添加劑由山西某科技有限公司生產,CFA中含FA 2%,在瘤胃和小腸中FA的釋放率分別為28.3%和69.7%;CCA中含CA 2%,在瘤胃和小腸中CA的釋放率分別為24.8%和70.5%。CFA的添加水平依據Zhang等[4]的試驗結果確定,CCA的添加水平依據NRC(2001)[12]推薦的BW為650 kg的泌乳奶牛CA需要量為0.6 mg·d-1,CA的小腸吸收率為10%~15%[11]和CCA中CA在小腸的釋放率為70.5%計算得到。飼養試驗從奶牛產前21 d開始到產后21 d結束,共42 d。試驗牛飼養于同一圈舍內,不同組之間用鐵柵欄隔開,每頭牛固定采食位,每日飼喂2次,自由采食和飲水,每日擠奶3次。每日晨飼前,將CFA和CCA添加劑與約500 g全混合日糧(TMR)混勻飼喂奶牛,待牛采食完后再飼喂其余日糧。
1.2 體重和采食量的測定
于奶牛產犢后第1和第21天,每次連續2 d,早晨擠奶后,測定每頭牛空腹BW,計算試驗期間體重變化(BWC)。奶牛產后第4天開始,記錄每頭牛每天的喂料量和剩料量,采集第7、14和21天的TMR樣品和剩料樣品,測定干物質(DM)含量[13],計算每頭牛每天干物質采食量(DMI)。
1.3 奶樣的采集與測定
奶牛產后第4天開始,記錄每頭牛每天的產奶量。采集每頭牛產后第7、14和21天3次擠奶的奶樣,以牛為單位按早、中和晚4∶3∶3的比例制成混合樣,置于裝有2-溴-2-硝基-1,3-丙二醇的奶樣瓶中,用紅外乳品分析儀(MK-120,丹麥)測定脂肪、蛋白質和乳糖含量。
1.4 糞便樣品的采集與測定
奶牛產后第18~21天,采集每頭牛糞樣。糞樣通過直腸采集,每天4次,每次約150 g,-20℃保存,試驗結束后,以牛為單位按濕重比制成混合樣,加入濕糞重25%的10%酒石酸溶液,65℃烘至恒重。TMR樣和糞樣,粉碎過1 mm篩,依據AOAC(2006)[13]的方法測定DM、有機物(OM)、粗蛋白質(CP)和酸不溶灰分(AIA)的含量,依據Van Soest等[14]的方法測定中性洗滌纖維(NDF)和酸性洗滌纖維(ADF)含量。把AIA作為內源指示劑,計算各養分消化率,某養分表觀消化率=100%-[TMR中AIA含量×糞中某養分含量/(糞中AIA含量×TMR中某養分含量)]×100%。
1.5 瘤胃液樣品的采集與測定
奶牛產后第19、20和21天,早飼后3~4 h,用胃管采樣器采集每頭牛瘤胃液樣品約100 mL。為避免唾液污染,棄掉先采集的約200 mL瘤胃液。瘤胃液樣品立即用酸度計(PHS-3C,中國山東)測定pH,然后用紗布(4層)過濾,濾液保存于-20℃,用氣相色譜儀(Trace 1300,中國四川),采用內標法測定揮發性脂肪酸(VFA)含量[13]。
1.6 血液樣品的采集與測定
奶牛產后第14和21天,擠奶后、晨飼前,采集每頭牛尾靜脈血液約20 mL,2 500×g離心20 min,分離血清,-20℃保存。血液中葡萄糖、TG、膽固醇(TC)和NEFA含量用分光光度計測定(UV759,中國上海),BHB、極低密度脂蛋白(VLDL)、載脂蛋白B100(ApoB100)、同型半胱氨酸(Hcy)、FA和CA含量用酶標儀(DR200-Bn,中國山東)測定。指標測定試劑盒均購自上海篤瑪生物科技有限公司。
1.7 肝組織樣品的采集與測定
奶牛產后第21天,擠奶后、晨飼前,每組隨機選擇6頭奶牛,用活體穿刺采樣針采集每頭牛肝組織樣品約0.5 g。肝組織樣品用無菌濾紙吸凈表面的水分和血液,放入液氮中貯存,隨后轉入-80℃冰箱。肝組織樣品每克鮮組織中FA和CA含量依據試劑盒(上海篤瑪生物科技有限公司)說明書測定;TG和TC的提取和測定依據Homan和Anderson[15]的方法;總脂、磷脂酰乙醇胺(PE)和磷脂酰膽堿(PC)的提取和測定依據Becart等[16]的方法。
1.8 數據統計分析
奶牛產后DMI和產奶量數據按照每頭牛全期平均值進行統計分析。乳成分、瘤胃發酵參數和血液指標測定值均按照每頭牛平均值進行統計分析。所有數據均依據2×2因子設計,采用SAS 9.0軟件中的混合模型進行方差分析,Plt;0.05認為差異顯著。
2 結 果
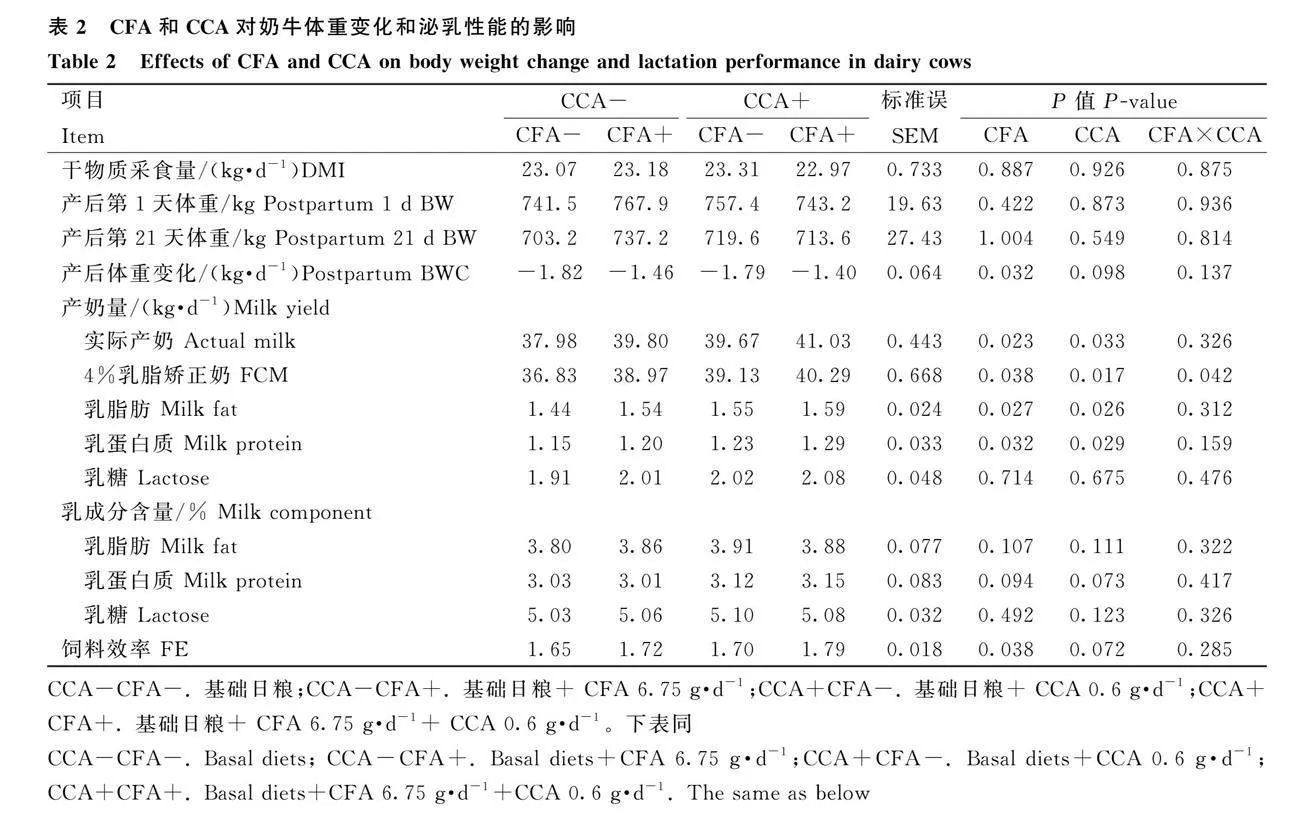
2.1 CFA和CCA對奶牛體重變化和產奶性能的影響
由表2可知,補充CFA或CCA,奶牛DMI、產后第1天BW、第21天BW、乳糖產量和乳成分含量(乳脂肪、乳蛋白質和乳糖)無顯著變化(Pgt;0.05),實際乳、乳脂校正乳(FCM)、乳脂肪和乳蛋白質產量顯著提高(Plt;0.05)。補充CFA,奶牛BWC顯著降低(Plt;0.05),飼料效率(FE)顯著提高(Plt;0.05)。補充CCA,奶牛BWC和FE無顯著變化(Pgt;0.05)。CFA和CCA共同補充組奶牛FCM產量顯著高于CFA或CCA單獨補充(Plt;0.05)。
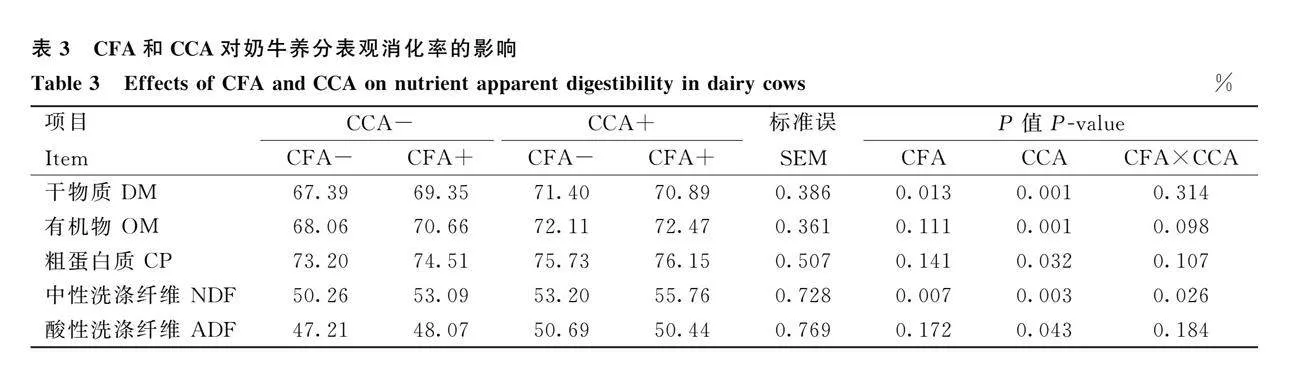
2.2 CFA和CCA對奶牛養分表觀消化率的影響
由表3可知,補充CFA,DM和NDF表觀消化率顯著提高(Plt;0.05),OM、CP和ADF表觀消化率無顯著變化(Pgt;0.05)。補充CCA,DM、OM、CP、NDF和ADF表觀消化率顯著提高(Plt;0.05)。CFA和CCA共同添加組奶牛NDF表觀消化率顯著高于CFA或CCA單獨添加組(Plt;0.05)。
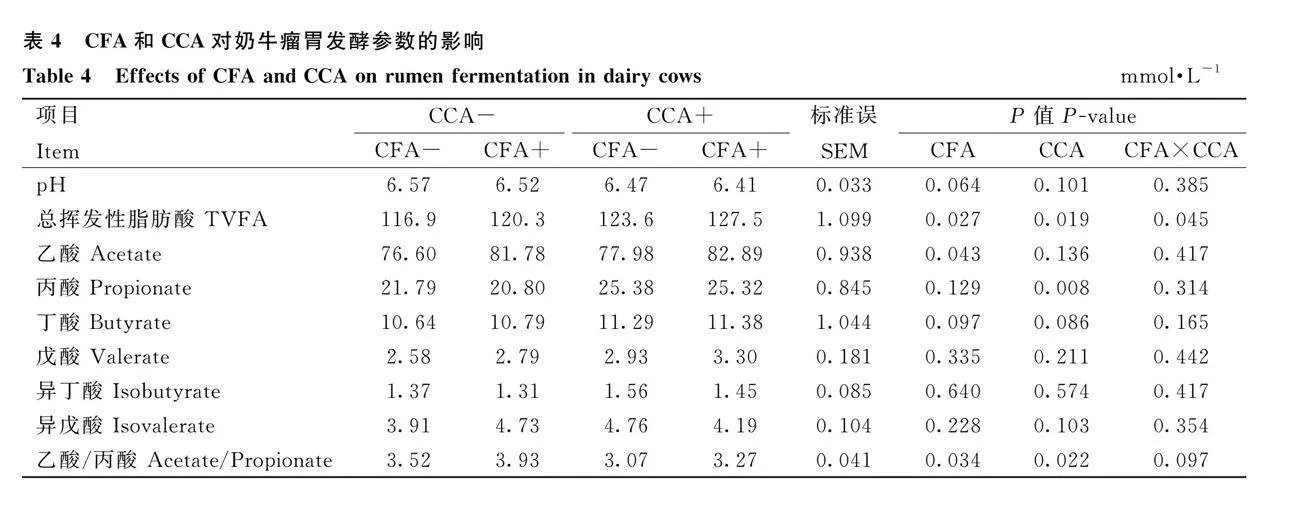
2.3 CFA和CCA對奶牛瘤胃發酵參數的影響
由表4可知,補充CFA或CCA,奶牛瘤胃pH、丁酸、戊酸、異丁酸和異戊酸濃度無顯著變化(Pgt; 0.05),總VFA(TVFA)濃度顯著增加(Plt;0.05)。補充CFA,瘤胃乙酸濃度和乙酸/丙酸顯著增加(Plt;0.05),丙酸濃度無顯著變化(Pgt;0.05)。補充CCA,瘤胃乙酸濃度無顯著變化(Pgt;0.05),丙酸濃度顯著增加(Plt;0.05),乙酸/丙酸顯著降低(Plt;0.05)。聯合補充CFA和CCA,瘤胃TVFA濃度顯著高于單獨補充CFA或CCA(Plt;0.05)。
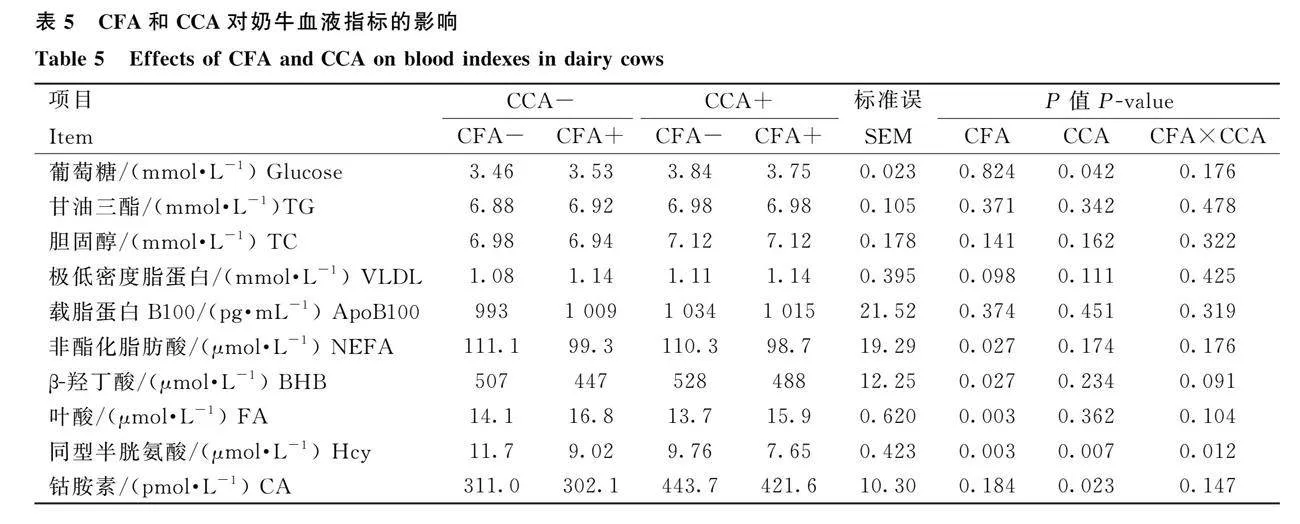
2.4 CFA和CCA對奶牛血液指標的影響
由表5可知,補充CFA或CCA,奶牛血液TG、TC、VLDL和ApoB100含量無顯著變化(Pgt;0.05),Hcy含量顯著降低(Plt;0.05)。補充CFA,血液葡萄糖和CA含量無顯著變化(Pgt;0.05),NEFA和BHB含量顯著降低(Plt;0.05),FA含量顯著提高(Plt;0.05)。補充CCA,血液葡萄糖和CA濃度顯著提高(Plt;0.05),NEFA、BHB和FA含量無顯著變化(Pgt;0.05)。聯合補充CFA和CCA組奶牛血液Hcy含量顯著低于CFA或CCA組(Plt;0.05)。
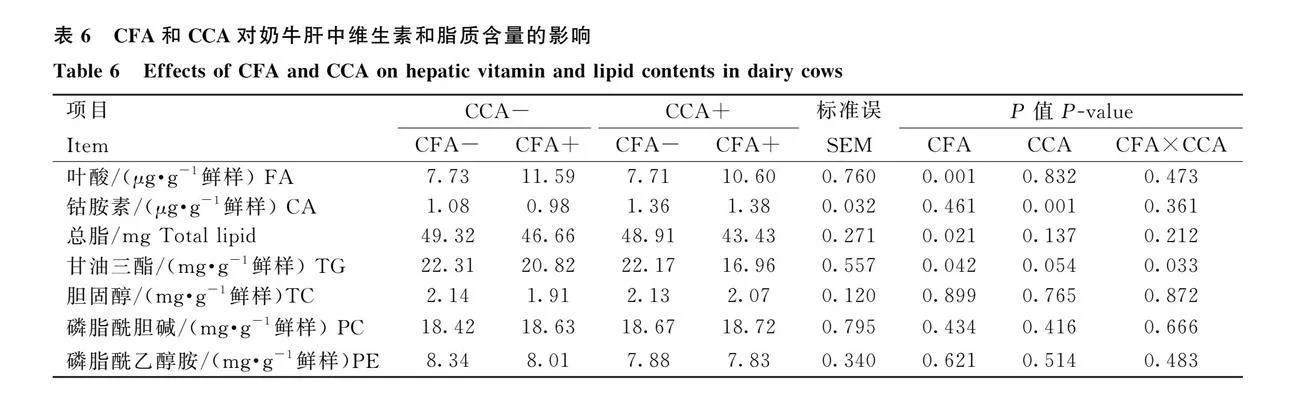
2.5 CFA和CCA對奶牛肝中維生素和脂質含量的影響
由表6可知,補充CFA或CCA對奶牛肝中TC、PC和PE含量無顯著影響(Pgt;0.05)。補充CFA,肝臟FA含量顯著提高(Plt;0.05),總脂和TG含量顯著降低(Plt;0.05)。補充CCA,奶牛肝臟FA、總脂和TG含量無顯著變化(Pgt;0.05),CA含量顯著提高(Plt;0.05)。聯合補充CFA和CCA組奶牛肝臟TG含量顯著低于單獨補充CFA或CCA組(Plt;0.05)。
3 討 論
3.1 CFA添加效果
本試驗中,奶牛補充CFA,DMI無顯著變化、BWC減少,因此,產奶量、乳脂肪和乳蛋白質產量提高歸因于DM消化率與瘤胃TVFA和乙酸濃度增加,表明補充CFA提高了養分利用率,為奶牛乳合成過程提供了更多的能量和前體物質。其中,乳脂肪產量增加可歸因于瘤胃乙酸濃度增加。乙酸是乳脂肪酸合成的前體,增加奶牛乙酸供應能促進乳脂肪酸合成[17]。另外,FA作為一碳基團的載體,能促進細胞蛋白質合成和能量利用[2]。補充CFA,血液和肝FA水平提高,表明奶牛FA狀態改善,也是泌乳性能提高的原因。其他試驗發現,圍產期奶牛補充CFA上調了與能量利用和泌乳相關的基因的表達[18]。圍產期奶牛日糧中補充CFA或FA,泌乳早期DMI和BW無顯著變化,乳和乳蛋白質產量提高[4,8]。然而,Preynat等[19]發現,奶牛產前21 d開始,每周肌肉注射FA 160 mg,泌乳早期DMI、乳和乳成分產量無顯著變化。試驗結果的不一致與FA的補充方式不同有關。本試驗用的CFA添加劑中約28.3%的FA在瘤胃中釋放,69.7%的FA在小腸中釋放,因此能實現對瘤胃和腸道養分消化的調控。
本試驗中,補充CFA提高了DM和NDF表觀消化率,與CFA對瘤胃和小腸養分消化的正向調控有關,和Zhang等[4]的試驗結果一致。試驗用CFA中的FA既能在瘤胃中釋放,又能有效到達小腸,實現對腸道養分消化的調控。本試驗中,補充CFA奶牛瘤胃TVFA和乙酸濃度、乙酸/丙酸增加,表明瘤胃發酵模式轉化為產生更多的乙酸,與NDF表觀消化率提高的結果一致。試驗結果表明,補充CFA促進了瘤胃中纖維分解菌的生長和養分的降解,與Zhang等[4]的結果一致。在瘤胃中,飼糧中的NDF被纖維分解菌降解產生乙酸。FA參與微生物的一碳代謝過程,是纖維分解菌生長的必需因子[20]。已有報道,公牛補充CFA,瘤胃纖維分解菌數量和纖維酶活性增加[21],DM和NDF降解率提高[22]。另外,FA也是維持小腸和胰腺功能正常的必需因子[23]。據報道,公牛飼糧中補充CFA,小腸蛋白酶和淀粉酶活性提高[21],體外培養液中補充FA,DM在腸道的消化率提高[24]。
本試驗中,補充CFA對奶牛血液葡萄糖水平無顯著影響,與瘤胃丙酸濃度、乳糖產量和含量無顯著變化的結果一致。奶牛血液中的葡萄糖約80%來源于丙酸糖異生作用,是乳糖合成的前體[12]。肝內合成的TG、TC、PE、PC與ApoB100等載脂蛋白結合形成VLDL轉運出肝,其中ApoB100是調控VLDL合成和分泌的關鍵因子[25]。補充CFA對奶牛血液TG、TC、VLDL和ApoB100水平無顯著影響,與肝臟中TC、PC和PE含量無顯著變化的結果一致,表明肝臟VLDL的合成和分泌無顯著變化。血液中NEFA和BHB水平可反映奶牛的能量狀態,其中NEFA主要來源于體脂肪分解,是肝TG的主要來源,BHB是NEFA在肝臟中不完全氧化的產物[1]。因此,補充CFA,奶牛血液NEFA和BHB水平顯著降低,與BWC減少的結果一致,表明奶牛能量利用改善,體脂分解減少。其他研究同樣發現,圍產期奶牛飼糧中補充FA,泌乳早期血液葡萄糖水平無顯著變化,BHB水平顯著降低[5,19]。Duplessis等[3]分析了5項研究的數據后發現,泌乳早期奶牛血液NEFA和BHB水平與血液FA含量呈負相關。補充CFA奶牛肝總脂和TG含量降低,可歸因于奶牛體脂分解減少,同時也與FA對肝脂質代謝的調控有關。據報道,飼糧中補充CFA,荷斯坦公牛肝組織中脂肪酸β-氧化通路關鍵基因表達上調,TG合成代謝關鍵基因表達下調[5],泌乳早期奶牛肝組織的再生和脂質分解增強[6]。但是,Graulet等[8]發現,飼糧中補充2.5 g·d-1的FA,泌乳早期奶牛肝中總脂和TG含量增加。試驗結果的不同可能與FA添加水平或日糧組成不同有關。
3.2 CCA添加效果
本試驗中,飼糧中補充CCA,奶牛DMI和BWC無顯著變化,與血液NEFA和BHB水平無顯著變化的結果一致。試驗結果表明,補充CCA沒有增加奶牛體脂動員,因此產奶量和乳脂肪與乳蛋白質產量提高,歸因于養分消化率和瘤胃TVFA濃度的增加,以及CA在蛋白質合成代謝中的營養生理功能。一碳循環中,CA依賴的MS催化Hcy轉化為蛋氨酸,蛋氨酸是奶牛乳蛋白質合成的必需氨基酸[2,12]。本試驗中,補充CCA,奶牛血液和肝CA含量增加,血液Hcy水平降低,表明奶牛CA狀態改善,更多的Hcy被轉化為蛋氨酸。然而,Graulet等[8]報道,圍產期奶牛飼糧中補充CA 0.5 g·d-1,產后21 d DMI、BWC、泌乳性能和血液NEFA含量無顯著變化。Wang等[7]發現,圍產期奶牛每周肌肉注射1次10 mg CA,泌乳早期DMI、乳、乳蛋白質和乳糖產量提高,BWC與血液NEFA和BHB水平降低。試驗結果的不一致可能與各試驗采用的CA補充形式和水平不同有關。本試驗用的CCA添加劑中約24.8%的CA在瘤胃中釋放,70.5%的CA在小腸中釋放,因此能實現對瘤胃和腸道養分消化的調控。
本試驗中,奶牛補充CCA,日糧養分表觀消化率提高,與瘤胃TVFA和丙酸濃度增加的結果一致,表明養分在瘤胃的降解增加,與CCA對瘤胃微生物生長的促進作用有關。研究表明,CA是瘤胃微生物的必需營養因子,參與微生物DNA、乙酰CoA和丙酰CoA的合成,在丙酸生成過程中,CA依賴的甲基丙二酰CoA變位酶(MCM)催化琥珀酰CoA轉化為甲基丙二酰CoA[26]。體外試驗同樣發現,補充CA 2 mg·g-1 DM,奶牛瘤胃TVFA和丙酸濃度增加[27];不同精粗比底物添加CA 40或90 ng·mL-1,羊瘤胃TVFA濃度增加[28]。另外,CCA也能促進養分在腸道的消化。體外試驗發現,補充CA,DM在全消化道、瘤胃和小腸的消化率均提高[24]。本試驗中,補充CCA,瘤胃乙酸濃度無顯著變化,丙酸濃度增加,導致乙酸/丙酸降低,表明瘤胃發酵模式轉化為產生更多的丙酸。CA是瘤胃丙酸產生的必需因子,在肝中,CA依賴的MCM催化丙酰CoA異構化生成琥珀酰CoA,是丙酸進入糖異生代謝的關鍵步驟[29]。本試驗發現,補充CCA奶牛血液葡萄糖含量提高,表明奶牛糖異生代謝被促進,能量供應改善,這是補充CCA奶牛泌乳性能提高的另一個原因。另外,本試驗發現,飼糧中補充CCA,奶牛血液和肝組織中脂質代謝相關指標無顯著變化,表明單獨補充CCA對緩減圍產期奶牛體脂動員和肝脂質沉積無顯著影響。
3.3 CFA和CCA互作效應
依據本研究目的,在此只對CCA和CFA互作效應顯著的結果進行討論分析。與單獨補充相比,CFA和CCA聯合補充,奶牛FCM產量、NDF消化率和瘤胃TVFA濃度較高,血液Hcy濃度、肝TG含量較低,表明CFA和CCA聯合補充對提高奶牛泌乳性能和養分消化、減少肝脂質沉積比二者單獨補充更有效。試驗結果的產生與FA和CA在一碳代謝中的營養生理功能有關。一碳循環對動物蛋白質合成和能量代謝起重要調控作用[2]。一碳代謝中,Hcy和5-甲基四氫葉酸在CA依賴的MS催化下,轉化為蛋氨酸和四氫葉酸(FA的活性形式),這是維持一碳循環正常高效進行的關鍵[2],補充CCA有助于FA功能的發揮。本試驗中,奶牛血液Hcy濃度的變化結果表明,CFA和CCA聯合補充對一碳循環效率的改善優于二者單獨補充。體外試驗發現,與單獨添加FA相比,FA和CA共同添加組CP 12 h瘤胃消化率較高[24]。Graulet等[8]發現,聯合補充FA和CA可以緩減單獨補充FA造成的泌乳早期奶牛肝脂質增加。Duplessis等[3]報道,泌乳早期奶牛血液NEFA和BHB水平與血液CA/FA呈正相關。
4 結 論
圍產期奶牛單獨補充CFA或CCA,泌乳性能、養分消化和瘤胃發酵改善。補充CFA,奶牛BWC和肝脂質沉積減少。聯合補充CFA和CCA對提高奶牛泌乳性能、養分消化和瘤胃TVFA產量,以及降低肝脂質含量,比二者單獨補充更有效。
參考文獻(References):
[1] BOBE G,YOUNG J W,BEITZ D C.Invited review:pathology,etiology,prevention,and treatment of fatty liver in dairy cows[J].J Dairy Sci,2004,87(10):3105-3124.
[2] BROSNAN M E,MACMILLAN L,STEVENS J R,et al.Division of labour:how does folate metabolism partition between one-carbon metabolism and amino acid oxidation?[J] Biochem J,2015,47(2):135-146.
[3] DUPLESSIS M,CHORFI Y,GIRARD C L.Longitudinal data to assess relationships among plasma folate,vitamin B12,non-esterified fatty acid,and β-hydroxybutyrate concentrations of Holstein cows during the transition period[J].Metabolites,2023,13(4):547.
[4] ZHANG Z,LA S K,ZHANG G W,et al.Diet supplementation of palm fat powder and coated folic acid on performance,energy balance,nutrient digestion,ruminal fermentation and blood metabolites of early lactation dairy cows[J].Anim Feed Sci Technol,2020,265:114520.
[5] ZHANG Z,LIU Q,WANG C,et al.Effects of palm fat powder and coated folic acid on growth performance,ruminal fermentation,nutrient digestibility and hepatic fat accumulation of Holstein dairy bulls[J].J Integr Agr,2020,19(4):1074-1084.
[6] OUATTARA B,BISSONNETTE N,DUPLESSIS M,et al.Supplements of vitamins B9 and B12 affect hepatic and mammary gland gene expression profiles in lactating dairy cows[J].BMC Genomics,2016,17(1):640.
[7] WANG D M,ZHANG B X,WANG J K,et al.Effect of dietary supplements of biotin,intramuscular injections of vitamin B12,or both on postpartum lactation performance in multiparous dairy cows[J].J Dairy Sci,2018,101(9):7851-7856.
[8] GRAULET B,MATTE J J,DESROCHERS A,et al.Effects of dietary supplements of folic acid and vitamin B12 on metabolism of dairy cows in early lactation[J].J Dairy Sci,2007,90(7):3442-3455.
[9] DUPLESSIS M,LAPIERRE H,SAUERWEIN H,et al.Combined biotin,folic acid,and vitamin B12 supplementation given during the transition period to dairy cows:part I.Effects on lactation performance,energy and protein metabolism,and hormones[J].J Dairy Sci,2022,105(8):7079-7096.
[10] DUPLESSIS M,GERVAIS R,LAPIERRE H,et al.Combined biotin,folic acid,and vitamin B12 supplementation given during the transition period to dairy cows:part II.Effects on energy balance and fatty acid composition of colostrum and milk[J].J Dairy Sci,2022,105(8):7097-7110.
[11] SANTSCHI D E,BERTHIAUME R,MATTE J J,et al.Fate of supplementary B-vitamins in the gastrointestinal tract of dairy cows[J].J Dairy Sci,2005,88(6):2043-2054.
[12] NRC.Nutrient Requirements of dairy cattle[M].7th rev ed.Washington:National Academy Press,2001.
[13] AOAC.Official methods of analysis of the association of official analytical chemists[M].18th ed.Gaithersburg:Association of Official Analytical Chemists,2005.
[14] VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].J Dairy Sci,1991,74(10):3583-3597.
[15] HOMAN R,ANDERSON M K.Rapid separation and quantitation of combined neutral and polar lipid classes by high-performance liquid chromatography and evaporative light-scattering mass detection[J].J Chromatogr B,1998,708(1-2):21-26.
[16] BECART J,CHEVALIER C,BIESSE J P.Quantitative analysis of phospholipids by HPLC with a light scattering evaporating detector-application to raw materials for cosmetic use[J].J High Resolut Chromatogr,1990,13(2):126-129.
[17] MATAMOROS C,CAI J,PATTERSON A D,et al.Comparison of the effects of short-term feeding of sodium acetate and sodium bicarbonate on milk fat production[J] J Dairy Sci,2021,104(7):7572-7582.
[18] KHAN M Z,LIU L,ZHANG Z C,et al.Folic acid supplementation regulates milk production variables,metabolic associated genes and pathways in perinatal Holsteins[J].J Anim Physiol Anim Nutr,2020,104(2):483-492.
[19] PREYNAT A,LAPIERRE H,THIVIERG M C,et al.Influence of methionine supply on the response of lactational performance of dairy cows to supplementary folic acid and vitamin B12[J].J Dairy Sci,2009,92(4):1685-1695.
[20] SLYTER L L,WEAVER J M.Tetrahydrofolate and other growth requirements of certain strains of Ruminococcus flavefaciens[J].Appl Environ Microbiol,1977,33(2):363-369.
[21] LIU Y Q,WANG C,LIU C,et al.Effects of coated folic acid and coated methionine on growth performance,nutrient digestibility and rumen fermentation in Simmental bulls[J].Anim Feed Sci Technol,2023,298:115596.
[22] WANG C,LIU Q,GUO G,et al.Effects of rumen-protected folic acid on ruminal fermentation,microbial enzyme activity,cellulolytic bacteria and urinary excretion of purine derivatives in growing beef steers[J].Anim Feed Sci Technol,2016,221:185-194.
[23] LONGNECKER D S.Abnormal methyl metabolism in pancreatic toxicity and diabetes[J].J Nutr,2002,132(8):2373S-2376S.
[24] PARNIAN-KHAJEHDIZAJ F,TAGHIZADEH A,HOSSEINKHANI A,et al.Evaluation of dietary supplementation of B vitamins and HMBi on fermentation kinetics,ruminal or post-ruminal diet digestibility using modified in vitro techniques[J].J Biosci Biotechnol,2018,7(2-3):125-133.
[25] BERNABUCCI U B,RONCHI L,BASIRICO D,et al.Abundance of mRNA of apolipoprotein B100,apolipoprotein E,and microsomal triglyceride transfer protein in liver from periparturient dairy cows[J].J Dairy Sci,2004,87(9):2881-2888.
[26] MARTENS J H,BARG H,WARREN M,et al.Microbial production of vitamin B12[J].Appl Microbiol Biotechnol,2002,58(3):275-285.
[27] LIU Z H,WANG K,NAN X M,et al.Effects of combined addition of 3-nitrooxypropanol and vitamin B12 on methane and propionate production in dairy cows by in vitro-simulated fermentation[J].J Dairy Sci,2023,106(1):219-232.
[28] 李亞學,王佳堃,孫 華,等.不同精粗比下添加維生素B12對體外瘤胃發酵和微生物酶活力的影響[J].動物營養學報,2012,24(10):1888-1896.
LI Y X,WANG J K,SUN H,et al.In vitro rumen fermentation and microbial enzyme activities influenced by vitamin B12 supplementation in different concentrate to forage ratios[J].Chinese Journal of Animal Nutrition,2012,24(10):1888-1896.(in Chinese)
[29] ASCHENBACH J R,KRISTENSEN N B,DONKIN S S,et al.Gluconeogenesis in dairy cows:the secret of making sweet milk from sour dough[J].IUBMB Life,2010,62(12):869-877.
(編輯 范子娟)

