GreA蛋白對腸炎沙門菌生物學(xué)特性及致病力影響



摘 要: 旨在研究轉(zhuǎn)錄延長因子GreA蛋白對腸炎沙門菌生物學(xué)特性和致病力的影響。以ATCC13076為親本株,通過λ-Red重組系統(tǒng)構(gòu)建ΔgreA和ΔgreB單基因缺失株、ΔgreAΔgreB雙基因缺失株,檢測親本株及缺失株的體外生長和運動力,對壓力環(huán)境抵抗力,生物被膜形成能力,以及對細(xì)胞和小鼠的致病力,并利用RNA-seq檢測差異表達(dá)基因。結(jié)果顯示:GreA蛋白負(fù)調(diào)控腸炎沙門菌H2O2抵抗力、生長速度以及生物被膜形成能力,正調(diào)控腸炎沙門菌運動能力、細(xì)胞入侵和胞內(nèi)增殖能力及其在小鼠臟器的定殖能力,但對高溫和酸性環(huán)境抵抗力無顯著影響。GreA蛋白影響107個基因表達(dá),其中正向調(diào)控fim操縱子、flg操縱子、inv操縱子等,主要與細(xì)菌運動及入侵細(xì)胞相關(guān);負(fù)向調(diào)控于cps操縱子、cys操縱子、leu操縱子等,主要與氨基酸合成及代謝相關(guān)。GreA蛋白通過調(diào)控鞭毛合成和細(xì)胞入侵相關(guān)代謝通路的表達(dá),影響腸炎沙門菌環(huán)境適應(yīng)性生存及致病力。
關(guān)鍵詞: 腸炎沙門菌;GreA;生物學(xué)特性;RNA-seq
中圖分類號:S852.612
文獻(xiàn)標(biāo)志碼:A
文章編號:0366-6964(2024)11-5173-10
收稿日期:2024-01-08
基金項目:河北省自然科學(xué)基金項目(C2019402120);河北省高等學(xué)校科學(xué)技術(shù)研究項目(QN2019015);河北省三期現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系蛋禽創(chuàng)新團(tuán)隊資助項目(HBCT2024260205)
作者簡介:蔡夢雷(1997-),男,河南商丘人,碩士,主要從事病原細(xì)菌致病機(jī)制研究,E-mail: caimenglei2022@163.com
*通信作者:崔國林,主要從事病原細(xì)菌致病機(jī)制研究,E-mail:czzcgl_19@163.com
The Effect of GreA Protein on the Biological Characteristics and Pathogenicity of Salmonella
Enteritidis
CAI" Menglei1,2, ZHAO" Dongxu1, ZHANG" Zhenggang1, LIU Donghai1, JIANG Tingting1, SU" Shixuan
1, YAN" Xuemin1, XUE" Xiaoyang 2, CUI" Guolin1, 2*
(1.School of Life Science and Food Engineer, Hebei University of Engineering, Handan 056038,
China;
2.Huayu Agricultural Science and Technology Co., Ltd, Handan 057151," China)
Abstract: "The aim is to study the effect of GreA protein on the biological characteristics and pathogenicity of Salmonella Enteritidis. Based on the parent strain ATCC13076, ΔgreA and ΔgreB single gene deletion strains and ΔgreAΔgreB double gene deletion strains were constructed by λ-Red recombinant system. Their growth and swimming motility, resistance to stressful environment, biofilm formation ability, and pathogenicity to cells and mice of the parents and the deletion strains were detected. RNA-seq was used to detect differentially expressed genes (DEGs). GreA protein negatively regulated the H2O2 resistance, the growth in vitro and biofilm formation ability of Salmonella Enteritidis, and positively regulated the motor ability, cell invasion and intracellular proliferation ability of Salmonella Enteritidis and its colonizing ability in mouse organs, but have no significant effect on resistance of Salmonella Enteritidis to high temperature and acid environment. GreA protein affects the expression of 107 genes, including positive regulation of inv operon, fim operon and flg operon, which are mainly related to bacterial motility and cell invasion; and negative regulation of cps operon, cbp operon and leu operon, which are related to amino acid synthesis and metabolism. GreA protein affects the environmental adaptability and pathogenicity of Salmonella Enteritidis by regulating the expression of metabolic pathways related to flagellar synthesis and cell invasion.
Key words:" Salmonella Enteritidis; biological characteristics; GreA; RNA-seq
*Corresponding author:" CUI Guolin, E-mail: czzcgl_19@163.com
沙門菌屬于革蘭陰性菌,是一種重要的人獸共患病致病菌。目前已知的沙門菌血清型超過2 600余種,其中腸炎沙門菌(Salmonella enterica serovar Enteritidis)是導(dǎo)致畜禽產(chǎn)業(yè)及其相關(guān)產(chǎn)品污染的主要血清型,并且在沙門菌引起的人類食物中毒中占有很高的比例[1-2]。腸炎沙門菌無宿主特異性、繁殖速度快,可在水、食物等載體中存活數(shù)月,感染宿主后可引起高燒、腹瀉、嘔吐等[3]。該菌造成的經(jīng)濟(jì)損失逐年增加,對全世界公共衛(wèi)生構(gòu)成巨大威脅[4]。腸炎沙門菌的致病性和傳染性受毒力島、雙組分系統(tǒng)等多種基因結(jié)構(gòu)的調(diào)控,而轉(zhuǎn)錄是這些基因表達(dá)的第一步,轉(zhuǎn)錄延長因子Gre所發(fā)揮的功能就顯得尤為重要[5]。
Gre因子是一種轉(zhuǎn)錄延長因子,廣泛存在于原核生物中,屬于RNAP輔助通道因子,在大腸桿菌、沙門菌等腸道細(xì)菌中包括GreA和GreB兩種蛋白,主要功能是拯救停滯的RNA聚合酶復(fù)合物、維持基因轉(zhuǎn)錄保真性、抑制DNA斷裂修復(fù)[6]。Gre因子缺失引起細(xì)菌對離子去污劑、高溫和滲透壓休克的敏感性升高,越來越多的證據(jù)表明,GreA因子有助于各種細(xì)菌適應(yīng)壓力環(huán)境[7-8]。在分歧桿菌中,greA基因的缺失導(dǎo)致生長遲緩、不良應(yīng)激反應(yīng)抵抗能力減弱以及細(xì)胞內(nèi)存活率下降[9]。過表達(dá)GreA可增強(qiáng)大腸桿菌對熱休克和氧化應(yīng)激的抵抗力[10]。腸炎沙門菌適于在多種動物體內(nèi)和環(huán)境中生存,基因的轉(zhuǎn)錄調(diào)控對于其適應(yīng)性生存具有重要作用。前期研究發(fā)現(xiàn),greA、greB基因雙缺失可導(dǎo)致腸炎沙門菌基因組中300個以上基因差異表達(dá),引起其在動物及細(xì)胞中的毒性變化,但單獨greA基因?qū)δc炎沙門菌致病力的作用仍未知。
GreA和GreB蛋白的結(jié)構(gòu)高度同源,且相互間具有一定功能重疊[11-12],因此研究擬通過腸炎沙門菌親本株與greA單基因缺失株比較、greA、greB雙基因缺失株與greB單基因缺失株比較,交互比較和分析GreA蛋白在腸炎沙門菌致病力相關(guān)表型調(diào)控中的功能。研究將揭示和完善腸炎沙門菌毒力調(diào)控網(wǎng)絡(luò),為開展腸炎沙門菌弱毒疫苗和藥物研發(fā)提供一種新的靶標(biāo)。
1 材料與方法
1.1 實驗動物、菌株及細(xì)胞
6~8周齡昆明鼠購自斯貝福(北京)生物技術(shù)有限公司。
腸炎沙門菌標(biāo)準(zhǔn)株ATCC13076,RAW264.7細(xì)胞,質(zhì)粒pKD3、pKD46、pCP20由中國農(nóng)業(yè)大學(xué)蘇敬良教授惠贈;HCT116細(xì)胞購自北京協(xié)和細(xì)胞資源中心。
1.2 主要試劑
LB液體培養(yǎng)基、LB固體培養(yǎng)基、胰蛋白酶購自北京索萊寶公司,胎牛血清(FBS)購自榮曄生物科技有限責(zé)任公司,氨芐青霉素鈉、慶大霉素購自Sigma公司,DMEM培養(yǎng)基購自Biosharp公司。
1.3 腸炎沙門菌缺失株構(gòu)建
以腸炎沙門菌標(biāo)準(zhǔn)株ATCC13076(WT)為親本株,通過λ-Red重組系統(tǒng)構(gòu)建腸炎沙門菌基因缺失株。pKD46質(zhì)粒電擊轉(zhuǎn)入WT感受態(tài)細(xì)胞;利用greAF/greAR引物(見表1)擴(kuò)增pKD3質(zhì)粒中氯霉素抗性基因和FRT位點,將該PCR產(chǎn)物電擊轉(zhuǎn)入上述感受態(tài)細(xì)胞;42℃培養(yǎng)16 h,消除pKD46質(zhì)粒;將pCP20質(zhì)粒電擊轉(zhuǎn)入以消除氯霉素抗性基因。42 ℃培養(yǎng)消除pCP20質(zhì)粒,獲得ΔgreA基因缺失株。采用相似的方法構(gòu)建ΔgreB基因缺失株和ΔgreAgreB基因缺失株。
利用greApF/greApR、greBpF/greBpR引物(見表1)鑒別上述缺失株。
1.4 體外培養(yǎng)檢測
于LB固體培養(yǎng)基復(fù)蘇WT、ΔgreAΔgreB、ΔgreA、ΔgreB,挑取單菌落,接種10 mL LB液體培養(yǎng)基,37 ℃、160 r·min-1過夜培養(yǎng)約16 h。
過夜菌1∶1 000轉(zhuǎn)接至100 mL LB液體培養(yǎng)基,37℃、160 r·min-1搖床培養(yǎng),間隔1~2 h測定菌液OD600 nm,連續(xù)測定24 h并繪制生長曲線。同時,過夜菌劃線接種LB固體培養(yǎng)基,37℃培養(yǎng)24 h。生長曲線進(jìn)行多次獨立重復(fù)試驗,但單次測定時無生物學(xué)重復(fù)。
過夜菌調(diào)整OD600 nm=1.0,分別吸取菌液2 μL,滴入LB半固體培養(yǎng)基(0.3%瓊脂),約15 min液滴干燥,正置濕盒內(nèi),37℃培養(yǎng)約5 h,測量運動環(huán)直徑[13]。
1.5 環(huán)境適應(yīng)性檢測
參考文獻(xiàn)方法進(jìn)行抑菌試驗[14]。過夜菌轉(zhuǎn)接培養(yǎng)約3 h至對數(shù)期,調(diào)整菌液OD600 nm=0.3(約3×108 CFU·mL-1)。100倍稀釋后,加入到含1 mmol·L-1 H2O2、pH=4.5的LB液體培養(yǎng)基中,分裝至48孔板,1 mL·孔-1。室溫靜置1 h,倍比稀釋后涂布LB固體培養(yǎng)基。
將轉(zhuǎn)接培養(yǎng)至對數(shù)期的菌液調(diào)整OD600 nm=0.3,10倍梯度稀釋,以101~106濃度滴入LB固體培養(yǎng)基,干燥后分別置于37、42、48 ℃培養(yǎng)24 h,觀察菌株生長情況。
過夜菌調(diào)整為OD600 nm=1.0,100倍稀釋后接種96孔細(xì)胞板,200 μL·孔-1,設(shè)空白對照。置于濕盒,37℃培養(yǎng)48、72 h,采用結(jié)晶紫染色法測定生物被膜形成能力的差異[15]。
1.6 細(xì)胞試驗
人結(jié)腸癌細(xì)胞HCT116、小鼠單核巨噬細(xì)胞RAW264.7培養(yǎng)于10% FBS的DMEM培養(yǎng)基,培養(yǎng)條件是37℃、5% CO2。根據(jù)文獻(xiàn)方法進(jìn)行細(xì)胞試驗[16-17]。接種細(xì)胞于24孔板,培養(yǎng)細(xì)胞密度至70%~80%。過夜菌WT、ΔgreAΔgreB、ΔgreA、ΔgreB轉(zhuǎn)接培養(yǎng)至對數(shù)期,調(diào)整OD600 nm=0.3,使用1% FBS的DMEM培養(yǎng)基100倍稀釋,以感染復(fù)數(shù)(MOI)=10∶1感染細(xì)胞,孵育1 h。100 μg·mL-1慶大霉素作用1 h,之后加入10 μg·mL-1慶大霉素繼續(xù)培養(yǎng)。感染2、24 h使用預(yù)冷蒸餾水裂解細(xì)胞,所得混懸液稀釋后涂布LB固體培養(yǎng)基,37℃培養(yǎng)24 h后細(xì)菌計數(shù)。
1.7 動物試驗
將6~8周齡小鼠分為WT組、ΔgreAΔgreB組、ΔgreA組、ΔgreB組以及對照組,每組16只。過夜培菌菌轉(zhuǎn)接再培養(yǎng),以LB液體培養(yǎng)基調(diào)整菌液OD600 nm=0.3,10倍稀釋(約107 CFU·mL-1),腹腔注射途徑攻毒小鼠,100 μL·只-1。感染6、24、48和72 h處死小鼠,取肝和脾,經(jīng)勻漿、稀釋,涂布XLD平板,37 ℃培養(yǎng)24 h后細(xì)菌計數(shù)。動物試驗按照河北工程大學(xué)動物倫理委員會批準(zhǔn)方案進(jìn)行。
1.8 RNA-seq
過夜菌WT、ΔgreAΔgreB、ΔgreA、ΔgreB以1∶100比例分別轉(zhuǎn)接3瓶100 mL LB培養(yǎng)基,培養(yǎng)至細(xì)菌OD600 nm=0.6,利用細(xì)胞/細(xì)菌總RNA提取試劑盒分別提取細(xì)菌總RNA,經(jīng)超微量分光光度計定量合格后,委托華大生物科技有限公司(武漢)測序和分析,測序平臺采用MGISEQ2000(PE150測序)。選取WT與ΔgreA或ΔgreAΔgreB與ΔgreB測序數(shù)據(jù)進(jìn)行比較,通過基于負(fù)二項分布模型的DESeq2方法,以Plt;0.05且log2FoldChange≥1為標(biāo)準(zhǔn)篩選差異表達(dá)基因,所得P值經(jīng)Bonferroni校正。
1.9 數(shù)據(jù)分析
統(tǒng)計學(xué)分析采用單因素方差分析,圖表繪制采用GraphPad Prism 9軟件。如無特別說明,圖表數(shù)據(jù)均為“平均值±標(biāo)準(zhǔn)差(x±s)”。*. Plt;0.05; **.Plt;0.01; ***. Plt;0.001。
2 結(jié) 果
2.1 greA基因?qū)δc炎沙門菌體外生長的影響
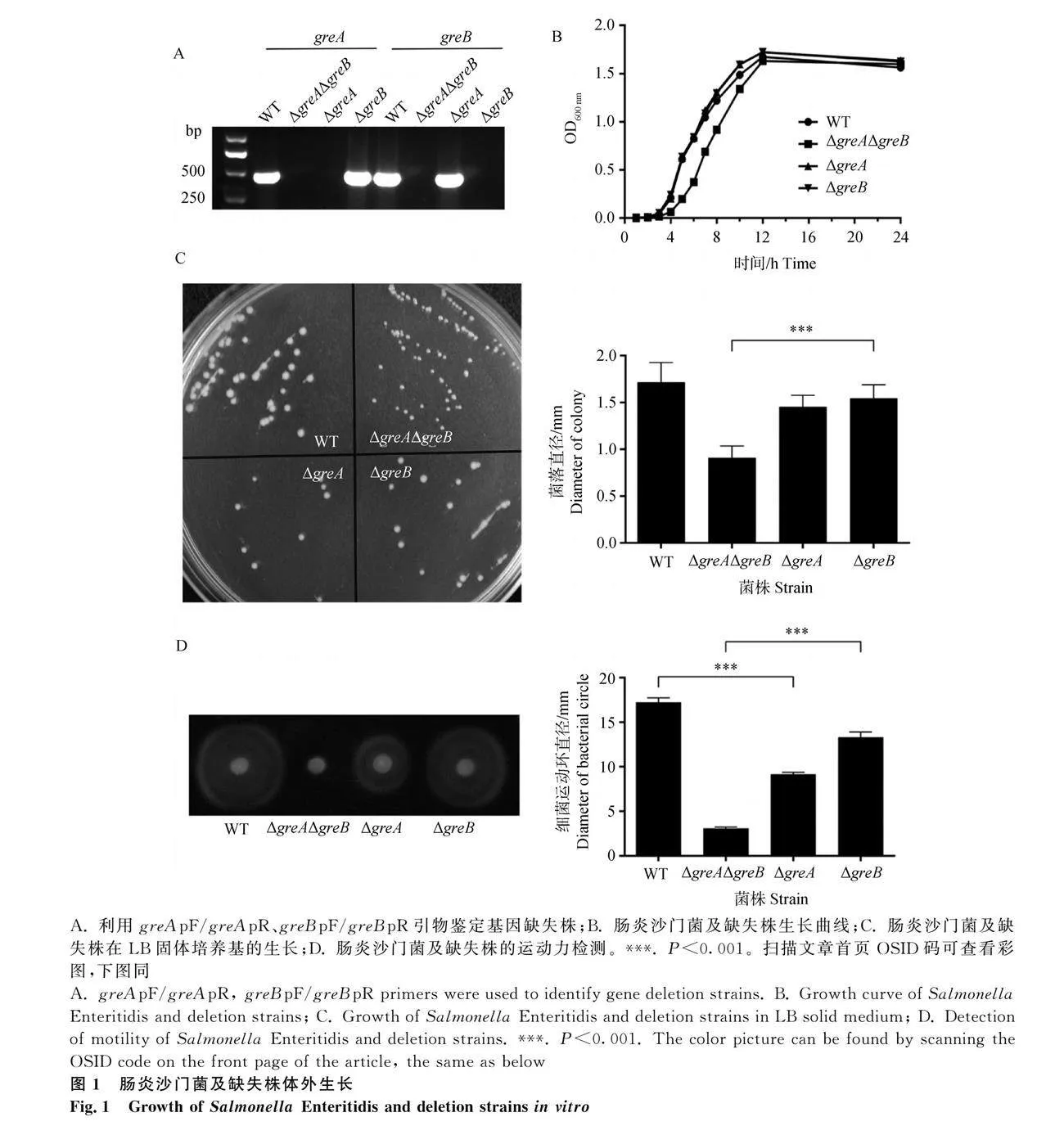
以WT為親本株,通過λ-Red重組系統(tǒng)構(gòu)建了ΔgreAΔgreB、ΔgreA、ΔgreB。PCR結(jié)果顯示,ΔgreAΔgreB未檢測到greA和greB基因,ΔgreA未檢測到greA基因、ΔgreB未檢測到greB基因(圖1A)。
液體培養(yǎng)基中,ΔgreAΔgreB對數(shù)期生長速度略緩于ΔgreB,而在平臺期又可達(dá)到同一水平(圖1B)。這與固體培養(yǎng)基上培養(yǎng)的結(jié)果類似,腸炎沙門菌及缺失株在LB固體培養(yǎng)基的形態(tài)一致,ΔgreAΔgreB單菌落直徑顯著小于ΔgreB(圖1C)。
從運動環(huán)照片,可較為直觀地觀察到基因缺失后,腸炎沙門菌運動能力下降。測量運動環(huán)直徑可知,ΔgreAΔgreB運動力比ΔgreB大幅下降(Plt;0.001),WT與ΔgreA間也存在極顯著差異(圖1D)。
2.2 greA基因?qū)δc炎沙門菌環(huán)境適應(yīng)性的影響
通過實驗室條件模擬抑菌環(huán)境,檢測其生存能力。在1 mmol·L-1 H2O2中,ΔgreAΔgreB與ΔgreB相比,其生存率提升了2.5倍(Plt;0.001)。較之WT菌,ΔgreA中也有類似的提升(Plt;0.05)(圖2A)。在酸性環(huán)境中,腸炎沙門菌親本株與缺失株存活率無差異(圖2B)。37、42 ℃條件下,各濃度腸炎沙門菌及缺失株均可生長,48 ℃時各菌株均被抑制(圖2C)。
利用結(jié)晶紫染色法測定生物被膜,結(jié)果顯示,在48、72 h時,所有缺失株生物被膜形成能力均高于親本株。其中,ΔgreAΔgreB的生物被膜形成能力顯著高于ΔgreB,提升約2倍(Plt;0.001)。WT與ΔgreA雖無差異性,但后者生物被膜形成能力高于WT(圖2D)。
2.3 greA基因?qū)δc炎沙門菌細(xì)胞感染的影響
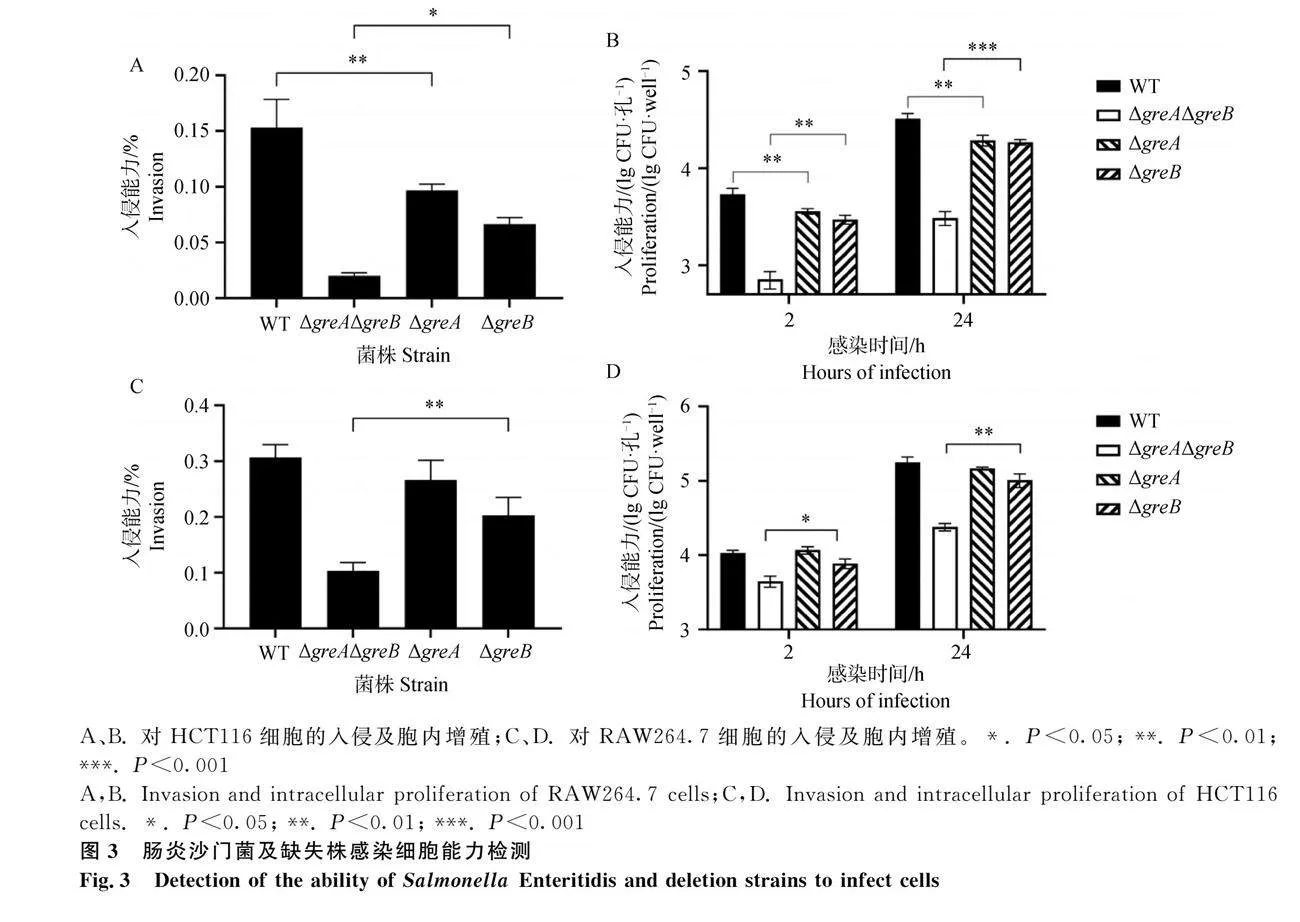
腸炎沙門菌及缺失株感染細(xì)胞,以探究greA基因?qū)θ肭旨?xì)胞及胞內(nèi)增殖能力的影響。結(jié)果顯示,缺失株侵襲細(xì)胞的能力均呈現(xiàn)下降趨勢。入侵能力方面,較之ΔgreAΔgreB,ΔgreB入侵上皮細(xì)胞的能力提升3倍(Plt;0.05)(圖3A),入侵巨噬細(xì)胞的能力提升2倍(Plt;0.01)(圖3C);胞內(nèi)增殖方面,ΔgreAΔgreB與ΔgreB在兩種細(xì)胞中的菌量均有顯著差異(圖3B~D)。WT與ΔgreA僅在HCT116細(xì)胞中存在顯著性差異,前者入侵及增殖能力顯著高于后者(Plt;0.01)。從2 h培養(yǎng)至24 h,各菌株的增殖倍數(shù)存在差異,增殖倍數(shù)大小比較:ΔgreBgt;ΔgreAΔgreB,WTgt;ΔgreA。
2.4 greA基因?qū)δc炎沙門菌致病力的影響
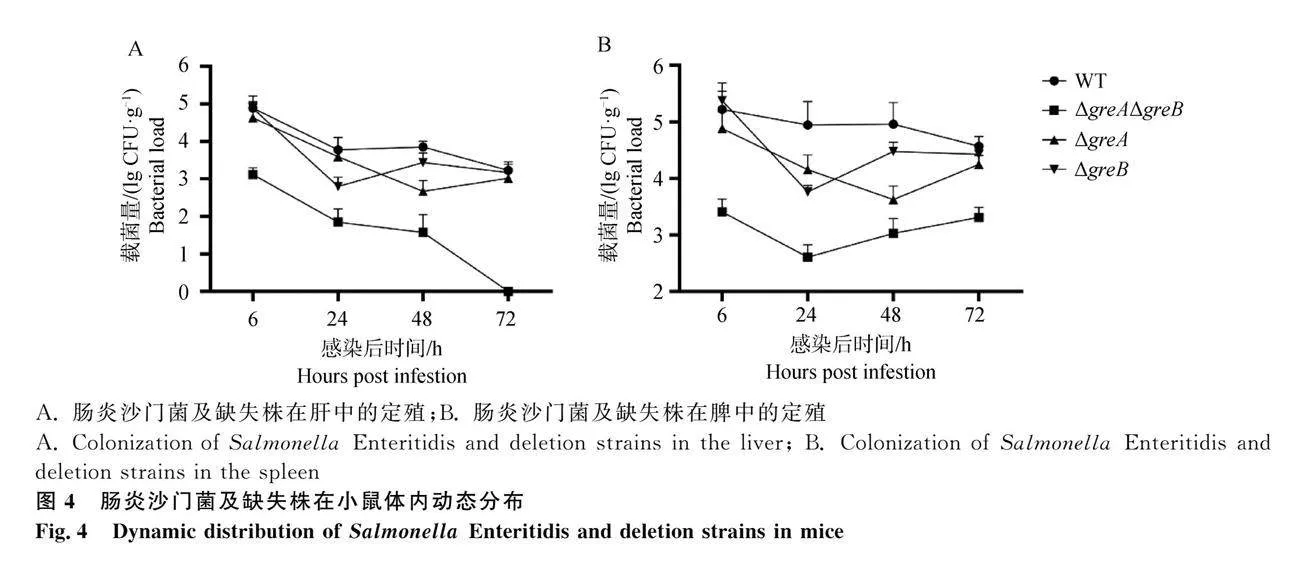
脾是腸炎沙門菌感染的主要靶器官,腹腔注射沙門菌1.1×106 CFU后,WT在脾的載菌量達(dá)到1.6×105 CFU·g-1,并且在72 h內(nèi)一直維持在較高水平。在肝和脾,ΔgreAΔgreB各時間點的細(xì)菌載量均顯著低于ΔgreB,并且ΔgreAΔgreB在72 h未從肝中檢出。相較于WT,ΔgreA在小鼠器官的定殖率下降幅度較小,尤其是在6與72 h時,二者的器官載量幾乎在同一水平(圖4)。
2.5 RNA-seq分析
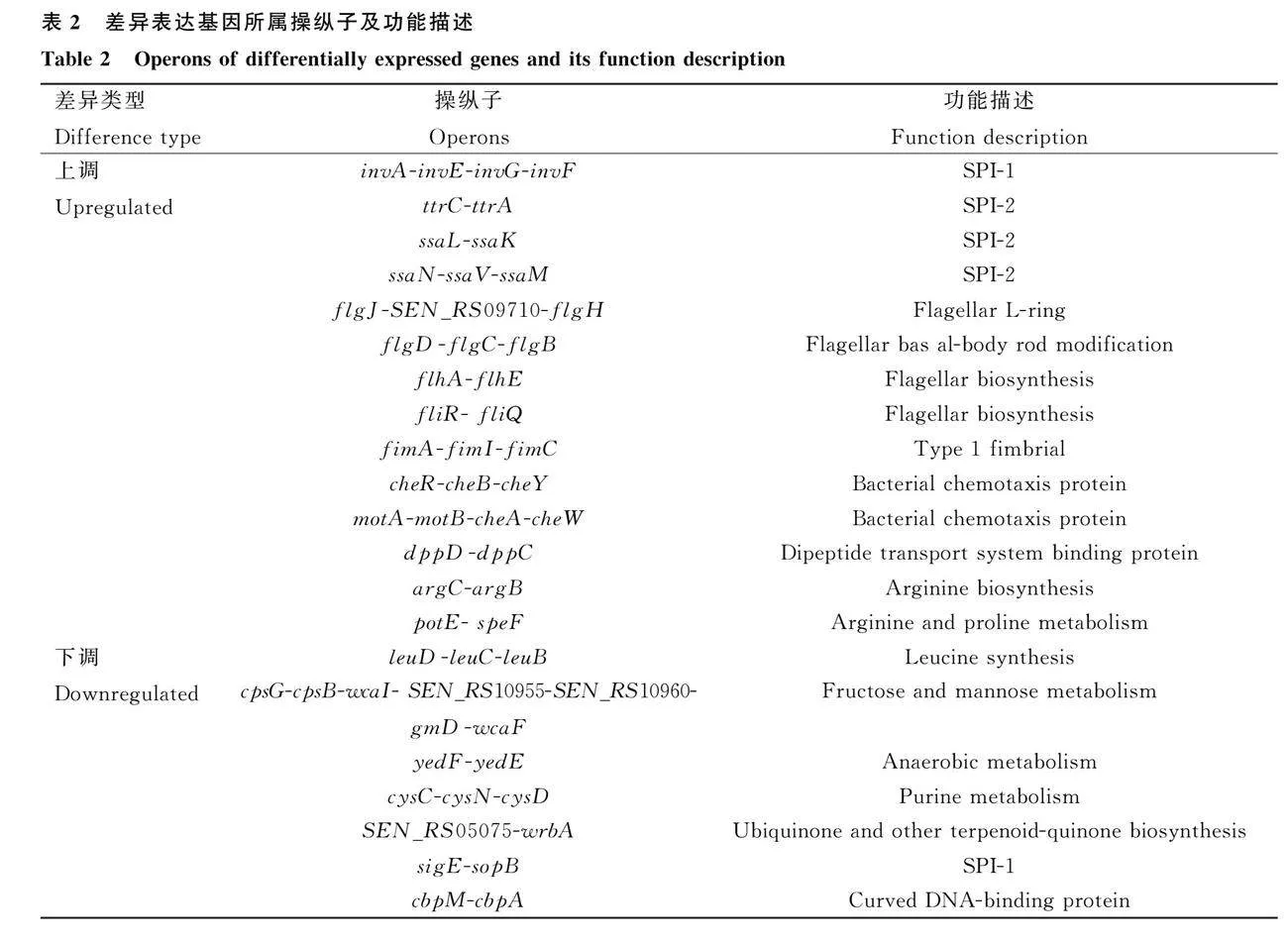
RNA-seq原始數(shù)據(jù)過濾后,Q20gt;96%,Q30gt;90%,且G、C含量大于54%,可定位到參考基因組上的序列占比在96%以上,表明試驗無污染且測序數(shù)據(jù)可靠。ΔgreAΔgreB與ΔgreB中共有107個差異表達(dá)基因,約占腸炎沙門菌基因數(shù)量的2.5%,其中有54個基因上調(diào),主要集中于與沙門菌鞭毛合成相關(guān)的flh、flg、fli操縱子,細(xì)胞黏附相關(guān)的fim操縱子、沙門菌入侵細(xì)胞相關(guān)的inv操縱子及與氨基酸合成及代謝相關(guān)的arg、potE-speF操縱子;53個基因下調(diào),主要集中于與SPI-1效應(yīng)蛋白相關(guān)的sigE-sopB操縱子,厭氧代謝相關(guān)的yed操縱子及氨基酸合成相關(guān)的leu操縱子(表2)。
在WT與ΔgreA中75個差異表達(dá)基因,將其與ΔgreAΔgreB與ΔgreB的差異表達(dá)基因作交集處理,共發(fā)現(xiàn)18個差異表達(dá)基因(圖5)。KEGG通路分析顯示,差異表達(dá)基因主要集中于外源物質(zhì)的生物降解和代謝、氨基酸代謝、碳水化合物代謝、能量代謝、信號轉(zhuǎn)導(dǎo)、跨膜運輸?shù)韧贰?/p>
3 討 論
腸炎沙門菌及缺失株體外培養(yǎng)過程中,ΔgreAΔgreB生長速度、菌落直徑均小于ΔgreB,表明greA基因缺失,延緩了腸炎沙門菌的生長速度。在各溫度條件下,腸炎沙門菌及缺失株敏感性一致,但在48℃并未失活,恢復(fù)至適宜溫度其生長可達(dá)正常水平。同樣地,酸性環(huán)境可抑制腸炎沙門菌的生存,但GreA蛋白對此并無抵抗能力。
鞭毛是細(xì)菌重要的運動器官,與致病力密切相關(guān),對其在宿主腸道定殖和形成全身感染至關(guān)重要[18-19]。在greA基因缺失后,腸炎沙門菌的運動力大幅度下降。細(xì)菌的運動能力下降,有利于生物被膜的形成[20]。由于鞭毛、菌毛、細(xì)胞黏附素的存在,細(xì)菌得以在物體表面形成生物被膜,是其抵抗惡劣環(huán)境及抗生素等殺菌劑的一種重要機(jī)制[21-23]。經(jīng)培養(yǎng)48、72 h,在WT與ΔgreA、ΔgreB與ΔgreAΔgreB中,前者生物被膜形成能力均弱于后者,表明GreA蛋白負(fù)調(diào)控腸炎沙門菌生物被膜的形成。唐正露等[24]發(fā)現(xiàn)ΔhilD基因缺失株生物被膜形成能力也觀察到類似情況,而Gre因子對hilD的表達(dá)具有調(diào)控作用[5]。腸炎沙門菌在體外生存或入侵到機(jī)體內(nèi)時或可進(jìn)入氧化環(huán)境,以H2O2模擬該情況,腸炎沙門菌及缺失株處于該環(huán)境1 h,存在greA基因的腸炎沙門菌生存率大幅度下降,提示GreA蛋白降低了腸炎沙門菌的抗氧化能力。生物被膜變化趨勢與各菌株在H2O2的存活率一致,故推測GreA蛋白可能通過調(diào)控腸炎沙門菌生物被膜形成相關(guān)的flg、flh等操縱子,從而影響其抗氧化能力。
腸炎沙門菌大多以水、食物等途徑經(jīng)口進(jìn)入機(jī)體,作為一種胞內(nèi)菌,主要黏附于腸上皮細(xì)胞,隨即入侵該細(xì)胞引起吞噬細(xì)胞浸潤,之后巨噬細(xì)胞和嗜異性細(xì)胞吞噬腸炎沙門菌,最終腸炎沙門菌以巨噬細(xì)胞作為載體擴(kuò)散至各器官甚至引起全身感染[25]。腸炎沙門菌的毒力主要依賴于毒力島-1(SPI-1)和毒力島-2(SPI-2)兩大染色體基因簇的存在,分別介導(dǎo)了沙門菌入侵和在宿主細(xì)胞內(nèi)增殖的能力,每個毒力島又分別編碼了Ⅲ型分泌系統(tǒng)(T3SS)以及毒力調(diào)節(jié)因子[26]。腸炎沙門菌對腸上皮細(xì)胞和巨噬細(xì)胞的入侵以及胞內(nèi)增殖能力是引起宿主感染的關(guān)鍵。Gaviria-cantin等[5]發(fā)現(xiàn)Gre因子影響鼠傷沙門菌對上皮細(xì)胞HT-29及Caco-2細(xì)胞的侵襲。本研究中,ΔgreAΔgreB對上皮細(xì)胞HCT116和巨噬細(xì)胞RAW264.7的入侵以及胞內(nèi)增殖能力均大幅下降,但greA基因的回補(bǔ)又使其細(xì)胞侵襲能力顯著提升。Ⅰ型菌毛具有黏附宿主細(xì)胞的功能,對細(xì)菌侵襲細(xì)胞具有重要意義,其基因主要由fim操縱子控制[27-28]。RNA-seq檢測顯示,ΔgreAΔgreB與ΔgreB中,fim操縱子顯著上調(diào)。這提示GreA蛋白可能提高腸炎沙門菌感染細(xì)胞的能力。
急性攻毒試驗中,ΔgreAΔgreB短時間內(nèi)在肝中基本清除,作為疫苗候選株不存在垂傳或污染產(chǎn)銷鏈的風(fēng)險。各菌株在小鼠臟器的細(xì)菌載量整體上均呈下降趨勢,其中WT菌株在肝和脾的細(xì)菌載量始終維持在較高水平,相較之下,ΔgreAΔgreB在各時間點的定殖率均大幅度降低,而ΔgreB定殖率介于以上二者之間,提示GreA蛋白可提升腸炎沙門菌在宿主體內(nèi)定殖能力。greA和greB基因高度同源,且存在功能上的重疊[11-12]。在對巨噬細(xì)胞的入侵及器官定殖中,WT與ΔgreA無差異,可能是由于ΔgreA中的greB基因通過影響ssa、inv、fim等操縱子的表達(dá),對greA基因缺失引起的腸炎沙門菌功能下降發(fā)生了代償行為。
以RNA-seq初步探索其分子致病機(jī)制,在WT與ΔgreA、ΔgreAΔgreB與ΔgreB均有100個差異表達(dá)基因,主要集中于氨基酸代謝與生物合成、碳水化合物代謝、雙組分系統(tǒng)等通路。根據(jù)基因功能發(fā)現(xiàn)GreA因子可能通過調(diào)控鞭毛合成、細(xì)胞黏附、細(xì)胞入侵、SPI-1等基因的表達(dá),進(jìn)而影響相關(guān)腸炎沙門菌生物學(xué)表型。
4 結(jié) 論
GreA因子對腸炎沙門菌的多種毒力相關(guān)基因具有調(diào)控作用,影響包括運動力、抗氧化能力等多種生物學(xué)表型,在細(xì)胞侵襲及動物致病力方面發(fā)揮重要功能,本研究結(jié)果進(jìn)一步完善了腸炎沙門菌的分子致病機(jī)制,為GreA因子的深入研究以及相關(guān)弱毒疫苗和藥物的研發(fā)提供一定的理論基礎(chǔ)。
參考文獻(xiàn)(References):
[1] BASIRI N, ZAREI M, KARGAR M, et al. Effect of plasma-activated water on the biofilm-forming ability of Salmonella enterica serovar enteritidis and expression of the related genes[J]. Int J Food Microbiol, 2023, 406:110419.
[2] FERRARI R G, ROSARIO D K A, CUNHA-NETO A, et al. Worldwide epidemiology of Salmonella serovars in animal-based foods: a meta-analysis[J]. Appl Environ Microbiol, 2019, 85(14):e00591-19.
[3] 李 宇, 馮忠義, 任艷茹, 等. 腸炎沙門菌感染對蛋雞肝臟ATP5G3、ND2基因表達(dá)的影響[J]. 山東畜牧獸醫(yī), 2023, 44(4):1-4.
LI Y, FENG Z Y, REN Y R, et al. Effects of Salmonella enteritidis infection on ATP5G3 and ND2 gene expression in liver of laying hens[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2023, 44(4):1-4. (in Chinese)
[4] ZAHOOR I, GHAYAS A, BASHEER A. Genetics and genomics of susceptibility and immune response to necrotic enteritis in chicken: a review[J]. Mol Biol Rep, 2018, 45(1):31-37.
[5] GAVIRIA-CANTIN T, EL MOUALI Y, LE GUYON S, et al. Gre factors-mediated control of hilD transcription is essential for the invasion of epithelial cells by Salmonella enterica serovar typhimurium[J]. PLoS Pathog, 2017, 13(4):e1006312.
[6] DYLEWSKI M, FERNNDEZ-COLL L, BRUHN-OLSZEWSKA B, et al. Autoregulation of greA expression relies on GraL rather than on greA promoter region[J]. Int J Mol Sci, 2019, 20(20):5224.
[7] ORLOVA M, NEWLANDS J, DAS A, et al. Intrinsic transcript cleavage activity of RNA polymerase[J]. Proc Natl Acad Sci U S A, 1995, 92(10):4596-4600.
[8] NOGALES J, CAMPOS R, BENABDELKHALEK H, et al. Rhizobium tropici genes involved in free-living salt tolerance are required for the establishment of efficient nitrogen-fixing symbiosis with Phaseolus vulgaris[J]. Mol Plant Microbe Interact, 2002, 15(3):225-232.
[9] FENG S, LIU Y, LIANG W, et al. Involvement of transcription elongation factor GreA in Mycobacterium viability, antibiotic susceptibility, and intracellular fitness[J]. Front Microbiol, 2020, 11:413.
[10] LI K, JIANG T Y, YU B, et al. Transcription elongation factor GreA has functional chaperone activity[J]. PLoS One, 2012, 7(12):e47521.
[11] LAPTENKO O, LEE J, LOMAKIN I, et al. Transcript cleavage factors GreA and GreB act as transient catalytic components of RNA polymerase[J]. EMBO J, 2003, 22(23):6322-6334.
[12] VINELLA D, POTRYKUS K, MURPHY H, et al. Effects on growth by changes of the balance between GreA, GreB, and DksA suggest mutual competition and functional redundancy in Escherichia coli[J]. J Bacteriol, 2012, 194(2):261-273.
[13] 胡凌蕓, 丁睿清, 王 菲, 等. 腸炎沙門菌C50041ΔpagN缺失株的構(gòu)建及其生物學(xué)特性分析[J]. 中國獸醫(yī)科學(xué), 2023, 53(8):1019-1025.
HU L Y, DING R Q, WANG F, et al. Construction of pagN gene deletion strain of Salmonella enteritidis and its biochemical characteristics analysis[J]. Chinese Veterinary Science, 2023, 53(8):1019-1025. (in Chinese)
[14] LI J, OVERALL C C, JOHNSON R C, et al. ChIP-Seq analysis of the σE regulon of Salmonella enterica serovar typhimurium reveals new genes implicated in heat shock and oxidative stress response[J]. PLoS One, 2015, 10(9):e0138466.
[15] STEPANOVIC' S, VUKOVIC' D, DAKIC' I, et al. A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. J Microbiol Methods, 2000, 40(2):175-179.
[16] ESPINOZA R A, SILVA-VALENZUELA C A, AMAYA F A, et al. Differential roles for pathogenicity islands SPI-13 and SPI-8 in the interaction of Salmonella enteritidis and Salmonella Typhi with murine and human macrophages[J]. Biol Res, 2017, 50(1):5.
[17] 崔國林, 李冰心, 張寒琪, 等. FTN_0109蛋白對土拉弗朗西斯菌致病力的影響[J]. 畜牧獸醫(yī)學(xué)報, 2020, 51(2):337-345.
CUI G L, LI B X, ZHANG H Q, et al. The effect of the protein FTN_0109 on the virulence of Francisella tularensis[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(2):337-345. (in Chinese)
[18] DE OLIVEIRA BARBOSA F, DE FREITAS NETO O C, BATISTA D F A, et al. Contribution of flagella and motility to gut colonisation and pathogenicity of Salmonella enteritidis in the chicken[J]. Braz J Microbiol, 2017, 48(4):754-759.
[19] 王 俊, 李 軍, 崔國林. FliC蛋白R91S突變對腸炎沙門菌鞭毛形態(tài)和小鼠體內(nèi)定植的影響[J]. 畜牧獸醫(yī)學(xué)報, 2022, 53(2):607-617.
WANG J, LI J, CUI G L. The effect of R91S mutation in FliC on the flagellar shape and Salmonella enteritidis colonization in BALB/c mice[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(2):607-617. (in Chinese)
[20] 李莉莉, 陳凱風(fēng), 陳 兵, 等. STM1827在鼠傷寒沙門菌生物被膜形成及環(huán)境應(yīng)激中的調(diào)控作用[J]. 畜牧獸醫(yī)學(xué)報, 2023, 54(12):5207-5217.
LI L L, CHEN K F, CHEN B, et al. Regulatory role of STM1827 in the biofilm formation and environmental stress of Salmonella typhimurium[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(12):5207-5217. (in Chinese)
[21] 劉 琳, 譚小娟, 賈愛群. 細(xì)菌群體感應(yīng)與細(xì)菌生物被膜形成之間的關(guān)系[J]. 微生物學(xué)報, 2012, 52(3):271-278.
LIU L, TAN X J, JIA A Q. Relationship between bacterial quorum sensing and biofilm formation—a review[J]. Acta Microbiologica Sinica, 2012, 52(3):271-278. (in Chinese)
[22] DIDOUH N, KHADIDJA M, CAMPOS C, et al. Assessment of biofilm, enzyme production and antibiotic susceptibility of bacteria from milk pre- and post-pasteurization pipelines in Algeria[J]. Int J Food Microbiol, 2023, 407:110389.
[23] DULA S, AJAYEOBA T A, IJABADENIYI O A. Bacterial biofilm formation on stainless steel in the food processing environment and its health implications[J]. Folia Microbiol (Praha), 2021, 66(3):293-302.
[24] 唐正露, 曹 堃, 張 麗, 等. 腸炎沙門氏菌ssrAB、hilA、hilD基因缺失菌株的構(gòu)建及其生物學(xué)特性[J]. 微生物學(xué)通報, 2021, 48(4):1195-1205.
TANG Z L, CAO K, ZHANG L, et al. Construction and characterization of ssrAB, hilA, hilD-deficient mutants of Salmonella enteritidis[J]. Microbiology China, 2021, 48(4):1195-1205. (in Chinese)
[25] 董曉璐, 秦曉杰, 劉陽泰, 等. 食源性沙門氏菌在人體胃腸道中耐受及致病機(jī)制研究進(jìn)展[J]. 食品與發(fā)酵工業(yè), 2021, 47(24):286-292.
DONG X L, QIN X J, LIU Y T, et al. Research progress on tolerance and pathogenic mechanism of foodborne Salmonella spp." in human gastrointestinal tract[J]. Food and Fermentation Industries, 2021, 47(24):286-292. (in Chinese)
[26] BANDA M M, PEREZ-MORALES D, ZAVALA-ALVARADO C, et al. Two additional connections between the transcriptional programs controlling invasion and intracellular replication of Salmonella:HilD-SprB positively regulates phoP and slyA[J]. J Bacteriol, 2022, 204(11):e0020422.
[27] 續(xù)晨冉. 小檗堿對沙門氏菌Ⅰ型菌毛及其細(xì)菌生物膜的抑制作用[D]. 長沙:湖南師范大學(xué), 2021.
XU C R. Inhibitory effect of berberine on Salmonella type I fimbriae and its biofilm[D]. Changsha: Hunan Normal University, 2021. (in Chinese)
[28] KATANI R, KUDVA I T, SRINIVASAN S, et al. Strain and host-cell dependent role of type-1 fimbriae in the adherence phenotype of super-shed Escherichia coli O157:H7[J]. Int J Med Microbiol, 2021, 311(4):151511.
(編輯 白永平)

