鎘積累對艾納香內生菌群落結構和共發生網絡的影響

摘 要:" 為探究器官鎘(Cd)積累對艾納香內生菌的影響,該文采用16S rRNA基因高通量測序技術結合分子生態網絡分析,研究不同外源鎘處理(0、2.0 mg·kg-1)下艾納香根、莖、葉Cd積累對內生菌群落結構特征的影響。結果表明:(1)與未添加外源Cd(0 mg·kg-1,Cd0)相比,Cd(2.0 mg·kg-1,Cd2)處理促進了植株生長,根、莖、葉中Cd積累量順序為葉(16.75 mg·kg-1)gt;莖(11.99 mg·kg-1)gt;根(3.96 mg·kg-1)。(2)α多樣性分析表明,各器官內生菌豐富度(Sobs指數、Ace指數和Chao1指數)和多樣性(Shannon指數和Simpson指數)均以根最高,莖次之,葉最低,并且Cd2處理各器官內生菌豐富度和多樣性均高于Cd0處理。(3)在門水平上,兩個處理根、莖、葉內生菌均以變形菌門、放線菌門和厚壁菌門為優勢菌群;在屬水平上,代爾夫特菌是Cd0和Cd2處理各器官的主要菌屬,相對豐度分別為53.0%~92.7%和57.1%~89.2%;艾納香根、莖、葉內生菌群落結構有一定的相似性,Cd2處理提高了根、莖、葉共有內生菌屬的比例及各器官(根除外)獨有內生菌屬比例。(4)線性判別分析(LEfSe)表明,相同處理不同器官間及不同處理相同器官間內生菌屬存在差異。(5)冗余分析(RDA)發現,根際土壤Cd含量、器官Cd含量與內生菌群落結構組成有明顯的相關性。(6)共發生網絡分析結果顯示,Cd積累使艾納香根、葉內生菌共發生網絡變得復雜且增強了根、莖物種間的競爭作用和葉物種間的協同共生作用。綜上認為,外源Cd處理影響了艾納香各器官內生菌群落結構及相互作用模式。
關鍵詞: 艾納香, 內生菌, 鎘(Cd), 16S rRNA, 共發生網絡
中圖分類號:" Q938.1
文獻標識碼:" A
文章編號:" 1000-3142(2024)10-1878-16
收稿日期:" 2024-02-22
接受日期:" 2024-03-19
基金項目:" 國家自然科學基金(31960265)。
第一作者: 陳嬌嬌(1997—),碩士研究生,研究方向為環境生物學,(E-mail)2681972430@qq.com。
*通信作者:" 王俊麗,博士,副教授,主要從事環境生物學相關研究,(E-mail)411395583@qq.com。
Effects of cadmium accumulation on the structure and
co-occurrence network of endophytic bacterial
community in Blumea balsamifera
CHEN Jiaojiao, REN Jianguo, WANG Junli*
( Key Laboratory of Environmental Pollution Monitoring and Disease Control, Ministry of Education,
School of Public Health, Guizhou Medical University, Guiyang 561113, China )
Abstract:" To probe into the impacts of organ cadmium accumulation on endophytic bacteria in Blumea balsamifera, the methods of high-throughput sequencing of 16S rRNA gene V3-V4 region and molecular ecological network analysis were employed to study the effects of Cd accumulation in root, stem and leaf of B. balsamifera on the community characteristics of endophytic bacteria under different exogenous cadmium treatments (0 and 2.0 mg·kg-1). The results were as follows: (1) In comparison with the control group without exogenous cadmium addition (0 mg·kg-1, Cd0), the treatment group with cadmium spiking (2.0 mg·kg-1, Cd2) in soils promoted plant growth and the cumulative Cd contents in root, stem and leaf, with the order of leaf (16.75 mg·kg-1) gt; stem (11.99 mg·kg-1) gt; root (3.96 mg·kg-1). (2) α diversity analysis showed that the endophytic bacteria richness (Sobs, Ace and Chao1 indices) and diversity (Shannon and Simpson indices) for organs were the highest in root, followed by stem and leaf under Cd0 and Cd2 treatments. Additionally, the indices of richness and diversity of endophytic bacteria for each organ under Cd2 treatment were superior to those under Cd0. (3) At the phylum level, Proteobacteria, Actinobacteriota and Firmicutes were the dominant bacterial phyla in all the organs for both treatments; at the genus level, Delftia was the main bacterial genus with the relative abundance ranged from 53.0% to 92.7% and 57.1% to 89.2% in the plant organs of Cd0 and Cd2, respectively; certain similarities existed among the endophytic bacterial community structures of root, stem and leaf of B. balsamifera, and Cd2 increased the proportion of mutual endophytic bacterial genera in root, stem and leaf and that of unique endophytic ones in each organ (except for the root). (4) Linear discriminant analysis Effect Size (LEfSe) analysis showed that there existed the differences on endophytic bacterial genera residing in different organs within the same treatment and also the same organ between treatments. (5) Redundancy analysis (RDA) showed that the contents of rhizosphere soil Cd and plant organ Cd were significantly correlated with the composition of endophytic bacterial community. (6) Co-occurrence network analysis clarified that cadmium accumulation in B. balsamifera complicated the interaction network of endophytic bacteria occurring in root and leaf, and enhanced the competition among endophytic bacterial species in root and stem, and the symbiosis in leaf. In summary, exogenous Cd treatment affected the community structure and interaction mode of endophytic bacteria in B. balsamifera organs.
Key words: Blumea balsamifera, endophytic bacteria, cadmium(Cd), 16S rRNA, co-occurrence network
鎘(Cd)是我國農田重金屬污染元素之一,是植物非必需元素。隨著工業化的發展,Cd通過汽車尾氣、水泥廠、農用化肥和冶煉廠粉塵等途徑排放到環境中,造成環境污染(Zhou et al., 2017;Lin et al., 2022)。Cd污染導致植物營養缺乏、光合強度降低、氧化應激發生等,表現為植物生長受抑制,嚴重會導致植物死亡(張星雨等,2021)。中藥材是中醫臨床防病治病的物質基礎,在臨床治療中占有重要地位,其質量好壞直接關系著臨床療效。已有研究表明,Cd在多種中藥材中有超標的風險,并且對中草藥生長發育及活性成分積累均有抑制作用(蒲翔等,2019;張德林等,2019)。
植物內生菌是一類存在于植物體內,不對寄主植物產生傷害的微生物類群(Hardoim et al., 2008)。在長期協同進化過程中,內生菌與宿主植物形成了互利共生的友好關系,表現為宿主植物為內生菌提供穩定的生存環境和營養物質,而內生菌則通過分泌代謝物調節宿主植物的生理活動,進而促進植物從土壤環境中汲取養分(姚雨軒,2022)。當寄主植物遭遇非生物(Cd2+)脅迫時,內生菌主要通過激素調節(He et al., 2017)、增強光合作用(Zhang et al., 2023)、增加蛋白質含量(Zhou et al., 2021)、增強抗氧化系統(Kuramshina et al., 2018)、強化根系細胞壁木質素沉積(Maslennikova et al., 2023)以及與宿主協同作用(Xie et al., 2023)等方式緩解重金屬脅迫;或通過胞內積累、胞外固定等將有毒重金屬轉化成低毒或無毒形式(Long et al., 2021);還可通過分泌鐵載體(Nakamoto et al., 2021)、有機酸(Li et al., 2017)、氨基酸(Latif et al., 2016)和提高土壤pH (Wang et al., 2022)等降低重金屬的植物有效性;也可通過調節植物對重金屬吸收、轉運基因的表達,從而降低或增強植物對重金屬的積累(Cheng et al., 2021;Qian et al., 2022)。
已有研究表明,超積累植物不同器官或組織內細菌群落組成與其重金屬積累量密切相關(羅繼鵬等,2018)。Cd積累會對原有內生菌產生選擇性壓力,導致一些不能適應Cd脅迫的內生菌群落數量減少或消失(鄒淑華等,2019)。姚雨軒(2022)研究指出,重金屬污染水平是影響刺槐(Robinia pseudoacacia)內生菌群落組成差異的關鍵因子之一,隨著重金屬含量增加,內生菌群落多樣性(Shannon指數)降低,而豐富度(Chao1指數)增加,同時,內生菌共現網絡模塊的平均度、聚類系數、網絡節點密度和連接邊數均隨重金屬含量增加而減少。Cu-Cd礦區和良田蓖麻(Ricinus communis)內生細菌群落多樣性和豐富度研究結果表明,無Cd區蓖麻內生細菌群落的多樣性和豐富度均大于Cd污染區(Li et al., 2023)。在鄒淑華等(2019)研究中,耐Cd型(HE)東南景天(Sedum alfredii)葉片內生細菌的豐富度在Cd0(未添加Cd)土壤上最大,而莖和根系內生細菌的豐富度在Cd5(土壤Cd添加水平為5 mg·kg-1)土壤上最大。另外,器官內生菌共發生網絡結構受重金屬的積累量影響,如刺槐根中因積累了大量的Cd2+,導致其根部共發生網絡結構較地上部簡單(姚雨軒,2022)。但在不同Zn污染水平上,東南景天莖和葉不僅積累大量的Zn,而且其內生菌豐富度大多高于根部(陸麗婷,2018)。
艾納香(Blumea balsamifera)是貴州省道地藥材,可用于治療鼻竇炎、絞痛、咳嗽、腎結石、流感等疾病(Widhiantara amp; Jawi, 2021)。艾納香對Cd具有富集作用,富集系數為2.5~15.8,各器官Cd積累量表現為葉gt;莖gt;根(梁娟等,2016;陳子涵等,2022),由于定殖于植物器官、組織中與植物生長、生理密切相關的內生菌通常具有耐重金屬性(Mufti et al., 2015),因此有必要探究不同器官Cd積累量對其內生菌群落結構的影響,為從內生菌角度探討不同器官耐Cd差異性提供新思路。因此,本研究設置了2個不同實驗組(Cd0和Cd2),利用16S rRNA基因高通量測序技術進行艾納香根、莖、葉內生菌群落組成分析,并結合內生菌分子生態網絡分析,以了解Cd積累對內生菌群落結構特征變化的影響,以及與器官Cd積累密切相關的內生細菌種類,為今后開發利用功能內生菌治理Cd污染土壤提供科學依據。
1 材料與方法
1.1 艾納香植株培育
試驗幼苗選自貴州省羅甸縣艾納香種植基地2~3個月幼苗,試驗土壤選自貴州醫科大學南校區農用土壤,基本理化性質為pH=7.54,速效氮4.15 mg·kg-1,有機磷0.74 mg·kg-1,速效鉀87.40 mg·kg-1,有機質1.31 mg·kg-1,土壤Cd的背景值為0.031 mg·kg-1。本試驗采用盆栽培養,設置兩個處理 [無Cd處理組(Cd0,種植土壤無外源Cd添加)和Cd處理組(Cd2,種植土壤Cd添加濃度為2.0 mg·kg-1)],每個處理組6個重復,每盆分裝5 kg試驗土,種植大小一致的幼苗一株,共12株。
1.2 樣本采集
盆栽培養170 d后,每處理組各采收3株生長健康的艾納香(無菌斑、蟲咬缺口和機械損傷)植株連同土壤一并帶回實驗室,用軟毛刷收集植物根際土壤,并保存于-80 ℃。用自來水沖洗艾納香植株完畢后,室溫晾干,并將根、莖、葉分別稱其鮮重。一部分根、莖、葉樣品烘干至恒重、磨碎、過60目尼龍篩,儲存于干燥器中用于各器官Cd含量測定;一部分樣品進行表面消毒后用于內生菌DNA提取。
1.3 植株和土壤樣品的化學分析
參考陳子涵等(2022)的方法,分別稱取0.1 g植物樣品(根、莖、葉)及土樣,加入7 mL HNO3-H2O2(體積比V∶V=5∶2)酸泡過夜,再置于電熱板上150 ℃消解,消解至體積不足1 mL(呈澄清或淡黃色),冷卻、定容,用石墨爐原子吸收光譜儀(contrAA 700)測定Cd含量,進而計算各器官Cd質量分數。根際土壤Cd的測定參考《土壤環境質量標準》(夏家淇等,1995)。根據公式(1)、(2)計算轉移系數和富集系數。
富集系數=艾納香體內Cd含量/土壤中Cd含量(1)
轉移系數=艾納香地上部Cd含量/根部Cd含量(2)
1.4 樣本表面消毒
將采集的根、莖、葉樣品剪成大段(長約5 cm),無菌水徹底清洗后,先用75%酒精表面消毒(根1 min、莖和葉10 s),無菌蒸餾水漂洗1次,再用1.0% NaClO消毒3 min,然后用無菌水清洗3次,收集最后1次無菌水沖洗液,吸取100 μL涂布至LB培養基(胰蛋白胨10 g·L-1,酵母提取物5 g·L-1,氯化鈉10 g·L-1,瓊脂15g·L-1)平板恒溫(28 ℃)培養2~3 d,以檢查組織表面消毒是否徹底。將表面消毒徹底的樣本轉移到無菌研缽中,加入液氮研磨成粉狀,無菌轉移至滅菌EP管內。各處理組根、莖和葉樣品分別準備3份。
1.5 DNA提取和高通量測序
DNA提取采用FastDNA Spin Kit for Soil試劑盒(MP Biomedicals, USA),按照說明書的提取步驟進行,將提取得到的總DNA通過微量分光光度計(NanoDrop2 000,Thermo Fisher Scientific,USA)測定DNA濃度和純度。
采用引物338F:5′-ACTCCTACGGGAGGCAGC
AG-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′對16S rRNA基因的V3-V4區進行擴增,擴增體系:5×FastPfu Buffer 4 μL,2.5 mmol·L-1 dNTPs 2 μL,上游引物(5 μmol·L-1) 0.8 μL,下游引物(5 μmol·L-1) 0.8 μL,FastPfu DNA Polymerase 0.4 μL,BSA 0.2 μL,基因組DNA 10 ng,補ddH2O至20 μL。PCR反應體系:預變性95 ℃ 3 min,30個循環(變性95 ℃ 30 min,退火55 ℃ 30 s,延伸72 ℃ 45 s),穩定延伸72 ℃ 10 min,10 ℃保存直至反應結束。每個樣本3個重復,使用2%的瓊脂糖凝膠電泳分離PCR產物,使用AxyPrep DNA Gel Extraction Kit純化PCR產物,測序工作交由上海美吉生物醫藥科技有限公司完成。
1.6 高通量數據處理及分析
使用Fastp軟件和FLASH軟件對原始測序序列進行質控及拼接,過濾reads尾部質量值20以下的堿基,允許overlap區最大錯配比率為0.2,根據97%的相似度對序列進行操作分類單元(operational taxonomic unit,OTU)聚類,去除所有樣本中注釋到的葉綠體和線粒體序列,將所有樣本序列抽平至2 000,利用RDP classifier分類網站和Silva 16 rRNA基因數據庫進行OTU物種分類學注釋,置信度閾值為70%。計算α多樣性(Shannon指數、Simpson指數、Sobs指數、Chao1指數、Ace指數),并采用Wilxocon秩和檢驗進行α多樣性組間差異分析。用線性判別分析(Linear discriminant analysis Effect Size,LEfSe)確定同一處理不同器官間或不同處理組間相同器官屬水平差異顯著的內生細菌類群(LDA值gt;2)。使用基于歐氏距離的冗余分析(redundancy analysis, RDA)探討土壤Cd和器官Cd對艾納香細菌群落結構的影響。對各器官中所有屬(genus)間進行Spearman相關分析,得到相關系數矩陣和P值矩陣,并采用Benjamini and Hochberg 1 discovery rate (FDR)方法矯正上述計算中所得到的P值,根據屬間Spearman相關系數(|r|gt;0.7)和Plt;0.001作為閾值進行物種間共發生網絡圖構建。利用Gephi軟件(0.10.1)構建分子生態網絡(molecular ecological networks, MENs),并計算包括網絡平均連通度、網絡直徑、網絡密度、平均聚類系數、模塊化、模塊個數等在內的網絡拓撲屬性。
1.7 數據處理
使用SPSS 26.0和Excel進行數據的整理分析和繪圖,實驗數據用平均值±標準差。服從正態分布和滿足方差齊性時,采用t檢驗、方差分析(ANOVA)法分析數據差異,不滿足正態分布和方差齊性時采用非參數Wilcoxon秩和檢驗及Kruskal-Wallis H秩和檢驗。
2 結果與分析
2.1 艾納香器官生物量及Cd含量
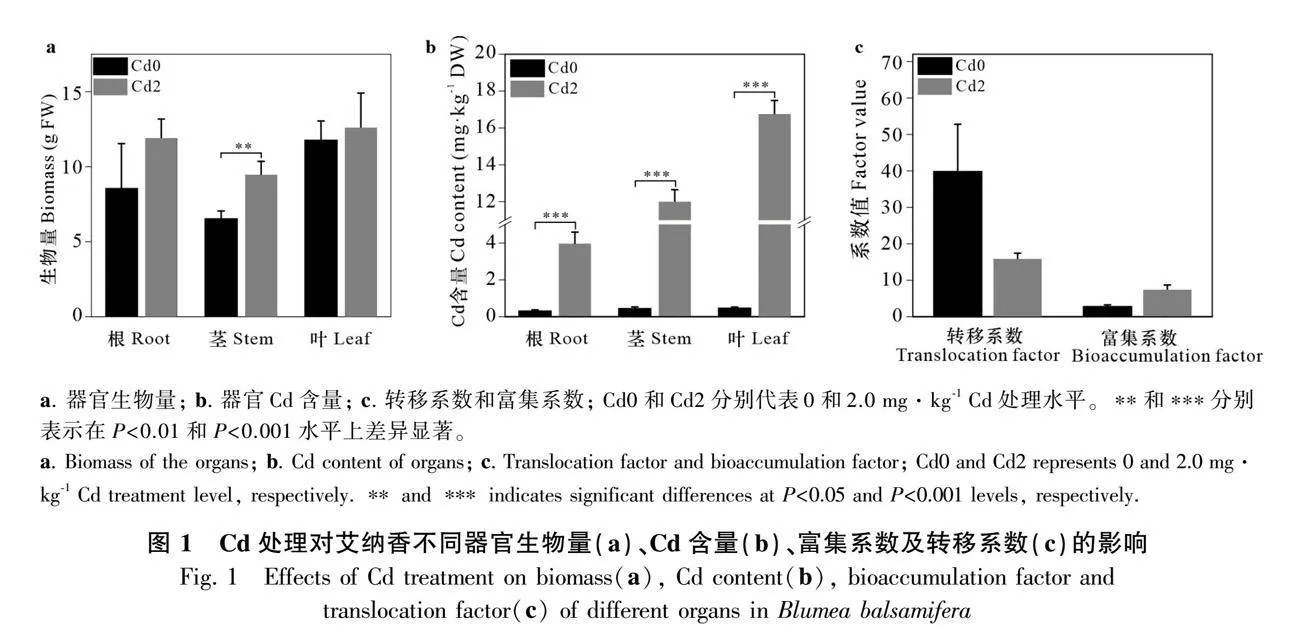
由圖1:a可知,與Cd0處理相比,Cd2處理下艾納香各器官生物量均增加且莖的生物量增加明顯(Plt;0.01),由此可見,2.0 mg·kg-1Cd處理對艾納香生長無抑制作用,進而說明艾納香對一定量的Cd有耐受性。
Cd含量測定結果(圖1:b)表明,艾納香各器官Cd積累量大小表現為葉gt;莖gt;根,并且Cd2處理下各器官Cd含量顯著高于Cd0處理(Plt;0.001)。此外,由圖1:c可知,艾納香對外源Cd的轉移系數達到15.82,富集系數達到7.39,說明艾納香對Cd具有較強的轉移和富集能力。
2.2 Cd對艾納香內生細菌α多樣性影響
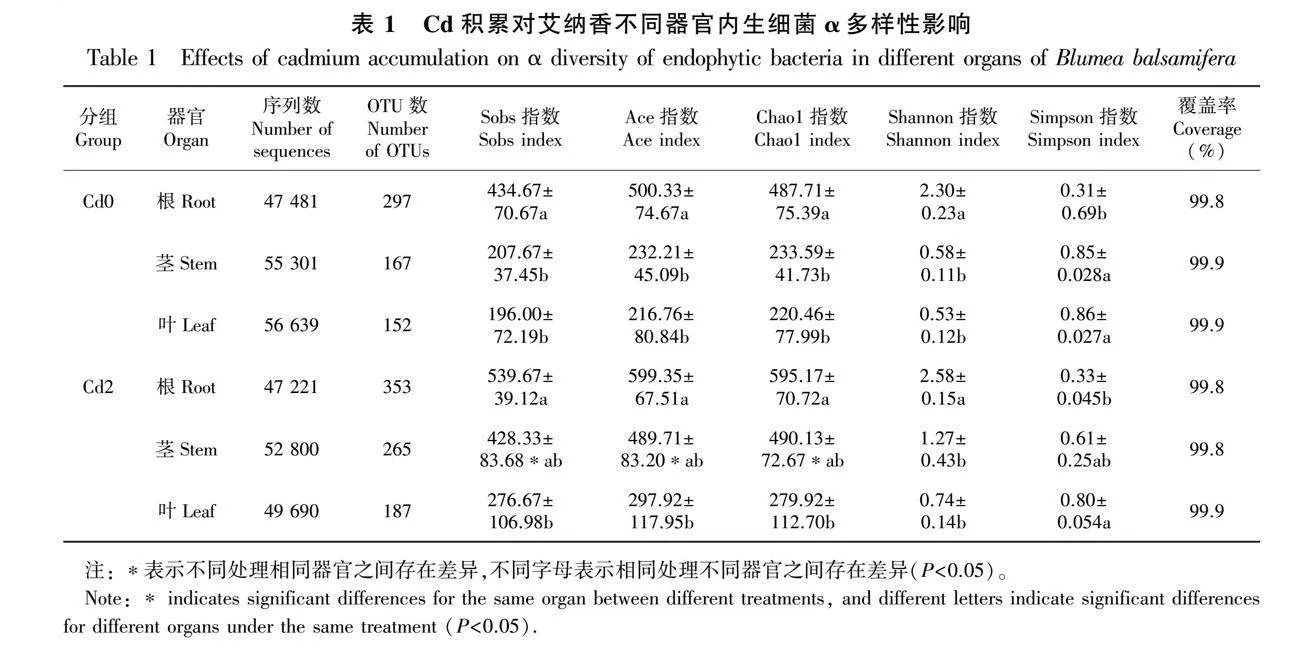
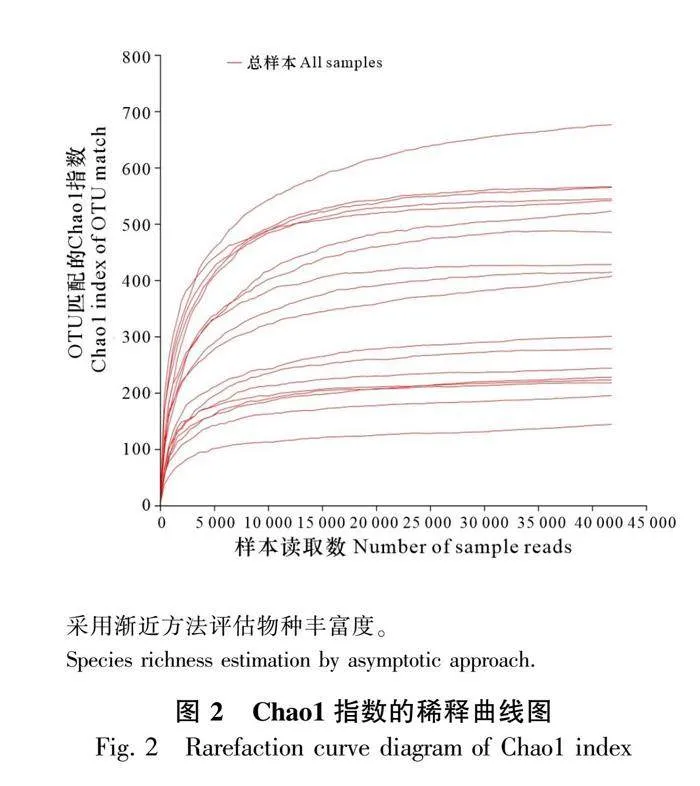
使用Fastp、FLASH軟件對18個樣本的原始測序結果進行過濾、拼接、篩選等后續處理,共獲得969 532條優化序列,其中Cd0處理樣本平均獲得159 421條優化序列,Cd2處理樣本平均獲得149 711條優化序列。在97%相似度下,序列被注釋得到1 421個OTUs,Cd0和Cd2處理分別得到616個和805個OTUs(表1)。為驗證艾納香樣本的測序深度能否充分反映艾納香實驗樣本的內生菌多樣性,本實驗繪制了Chao1指數的稀釋曲線,如圖2所示,稀釋曲線持續增高后呈平穩狀態,說明測序量充足,支持后續的分析。
艾納香根、莖、葉內生菌α多樣性分析結果見表1。相同處理條件下, 不同器官內生菌豐富度(Sobs指數、Ace指數和Chao1指數)和多樣性(Shannon指數和Simpson指數)存在一定差異,具體表現為根中內生菌豐富度及多樣性明顯高于莖和葉(Plt;0.05),而莖、葉中內生菌多樣性及豐富度無顯著差異。總的來看,艾納香各器官內生菌α多樣性呈現為根gt;莖gt;葉。
組間α多樣性結果(表1)表明,Cd2處理下艾納香各器官內生菌多樣性及豐富度均高于Cd0處理,特別是莖中內生菌豐富度(Plt;0.05),由此可見外源Cd添加(2.0 mg·kg-1)提高了艾納香內生菌α多樣性,也進一步說明了宿主器官Cd積累會使植株‘招募’更多種類內生菌以使其適應體內不同微環境的變化。
2.3 Cd對艾納香內生菌群落組成的影響
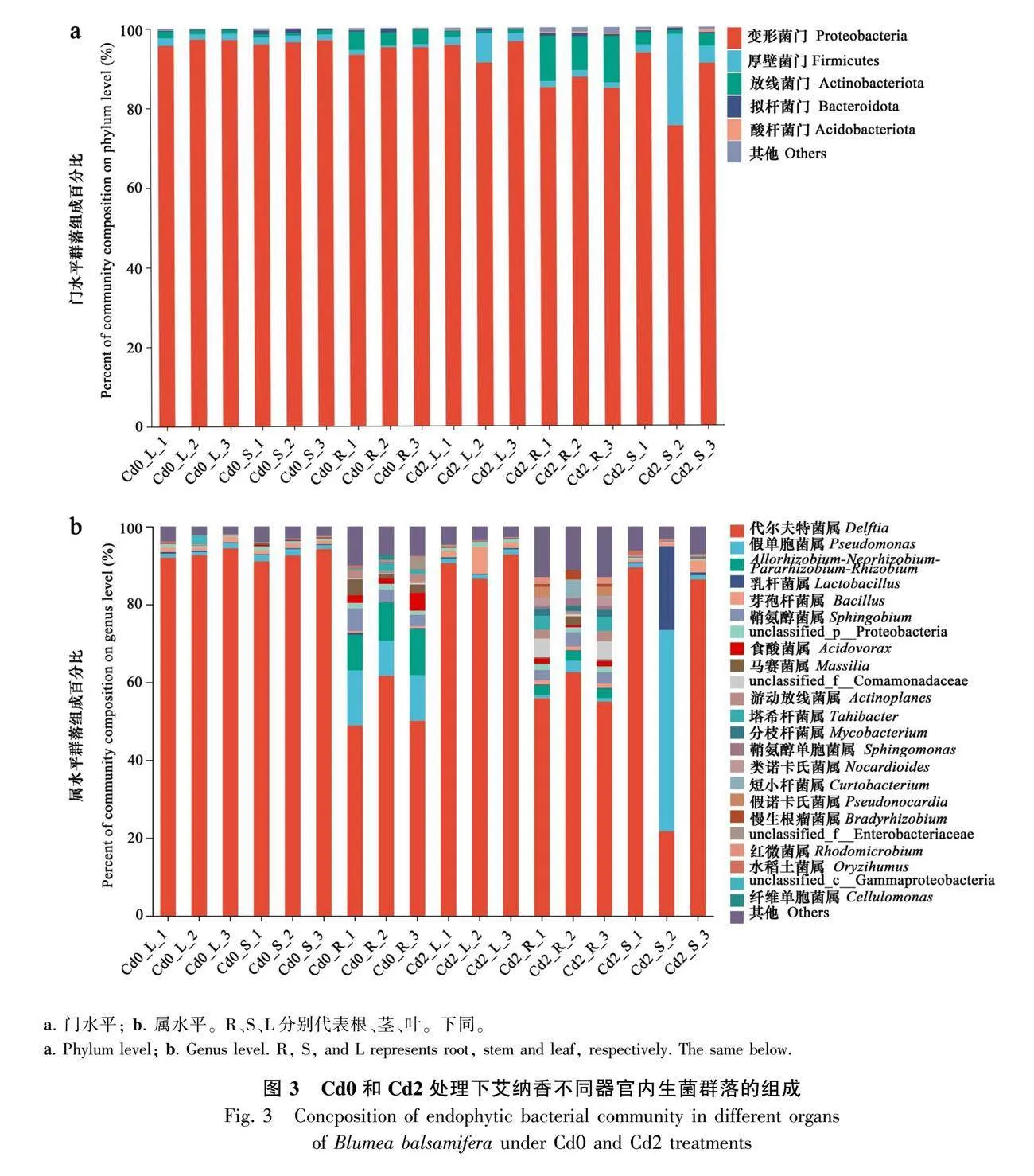
基于門水平的內生菌群落相對豐度分析表明,外源Cd處理會影響艾納香各器官內生菌群落組成(圖3:a)。變形菌門(Proteobacteria)、放線菌門(Actinobacteriota)和厚壁菌門(Firmicutes)等在各器官中占絕對數量優勢。Cd2處理下,根、莖、葉中放線菌門、厚壁菌門、酸桿菌門(Acidobacteria)相對豐度分別為10.6%、1.6%、0.4%,2.5%、9.8%、0.5%和1.1%、3.9%、0.1%,高于Cd0處理相應器官——根(3.9%、0.9%、0.0%)、莖(0.9%、1.7%、0.1%)、葉(1.1%、1.7%、0.0%)3個門水平的細菌數量;Cd2處理下,根、莖、葉中變形菌門相對豐度(84.8%、85.6%、93.9%)低于Cd0處理相應器官變形菌門數量(93.9%、96.2%、96.4%)。Cd0和Cd2處理葉中擬桿菌門(Bacteroidota)相對豐度無差異,但在根和莖中擬桿菌門數量有差異,表現為莖中Cd0gt;Cd2、根中Cd0lt;Cd2。
在屬水平上,各處理器官以代爾夫特菌屬(Delftia)、假單胞菌屬(Pseudomonas)、乳桿菌屬(Lactobacillus)、芽孢桿菌屬(Bacillus)為主要菌屬,代爾夫特菌屬在各樣本中的相對豐度范圍為22%~92.7%(圖3:b)。Cd0處理的莖、葉中代爾夫特菌屬相對豐度均大于92%,其數量占絕對優勢,此外Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、鞘氨醇菌屬(Sphingobium)主要存在于根中。Cd2處理下,根中鞘氨醇菌屬,莖中假單胞菌屬、乳桿菌屬,葉中芽孢桿菌屬相對豐度均高于Cd0處理,但根中假單胞菌屬、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium,莖和葉中代爾夫特菌屬相對豐度低于Cd0處理,該結果表明鞘氨醇菌屬、假單胞菌屬、乳桿菌屬、芽孢桿菌屬等內生菌具有耐Cd能力。
韋恩圖分析(屬水平)(圖4)結果表明:Cd0處理下,根中獨有菌屬62個(20.9%),莖中獨有菌屬16個(5.4%),葉中獨有菌屬10個(3.4%),根、莖、葉中共有菌屬132個(44.4%);Cd2處理下,根中獨有菌屬31個(10.1%),莖中獨有菌屬18個(5.8%),葉中獨有菌屬5個(1.6%),根、莖、葉中共有菌屬175個(56.8%)。綜上表明,各處理下艾納香根、莖、葉中內生細菌的群落組成具有一定的相似性,但不同處理間相同器官內生菌組成的變化間接反映了內生菌對各器官不同化學組成環境適應的改變。此外,與Cd0處理相比,Cd2處理的莖和葉中擁有更多的內生菌屬(圖4),表明更多種屬細菌參與宿主對高積累Cd脅迫的抵抗。
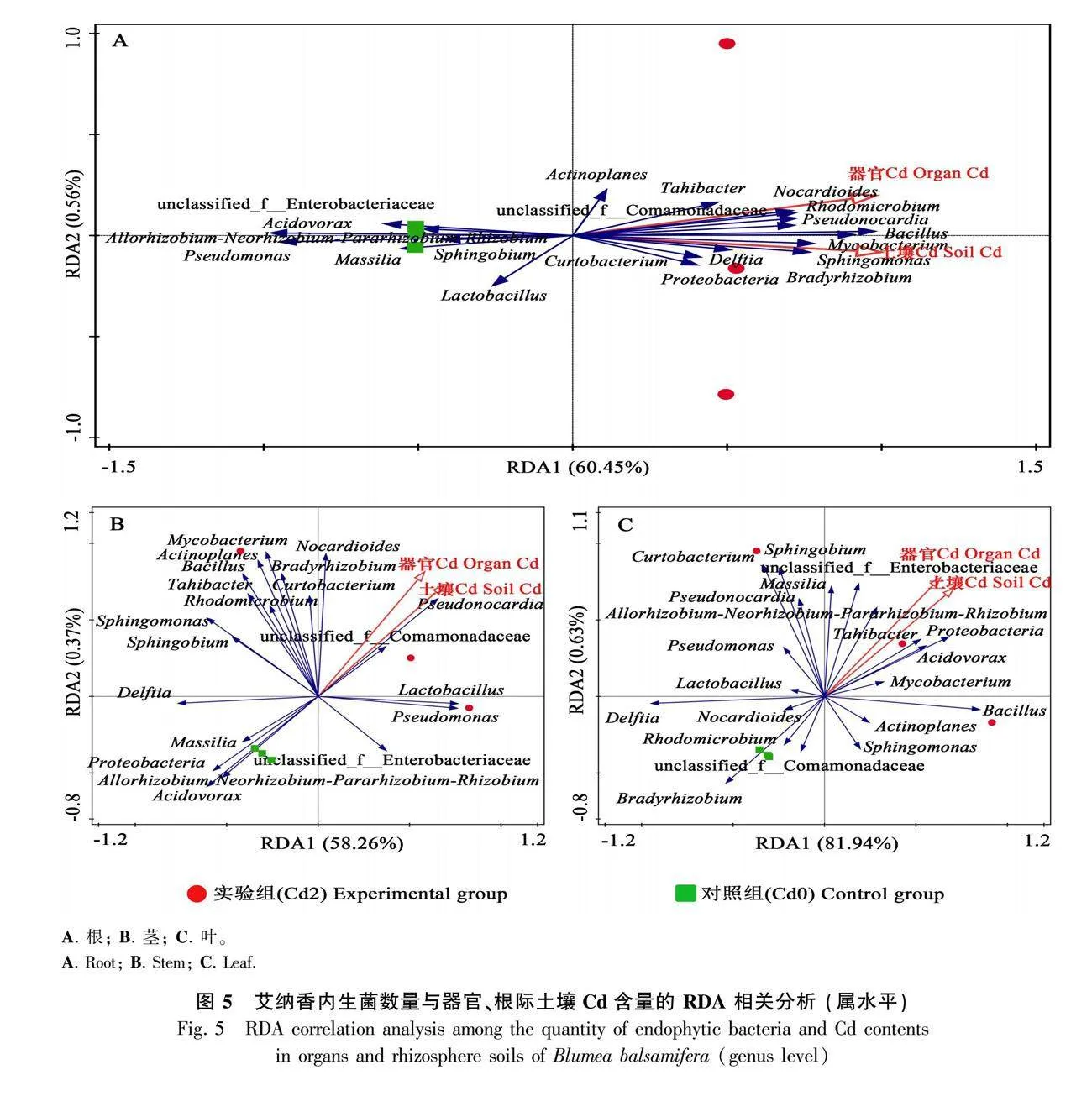
通過冗余分析(RDA)識別內生菌群落與根際土壤Cd和器官Cd含量之間的關系。由圖5可知,在艾納香根、莖、葉前20種物種中,Cd2處理各器官多數內生菌豐度與根際土壤Cd、器官Cd含量呈正相關,包括根中芽孢桿菌屬、分枝桿菌屬(Mycobacterium)、鞘氨醇單胞菌屬(Sphingomonas)、假諾卡氏菌屬(Pseudonocardia)、unclassified_f Comamonadaceae、塔希桿菌屬(Tahibacter)、代爾夫特菌屬等,莖中分枝桿菌屬、類諾卡氏菌屬(Nocardioides)、游動放線菌屬(Actinoplanes)、芽孢桿菌屬、短小桿菌屬(Curtobacterium)、慢生根瘤菌屬(Bradyrhizobium)、假單胞菌屬等,葉中芽孢桿菌屬、短小桿菌屬、鞘氨醇菌屬、食酸菌屬(Acidovorax)、塔希桿菌屬、unclassified_f Enterobacteriaceae、馬賽菌屬(Massilia)等;僅有少數內生菌與之呈負相關,如根中Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、假單胞菌屬、食酸菌屬、馬賽菌屬、鞘氨醇菌屬,莖中食酸菌屬、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、馬賽菌屬、代爾夫特菌屬,葉中慢生根瘤菌屬、代爾夫特菌屬、紅微菌屬(Rhodomicrobium)、unclassified_f Comamonadaceae、類諾卡氏菌屬等。而Cd0處理各器官內生菌豐度與根際土壤Cd、器官Cd含量的關系與Cd2處理的結果相反。上述結果說明Cd處理下內生菌組成和結構的變化對艾納香Cd富集作用有著重要的影響。
2.4 Cd對艾納香內生菌物種差異的影響
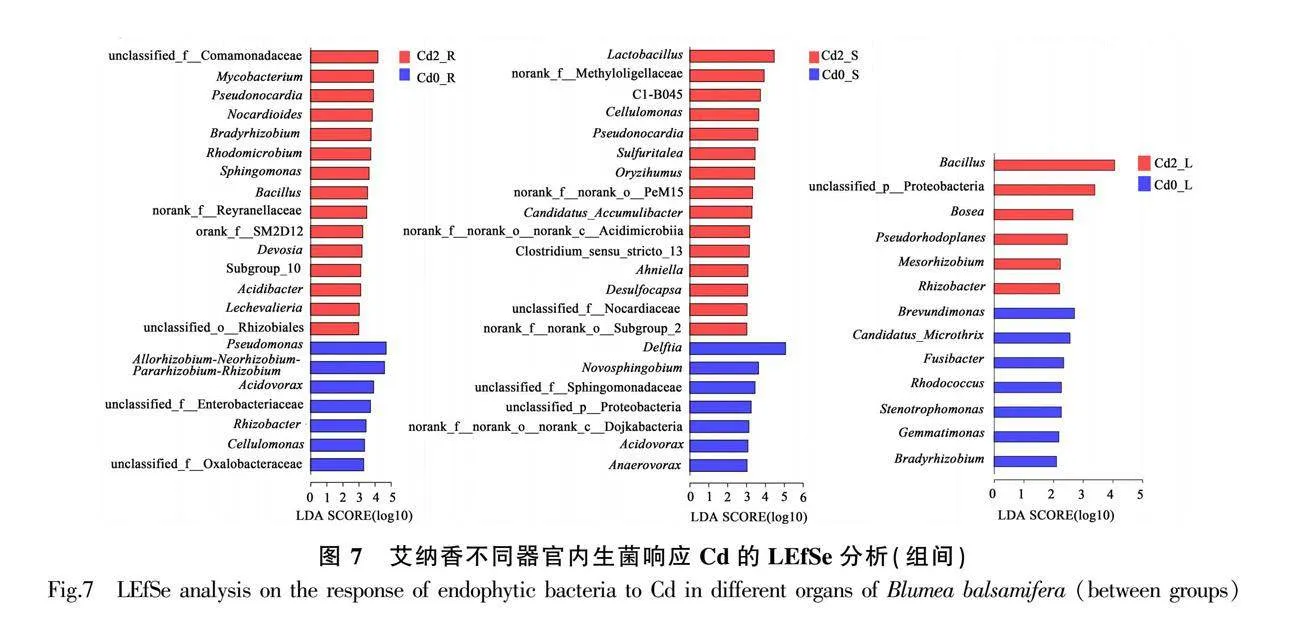
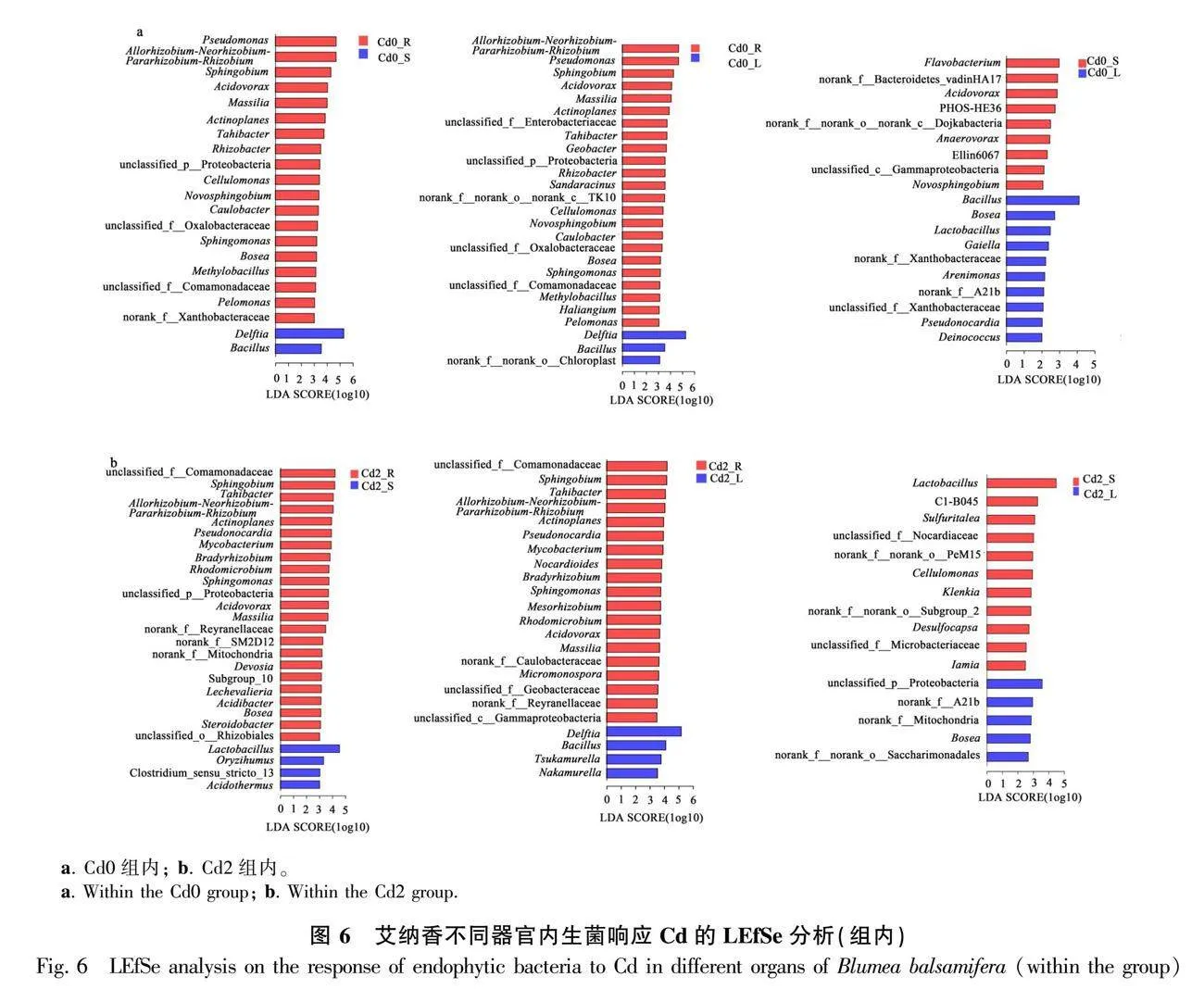
以內生細菌類群為研究對象,利用線性判別分析(LEfSe)區分同一處理組內不同器官間及不同處理組相同器官之間的主要差異物種。結果發現,Cd0處理下,與莖、葉相比,根中的差異物種類較多,主要有Allorhizobium-Neorhizobium-Pararhizo-bium-Rhizobium、假單胞菌屬、鞘氨醇菌屬、食酸菌屬、馬賽菌屬、游動放線菌屬、塔希桿菌屬、Rhizobacter、纖維單胞菌屬(Cellulomonas)、Novosphingobium、Caulobacter、Bosea、鞘氨醇單胞菌屬、Methylobacillus等物種;與根相比,莖、葉中主要差異物種有代爾夫特菌屬和芽孢桿菌屬;此外,葉中芽孢桿菌屬、Bosea、乳桿菌屬、Gaiella、Arenimonas、假諾卡氏菌屬、Deinococcus等數量明顯高于莖(圖6:a)。
同樣在Cd2處理下,與莖、葉相比,根中存在更多的差異物種,主要有鞘氨醇菌屬、塔希桿菌屬、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、游動放線菌屬、假諾卡氏菌屬、分枝桿菌屬、慢生根瘤菌屬、鞘氨醇單胞菌屬、紅微菌屬、食酸菌屬、馬賽菌屬等物種;與根相比,莖中主要差異物種有乳桿菌屬、水稻土菌屬(Oryzihumus)、Acidothermus,葉中主要有代爾夫特菌屬、芽孢桿菌屬、Tsukamurella、Nakamurella;另外,莖中的差異物種較葉中多,主要有乳桿菌屬、Sulfuritalea、纖維單胞菌屬、Klenkia、Desulfocapsa、Iamia等物種(圖6:b)。
不同處理相同器官比較發現(圖7),Cd2處理各器官存在更多差異物種,根中主要有分枝桿菌屬、假諾卡氏菌屬、類諾卡氏菌屬、慢生根瘤菌屬、鞘氨醇單胞菌屬、芽孢桿菌屬、Devosia、Acidibacter、Lechevalieria等物種,莖中主要有乳桿菌屬、纖維單胞菌屬、假諾卡氏菌屬、Sulfuritalea、水稻土菌屬、Ahniella、Desulfocapsa等物種,葉中主要有芽孢桿菌屬、Bosea、Pseudorhodoplanes、Mesorhizobium、Rhizobacter等物種;Cd0處理根中主要有假單胞菌屬、Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、食酸菌屬等物種,莖中主要有代爾夫特菌屬、Novosphingobium等物種,葉中主要有Brevundimonas、Candidatus_Microthrix等物種。綜上表明,Cd積累不但影響各器官內生菌物種組成,還有促使各器官‘招募’更多差異內生菌的趨向,這或許在艾納香對Cd積累的適應中起著關鍵作用。
2.5 Cd對艾納香內生菌共發生網絡的影響
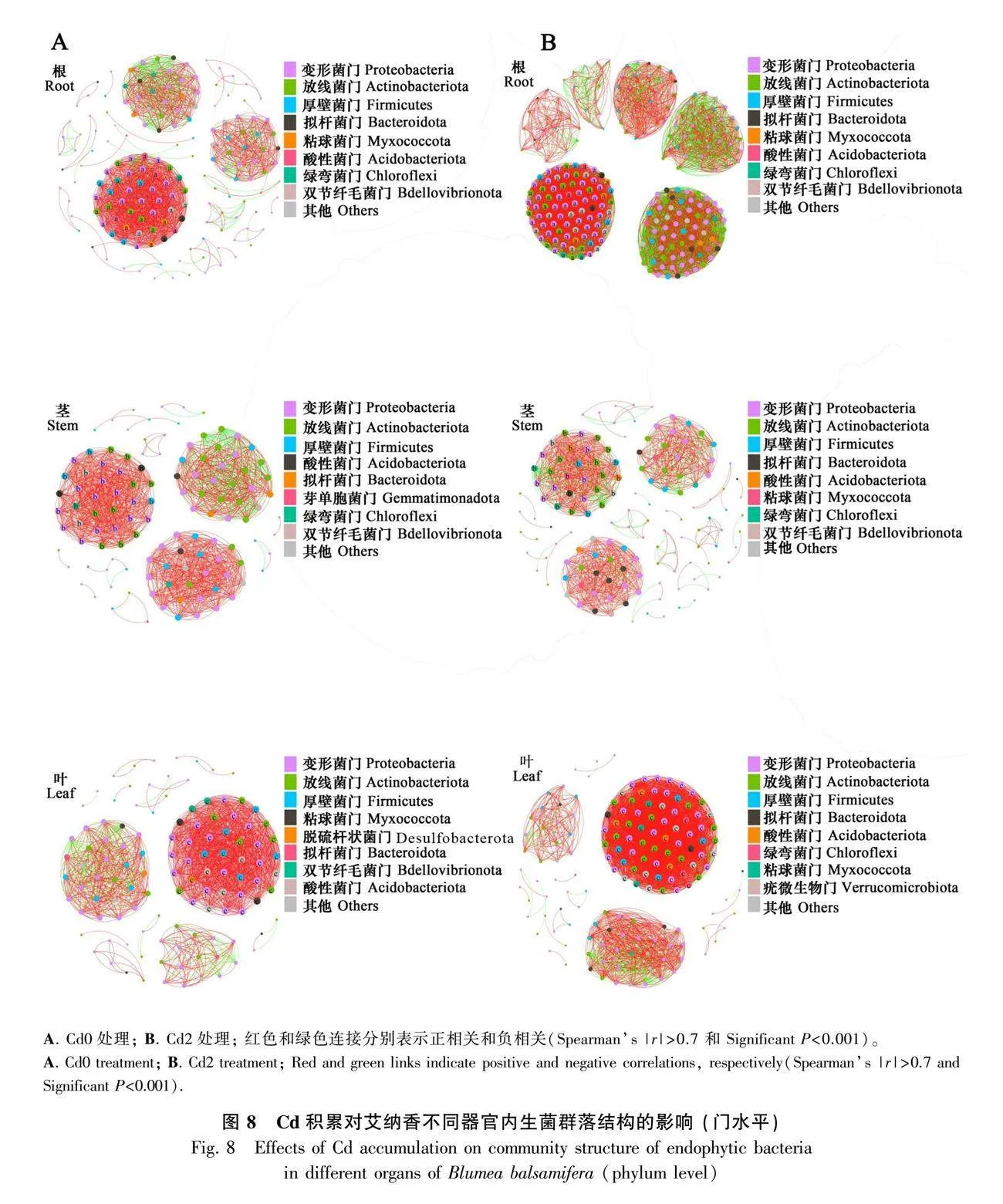
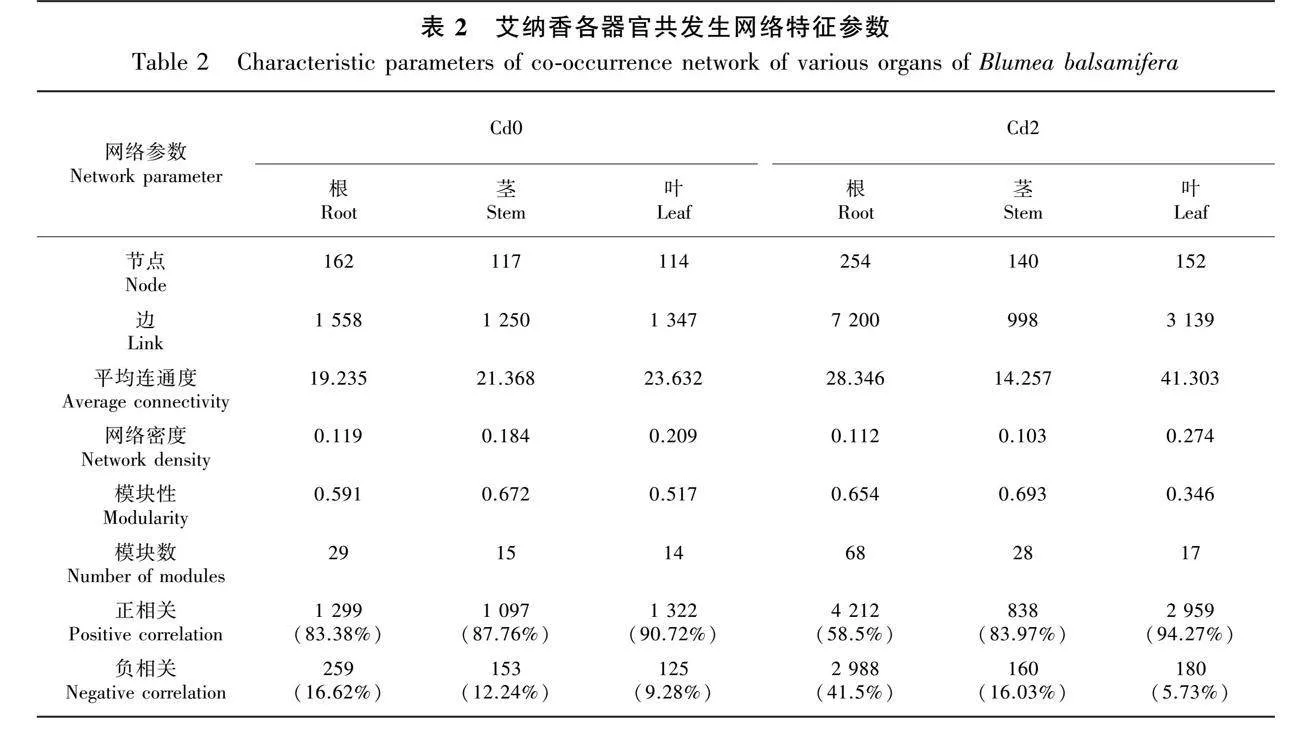
共發生網絡總體拓撲性質分析結果見表2。Cd0處理下根、莖、葉共發生網絡節點分別為162、117、114,邊分別為1 558、1 250、1 347,平均連通度分別為19.235、21.368、23.632,網絡密度分別為0.119、0.184、0.209;Cd2處理下根、莖、葉共發生網絡節點分別為254、140、152,邊分別為7 200、998、3 139,平均連通度分別為28.346、14.257、41.303,網絡密度分別為0.112、0.103、0.274。上述結果表明,Cd2處理下根和葉內生菌共發生網絡規模趨向大而復雜,莖則表現出相反效果。Cd0處理下根、莖、葉各器官內生菌共發生網絡模塊性數值分別為0.591、0.672、0.517,模塊數分別為29、15、14,Cd2處理下各器官共發生網絡模塊性數值分別為0.654、0.693、0.346,模塊數分別為68、28、17。該結果表明Cd2處理下根、莖和葉共發生網絡內生菌功能單元均有所增加,各器官共發生網絡模塊表現(模塊性)以葉網絡模塊間連接較多且緊密,莖次之。此外,各處理樣本內生菌群落均以正相關為主,但隨著Cd的施加,根、莖中共發生網絡正相關連線比例減少(特別是根),而葉中正相關連線比例則有所增加,表明Cd處理改變了各器官內生菌物種間的相互作用,具體表現為葉中協同共生關系的加強和根、莖中物種間競爭關系的增強。
對物種進行相關性網絡互作分析,由內生菌共發生網絡結構組成(圖8)可知:Cd0處理下,根中邊數較大的物種為Pseudoxanthobacter(42)、Dokdonella(42)、Novispirillum(42)、Bryobacter(42)、Occallatibacter(42)、Gemmatimonas(42)、Azovibrio(42)、Cryomorpha(42)、Zymobacter(42)、Romboutsia(42)等,莖中邊數較大的物種為Planococcus(31)、Aquaspirillum(31)、Turicibacter(31)、Dactylosporangium(31)、Devosia(31)、Thauera(31)、Haematobacter(31)、Garicola(31)、Agromyces(31)、Altererythrobacter(31)等,葉中邊數較大的物種為Planococcus(41)、Bdellovibrio(41)、Dokdonella(41)、Ahniella(41)、Hyphomicrobium(41)、Luteimonas(41)、Cellulomonas(41)、Photobacterium(41)、Pseudarthrobacter(41)、Reyranella(41)等;Cd2處理下,根中邊數較大的物種為Sporacetigenium(81)、乳桿菌屬(81)、Novispirillum(81)、Truepera(81)、Altererythrobacter(81)、 Romboutsia(81)、 Reyranella (81)、Gordonia(81)、Brevundimonas(81)、Dongia(81)等,莖中邊數較大的物種為Planifilum(28)、Luteimonas(28)、Dactylosporangium(28)、Thauera(28)、Streptococcus(28)、Ohtaekwangia(28)、Agromyces(28)、Zymobacter(28)、Microvirga(28)、Rubrobacter(28)等,葉中邊數較大的物種為Deinococcus(70)、Pseudoxanthobacter(70)、Pedomicrobium(70)、Planococcus(70)、Rhodoplanes(70)、Planifilum(70)、Lechevalieria(70)、Aquaspirillum(70)、Nonomuraea(70)、Dokdonella(70)等。由此可見,器官Cd積累會影響各器官內生菌共發生網絡結構和物種間的互作關系。
3 討論
3.1 Cd積累對艾納香器官內生菌群落結構的影響
植物內生菌群落易受非生物和生物因子所調節(Hallmann et al., 1997;Fuentes-Ramirez et al., 1999;Seghers et al., 2004;Liang et al., 2021)。相關研究普遍認為Cd污染導致植物內生菌多樣性下降(亓文鈺,2021;Li et al., 2023),但在黑麥草(Lolium perenne) (Liang et al., 2021)、超積累型東南景天等(鄒淑華等,2019)相關研究中發現,金屬Cd污染導致內生菌多樣性增加,同樣在本研究中,艾納香Cd脅迫積累不僅能促進植株生長,還能提高各器官內生細菌多樣性和豐富度,該現象的發生與一些研究者指出的內生菌多樣性越高,宿主植物對環境脅迫的適宜性越強結果相符(Sánchez-López et al., 2018)。另外,本研究Cd0和Cd2處理下,艾納香根中內生細菌多樣性和豐富度均顯著高于莖和葉,這與三七(Panax notoginseng)內生菌分布結果相似(Liu et al., 2020),可能與根內生菌主要來源于土壤有關(Gao amp; Shi, 2018)。
本研究中艾納香內生菌群落由變形菌門、放線菌門和厚壁菌門等組成,其中變形菌門占主要地位,這與甘松(Nardostachys jatamansi) (李瑩等,2022)、冰川棘豆(Oxytropis glacialis) (許國琪等,2021)等植物內生菌組成的研究結果一致,說明植物內生菌在較大分類單元下基本一致。在本研究中,與Cd0處理相比,Cd2處理根、莖、葉中變形菌門的相對豐度降低,而放線菌門、厚壁菌門、酸桿菌門的相對豐度升高,這與Liang等(2021)和鄒淑華等(2019)的研究結果一致。從屬水平上來看,Cd積累導致艾納香根、莖、葉中優勢菌屬增加,如根中的代爾夫特菌屬、鞘氨醇菌屬,莖中的假單胞菌屬、乳桿菌屬以及葉中的芽孢桿菌屬,RDA分析結果也表明上述菌屬與器官Cd含量和土壤Cd含量的密切相關性。各器官不同程度的Cd積累導致內生菌群落結構不同也體現在東南景天上(鄒淑華等,2019),如超積累型東南景天(HE)莖中Alphaproteobacteria,葉片中Gammaproteobacteria、Negativicutes和Clostridia 4個綱內生菌的相對豐度隨Cd2+積累的增多顯著增加。與根部相比,超積累植物Thlaspi caerulescens subsp. calaminaria地上部內生菌不僅有耐高濃度Cd2+、Zn2+等特點,還存在器官特定優勢菌屬,如Methylobacterium (Lodewyckx et al., 2002),由此可見,內生菌群落結構受宿主植物和土壤環境的影響。
相關研究指出,在Cd脅迫下,植物能夠‘招募’特定的內生菌種群,從而實現高Cd抗性和植物生長促進特性(臺喜生等,2021;Liang et al., 2021)。一般來說,‘招募’的特定內生菌種群往往具有較強的耐Cd性,如東南景天從根際土壤中‘招募’大量耐Cd/Zn內生菌,包括Burkholderia、芽孢桿菌屬、Novosphingobium等來強化其對重金屬脅迫的抵抗(Wu et al., 2020)。本文研究結果發現,Cd處理艾納香根、莖、葉中存在大量的差異優勢物種,如芽孢桿菌屬、假單胞菌屬、乳桿菌屬等。Maslennikova等(2023)研究指出,芽孢桿菌屬能夠強化根系細胞壁木質素的沉積,進而阻止Cd向地上部轉移,以減輕其毒害作用。假單胞菌屬可通過調節東南景天重金屬ATPase(HMA)、天然抗性相關巨噬蛋白(NRAMP)、ZRT/IRT-like蛋白(ZIP)等基因的表達來實現對Cd轉移的調控和耐性(Chen et al., 2017)。乳桿菌屬的胞外多糖通過改變水稻根Cd亞細胞分布和Cd化學形態形式來減少Cd向地上部籽粒的轉移和減輕Cd毒害(Li KT et al., 2022)。由此可見,艾納香各器官中更多差異內生菌可能參與艾納香生長及Cd2+的吸收、積累和解毒生理代謝過程。
3.2 Cd積累對艾納香內生菌共發生網絡結構的影響
在生態系統中,微生物通常以復雜的網絡結構共存和相互作用,構建微生物共發生網絡為探究微生物群落內潛在的相互作用提供了技術支撐(Chu et al., 2021)。一般來說,網絡越復雜,群落結構越穩定(Li H et al., 2022)。艾納香各器官內生菌共發生網絡分析結果表明,無論是Cd0處理,還是Cd2處理,根部內生菌網絡結構都比莖、葉復雜且物種間以正相關為主,這與Zhang等(2022)的研究結果一致,即在兩種農業種植模式中,均表現為番茄根中內生細菌網絡比莖中復雜。兩處理組對比發現,Cd2處理下根、葉內生菌共發生網絡比Cd0更復雜(表現為更多的邊數和較大的平均連通度和網絡密度數值),并且增加了根、莖中內生菌共發生網絡負相關邊比例和葉中正相關邊比例,進而說明Cd積累導致各器官內生菌之間的相互作用關系有所改變,即在根、莖中物種間競爭關系的增強,而在葉中則為物種間共生關系的增強,但從總體而言,各器官物種間的共生關系占主導地位。同樣在He等(2021)研究中,高鎘污染提高鴨跖草(Commelina communis)內生菌共發生網絡復雜性且物種間主要以正相關關系存在,而超積累植物刺槐(Robinia pseudoacacia)在鎘、銅、鉛等污染狀態下,器官內生菌共發生網絡趨向于簡單,物種間的關系并不以正相關作用為主,從各器官內生菌共發生網絡模塊特性來看,葉內生菌共發生網絡比根更復雜(姚雨軒,2022),這與本研究中Cd2處理下器官內生菌共發生網絡特點表現基本一致。鎘污染下水稻器官內生菌共發生網絡分析表明,與地上部(模塊性為0.537)相比,根部(模塊性為0.277)積累更多Cd的同時其內生菌群落結構表現為更復雜化(Zheng et al., 2022),這與Berry和Widder(2014)闡述的復雜網絡能更好應對環境變化觀點相一致。在本研究中,Cd積累下艾納香器官葉的模塊性遠低于莖和根,說明葉部內生菌共發生網絡模塊間聯系緊密且不同物種分布于不同的模塊,有利于形成特定生態位相對穩定的共生內生菌群落以適應Cd積累脅迫。因此,在本研究中,Cd污染可能通過誘導艾納香建立更加復雜的內生菌共發生網絡和增強物種間的正向關聯強度來應對Cd積累的影響。值得注意的是,本文并未設置Cd對艾納香生長的抑制濃度且研究樣本量有限,存在不足之處。因此,在后續的研究中將進一步改進研究方案,使其變得更加深入、合理。
4 結論
(1)MiSeq測序表明,Cd積累提高了艾納香各器官內生菌α多樣性,各器官α多樣性總體表現為根gt;莖gt;葉。(2)RDA分析表明,艾納香器官內生菌群落組成與植株器官Cd含量和根際土壤Cd含量密切相關,并且大多數內生菌與植株體Cd含量和根際土壤Cd含量呈正相關。(3)線性判別分析(LEfSe)表明,艾納香根中內生菌差異物種較莖和葉豐富。此外,Cd積累顯著增加了根、莖和葉中的分枝桿菌屬、類諾卡氏菌屬、慢性根瘤菌屬、鞘氨醇單細胞菌屬、乳桿菌屬、纖維單胞菌屬、芽孢桿菌屬、Mesorhizobium、Rhizobacter等屬的耐Cd內生菌數量。(4)共發生網絡分析表明,艾納香根和葉中Cd積累使內生菌共發生網絡變得更加復雜。器官Cd積累增強了根、莖物種間的競爭關系和葉物種間的共生關系。
參考文獻:
BERRY D, WIDDER S, 2014. Deciphering microbial interactions and detecting keystone species with co-occurrence networks [J]." Front Microbiol, 5: 219.
CHEN B, LUO S, WU YJ, et al., 2017. The effects of the endophytic bacterium pseudomonas fluorescens sasm05 and IAA on the plant growth and cadmium uptake of Sedum alfredii Hance [J]." Front Microbiol, 8: 2538.
CHEN ZH, REN JG, PANG YX,et al., 2022. Effects of cadmium stress on resistant physiology, subcellular distribution and chemical forms of cadmium in Blumea balsamifera [J]." Seed, 41(2): 31-39." [陳子涵, 任建國, 龐玉新, 等, 2022. 鎘脅迫對艾納香抗性生理、亞細胞鎘分布和鎘化學形態的影響 [J]." 種子, 41(2): 31-39.]
CHENG C, WANG R, SUN LJ, et al., 2021. Cadmium-resistant and arginine decarboxylase-producing endophytic Sphingomonas sp. C40 decreases cadmium accumulation in host rice (Oryza sativa cliangyou 513) [J]." Chemosphere, 275: 130109.
CHU CQ, FAN MY, SONG CY, et al., 2021. Unveiling endophytic bacterial community structures of different rice cultivars grown in a cadmium-contaminated paddy field [J]." Front Microbiol, 12: 756327.
FUENTES-RAMIREZ LE, CABALLERO-MELLADO J, SEPULVEDA J, et al., 1999. Colonization of sugarcane by Acetobacter diazotrophicus is inhibited by high N-fertilization [J]." Fems Microbiol Ecol, 29(2): 117-128.
GAO T, SHI XY, 2018. Preparation of a synthetic seed for the common reed harboring an endophytic bacterium promoting seedling growth under cadmium stress [J]." Environ Sci Pollut Res Int, 25(9): 8871-8879.
HALLMANN J, QUADT-HALLMANN A, MAHAFFEE WF, et al., 1997. Bacterial endophytes in agricultural crops [J]." Can J Microbiol, 43(10): 895-914.
HARDOIM PR, VAN OVERBEEK LS, ELSAS JD, 2008. Properties of bacterial endophytes and their proposed role in plant growth [J]." Trends Microbiol, 16(10): 463-471.
HE L, REN YZ, ZENG WM, et al., 2021. Deciphering the endophytic and rhizospheric microbial communities of a metallophyte Commelina communis in different Cu-polluted soils [J]." Microorganisms, 9(8): 1689.
HE YM, YANG ZX, LI MR, et al., 2017. Effects of a dark septate endophyte (DSE) on growth, cadmium content, and physiology in maize under cadmium stress [J]." Environ Sci Pollut Res Int, 24(22): 18494-18504.
KURAMSHINA ZM, SMIRNOVA YV, KHAIRULLIN RM, 2018. Cadmium and nickel toxicity for Sinapis alba plants inoculated with endophytic strains of Bacillus subtilis [J]." Russ J Plant Physiol, 65(2): 269-277.
LATIF KA, IHSAN U, JAVID H, et al., 2016. Regulations of essential amino acids and proteomics of bacterial endophytes Sphingomonas sp. Lk11 during cadmium uptake [J]." Environ Toxicol, 31(7): 887-896.
LI H, LOU LY, TANG B, et al., 2022. Dynamic changes of rhizosphere soil bacterial community and nutrients in cadmium polluted soils with soybean-corn intercropping [J]." BMC Microbiol, 22(1): 57.
LI KT, PENG SY, ZHANG B, et al., 2022. Exopolysaccharides from Lactobacillus plantarum reduces cadmium uptake and mitigates cadmium toxicity in rice seedlings [J]." World J Microbiol Biotechnol, 38(12): 243.
LI Q, FU QL, ZHU J, et al., 2023. Endophyticbacteria in Ricinus communis L.: diversity of bacterial community, plant-growth promoting traits of the isolates and its effect on Cu and Cd speciation in soil [J]. Agronomy, 13(2): 333.
LI Y, HAN H, HE LY, et al., 2017. Inoculation with endophytic Bacillus megaterium H3 increases Cd phytostabilization and alleviates Cd toxicity to hybrid pennisetum in Cd-contaminated aquatic environments [J]." Environ Sci Pollut Res Int, 24(2): 1416-1423.
LI Y, ZHONG HR, LI YS, et al., 2022. Community structure and diversity analysis of rhizosphere bacterial of Nardostachys jatamansi and endophytic bacteria in medicinal parts based on high-throughput sequencing technology [J]." Chin Herb Med, 55(3): 835-847." [李瑩, 鐘海蓉, 李奕松, 等, 2022. 基于高通量測序研究甘松根際細菌及藥用部位內生細菌群落結構及多樣性 [J]." 中草藥, 53(3): 835-847.]
LIANG J, ZHOU HF, REN JG, et al.,2016. Physiological response to cadmium stress and distribution characteristics of cadmium in the body of Blumea balsamifera [J]." Jiangsu Agric Sci, 45(5): 271-274." [梁娟, 周華芳, 任建國, 等, 2016. 黔產艾納香對鎘脅迫的生理響應及其體內鎘分布特征 [J]." 江蘇農業科學, 45(5): 271-274.]
LIANG SX, ZHANG Y, CUI BJ, 2021. Insights into the effects of cadmium stress on endophytic bacterial community in the hyperaccumulating plant ryegrass [J]." Environ Pollut Bioavailab, 33(1): 460-468.
LIN CL, CHEN YF, FANG SZ, et al., 2022. Cadmium contamination of Chinese agricultural soils [J]." Fresenius Environ Bull, 31(3): 2466-2473.
LIU TH, ZHOU Y, TAO WC, et al., 2020. Bacterial diversity in roots, stems, and leaves of Chinese medicinal plant Paris polyphylla var. yunnanensis [J]." Pol J Microbiol, 69(1): 91-97.
LODEWYCKX C, MERGEAY M, VANGRONSVELD J, et al., 2002. Isolation, characterization, and identification of bacteria associated with the zinc hyperaccumulator Thlaspi caerulescens subsp. calaminaria [J]." Int J Phytorem, 4(2):101-115.
LONG JY, YU MX, XU HH, et al., 2021. Characterization of cadmium biosorption by inactive biomass of two cadmium-tolerant endophytic bacteria Microbacterium sp. D2-2 and Bacillus sp. C9-3 [J]." Ecotoxicology, 30(7): 1419-1428.
LU LT, 2018. The effect of Zinc pollution on endophytic bacteria diversity and infection characteristic of Sedum alfredii [D]. "Guangzhou: South China Agricultural University." [陸麗婷, 2018. 土壤Zn污染水平對東南景天內生菌多樣性及其定殖分布特征影響 [D]." 廣州: 華南農業大學.]
LUO JP, TAO Q, WU KR, et al., 2018. Research progress in composition and function of hyperaccumulator-associated endogenous microorganism community [J]." J Zhejiang Univ, 44(5): 515-529." [羅繼鵬, 陶琦, 吳可人, 等, 2018. 超積累植物內生微生物群落組成特征及其功能研究進展 [J]." 浙江大學學報, 44(5): 515-529.]
MASLENNIKOVA D, KORYAKOV I, YULDASHEV R, et al., 2023. Endophytic plant growth-promoting bacterium Bacillus subtilis reduces the toxic effect of cadmium on wheat plants [J]." Microorganisms, 11(7): 1653.
MUFTI R, AMNA RAFIQUE M, HAQ F, et al., 2015. Genetic diversity and metal resistance assessment of endophytes isolated from Oxalis corniculata [J]." Soil Environ, 34(1): 89-99.
NAKAMOTO Y, DOYAMA K, HARUMA T, et al., 2021. Fe, Mn and U-238 accumulations in Phragmites australis naturally growing at the mill tailings pond; iron plaque formation possibly related to root-endophytic bacteria producing siderophores [J]." Minerals, 11(12): 1337.
PU X, LONG LH, XIE Y, et al., 2019. Determination of heavy metals in 11 Chinese medicinal materials by ICP-MS and its statistical analysis [J]." Lishizhen Med Mat Med Res, 30(10): 2345-2348." [蒲翔, 龍立慧, 謝宇, 等, 2019. 11種中藥材中重金屬含量的ICP-MS法測定及統計分析 [J]." 時珍國醫國藥, 30(10): 2345-2348.]
QI WY, 2021. Regulation mechanism and endophytic flora of selenium nanoparticles alleviating cadmium stress in Brassica napus [D]." Jinan: Shandong University." [亓文鈺, 2021. 納米硒緩解甘藍型油菜鎘脅迫的調控機理與內生菌群研究 [D]." 濟南: 山東大學.]
QIAN L, SONG F, XIA J, et al., 2022. A glucuronic acid-producing endophyte Pseudomonas sp. MCS15 reduces cadmium uptake in rice by inhibition of ethylene biosynthesis [J]." Front Plant Sci, 13: 876545.
SEGHERS D, WITTEBOLLE L, TOP EM, et al., 2004. Impact of agricultural practices on the Zea mays L. endophytic community [J]." Appl Environ Microbiol, 70(3): 1475-1482.
SNCHEZ-LPEZ AS, THIJS S, BECKERS B, et al., 2018. Community structure and diversity of endophytic bacteria in seeds of three consecutive generations of Crotalaria pumila growing on metal mine residues [J]." Plant Soil, 422(1/2): 51-66.
TAI XS, YANG RQ, CHANG GH, et al., 2021. Research progress of endophyte resources in metal mining area [J]." Chin Wild Plant Resour, 40(4): 64-76." [臺喜生, 楊蕊琪, 常國華, 等, 2021. 金屬礦區植物內生菌資源研究進展 [J]." 中國野生植物資源, 40(4): 64-76.]
WANG YL, WANG R, KOU FL, et al., 2022. Cadmium-tolerant facultative endophytic Rhizobium larrymoorei S28 reduces cadmium availability and accumulation in rice in cadmium-polluted soil [J]." Environ Technol Innovation, 26: 102294.
WIDHIANTARA IG, JAWI IM, 2021. Phytochemical composition and health properties of Sembung plant (Blumea balsamifera): A review [J]." Vet World, 14(5): 1185-1196.
WU YJ, MA LY, ZHANG XC, et al., 2020. A hyperaccumulator plant Sedum alfredii recruits Cd/Zn-tolerant but not Pb-tolerant endospheric bacterial communities from its rhizospheric soil [J]." Plant Soil, 455: 257-270.
XIA JQ, CAI DJ, XIA ZL, et al., 1995. The soil environmental quality standard: GB 15618-1995 [S]." Beijing:State Environmental Protection Administration, State Bureau of Technical Supervision." [夏家淇, 蔡道基, 夏增祿, 等, 1995. 土壤環境質量標準: GB 15618-1995 [S]." 北京: 國家環境保護局, 國家技術監督局.]
XIE M, GAO X, ZHANG S, et al., 2023. Cadmium stimulated cooperation between bacterial endophytes and plant intrinsic detoxification mechanism in Lonicera japonica Thunb [J]." Chemosphere, 325: 13841.
XU GQ, LIU YX, CAO PX, et al., 2021. Endophytes diversity of Oxytropis glacialis different tissues based on Illumina MiSeq sequencing [J]." Acta Ecol Sin, 41(12): 4993-5003." [許國琪, 劉怡萱, 曹鵬熙, 等, 2021. 基于Illumina MiSeq測序技術對冰川棘豆(Oxytropis glacialis)不同組織內生菌多樣性的研究 [J]." 生態學報, 41(12): 4993-5003.]
YAO YX, 2022. Study on community characteristics and influencing factors of endophytic bacteria of Robinia pseudoacacia in heavy metal contaminated area [D]." Changsha: Central South University of Forestry and Technology." [姚雨軒, 2022. 重金屬污染地刺槐內生菌群落特征及其影響因子研究 [D]." 長沙: 中南林業科技大學.]
ZHANG DL, ZHANG SD, YANG HY, et al., 2019. Effect of soil Cd pollution on yield and quality of Ligusticum chuanxiong Hort [J]." J Chin Med Mat, 42(6): 1228-1230." [張德林, 張思荻, 楊海燕, 等, 2019. 基于土壤Cd污染對川芎產量和品質的影響研究 [J]." 中藥材, 42(6): 1228-1230.]
ZHANG SQ, LI YM, WANG P, et al., 2023. Lactic acid bacteria promoted soil quality and enhanced phytoextraction of Cd and Zn by mustard:a trial for bioengineering of toxic metal contaminated mining soils [J]." Environ Res, 216: 114646.
ZHANG XY, YE ZB, ZHANG YY, 2021. Advances in physiological and molecular mechanism of plant response to cadmium stress [J]." Plant Physiol J, 57(7): 1437-1450." [張星雨, 葉志彪, 張余洋, 2021. 植物響應鎘脅迫的生理與分子機制研究進展 [J]." 植物生理學報, 57(7): 1437-1450.]
ZHANG ZY, XIAO YS, ZHAN Y, et al., 2022. Tomato microbiome under long-term organic and conventional farming [J]." iMeta, 1(3): e48.
ZHENG ZY, LI P, XIONG ZQ, et al., 2022. Integrated network analysis reveals that exogenous cadmium-tolerant endophytic bacteria inhibit cadmium uptake in rice [J]." Chemosphere, 301: 134655.
ZHOU D, SONG X, ZHAO FJ, et al., 2017. Soil environment and pollution remediation preface [J]." Pedosphere, 27(3): 387-388.
ZHOU X, LIU XQ, ZHAO JT, et al., 2021. The endophytic bacterium Bacillus koreensis 181-22 promotes rice growth and alleviates cadmium stress under cadmium exposure [J]." Appl Microbiol Biotechnol, 105: 8517-8529.
ZOU SH, DENG PX, LONG XX, 2019. Impacts of cadmium on the diversity of endophytic bacteria associated with hyperaccumulating and non-hyperaccumulating ecotypes of Sedum alfredii [J]." Acta Microbiol Sin, 59(12): 2306-2322." [鄒淑華, 鄧平香, 龍新憲, 2019. 鎘對超積累和非超積累生態型東南景天內生細菌多樣性的影響 [J]." 微生物學報, 59(12): 2306-2322.]
(責任編輯 周翠鳴)

