鎘暴露對不同周齡仔鼠睪丸的影響
摘要:目的" 研究孕前、孕期直至哺乳期鎘暴露對子代雄鼠睪丸發育的影響及其潛在機制。方法" 將10周齡C57BL/6J雌雄小鼠隨機分為對照組和鎘暴露組。12周齡時,兩組小鼠分別按雌鼠/雄鼠為2∶1的比例合籠交配。鎘暴露組孕鼠繼續予低劑量鎘喂養至哺乳結束。子代雄鼠哺乳喂養至3周齡斷乳。斷乳后,部分3周齡雄性仔鼠終止實驗,另一部分按親代分組方式繼續喂養至10周齡。結果" 與對照組比較,鎘暴露組子代3周齡及10周齡小鼠睪丸組織內鎘濃度明顯升高,且10周齡小鼠明顯高于3周齡(Plt;0.05);鎘暴露組子代3周齡小鼠睪丸組織未見明顯損傷,cleaved caspase-3/caspase-3表達比例無明顯變化(Pgt;0.05);鎘暴露組子代10周齡小鼠睪丸生精上皮排列紊亂、生精細胞脫落,cleaved caspase-3/caspase-3、BAX/BCL-2的表達比例顯著升高(Plt;0.05),cleaved caspase-8/caspase-8、caspase-12、IRE1蛋白的表達無明顯變化(Pgt;0.05)。結論" 鎘可通過胎盤屏障進入子代雄鼠體內并在睪丸內蓄積,對幼年期睪丸發育無明顯損傷,但其不斷積累可通過增加睪丸細胞凋亡引起青春期雄性大鼠睪丸的損傷。
關鍵詞:鎘;雄性;子代;睪丸
中圖分類號:R114" " " " " " " " " " " " " " " " " "文獻標識碼:A" " " " " " " " " " " " " " " " "DOI:10.3969/j.issn.1006-1959.2024.19.011
文章編號:1006-1959(2024)19-0068-06
Effects of Cadmium Exposure on Testiculus of Mice Offspring at Different Weeks of Age
XIONG Lijuan1,ZHOU Bin2
(Department of Emergency1,Department of Endocrinology,Genetics and Metabolism2,Jiangxi Provincial
Children’s Hospital,Nanchang 330006,Jiangxi,China)
Abstract:Objective" To study the effects of cadmium exposure before pregnancy, during pregnancy and lactation on testiculus development of male offspring and its potential mechanism.Methods" Ten-week-old C57BL/6J male and female mice were randomly divided into control group and cadmium exposure group. At the age of 12 weeks, the two groups of mice were mated according to the ratio of female/male mice of 2∶1. The pregnant rats in the cadmium exposure group continued to be fed with low-dose cadmium until the end of lactation. The male offspring were fed to weaning at 3 weeks of age. After weaning, some 3-week-old male pups terminated the experiment, and the other part continued to be fed to 10 weeks of age according to the parental grouping method.Results" Compared with the control group, the cadmium concentration in the testiculus tissue of the 3-week-old and 10-week-old mice in the cadmium exposure group was significantly increased, and that in the 10-week-old mice were significantly higher than that in the 3-week-old mice (Plt;0.05). There was no significant damage to the testiculus tissue of the 3-week-old mice in the cadmium exposure group, and there was no significant change in the expression ratio of cleaved caspase-3/caspase-3 (Pgt;0.05). In the cadmium exposure group, the spermatogenic epithelium of the testis of the 10-week-old mice was disordered, the spermatogenic cells were detached, and the expression ratios of cleaved caspase-3/caspase-3 and BAX/BCL-2 were significantly increased (Plt;0.05).Conclusion" Cadmium can enter the male mice offspring through the placental barrier and accumulate in the testiculus, and has no obvious damage to the development of the testiculus in the juvenile stage, but its continuous accumulation can cause testiculus damage in adolescent male mice by increasing testiculus cell apoptosis.
Key words:Cadmium;Male;Offspring;Testiculus
近幾十年來,全球不孕不育率呈逐年上升趨勢,預計達8%~12%[1],其中因男性因素所致者占40%~50%[2],其年齡標準化患病率以每年0.291%的速率增加[1],已成為全球性的健康問題。男性特發性不育最常見,占男性不育癥的30%~50%[2]。男性特發性不育的發生與多種因素有關,包括不良生活習慣、社會心理壓力和環境毒物暴露等[3]。鎘(cadmium, Cd)是常見的有毒環境化學物之一,主要以化合物的形式(CdO, CdCl2或CdSO4等)存在于自然界中。隨著工業化的發展,鎘被廣泛應用于橡膠加工、鍍鋅工藝、塑料穩定劑、農藥和化肥等領域[4],并被釋放到水、空氣和土壤中造成環境污染。人類主要是通過食用受污染的食物、飲用受污染的水、吸煙等途徑吸收鎘。鎘進入人體后因排泄率極低、半衰期長,易在體內蓄積造成重要器官系統的損傷[7]。近年來,大量研究表明鎘具有生殖毒性[5,6]。流行病學調查表明[7,8],職業或非職業鎘暴露者血液和精液中的鎘濃度與精子參數和精子酶活性成反比。動物實驗表明[9-11],直接鎘暴露可通過損傷生精細胞、減少Sertoli和Leydig細胞、破壞血睪屏障等引起睪丸損傷。但目前的研究大多考慮鎘暴露后對成年子代雄鼠生殖的影響,而極少涉及對子代未成熟睪丸的影響。因此,本研究采用親代小鼠交配前開始鎘暴露至哺乳期結束,模擬人類孕前、孕期及哺乳期鎘暴露,旨在研究親代鎘暴露后對子代睪丸的影響。
1材料與方法
1.1主要儀器與試劑" HM325切片機(美國Thermo Fisher公司),BX43奧林巴斯顯微鏡(日本Olympus公司)及電感耦合等離子體質譜儀(ICP-MS, 美國Thermo Fisher公司)。氯化鎘(CdCl2·5H2O)(英國Alfa Aesar公司);硝酸(美國Thermo Fisher公司);TRIzol(美國Invitrogen公司);TaqMannbsp; 引物(美國Thermo Fisher公司);RT-PCR一步法成套試劑盒及DNA marker(美國Promega公司);山羊抗鼠/兔二抗(美國CST公司);兔源BAX一抗、兔源BCL-2一抗、兔源caspase-12 一抗(ABclonal公司);兔源cleaved caspase-3、兔源caspase-3、兔源CHOP、兔源cleaved caspase-8、兔源caspase-8、鼠源β-actin抗體(美國Santa Cruz公司)。化學發光試劑盒(美國Bio-Rad公司);TUNEL 試劑盒(美國Promega公司)。
1.2實驗動物分組" 8周齡SPF級C57BL/6 J小鼠(親代)雌性24只,體重(20.1±1.5)g;雄性12只,體重(25.5±1.1)g,由南昌大學實驗動物科學中心提供,動物合格證號SYXK(贛)-2015-0001。所有實驗動物飼養于獨立通風籠盒(IVC)的實驗動物房,維持恒溫(25 ℃),相對濕度為(55±5)%,12 h明暗循環。本實驗通過南昌大學動物福利倫理委員會批準。
1.3染毒方法" SPF級8周齡親代C57BL/6 J小鼠開始給予實驗室標準飲食,并予去離子水喂養。1周后,標準飲食改為AIN-76A純化飼料,以防止金屬污染,每周記錄用水量。10周齡時,親代小鼠分為兩組:對照組(飼糧為AIN-76A純化飼料和去離子水)和低劑量鎘暴露組(提供含鎘的飲用水,終濃度為5 mg/L),根據國際化學品安全計劃報道此劑量低于鎘的1% LD50,為低劑量鎘[11,12]。12周齡時,兩組小鼠分別按雌鼠/雄鼠為2∶1的比例合籠交配。鎘暴露組孕鼠繼續予低劑量鎘喂養直至哺乳結束。子代雄鼠哺乳喂養至3周齡斷乳。斷乳后稱重,以三溴乙醇(阿弗丁,250 mg/kg)麻醉小鼠后處死,收集部分雄性仔鼠睪丸;另部分雄性仔鼠按親代分組方式分別給予去離子水及含鎘飲用水喂養(終濃度為5 mg/L),直至10周齡。
1.4睪丸組織內鎘濃度測量" 采用電感耦合等離子體質譜(ICP-MS)儀測定睪丸內鎘的含量。切取約10~20 mg睪丸組織,置于2 ml試管中稱量。然后進行鎘濃度的測定,方法同本課題組前期研究發表文獻中的操作[11]。完成后,數據導出進行分析。
1.5睪丸組織病理損傷評價" 將睪丸在福爾馬林中固定至少24 h,然后進行石蠟包埋。用HM325切片機將石蠟包埋的睪丸樣品切成約4 μm厚的薄片。樣本切片用蘇木精和伊紅染色(Hamp;E),使用奧林巴斯BX43顯微鏡在100倍和400倍放大下觀察。
1.6 Western Blot檢測細胞凋亡相關蛋白" 切取20 mg組織塊置于2 ml凍存管中,加入400 μl組織裂解液,置于冰上,用組織勻漿器在冰上勻漿3次,每次10 s左右。將勻漿后的組織標本置于旋轉攪拌器上,4 ℃震蕩1 h,4 ℃ 12 000轉離心20 min,取上清液測蛋白質濃度并保存。與課題組既往實驗研究方法相同[13],取測好蛋白濃度的組織液制樣,采用12%聚丙烯酰胺凝膠電泳,電泳完畢后進行轉膜,進而封閉、敷抗體,最后進行曝光保存照片。對采集到的圖像使用 Image Lab軟件進行灰度值分析,以目的蛋白灰度值與內參β-actin灰度值的比值表示蛋白的相對表達水平。
1.7統計學方法" 所有數據均以(x±s)形式表示。采用t檢驗進行比較。GraphPad Prism 8軟件用于數據分析和圖表制作。Plt;0.05為差異有統計學意義。
2結果
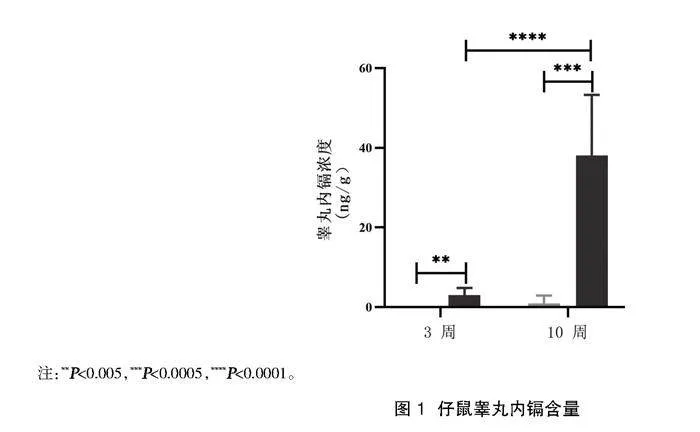
2.1仔鼠睪丸內鎘含量的測定" 與對照組3周齡仔鼠相比,鎘暴露組3周齡仔鼠睪丸組織內平均鎘含量升高,差異有統計學意義(Plt;0.05)。與對照組10周齡仔鼠相比,鎘暴露組10周齡仔鼠睪丸組織內平均鎘含量為(38.12±15.18)ng/g,明顯升高,差異有統計學意義(Plt;0.05);與鎘暴露組3周齡仔鼠相比,鎘暴露組10周齡仔鼠睪丸組織內平均鎘含量升高,差異有統計學意義(Plt;0.05)。鎘暴露后仔鼠睪丸內鎘含量的變化見圖1。
2.2仔鼠體重、睪丸重量及其臟器系數的測定結果" 與相對應周齡的對照組雄性仔鼠比較,鎘暴露組雄性仔鼠的體重、睪丸重量及睪丸系數比較,差異無統計學意義(Pgt;0.05)。鎘染毒仔鼠體重、睪丸重量及其臟器系數的變化見表2。
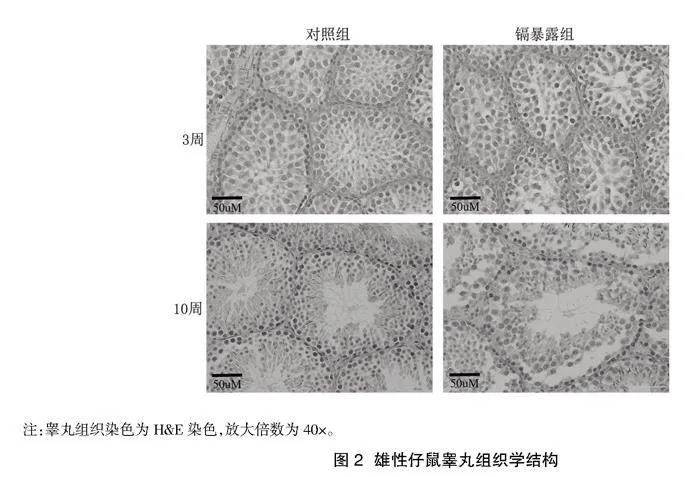
2.3鎘暴露對仔鼠睪丸組織結構的影響" 如圖2所示,睪丸組織Hamp;E染色結果顯示,對照組3周齡仔鼠睪丸組織內睪丸索規則排列,精原細胞及精母細胞形態完整;鎘暴露組3周齡仔鼠睪丸組織近似正常組織,睪丸索排列整齊,內可見精原細胞及精母細胞。對照組10周齡仔鼠睪丸生精上皮完整、連續,生精細胞排列整齊;鎘暴露組10周齡仔鼠睪丸生精上皮排列紊亂、生精細胞脫落。
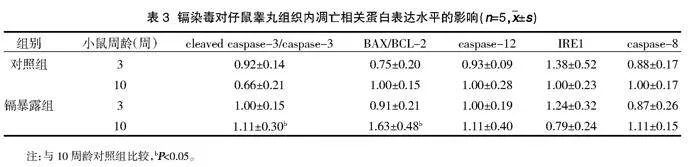
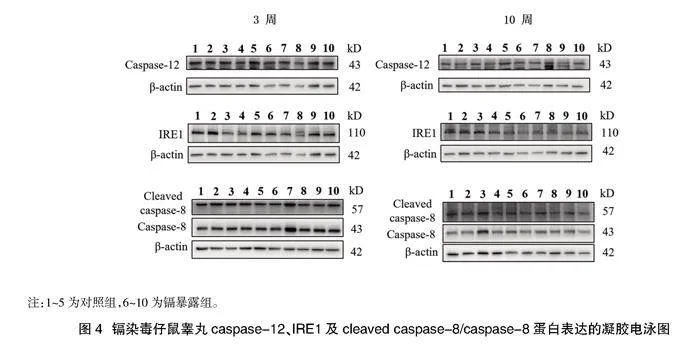
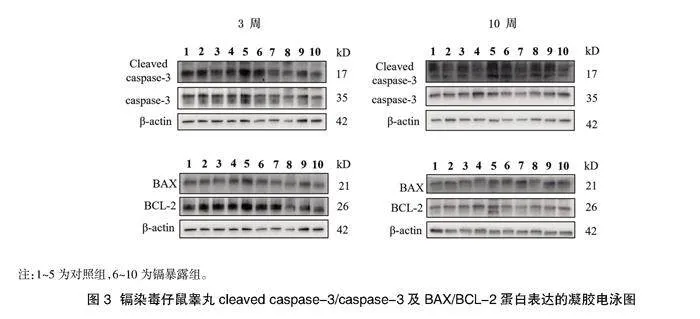
2.4仔鼠睪丸內細胞凋亡相關蛋白表達的影響" 與對照組3周齡相比較,鎘暴露組3周齡仔鼠睪丸組織內cleaved caspase-3/caspase-3表達比例無明顯升高,差異無統計學意義(Pgt;0.05),兩組間BAX/BCL-2、cleaved caspase-8/caspase-8表達比例及caspase-12、IRE1蛋白表達的比較,差異無統計學意義(Pgt;0.05);與對照組10周齡相比較,鎘暴露組10周齡仔鼠睪丸組織cleaved caspase-3/caspase-3及BAX/BCL-2的表達比例升高,差異有統計學意義(Plt;0.05);cleaved caspase-8/caspase-8表達比例及caspase-12、IRE1蛋白的表達與對照組比較,差異無統計學意義(Pgt;0.05),見表3、圖3、圖4。
3討論
隨著工業化的加速,鎘污染日漸加重。既往流行病調查研究發現鎘暴露與精子數量、精子質量等參數呈反比,提示男性不育可能與鎘污染有關。短時間大劑量鎘暴露或長時間小劑量鎘暴露后可通過引起小鼠睪丸內氧化應激、炎癥等直接損傷小鼠睪丸組織[14,15]。孕期、哺乳期鎘暴露可透過胎盤屏障將鎘傳給子代小鼠,引起成年子代雄鼠睪丸內雄性類固醇激素的活性,使睪酮水平下降,導致精子數量減少、精子質量下降[16,17]。目前研究大多集中在鎘暴露對自身睪丸的直接影響及對成年子代小鼠睪丸的影響,親代鎘暴露后對仔鼠睪丸的影響研究較少。因此,本研究擬建立親代小鼠鎘暴露模型,觀察親代鎘暴露后對未成年子代小鼠睪丸的影響。
ICP-MS檢測結果顯示,親代鎘暴露后可引起子代3周齡及10周齡小鼠睪丸內鎘含量升高,且10周齡小鼠睪丸內鎘含量高于3周齡子代小鼠。說明鎘可以通過胎盤屏障進入子代小鼠體內,并在子代小鼠睪丸內蓄積,與既往研究報道結果一致[18,19]。10周齡子代小鼠自3周齡時被停止哺乳后繼續飲用鎘污染水,導致鎘的蓄積增加,導致其睪丸內鎘含量高于3周齡子代小鼠睪丸內鎘含量。盡管鎘在子代小鼠睪丸內有明顯的蓄積,但對子代小鼠的體重及睪丸重量無明顯影響。
Huang Y等[20]的研究結果與本研究不一致,該研究對孕鼠灌胃進行鎘暴露[氯化鎘劑量分別為0.5、2、8 mg/(kg·d)],產下的第1代雌鼠再與正常雄鼠交配產下第2代小鼠,觀察鎘暴露對后兩代小鼠生殖的影響,采用電鏡觀察第1代和第2代21日齡小鼠睪丸的超微結構變化,發現高鎘暴露組(8 mg/kg)第1代小鼠睪丸內精原細胞核染色質聚集和細胞分裂,高鎘暴露組第2代小鼠睪丸內生精細胞出現核仁染色質聚集和核仁濃度升高,細胞質出現空泡現象,部分細胞出現碎裂,表明高鎘暴露組未成年子代小鼠的睪丸發生了結構損傷。本研究中鎘暴露組子代3周齡小鼠睪丸組織近似正常,睪丸索排列整齊,內有精原細胞及精母細胞,提示親代鎘暴露后雖然引起子代3周齡小鼠睪丸組織內鎘含量蓄積,但未引起睪丸組織的明顯損傷,這與上述研究結果不一致,這可能與給藥劑量不一致有關。本研究鎘暴露劑量為5 mg/L,根據國際化學品安全計劃(IPCS)報道此劑量低于鎘的1% LD50,為低劑量鎘暴露[11,12]。Huang Y等[20]研究中引起子代睪丸損傷的鎘暴露劑量為8 mg/kg,為大劑量鎘暴露,提示鎘在睪丸組織內需要達到一定的劑量才可能引起睪丸組織的損傷。鎘暴露組子代10周齡小鼠睪丸內生精上皮排列紊亂、生精細胞脫落,引起睪丸損傷。10周齡子代小鼠自3周齡時被停止哺乳后繼續飲用鎘污染水,鎘在睪丸組織內不斷蓄積增多而引起組織結構損傷,更進一步說明鎘可能需要在睪丸組織內需要達到一定的劑量才可能引起結構損傷。
鎘暴露組子代3周齡小鼠睪丸組織內cleaved caspase-3/caspase-3表達比例與對照組比較無統計學差異,且兩組間BAX/BCL-2、cleaved caspase-8/caspase-8表達比例及caspase-12、IRE1蛋白表達的比較無統計學差異,說明親代鎘暴露后對子代3周齡小鼠睪丸細胞的凋亡無明顯影響,與前所述不引起其睪丸組織損傷的結果一致。鎘暴露組子代10周齡小鼠睪丸組織內cleaved caspase-3/caspase-3表達比例較對照組升高,提示親代鎘暴露后引起子代10周齡小鼠睪丸細胞凋亡增加,與前述鎘暴露組子代10周齡小鼠睪丸組織病理損傷結果一致,提示親代鎘暴露疊加自身鎘暴露引起的睪丸損傷可能是由于鎘在睪丸內蓄積導致睪丸細胞凋亡增加而引起的。親代鎘暴露組子代10周齡小鼠睪丸組織BAX/BCL-2的表達比例較對照組升高,但cleaved caspase-8/caspase-8表達比例及caspase-12、IRE1蛋白的表達與對照組比較無統計學差異異,提示鎘暴露可能主要通過線粒體途徑引起子代10周齡小鼠睪丸細胞凋亡。
綜上所述,親代小鼠孕前至哺乳期鎘暴露后鎘可透過胎盤屏障進入子代小鼠體內,引起子代小鼠睪丸內鎘蓄積。鎘暴露對子代3周齡小鼠睪丸的組織學結構無明顯影響,沒有引起細胞凋亡的增加。子代3周齡小鼠斷乳后繼續進行鎘暴露至10周齡后,10周齡小鼠睪丸內鎘含量較3周齡明顯升高,且引起了睪丸組織結構損傷,其機制可能是通過線粒體途徑誘導睪丸細胞凋亡增多引起的。本研究未觀察子代3周齡小鼠體內鎘蓄積是否引起表觀遺傳學變化,未深入研究鎘暴露致子代10周齡小鼠睪丸細胞凋亡的具體機制,課題組將在未來的工作中進一步深入鎘暴露致子代小鼠的損傷機制,旨在為鎘暴露致后代男性不育的防治提供理論基礎。
參考文獻:
[1]Sun H,Gong TT,Jiang YT,et al.Global, regional, and national prevalence, and disability-adjusted life-years for infertility in 195 countries and territories, 1990-2017: results from a global burden of disease study, 2017[J].Aging (Albany NY),2019,11(23):10952-10991.
[2]Agarwal A,Baskaran S,Parekh N,et al.Male infertility[J].Lancet,2021,397(10271):319-333.
[3]Babakhanzadeh E,Nazari M,Ghasemifar S,et al.Some of the factors involved in male infertility: aprospectivereview[J].Int J Gen Med,2020,13:29-41.
[4]Xiong L,Zhou B,Liu H,et al.Comprehensive review of cadmium toxicity mechanisms in male reproduction and therapeutic strategies [J].Rev Environ Contam Toxicol,2021,258:151-193.
[5]Wang M,Wang XF,Li YM,et al.Crosstalk between autophagy and apoptosis regulates testicular injury/recovery induced by cadmium via PI3K with mTOR-independent pathway [J].Cell Death Dis,2020,11(1):46.
[6]Monta?o-González RI,Gutiérrez-Salmeán G,Mojica-Villegas MA,et al.Phycobiliproteins extract from Spirulina protects against single-dose cadmium-induced reproductive toxicity in male mice [J].Environ Sci Pollut Res Int,2022,29(12):17441-17455.
[7]He Y,Zou L,Luo W,et al.Heavy metal exposure, oxidative stress and semen quality: Exploring associations and mediation effects in reproductive-aged men[J].Chemosphere,2020,244:125498.
[8]Calogero AE,Fiore M,Giacone F,et al.Exposure to multiple metals/metalloids and human semen quality: A cross-sectional study[J].Ecotoxicol Environ Saf,2021,215:112165.
[9]Chen N,Su P,Wang M,et al.Ascorbic acid inhibits cadmium-induced disruption of the blood-testis barrier by regulating oxidative stress-mediated p38 MAPK pathways [J].Environ Sci Pollut Res Int,2018,25(22):21713-21720.
[10]Elblehi SS,El Euony OI,El-nahas AF.Partial ameliorative effect of Moringa leaf ethanolic extract on the reproductive toxicity and the expression of steroidogenic genes induced by subchronic cadmium in male rats [J].Environ Sci Pollut Res Int,2019,26(23):23306-23318.
[11]Xiong L,Zhou B,Young JL,et al.Exposure to low-dose cadmium induces testicular ferroptosis[J].Ecotoxicol Environ Saf,2022,234:113373.
[12]Bellinger D,Bolger M,Goyer R,et al.WHO food additives series 46: CADMIUM[EB/OL].(2006)[2023-08-10].https://inchem.org/documents/jecfa/jecmono/v46je11.htm.
[13]Xiong L,Zhou B,Young JL,et al.Effects of whole-life exposure to low-dose cadmium with post-weaning high-fat diet on offspring testes in a male mouse model [J].Chem Biol Interact,2022,353:109797.
[14]Faraji T,Momeni HR,Malmir M.Protective effects of silymarin on testis histopathology, oxidative stress indicators, antioxidant defence enzymes and serum testosterone in cadmium-treated mice [J].Andrologia,2019,51(5):e13242.
[15]Habib R,Wahdan SA,Gad AM,et al.Infliximab abrogates cadmium-induced testicular damage and spermiotoxicity via enhancement of steroidogenesis and suppression of inflammation and apoptosis mediators [J].Ecotoxicol Environ Saf,2019,182:109398.
[16]Zhou J,Zhang Y,Zeng L,et al.Paternal cadmium exposure affects testosterone synthesis by reducing the testicular cholesterol pool in offspring mice[J].Ecotoxicol Environ Saf,2022,242:113947.
[17]Zhang T,Gao X,Luo X,et al.The effects of long-term exposure to low doses of cadmium on the health of the next generation of mice[J].Chem Biol Interact,2019,312:108792.
[18]Tian H,Chen S,Leng Y,et al.Exposure to cadmium during gestation and lactation affects development and function of Leydig cells in male offspring[J].Environ Toxicol,2018,33(3):351-360.
[19]Wang Y,Li T,Li H,et al.CORO1A regulates lipoprotein uptake in Leydig cells exposed to cadmium[J].Ecotoxicol Environ Saf,2022,232:113255.
[20]Huang Y,Zhu J,Li H,et al.Cadmium exposure during prenatal development causes testosterone disruption in multigeneration via SF-1 signaling in rats [J].Food Chem Toxicol,2020,135:110897.
收稿日期:2023-08-16;修回日期:2023-09-27
編輯/肖婷婷
基金項目:1.江西省衛生廳科技計劃項目(編號:202130863);2.江西省自然科學基金青年基金項目(編號:20224BAB216028)
作者簡介:熊麗娟(1987.4-),女,江西豐城人,碩士,主治醫師,主要從事環境毒理學研究

