不同粒色小麥籽粒中葉酸及衍生物含量分析


摘要:葉酸在促進細胞生長、維持細胞活性、參與細胞增殖和分裂過程中起關鍵作用。彩色小麥富含花青素、鐵、鋅、硒等功能營養物質,人們對彩色小麥需求越來越大,為研究彩色小麥籽粒葉酸及衍生物的含量,以42 份不同粒色的小麥品種(系)為材料,利用高效液相色譜法測定了3 個生長條件籽粒中四氫葉酸(tetrahydrofolate,THF)、5-甲基四氫葉酸(5-CH3-THF)、5-甲酰基四氫葉酸(5-CHO-THF)和5,10-亞甲基四氫葉酸(5, 10-CH+THF) 4種葉酸衍生物的含量。結果表明,4種葉酸衍生物在不同粒色的小麥中均有分布,總葉酸含量變異范圍較廣,變異系數為18.34%~21.10%,其中臨4179總含量為66.99 μg·100g-1,為高葉酸含量品種。5-CH3-THF和5-CHO-THF含量約為總葉酸含量的70%,且與總葉酸含量顯著相關;紫粒和藍粒品種的總葉酸平均含量分別為62.31和62.97 μg·100 g-1,顯著高于白粒(41.90 μg·100 g-1)和紅粒品種(44.36 μg·100 g-1);基因型效應是影響總葉酸含量的主要因素,環境因素的影響較小。研究結果為小麥葉酸生物強化品種的選育和栽培提供了有價值的信息。
關鍵詞:小麥;粒色;葉酸;衍生物
doi:10.13304/j.nykjdb.2024.0184
中圖分類號:S512 文獻標志碼:A 文章編號:10080864(2024)11005610
葉酸(維生素B9)是一種水溶性B族維生素,由四氫葉酸及其衍生物組成。作為生命體必需的微量營養素,葉酸能促進細胞生長、維持細胞活性、參與細胞增殖和分裂,在機體的正常代謝和生長發育中起著重要作用[1]。不同葉酸衍生物的區別主要在于吡嗪環上有不同取代物,以及與鄰位氨基苯甲酰基谷氨酸結合的谷氨酸殘基。缺乏葉酸會引發許多疾病,主要有巨幼細胞貧血、動脈粥樣硬化和結直腸癌等[23]。對于孕婦而言,葉酸攝入不足可能會使嬰兒體重低,同時增加嬰兒患唇腭裂、心臟病和神經管畸形等疾病的風險[4]。目前每年約有790萬嬰兒患有出生缺陷,其中神經管畸形的發生率約占10%[56]。因此,如何合理、有效地補充葉酸,防止葉酸缺乏逐漸引起人們的重視。植物和微生物可自身合成葉酸,而動物和人類無法直接合成,必需依賴飲食攝入[7]。世界衛生組織推薦的葉酸攝入量為成人400 μg·d-1,孕婦600 μg·d-1 [8],葉酸缺乏現象多在貧窮地區和發展中國家發生[7,910]。通過服用藥片和加工食品補充葉酸以及多樣化飲食來攝入天然葉酸是解決葉酸缺乏癥的常用方法[7]。然而,藥片和加工食品的成本較高,這一方法在欠發達地區難以實施,而且攝入過多人工合成的葉酸會提高全基因組水平DNA甲基化,進而增加結腸癌、直腸癌和前列腺癌的患病風險,還會導致認知障礙[11-13]。由于經濟制約、飲食習慣或缺乏穩定的社會政策和持續的財政支持,世界上許多人無力消費除主食外的各種飲食[14]。因此,利用育種或栽培措施富集主糧作物的葉酸是一種健康、覆蓋面廣且經濟有效的方法,可使眾多欠發達地區人口受益。小麥是全球種植廣泛和較重要的糧食作物之一,其籽粒中的葉酸主要以四氫葉酸(tetrahydrofolate, THF)、5- 甲基- 四氫葉酸(5-methyltetrahydrofolate, 5-CH3-THF)、5-甲酰基-四氫葉酸(5-formyltetrahydrofolate, 5-CHO-THF)和5, 10-亞甲基- 四氫葉酸(5, 10-methylenetetrahydrofolate,5, 10-CH+THF)等形式存在[1516],培育富含葉酸的作物品種,通過日常飲食即可補充葉酸將有助于解決葉酸缺乏癥頻發的問題[17]。
根據籽粒種皮顏色的差異,小麥可分為普通的紅粒和白粒小麥,以及藍色和紫色的彩色小麥。彩色小麥富含植物蛋白、膳食纖維、維生素、微量元素和花青素、黃酮、生物堿、植物甾醇等活性物質,對改善糖尿病、貧血病以及心腦血管疾病有一定的功效[18]。彩色小麥營養豐富,常用于開發功能保健食品[19]。不同小麥品種間的葉酸含量差異較大,Davis等[20]研究發現,美國和加拿大的小麥中總葉酸含量為16~81 μg·100 g-1;Piironen等[21]報道普通小麥總葉酸含量范圍為32.3~77.4 μg·100 g-1;Arcot等[22]報道小麥總葉酸含量達48~114 μg·100 g-1;Riaz 等[15]對中國北方地區315 個小麥品種的籽粒葉酸含量進行研究,發現不同小麥品種間總葉酸含量變化范圍為10.15~91.44 μg·100 g-1;Zheng 等[16] 分析了262 份中國小麥微核心種質的葉酸含量,總葉酸含量變化范圍為22.68~111.77 μg·100 g-1。這些研究測定了小麥種質中總葉酸的含量,為葉酸的生物營養強化提供了一定的理論依據,但這些研究所選材料基本為普通小麥品種,暫無彩色小麥籽粒葉酸含量的研究,彩色小麥是否富含葉酸尚不明確。本研究采用高效液相色譜(high-performance liquid chromatography,HPLC)測定小麥籽粒中葉酸及其衍生物的含量,分析葉酸在不同粒色小麥中的分布規律和特點,研究結果可為小麥生物營養強化和主糧作物功能化提供有價值的信息。
1 材料與方法
1. 1 試驗材料
1.1.1 小麥材料 供試材料為42份小麥 (Triticumaestivum L.)品種(系),籽粒種皮顏色包括紅色、白色、藍色和紫色,由本課題組收集。所有材料分別于2018年(E1)、2019年(E2)和2021年(E3)種植于山西農業大學小麥研究所試驗基地(臨汾市36°2′N,111°18′ E),10月上旬播種,翌年6月中旬收獲。每份材料種4行,行長2 m,每行40粒。田間管理與大田生產一致,小麥籽粒收獲后晾干留用。
1.1.2 試驗試劑 THF、5-CH3-THF、5-CHO-THF和5, 10-CH+THF 標準品均購自瑞士SchircksLaboratories,純度分別為98.0%、98.4%、99.7% 和95.1%。甲醇、乙腈和甲酸(色譜純)均購自上海麥克林生化有限公司。β-巰基乙醇、抗壞血酸、α-淀粉酶和小鼠血清等生物試劑購自阿拉丁試劑(上海)有限公司。磷酸二氫鉀和三水磷酸氫二鉀為分析純,購自上海生工生物工程股份有限公司。
1.1.3 試驗主要儀器 1260 Infinity 高效液相色譜儀(Agilent Technology)、JFS-13A 型實驗室旋風式粉粹磨(杭州大成光電儀器有限公司)、SB-5200DT 超聲脫氣機(寧波新芝生物科技股份有限公司)、AllegraX-30R 高速低溫離心機(BeckmanCoulter)、MX-S 旋渦儀(SCILOGEX)。
1. 2 葉酸標準儲備液制備
準確稱取THF、5-CH3-THF、5-CHO-THF 和5, 10-CH+THF標準品各5.0 mg,分別轉移至10 mL棕色容量瓶中,用pH 7.0的20 mmol·L-1磷酸緩沖液(含質量體積分數1% 的抗壞血酸和體積分數0.1%的β-巰基乙醇)定容,均配置成質量濃度為0.5 mg·mL-1 的葉酸標準儲備液,于-20 ℃冷凍儲藏,制作標準曲線時分別取葉酸標準儲備液稀釋,此過程需在避光條件下進行。
1.3 樣品制備及葉酸測定
將籽粒烘干至14%的含水量,使用旋風式粉粹機將小麥籽粒磨粉(過100目篩),稱取0.10 g全麥粉加入1.0 mL新配置的磷酸緩沖液,使用漩渦儀充分混合。為防止葉酸衍生物相互轉化,首先沸水浴5 min,取出后迅速置于冰上冷卻,加入50 μL α-淀粉酶溶液混勻后37 ℃孵育30 min,每10 min振蕩1次。沸水浴3 min使α-淀粉酶滅活后迅速置于冰上冷卻,加入20 μL 小鼠血清后37 ℃孵育2 h,每20 min振蕩1次。經小鼠血清孵育后,沸水浴3 min 滅活,冰上冷卻,4 ℃條件下12 000 r·min-1離心10 min,將上清液轉移至3 kD超濾離心管中離心30 min (4 ℃、12 000 r·min-1),取上清液-20 ℃保存備用。
1.4 色譜參數及方法學驗證
Agilent1260 高效液相色譜儀系統為AgilentChem Station,配備紫外檢測器,樣品環體積為20 μL,色譜柱為Akzo Nobel 100-5 C18分析柱,規格50.0 mm×2.1 mm。流動相A和B分別為水和乙腈,二者均含體積分數0.1% 的甲酸。流動相過0.22 μm有機濾膜后經超聲脫氣機20 min。梯度洗脫10 min,流速0.2 mL·min-1,紫外檢測器檢測波長280 nm。進樣器和色譜柱柱溫箱的溫度分別保持在4和25 °C。初始洗脫條件為95.0%流動相A和5.0%流動相B;在接下來的2 min內,流動相B的比例從5.0%增加至9.0%;8 min時,流動相B 的比例從9.0% 增加至9.6%;隨后的2 min 內B相的比例降低到初始的比例,最后達到平衡。葉酸標準品用于確定洗脫條件和保留時間,樣品中葉酸各衍生物通過保留時間鑒定,根據色譜系統Agilent Chem Station 自動積分獲取峰面積,外標法定量,每個樣品測定3次取平均值。
提取臨6308和晉麥47葉酸后分別以添加標品和不加標品的處理作為對照,測定3次取平均值,檢測各葉酸衍生物的加標回收率;重復提取5次品臨6308葉酸,檢測葉酸衍生物含量,計算相對標準偏差(relative standard deviation,RSD),評價檢測方法的精密度和準確度。
1.5 數據處理
利用JMP Pro16 (2022 JMP Statistical DiscoveryLLC)求最佳線性無偏預測(best linear unbiasedprediction, BLUP)以及廣義遺傳力,使用SPSS26.0 (IBM SPSS Statistics;IBM Corp., Armonk, NY,United States)進行相關性分析和差異顯著性比較,使用Origin 2022b繪制高效液相色譜圖及標準曲線。
2 結果與分析
2.1 方法學驗證結果
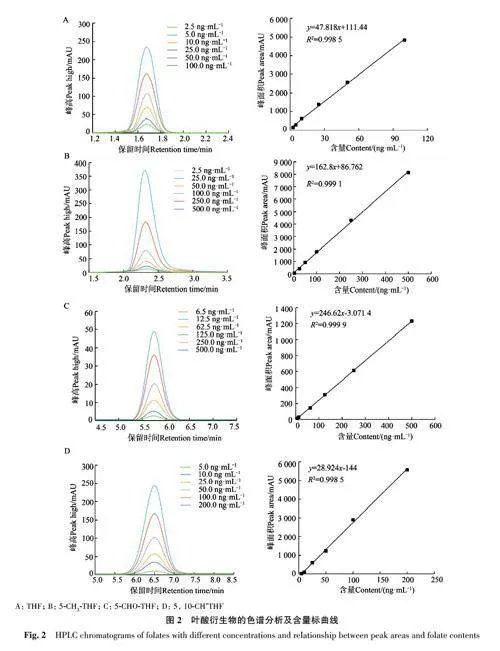
標準品THF、5-CH3-THF、5-CHO-THF和5,10-CH+THF分別用磷酸緩沖液(20 mmol·L-1,pH 7.0)溶解,經HPLC 分析,確定THF、5-CH3-THF、5-CHO-THF 和5, 10-CH+THF 的保留時間分別為1.69、2.30、5.75和6.50 min(圖1)。從圖1可以看出,不同葉酸衍生物色譜圖基線平穩,標品峰形較好,無明顯拖尾。不同葉酸衍生物標準溶液質量濃度從低到高依次進樣,峰面積外標法進行定量分析。標準曲線回歸方程的線性良好,根據對應的出峰時間和峰面積,代入相應的標準曲線中即可求得樣品中葉酸衍生物的含量(圖2)。
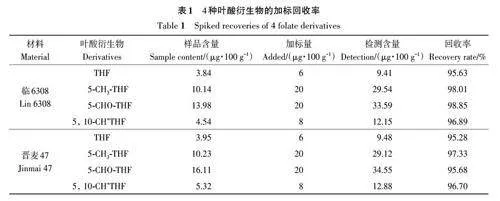
檢測添加標品和不加標品的臨6308和晉麥47各葉酸衍生物含量,結果表明各葉酸衍生物的加標回收率均在95.00%以上,進一步說明檢測方法準確可靠(表1)。
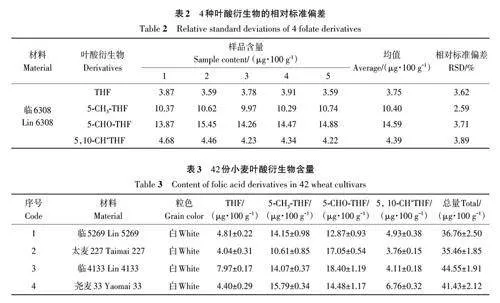
選擇臨6308重復測定各葉酸衍生物含量以驗證方法精密度,發現葉酸衍生物含量RSD均小于4.00%(表2),說明提取和檢測方法具有較好精密度和重復性。
2.2 小麥籽粒葉酸含量分析
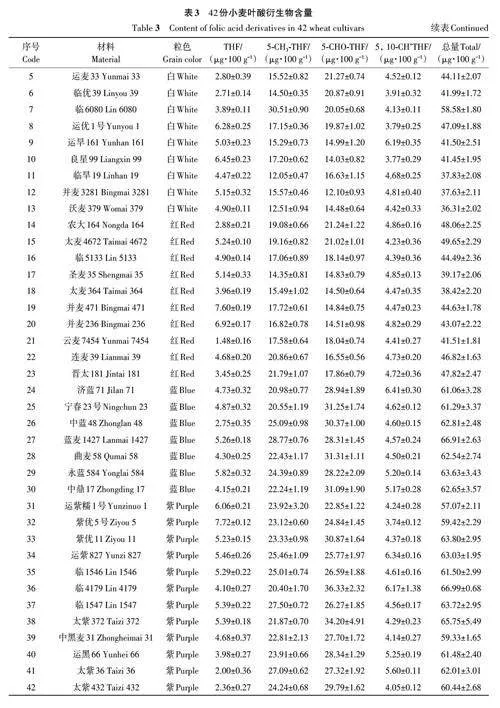
對3個環境下收獲的材料提取葉酸,4種葉酸衍生物在不同粒色的小麥中均有分布(表3)。不同小麥品種的總葉酸含量變異范圍較大,變異系數為18.34%~21.10%;3個環境下含量范圍分別為35.49~71.02、37.29~69.50和33.60~66.67 μg·100 g-1,平均值分別為52.01、53.84和49.41 μg·100 g-1。E1環境下總葉酸含量最高的3個品種分別為太紫372、臨4179、運紫827;E2環境下為紫優11、臨1547和臨4179;E3環境下為臨4179、紫優11和運紫827。其中臨4179 在3 個環境下總葉酸含量均超過65 μg·100 g-1,是高葉酸含量的品種;臨6080 的5-CH3-THF含量在所有品種中最高。
2.3 粒色對小麥葉酸含量的影響
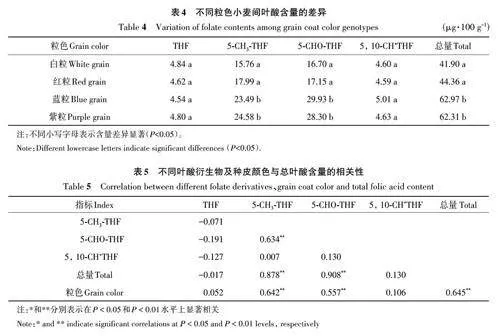
根據種皮顏色將小麥分為白粒、紅粒、藍粒和紫粒,對不同顏色籽粒中葉酸及衍生物含量進行比較,結果(表4)表明,紫粒和藍粒小麥的總葉酸含量分別為62.31和61.97 μg·100 g-1,白粒和紅粒小麥總葉酸含量分別41.90和44.36 μg·100 g-1,紫粒和藍粒小麥的總葉酸含量顯著高于白粒和紅粒小麥。紫粒和藍粒小麥的5-CH3-THF 和5-CHOTHF平均含量顯著高于白粒和紅粒小麥,而THF和5-CHO+THF含量差異不顯著。白粒和紅粒小麥以及紫粒和藍粒小麥相比,THF、5-CH3-THF、5-CHO-THF和5,10-CH+THF以及總葉酸含量均無明顯差異。紫粒和藍粒品種的5-CH3-THF、5-CHO-THF 和總葉酸含量顯著高于白粒和紅粒品種。
2.4 各成分和種皮顏色與總量的相關性
對不同葉酸衍生物與總葉酸含量進行相關性分析,結果(表5)表明,5-CH3-THF和5-CHO-THF與總葉酸的含量間存在顯著相關性,同時5-CH3-THF 和5-CHO-THF 之間也存在顯著相關性。種皮顏色與5-CH3-THF、5-CHO-THF 以及總葉酸含量間存在顯著相關性,而THF和5,10-CH+THF與總葉酸含量以及種皮顏色間相關性都不顯著。
2.5 基因型、環境及其互作對葉酸含量的影響
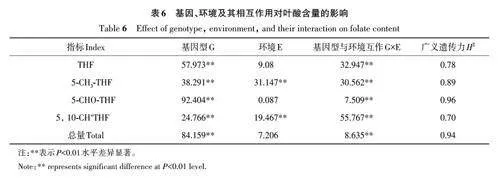
以3個環境下籽粒中各葉酸衍生物含量以及總葉酸含量研究基因型(genotype,G)、環境(environment,E)及其互作(G×E)對葉酸含量的影響,結果(表6)表明,基因型效應(G)和基因型與環境互作效應(G×E) 對籽粒總葉酸含量的影響均達到極顯著水平。基因型對4種葉酸衍生物的含量均有顯著影響;而環境條件僅對5-CH3-THF和5,10-CH+THF 有顯著影響。對THF、5-CHOTHF和總葉酸含量的影響排序為Ggt;G×Egt;E,對5-CH3-THF變化的影響排序為Ggt;Egt;G×E,而對5,10-CH+THF 變化的影響排序為G×Egt;Ggt;E。上述結果表明,基因型是影響葉酸含量的主要因素,環境因素對葉酸含量的影響較小。
3 討論
當前葉酸測定方法主要有微生物法、紫外-可見分光光度法、熒光分析法、高效液相色譜法等[23-27]。微生物法是經典的葉酸測定方法,根據微生物對樣品中葉酸的吸收程度從而對葉酸進行定量,能測定基質中總葉酸的含量。微生物法檢測結果較為準確且成本低,但只能檢測待測樣品中總葉酸的含量,不同的葉酸衍生物無法區分,且實驗周期長、批次間檢測結果重復性較差。紫外-分光光度法操作簡便,對提取條件要求低,但只能測定葉酸總量,無法檢測不同組分含量,且溶劑種類易造成較大誤差。熒光分析法雖較紫外分光光度法靈敏度較高,但是葉酸本身發射出的熒光強度較弱,因此常需加入敏化劑,如高錳酸鉀、芬頓試劑或過硫酸鉀等,而敏化劑的加入常使測定結果誤差變大。高效液相色譜法對不同的葉酸衍生物分離效果好、選擇靈敏性強,可與多種技術聯用,是目前使用最廣泛的葉酸檢測方法,已應用于果蔬和作物中不同葉酸衍生物含量的測定[28-30]。因此,本研究采用了高效液相色譜法來測定小麥籽粒中的葉酸含量。已有研究表明,THF、5-CH3-THF、5-CHO-THF 和5, 10-CH+THF 這4種葉酸衍生物占小麥籽粒總葉酸含量的90%以上,是小麥籽粒中葉酸的主要存在形式[1516,3132]。由于種質來源和測定方法的不同,前人對小麥籽粒中葉酸含量的測定結果略有差異。Piironen等[21]采用微生物法測定了種植在同一地點的150份小麥品種的總葉酸含量,含量范圍為32.3~77.4 μg·100 g-1,同時他們選用高效液相色譜法分析了9 份小麥品種中不同葉酸衍生物的含量,5-CHO-THF 是小麥葉酸的主要存在形式。Riaz等[15]采用高效液相色譜法測定了360份小麥品種中葉酸的含量,范圍為(10.15±2.86)~(91.44±5.64) μg·100 g-1,5-CH3-THF 和5-CHO-THF 是小麥籽粒中葉酸的主要存在形式,這與本文的研究結果一致。但Riaz等[15]的研究結果中不同環境下的共有品種數較少,本文篩選到多個環境中葉酸總含量均高于65 μg·100 g-1的品種有臨4179,同時臨6080的5-CH3-THF含量顯著高于其余品種,這些材料可為生物強化品種選育提供種質資源。
彩色小麥籽粒的顏色越深,其花青苷的含量越高,可達常規小麥的2~6倍,同時藍粒和紫粒小麥品種的品質性狀普遍優于白粒品種[33]。但葉酸含量是否與種皮顏色有關,目前暫無相關研究報道。本文通過比較42份不同粒色小麥的葉酸含量,發現藍粒和紫粒小麥總葉酸含量顯著高于紅粒和白粒種質,但紅粒和白粒種質間及藍粒與紫粒小麥種質間總葉酸含量無明顯差異,可能是因為相較于紅粒和白粒種質,藍粒和紫粒小麥的種皮和糊粉層含有較多的次生代謝產物,在代謝產物積累的同時也積累了葉酸不同衍生物。但需要注意的是,造成不同粒色間葉酸含量差異的原因也可能與本實驗選擇的品種數偏少有關。Shewry等[34]將相同小麥品種種植到不同國家,收獲后測定籽粒中葉酸的含量,發現環境對總葉酸含量影響顯著,基因型的影響較小。Riaz等[15]發現,小麥葉酸含量除受環境影響之外,基因和基因×環境互作效應對葉酸含量的影響也達到極顯著水平。這與本文得出基因型是影響葉酸含量的關鍵因素的結論不一致,可能是由于Shewry 等[34]和Riaz等[15]的研究采用的材料份數較少或不同環境下的共有品種數較少,不能準確分析基因型和環境對小麥葉酸含量的影響。Zheng等[16]以中國小麥微核心種質為材料,測定不同環境下收獲的籽粒葉酸含量,發現影響葉酸含量的主要因素是基因型,本文測定了42份不同粒色的小麥在不同環境下收獲后籽粒的葉酸含量,得出了一致的結論。這些結果為今后小麥葉酸及衍生物營養強化品種的選育和推廣提供了有價值的信息。
參考文獻
[1] EDELMANN M, KARILUOTO S, NYSTR?M L, et al .. Folate
in oats and its milling fractions [J]. Food Chem., 2012, 135(3):
1938-1947.
[2] 張婷,李光輝.妊娠期母體葉酸水平與母兒結局的研究進
展[J].中國全科醫學, 2019, 22(3): 253-257,262.
ZHANG T, LI G H. Research progress on maternal folic acid
level and pregnancy outcomes [J]. Chin. Gen. Practice, 2019,
22(3): 253-257,262.
[3] FIELD M S, KAMYNINA E, CHON J, et al .. Nuclear folate
metabolism [J]. Annu. Rev. Nutr., 2018, 38: 219-243.
[4] CZEIZEL A E, DUDáS I, VERECZKEY A, et al .. Folate
deficiency and folic acid supplementation: the prevention of
neural-tube defects and congenital heart defects [J]. Nutrients,
2013, 5(11): 4760-4775.
[5] RADER J I, SCHNEEMAN B O. Prevalence of neural tube
defects, folate status, and folate fortification of enriched cerealgrain
products in the United States [J]. Pediatrics, 2006, 117(4):
1394-1399.
[6] BHUTTA Z A, SALAM R A. Global nutrition epidemiology
and trends [J]. Ann. Nutr. Metab., 2012, 61(S1): 19-27.
[7] JHA A B, ASHOKKUMAR K, DIAPARI M, et al .. Genetic
diversity of folate profiles in seeds of common bean, lentil, chickpea
and pea [J]. J. Food Compos. Anal., 2015, 42: 134-140.
[8] REBEILLE F, RAVANEL S, JABRIN S, et al .. Folates in
plants: biosynthesis, distribution, and enhancement [J]. Physiol.
Plant, 2006, 126(3): 330-342.
[9] BLANCQUAERT D, VAN D J, STROBBE S, et al .. Improving
folate (vitamin B9) stability in biofortified rice through metabolic
engineering [J]. Nat. Biotechnol., 2015, 33(10): 1076-1078.
[10] KHALILI M, RAD A H, KHOSROUSHAHI A Y, et al ..
Application of probiotics in folate bio-fortification of yoghurt [J].
Probiotics Antimicrob. Proteins, 2020, 12(2): 756-763.
[11] CRIDER K S, YANG T P, BERRY R J, et al .. Folate and DNA
methylation: a review of molecular mechanisms and the evidence
for folate’s role [J]. Adv. Nutr., 2012, 3(1): 21-38.
[12] RAKSZEGI M, BOROS D, KUTI C, et al.. Compositionand enduse
quality of 150 wheat lines selected for the HEALTHGRAIN
diversityscreen [J]. J. Agric. Food Chem., 2008, 56(21): 9750-
9757.
[13] CAO X Y, XU J F, LIN Y L, et al .. Excess folic acid intake
increases DNA de novo point mutations [J/OL]. Cell Discov.,
2023, 9(1): 22 [2024-05-20]. https://doi. org/10.1038/s41421-
022-00512-0.
[14] BOTTO L D, LISI A, ROBERT-GNANSIA E, et al ..
International retrospective cohort study of neural tube defects
in relation to folic acid recommendations: are the recommendations
working? [J/OL] BMJ, 2005, 330(7491): 571 [2024-05-23].
https://doi.org/10.1136/bmj.38336.664352.82.
[15] RIAZ B, LIANG Q J, WAN X, et al .. Folate content analysis of
wheat cultivars developed in the North China Plain [J]. Food
Chem., 2019, 289:377-383.
[16] ZHENG J, WANG X S, WU B B, et al .. Folate (vitamin B9)
content analysis in bread wheat (Triticum aestivum L.) [J/OL].
Front. Nutr., 2022, 9: 933358 [2024-05-20]. https://doi.org/
10.3389/fnut.2022.933358.
[17] STROBBE S, VAN D S D. Folate biofortification in food crops [J].
Curr. Opin. Biotechnol., 2017, 44: 202-211.
[18] GUO Z F, ZHANG Z B, XU P, et al .. Analysis of nutrient
compositions of purple wheats [J]. Cereal Res. Commun., 2013,
41(2): 293-303.
[19] 張小燕,高遒竹,高向陽.特殊粒色小麥研究進展[J].糧油食
品科技, 2016, 24(4): 7-11.
ZHAO X Y, GAO Q Z, GAO X Y. Research progress on
special color wheat [J]. Sci. Technol. Cereals, Oils Foods,
2016, 24(4): 7-11.
[20] DAVIS K R, PETERS L J, LETOURNEAU D. Variability of the
vitamin content in wheat [J]. Cereal Food World, 1984, 29: 364-370.
[21] PIIRONEN V, EDELMANN M, KARILUOTO S, et al .. Folate
in wheat genotypes in the HEALTHGRAIN Diversity Screen [J].
J. Agric. Food Chem., 2008, 56(21): 9726-9731.
[22] ARCOT J, WOOTTON M, ALURY S, et al .. Folate levels in
twelve Australian wheats and changes during processing into
bread [J]. Food Aust., 2002, 54(1,2): 18-20.
[23] 郭健,李敏,孟妍,等.熒光分光光度法測定食品中葉酸的含
量[J].中國公共衛生, 2003, 19(10): 111.
[24] PANDRANGI S, LABORDE L F. Optimization of microbiological
assay of folic acid and determination of folate content in
spinach [J]. Int. J. Food Sci. Technol., 2004, 39(5): 525-532.
[25] 常娜寧,姜凌,蒲訓,等.作物葉酸檢測方法的研究進展[J].中
國農業科技導報, 2010, 12(2): 44-49.
CHANG N N, JIANG L, PU X, et al .. Research progress on
methodology for folate detection in crops [J]. J. Agric. Sci.
Technol., 2010, 12(2): 44-49.
[26] 蘇文斌. Fenton試劑氧化?熒光分析法測定果蔬中葉酸的含
量[J].食品科學, 2011, 32(4): 212-215.
SU W B. Fluorimetric determination of folic acid in vegetable
samples using Fenton reagent as oxidant [J]. Food Sci., 2011,
32(4): 212-215.
[27] 吳姝,陳思,胡琪,等.光催化氧化熒光衍生法檢測葉酸[J].分
析科學學報, 2022, 38(1): 1-5.
WU S, CHENG S, HU Q, et al .. Determination of folic acid
based on Photo-catalytic oxidation fluorescence derivatization [J]. J.
Anal. Sci., 2022,38(1): 1-5.
[28] EL?BIETA G, ANDRZEJ K. Determination of folate in some
cereals and commercial cereal-grain products consumed in
Poland using trienzyme extraction and high-performance liquid
chromatography methods [J]. Eur. Food Res. Technol., 2005,
221: 208-213.
[29] ZHANG G F, STOROZHENKO S, VAN DER STRAETEN D,
et al .. Investigation of the extraction behavior of the main
monoglutamate folates from spinach by liquid chromatographyelectrospray
ionization tandem mass spectrometry [J]. J.
Chromatogr. A, 2005, 1078(1,2): 59-66.
[30] PóO-PRIETO R, HAYTOWITZ D B, HOLDEN J M, et al ..
Use of the affinity/HPLC method for quantitative estimation of
folic acid in enriched cereal-grain products [J]. J. Nutr., 2006,
136(12): 3079-3083.
[31] PFEIFFER C M, ROGERS L M, GREGORY J F. Determination of
folate in cereal-grain food products using trienzyme extraction and
combined affinity and reversedphase liquid chromatography [J]. J.
Agric. Food Chem., 1997, 45(2): 407-413.
[32] UPADHYAYA P, TYAGI K, SARMA S, et al .. Natural
variation in folate levels among tomato (Solanum lycopersicum)
accessions [J]. Food Chem., 2017, 217: 610-619.
[33] 李杏普,蘭素缺,劉玉平.藍、紫粒小麥籽粒色素及其相關生
理生化特性的研究[J].作物學報, 2003,29(1):157-158.
LI X P, LAN S Q, LIU Y P. Studies on pigment and It’s related
physio-biochemical properties of blue or purple grain wheat [J].
Acta Agronomica Sinica, 2003, 29(1): 157-158.
[34] SHEWRY P R, PIIRONEN V, LAMPI A M, et al .. Effects of
genotype and environment on the content and composition of
phytochemicals and dietary fiber components in rye in the
HEALTHGRAIN diversity screen [J]. J. Agric. Food Chem.,
2010, 58(17): 9372-9383.

