木霉菌生防作用機制及協同防病的研究進展
摘要:木霉菌是一種廣泛分布的絲狀真菌,因其優秀的生防潛力,木霉菌在農業上被廣泛用作生物殺菌劑,用于防治多種植物病害。木霉菌能夠通過不同的直接作用機制(真菌寄生以及產生細胞壁裂解酶、抗生作用、爭奪空間或養分)或間接作用機制(誘導植物防御)來減少病原體引起的植物疾病。近年來,復合型的生防菌劑越來越受到重視,木霉菌因其對化學農藥的抗性以及與根際微生物的相容性,可以與其他生防產品協同使用產生更好的生防效果。綜述了木霉菌的相關作用機制,包括寄生、抗生作用、營養競爭和植物抗性的誘導,討論了其當前研究進展。此外,對木霉菌與其他具有防病效果的微生物或非生物(化學殺菌劑、其他物質)的協同防病研究進展進行綜述,探究目前研究現狀以及使用木霉作為生物殺菌劑的發展前景。
關鍵詞:木霉;生物防治;協同作用
doi:10.13304/j.nykjdb.2023.0524
中圖分類號:S476 文獻標志碼:A 文章編號:10080864(2024)11012610
農業在推動人類文明進步的過程中起到至關重要的作用。然而,許多重要的農業作物在種植過程中會受到植物病原菌的攻擊,從而導致嚴重減產,最終威脅到全球糧食安全。為了控制這些病原菌,化學農藥被廣泛施用,但也對生態環境造成了嚴重危害。近幾十年來,農業環境受到化學農藥的嚴重威脅,化學農藥的廣泛施用導致農藥中的相關化學成分滲入土壤,長期積累會對土壤質量產生破壞。受到農藥污染的土壤無法提供充足的養分和生物活性,對農作物生長不利。此外,農藥的施用還會導致農田徑流中的農藥殘留進入水體,對水體生態系統造成污染,影響水質和水生物健康。為保護環境免受化學藥劑的危害,生物農藥開始被廣泛研究。生物農藥是指利用生物活體(真菌、細菌、昆蟲病毒、轉基因生物等)或其代謝產物(信息素、生長素等)對農業有害生物進行殺滅或抑制的制劑,也稱天然農藥[1]。與化學農藥相比,生物農藥具有高效、選擇性強、低殘留、不易產生抗藥性等優點。在如今環境保護、綠色發展等理念的支持下,生物農藥的發展獲得越來越大的空間。
在生物防治劑中,木霉菌(Trichoderma)是當下研究的熱門菌種之一。木霉菌是一種絲狀真菌,廣泛分布于世界各地,通常定居在腐爛的木材或其他形式的有機植物物質內[2]。木霉菌是各種土壤生態系統(如農田、草原、森林、鹽沼和沙漠)真菌生物群的主要組成部分,包括溫帶和熱帶地區、南極洲和苔原[3]。它既可以作為生物防治劑,也可以作為生長促進劑。作為一種常用的生物防治劑,木霉菌可以防治多種植物病害。木霉菌可以有效地定殖于植物組織、根際和植物根部,并產生多種具有抗菌(細胞壁降解酶、抗生素、揮發性和非揮發性化合物)和生物刺激(植物激素、植物調節劑)特征的代謝物。木霉菌還可以直接作用于病原微生物,與整個土壤微生物組進行互作,改變土壤微生物群落。木霉菌在農業中的應用,能夠促進植物生長,提高植物對非生物脅迫的耐受性,并作為直接和間接的生物防治制劑(biological control agents,BCA)發揮作用,是近年來農業應用潛力最大的微生物群之一。本文綜述了木霉菌作為生防劑的作用機制和木霉菌的協同防病應用,并探究木霉菌的應用前景,旨在為開發木霉菌生物殺菌劑提供參考。
1 木霉的生物防治機制
1.1 真菌寄生
一種真菌(宿主)被另一種真菌(寄生真菌)寄生通常被稱為真菌寄生現象[4]。寄生真菌以寄生的方式從另一種真菌那里獲得一些營養物質。真菌寄生過程由4個不同的階段組成[5]。在第1階段,由化學動力吸引拮抗真菌;在第2階段,特異性識別發生;在第3階段,寄生真菌對宿主進行攻擊并纏繞菌絲;在第4階段,分泌裂解酶和抗真菌化合物來降解宿主的細胞壁。木霉菌是一種典型的真菌寄生真菌。對各木霉種基因組的比較分析表明,真菌寄生是木霉的共有生活方式。細胞壁降解酶(cell walldegradingenzymes,CWDES)是木霉進行真菌寄生的關鍵成分。胞外酶(如內幾丁質酶、β-1,3-葡聚糖酶和蛋白酶[6])是木霉菌分泌降解真菌細胞壁的主要酶,特異性碳水化合物結合蛋白稱為凝集素[7],在木霉菌對宿主真菌的細胞識別中起關鍵作用。初步識別時,木霉菌絲纏繞病原菌菌絲并滲透到宿主細胞表面(形成鉤子和附著胞形態),在幾丁質酶和葡聚糖酶的介導下分解幾丁質。隨后,真菌寄生真菌的菌絲釋放抗生素化合物,這些化合物滲透到受影響的菌絲中并抑制細胞壁的再合成,它們靶向病原真菌細胞壁的β-葡聚糖和幾丁質聚合物中的糖苷鍵,導致菌絲形態發生扭曲,如斷裂、腫脹和孔洞[8],從而抑制病原菌生長。
1.2 抗生作用和次級代謝產物的生成
抗生現象是指2個微生物之間的拮抗作用,其中1個微生物受到另1個微生物釋放的代謝產物或抗生素的不利影響。抗生現象是決定真菌腐生能力的重要指標,這種現象在包括木霉菌在內的各種真菌中都有觀察到,木霉菌可以產生許多具有拮抗作用的化合物,這些化合物包括細胞壁降解酶[9],如纖維素酶、木聚糖酶、果膠酶、葡聚糖酶、脂肪酶、淀粉酶、阿拉伯糖酶和蛋白酶。
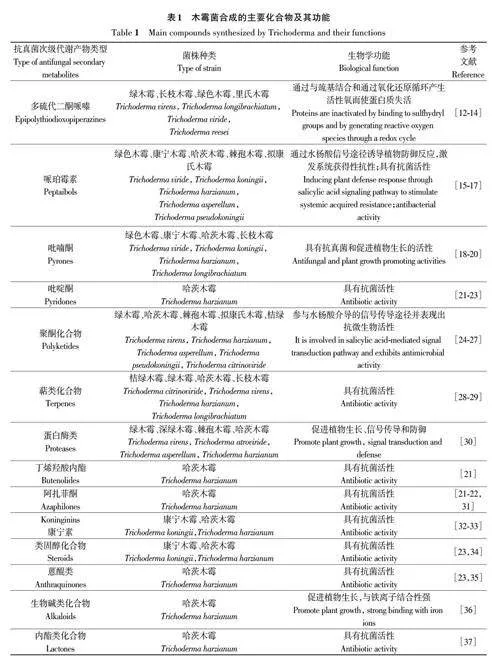
近年來,一些效應分子,如蛋白質、次級代謝產物(secondary metabolites,SMS)和小RNAs,已經被鑒定出來,它們改變植物生理、功能和結構的能力已被研究。這些效應分子可以促進木霉菌對宿主的定殖,激活防御機制[10],或者作為抑制病原體的生物活性分子[10]。目前已發現木霉菌可產生超過370種的SMS,其大多數具有強拮抗特性。多數木霉菌株都能產生非揮發和揮發性化合物(volatile organiccompounds,VOCs)。其中,主要產生代謝產物的木霉菌種類包括綠木霉(Trichoderma virens)、長枝木霉(Trichoderma longibrachiatum)、綠色木霉(Trichoderma"viride)、康寧木霉(Trichoderma koningii)、哈茨木霉(Trichoderma harzianum)、棘孢木霉(Trichodermaasperellum)等[11]。針對木霉屬真菌不同的抗真菌活性成分,將主要的木霉抗菌SMS進行分類,如表1所示。
1.3 營養和空間競爭
為了維持微生物種群的生存,當多種微生物存在于同一群落并共享有限的營養物質時,營養物質的競爭對它們的生存至關重要。有益真菌可以通過定殖植物組織、根際或葉際來剝奪病原體的空間和營養物質。理論上,所有真菌可在一定程度上采用這種作用模式,這取決于它們的性質以及對宿主植物和環境的適應[38]。木霉菌能夠產生一系列拮抗化合物(如抗生和代謝化合物),這些化合物與木霉的快速定殖能力相結合,可以占據根際空間,有利于植物的生長和限制其他潛在致病微生物的發展。然而,這種策略也被其他對植物有益真菌所采用,它們也能表現出高效的定殖機制來占據根際空間和內生區域。因此,在選擇木霉生防菌(或其他生防微生物)時,必需對植物有益生物如植物促生細菌(plant grwth-promotingbacterium, PGPB)進行拮抗試驗,以確定它們之間的協同或有害潛力。此外,木霉菌株對植物產生的抗菌化合物(如植保素、酚類和黃酮類化合物)具有耐藥性,這使得它們在根系和根際定殖方面具有更強的優勢。
木霉菌可以利用多種底物作為能量來源,這使得它們能夠有效地利用各種根際沉淀物,包括氨基酸、維生素、有機酸、糖類等營養物質。與其他微生物相比,木霉菌具有更好的動員和吸收土壤養分的能力[39],同時,木霉菌通過生物合成和釋放葡萄糖酸、檸檬酸和富馬酸等有機酸,這些有機酸可促進微量營養素如磷酸鹽、鐵離子、錳離子和鎂離子的吸收,導致土壤pH 降低。較低的土壤pH有助于提高土壤養分有效性,對于其他病原微生物也有一定的抑制作用。
木霉菌可以通過分泌鐵載體,來幫助它們戰勝周圍的其他微生物。鐵離子是多種酶的輔因子,在植物的生長發育中起重要作用[40]。在中性pH和有氧條件下,鐵主要以Fe3+的形式存在。在好氧環境中,鐵傾向于生成不溶性氧化鐵,使其不能被根系吸收[40]。木霉菌分泌鐵螯合物,稱為鐵載體[6],這種絡合物首先與不溶性鐵(Fe3+)結合,然后將其轉化為易吸收的可溶性形式,即Fe2+。與木霉菌相比,植物病原菌只能產生較低的結合鐵載體,因此,鐵載體在提高植物對鐵的有效性的同時,也消耗了土壤中的鐵源,從而抑制了植物病原菌的生長[40]。
1.4 誘導植物產生抗性
木霉菌株除了直接作用于病原微生物外,也可以通過誘導植物局部或系統防御機制的響應,來間接影響病原微生物的生存,從而達到生防目的。植物抗性的誘導是微生物 (外誘導劑) 和植物組織(內誘導劑)細胞釋放的各種誘導劑 (防御反應的誘導劑) 作用的結果。植物宿主防御的誘導可以是局部的和(或)系統的,這取決于刺激的類型、來源和數量,包含2種類型:植物誘導性抗性(induced systemic resistance,ISR)和植物系統獲得性抗性(systemic acquired resistance,SAR)。ISR是通過接種非致病性根際細菌誘導植物葉片產生抗病性,它不涉及病程相關蛋白的積累,而是由茉莉酸(jasmonic acid,JA)和(或)乙烯(ethylene,ET)介導的,這些物質是在施用一些非致病性根際細菌后產生的;SAR是由水楊酸(salicylic acid,SA)介導,SA是一種通常在病原體感染后產生并導致病程相關(pathogenesis-related proteins,PRs)蛋白表達的化合物,這些PRs蛋白包括多種酶[41],其中一些酶可直接裂解并入侵病原菌細胞,降解溶菌酶的活性,增強細胞壁邊界以抵抗感染或誘導局部細胞死亡。
木霉菌產生的誘導子通過激活信號轉導通路導致植物發生物理、生化和分子變化,例如跨膜離子流[42]、活性氧(reactive oxygen species,ROS)的產生[42],形成物理屏障(如木質素沉積、植物細胞壁加固)以防止植物病原體的傳播,同時還會生成相應的防御化合物[43](如植物抗毒素、揮發性有機化合物、酶和植物激素)。Marra等[44]使用木霉菌株M10、KV906、GV41、T22 及其次生代謝產物6-戊基-2H- 吡喃-2- 酮(6-pentyl-2H-pyran-2-one,6PP)和哈茨酸(harzianic acid, HA)對橄欖葉進行處理后,負責其防御反應的相關基因如乙烯響應性轉錄因子(ethylene responsive factor,ERF)、脂氧合酶(lipoxygenase,LOX)、硫氧還蛋白(thioredoxin,TD)以及病程相關蛋白27(pathogenesis-relatedprotein 27,PR 27)的基因表達量均出現上調,同時觀察到與橄欖孔雀斑病相關病癥顯著減少。Pimentel 等[45]通過溫室試驗發現,使用哈茨木霉KMISO 2-2-19 A菌株和棘孢木霉WKSSO 24-18菌株可以刺激大豆幼苗中防御基因的誘導,木霉菌與致病菌鐮刀菌在共接種大豆種子后,SA 和JA/ET途徑相關的防御相關基因表達水平顯著提高,與單獨接種病原菌相比,使用棘孢木霉誘導后,參與SA防御途徑的病程相關蛋白PR2和查爾酮合成酶(chalcone synthase,CHS)的表達分別提高2.7 和10.0 倍,參與JA/ET 途徑的病程相關蛋白PR3和PR12的表達分別增加14.79和2.64倍;哈茨木霉還能使丙二烯氧化物合酶 (allene oxidesynthase,AOS)和堿性過氧化物酶(basicperoxidase BP)的表達水平分別增加2.06 和2.38倍來誘導大豆對鐮刀菌(Fusarium virguliforme)的防御。Zehra等[46]發現,在用哈茨木霉BHU LMMT菌株和病原菌尖孢鐮刀菌番茄斑點病菌Fol 同時處理后,番茄病程相關基因的表達增加,病程相關基因的增加也會使被處理的組織具有更高的抗氧化劑(超氧化物歧化酶、過氧化氫酶、過氧化物酶)以及苯丙氨酸解氨酶(phenylalamine ammonialyase,PAL)和多酚氧化酶(polyphenol oxidase,PPO)的表達,PAL表達量是對照的3.65倍。
2 木霉菌的協同防病作用
由于田間環境的復雜性以及土壤生物群落的多樣性,單一的生物防治劑具有一定的局限性。目前的生防制劑大多由單一菌株純培養制備,限制了木霉菌產品的生防效率和穩定性。為克服這一問題,需要開發在病原拮抗、環境脅迫耐受、植物促進等方面具有互補作用的復合型生防產品,因此具有協同防病的生防產品越來越受到重視。
2.1 木霉菌與化學殺菌劑聯合應用
由于目前單一木霉菌劑存在防效低、藥效不穩定和易受環境條件影響等缺點,因此還無法完全替代化學農藥。近幾年,生防菌劑與化學農藥的聯合應用成為研究熱點。二者的聯合應用既能提高木霉在植物根際的定殖能力,更好地發揮其生防作用,也可以減少化學農藥的使用,達到保護環境的目的。但是,關于木霉菌和化學殺菌劑聯合施用的增效機制研究尚未進行系統報道。馬志強等[47]將哈茨木霉與啶酰菌胺進行聯用,推測增效機制是啶酰菌胺會導致病菌的菌絲部分溶解,易于哈茨木霉對病菌的纏繞和穿透,有利于其占據營養和空間,同時增強了哈茨木霉揮發性物質對灰霉病菌的抑菌活性。
生防菌劑與化學殺菌劑聯合施用時,首先需要明確二者之間的相容性。牛芳勝等[48]根據殺菌劑對木霉菌的半數效應濃度(EC50)與該殺菌劑對致病菌的EC50比值篩選可與木霉菌聯合施用的殺菌劑,若比值大于1即為增效,認為該化學殺菌劑可與生防木霉菌聯合施用;在評價二者的互作效果時,需要明確二者的協同效果是多種因素共同作用的結果:有木霉菌對致病菌的抑制作用,有病菌對致病菌的抑制作用,有殺菌劑對致病菌和木霉菌的抑制作用以及木霉菌和殺菌劑互作對致病菌的抑制作用。有些木霉菌還可以對化學農藥產生降解作用[49],在進行組合時還需考慮這一因素。Zhang等[50]研究了棘孢木霉與惡霉靈聯用防治豇豆枯萎病的效果,當單獨施用木霉菌及殺菌劑時,防效分別為62.69%和45.80%,當二者聯合施用時,防治效果提高為84.74%,顯著高于其他處理。后續的田間試驗也驗證了其結果,聯合施用的2次試驗防效分別為68.39%和75.69%,顯著高于木霉菌和惡霉靈單獨處理的防效。
2.2 木霉菌與生防微生物的協同作用
自然界中的微生物普遍以微生物群落的形式存在,通過生態位互補、功能互補、代謝互作、基因互作等方式維持健康土壤中的微生態平衡。因此,通過構建多組合的微生物聚合體,能夠與植物產生比單一微生物或菌株更復雜的相互作用,從而促進植物生長和在植物病害預防中實現協同或綜合效應。
2.2.1 木霉菌與細菌的協同作用 目前,對木霉菌與細菌的聯合應用已有大量研究,其中以假單胞菌屬、芽孢桿菌屬、根瘤菌屬、農桿菌屬等生防細菌為主。通過2個或2個以上不同菌種的組合,其構成的聯合體可以在促進植物生長、提高植物逆境耐受性以及抑制病原菌等方面產生重要協同效應。
根據木霉菌與細菌的作用機制,可以通過其對具體病菌的抑制能力來挑選互補的組合以達到抗病效果的增強。在挑選菌株時,需要考慮候選菌株間的親和性和互作性,以保證混合物能達到增效目的。 Izquierdo-García等[51]研究了綠色木霉GI006和貝萊斯芽孢桿菌Bs006作為組合對尖孢鐮刀菌(Fusarium oxysporum)的防治效果,發現二者的發酵上清對各自的生長均無明顯抑制效果,而且Bs006上清液中的代謝產物直接作用于病菌,并與GI006的作用機制形成互補,使發病率和病情指數均降低66.0%。Manjula等[52]使用熒光假單胞菌GB10、GB27與綠色木霉pq1對花生幼苗進行處理,其中熒光假單胞菌可以產生抗生素和抗菌物質,綠色木霉可以產生胞外幾丁質酶,并寄生在齊整小核菌(Scierotium rolfsii)菌絲體上,通過二者組合可以使感染齊整小核菌的死亡率顯著降低,GB10與綠色木霉pq1共同處理后,死亡率降低至18.3%,GB27和綠色木霉pq1共同處理后,死亡率降低至16.7%,比空白組同比降低78.0%和80.4%。
木霉菌與細菌共接種可能不會對2種微生物的活性產生協同作用,但卻顯著提高了其他有益微生物的活性。在將綠色木霉菌熒光假單胞菌和叢枝根菌真菌同時接種在野菊植株時觀察到,菌根真菌對根系定殖增加,促進植株中的相關養分吸收增強,葉綠素和類胡蘿卜素總含量積累更多[53]。
在進行共培養時,不是簡單的將木霉菌與細菌進行混合,不同的接種順序以及接種比例都會對其協同效應產生影響。在探究棘孢木霉GDFS1009和解淀粉芽孢桿菌1841的共培養時發現[54],使用同時接種法會對木霉的生長產生負面影響,與木霉孢子形成有關的基因出現下調,導致木霉菌生長速度變慢;但使用順序接種法則會使相關基因表達出現上調,由于二者間的競爭互作,在不同接種順序中其重要基因和代謝產物的表達出現差異化。棘孢木霉 GDFS1009與解淀粉芽胞桿菌ACCC11060在接種比例為1.9∶1.0時,其培養液中的抑菌物質產量顯著高于單一培養;但當接種比例為1.0∶1.0時,其共培養可提高特定氨基酸的產量[55]。因此,建立合適的培養配方極其重要。
2.2.2 木霉菌與真菌的協同作用 ①不同木霉菌間的協同作用。木霉菌雖然是常用的生防菌之一,但基于木霉菌群間的研究目前較少。木霉菌的組合設計并不是簡單地依賴于菌株數量的增加,更重要的是依賴于菌株之間通過相容共代謝和基因回路調控的協同性相互作用。在木霉共培養組合設計過程中,必需從多方面評估共發酵的效果,避免負面影響。Hao等[56]對15株木霉菌株在拮抗作用、生長繁殖及耐逆境性和植物促生等方面進行評價,篩選出3 株棘孢木霉菌株(T-Z4-1、T-1009、T-10264、)和1株哈茨木霉菌株(T-10569)作為最優組合,其組合進行共培養可增加植物生長調節代謝物的生成,并提高γ- 氨基丁酸(γ-aminobutyric acid,GABA)的含量,該氨基酸是提高黃瓜幼苗生長所必需的重要物質。陳凱等[5758]通過將深綠木霉HB20111和哈茨木霉TW21900進行共培養,先采用對峙培養觀察兩菌株的親和性,后驗證其共培養發酵液稀釋液對黃瓜枯萎病的溫室防治效果和黃瓜幼苗增重率分別達73.65% 和35.64%,說明二者共培養具有協同增效作用。Kumar等[59]使用綠色木霉ITCC No.7057和哈茨木霉ITCC No.6908對馬鈴薯塊莖進行單獨和聯合處理后發現,處理植株產生了含量較高的游離多酚類化合物,丁香酸(syringic acid)、莽草酸(shikimicacid)、沒食子酸(gallic acid)等酚類化合物的含量顯著增加,能直接起到抑菌作用,同時木霉菌群也提高了苯丙氨酸解氨酶、超氧化物歧化酶和β-1,3葡聚糖酶的活性,促進了植株相關防御機制的誘導。
②木霉菌與其他真菌間的協同作用。除了木霉種間的相互協同外,與叢枝菌根真菌(arbuscularmycorrhizal fungi,AMF)進行共接種也是目前的研究熱點。Yang等[60]研究鹽土中AMF與長枝木霉MF的相互作用及其對玉米的影響發現,在0 和75 mmol·L-1 NaCl條件下,二者共接種后顯著增加了玉米的生物量,與未接種相比分別提升68.6%和34.5%,同時顯著提高玉米地上部的K+/Na+值;此外,AMF和長枝木霉MF共接種不僅促進了植物的生長,還促進了AMF的生長;在0和75 mmol·L-1 NaCl條件下,與單獨接種AMF相比,共接種的AMF定殖率分別提高20.7%和44.8%,土壤菌絲長度、密度分別比未接種土壤增加91.3%和45.2%。Egberongbe等[61]使用哈茨木霉和Glomus mosseae對大豆進行聯合接種后,無論在滅菌還是未滅菌的土壤中,大豆的粗蛋白、水分、干重均顯著提高,聯合接種可提升大豆的產量、種子質量和種子成分。然而,在進行組合時需要注意,由于養分競爭和某些次生代謝產物的產生,也可能發生拮抗作用[62]。
2.3 木霉與其他物質的協同作用
除了與化學農藥及生防微生物進行協同防病外,一些具有間接生防效果的物質與木霉菌進行聯用也可以增強生防效果。D’errico等[63]將哈茨木霉與1,3 二氯丙烯(1,3-dichloropropene,1,3-D)熏蒸劑和有機肥進行聯合,驗證其對根結線蟲的殺蟲效果,結果表明,土壤熏蒸與哈茨木霉和有機肥的聯合施用,可以提高對根結線蟲的殺蟲效果和植株產量,并將熏蒸劑的殺線蟲效果延長到第2 個作物周期,是防治根結線蟲的有效策略。Aprile等[64]使用哈茨木霉和systemin(一種從番茄葉片提取的,在觸發植物防御中具有活性的多肽)處理植物發現,木霉菌和systemin在番茄植株上的聯合施用提高了JA水平,降低了SA含量,從而促進了植株的防御途徑的啟動,并可能促進了植株的定殖,導致植物免疫力的增強;同時,JA含量的增加會提高VOCs的生成,從而增強對病菌的抑制效果。El-mohamedy等[65]使用哈茨木霉和殼聚糖對番茄枯萎病菌Forl 的抑菌性進行評估發現,二者的聯合對Forl有較好的防治效果,顯著降低了Forl的發病率。殼聚糖可以激活植株相關防御基因,導致植物細胞的物理和生化變化,直接或間接地參與疾病的抑制。Al-surhanee[66]使用哈茨木霉和SA進行組合,可以增強對尖孢鐮刀菌的抑制效果,在掃描電鏡下觀察,SA處理后細胞成分和形態發生了更多的改變和損傷,破壞了真菌質膜和線粒體膜的完整性,同時二者也刺激了番茄幼苗的的抗真菌能力,提高了總酚和游離脯氨酸含量。
木霉菌與其他物質的結合,不僅能直接作用于病原菌和植物,也能通過修復土壤環境、優化微生物群落的方式間接達到生防效果。Cao等[67]將生物炭與木霉聯合施用,發現二者聯合施用不僅促進了黃瓜的生長,提高了葉片中超氧化物歧化酶、過氧化物酶和過氧化氫酶活性,而且提高了土壤pH和土壤有機質、有效氮、有效鉀等含量,與對照相比,處理后的土壤細菌豐度和均勻度均有提高,增加了土壤微生物群落的多樣性。
3 展望
木霉菌使用多種復雜的直接和間接生物防治機制,既可以對抗生物脅迫,例如廣譜病原微生物(真菌、細菌、昆蟲和線蟲),也可以對抗非生物脅迫如惡劣的環境條件等。因此,木霉菌相關制劑將在農業中廣泛應用,以防治各種病因的植物疾病。同時,由于其對于化學農藥的抗性以及與各種微生物的相容性和互作性,可以使木霉菌與各種低水平的化學農藥進行結合施用,在復雜的農業環境中發揮更強的生防作用。研究發現,高水平的物種多樣性可以增加微生物物種作為一個群落可以集體使用的資源(生態位寬度),并使微生物在根際更有效地生存[68]。同時多種微生物聯合產生的不同次生代謝產物的組合可能會加強對病原體的拮抗作用。在溫室試驗中,具有穩定構型和明確生態位與病原菌重疊的群落,降低了病原菌入侵的成功率,限制了病原菌在入侵群落中的生長。這為后續構建復合生防制劑提供了思路,即使用不同的微生物在根際區域占據不同的生態位,從而限制病原菌之間的競爭。雖然已有大量研究展示了木霉菌協同的生防效果,但其作用機理尚未明確。在今后的工作中,需要進一步了解協同作用機制是如何進行的,如產生水解酶基因、抗菌肽基因和鐵載體產生基因的表達,這樣才能便于后續相關生防制劑的研制。然而,大多數研究并沒有評估土壤中的現存微生物在根際接種時的生存情況[69],因此,為了更好地利用微生物群并提高其效率,應更加重視這方面的工作,而不僅僅只是確定復合菌劑間的相容性。
參 考 文 獻
[1] 袁楊,楊紅艷.我國生物農藥發展歷程及應用展望[J].南方
農業,2022,16(11):59-63.
[2] MUKHOPADHYAY R, KUMAR D. Trichoderma: a beneficial
antifungal agent and insights into its mechanism of biocontrol
potential [J/OL]. Egypt. J. Biol. Pest Control, 2020, 30(1): 133
[2023-06-06]. https://doi/org/10.1186/s41938-020-00333-x.
[3] KAMALA T, DEVI S I, SHARMA K C,et al .. Phylogeny and
taxonomical investigation of Trichoderma spp. from Indian
region of indo-burma biodiversity hot spot region with special
reference to manipur [J/OL]. Biomed. Res. Int., 2015, 2015:
285261 [2023-06-06]. https://doi/org/10.1155/2015/285261.
[4] MUKHERJEE P K, MENDOZA-MENDOZA A, ZEILINGER
S, et al .. Mycoparasitism as a mechanism of trichodermamediated
suppression of plant diseases [J]. Fungal Biol. Rev.,
2022, 39: 15-33.
[5] YANG P. The gene task1 is involved in morphological
development, mycoparasitism and antibiosis of Trichoderma
asperellum [J]. Biocontrol Sci. Technol.,2017,27(5):620-635.
[6] GHORBANPOUR M, OMIDVARI M, ABBASZADEHDAHAJI
P, et al .. Mechanisms underlying the protective
effects of beneficial fungi against plant diseases [J]. Biol.
Control, 2018, 117: 147-157.
[7] INBAR J, CHET I. The role of lectins in recognition and
adhesion of the mycoparasitic fungus Trichoderma spp. to its
host [J]. Adv. Exp. Med. Boil.,1996,408:229-231.
[8] KAUR R, KALIA A, LORE J S, et al.. Antifungal effect of
Trichoderma spp. Β1,3glucanase
on Phytophthora parasitica: hyphal
morphological distortions [J]. J. Phytopathol., 2020, 168(11-12):
700-706.
[9] CHAUBE S K, PANDEY S. Trichoderma: a valuable
multipurpose fungus for sustainable agriculture [J]. Malaysian
J. Sustain. Agric., 2022,6(2):97-100.
[10] TY?KIEWICZ R, NOWAK A, OZIMEK E, et al ..Trichoderma:
the current status of its application in agriculture for the
biocontrol of fungal phytopathogens and stimulation of plant
growth [J/OL]. Int. J. Mol. Sci.,2022,23(4):2329 [2023-06-06].
https://doi.org/10.3390/ijms23042329.
[11] 李紀順,陳凱,楊合同,等.木霉抗生性代謝產物研究進展[J].
農藥,2010,49(10):713-716,719.
LI J S, CHEN K, YANG H T, et al .. Bioactive secondary
metabolites from Trichoderma species [J].Agrochemicals,2010,
49(10):713-716,719.
[12] AHMAD ASAD S. Mechanisms of action and biocontrol
potential of Trichoderma against fungal plant diseases-a review
[J/OL].Ecol.Complex.,2022,49:100978 [2023-06-06]. https://
doi.org/10.1016/j.ecocom.2021.100978.
[13] GARDINER D M, WARING P, HOWLETT B J. The
epipolythiodioxopiperazine (ETP) class of fungal toxins:
distribution, mode of action, functions and biosynthesis [J].
Microbiology, 2005,151(pt4):1021-1032.
[14] MUKHERJEE P K, HORWITZ B A, KENERLEY C M. Secondary
metabolism in Trichoderma: a genomic perspective [J].
Microbiology, 2012,158(pt1):35-45.
[15] DEGENKOLB T, NIELSEN K, DIECKMANN R, et al..Peptaibol,
secondary-metabolite, and hydrophobin pattern of commercial
biocontrol agents formulated with species of the Trichoderma
harzianum complex [J]. Chem. Biodivers, 2015,12(4):662-684.
[16] ZHAO P, REN A, DONG P, et al.. Antimicrobial peptaibols,
trichokonins, inhibit mycelial growth and sporulation and induce
cell apoptosis in the pathogenic fungus Botrytis cinerea [J]. Appl.
Biochem. Microbiol., 2018,54(4):396-403.
[17] ZHAO P B, REN A Z, DONG P, et al .. The antimicrobial
peptaibol trichokonin IV promotes plant growth and induces
systemic resistance against Botrytis cinerea infection in moth
orchid [J/OL]. J. Phytopathol., 166(12): 12692 [202306-06].
https://doi.org/ 10.1111/jph.12692.
[18] SCARSELLETTI R, FAULL J L. In vitro activity of 6-pentyl-α-pyrone,
a metabolite of Trichoderma harzianum, in the inhibition of
Rhizoctonia solani and Fusarium oxysporum f. sp. lycopersici
[J].Mycol. Res.,1994,98(10):1207-1209.
[19] WORASATIT N, SIVASITHAMPARAM K, GHISALBERTI E L,
et al.. Variation in pyrone production, pectic enzymes and control of
rhizoctonia root rot of wheat among single-spore isolates of
Trichoderma koningii [J]. Mycol. Res., 1994, 98: 1357-1363.
[20] MUTAWILA C, VINALE F, HALLEEN F, et al.. Isolation,
production and in vitro effects of the major secondary metabolite
produced by Trichoderma species used for the control of grapevine
trunk diseases [J]. Plant Pathol., 2016, 65: 104-113.
[21] VINALE F, MARRA R, SCALA F,et al .. Major secondary
metabolites produced by two commercial Trichoderma strains
active against different phytopathogens [J]. Lett. Appl.
Microbiol., 2006,43(2):143-148.
[22] VINALE F, GHISALBERTI E L, SIVASITHAMPARAM K, et
al ..Factors affecting the production of Trichoderma harzianum
secondary metabolites during the interaction with different
plant pathogens [J]. Lett. Appl. Microbiol.,2009,48(6):705-711.
[23] AHLUWALIA V, KUMAR J, RANA V S,et al .. Comparative
evaluation of two Trichoderma harzianum strains for major
secondary metabolite production and antifungal activity [J].
Nat. Prod. Res., 2015,29(10):914-920.
[24] MUKHERJEE P K, BUENSANTEAI N, MORAN-DIEZ M E, et al..
Functional analysis of non-ribosomal peptide synthetases (NRPSs)
in Trichoderma virens reveals a polyketide synthase (PKS)/NRPS
hybrid enzyme involved in the induced systemic resistance
response in maize [J]. Microbiology, 2012,158(pt1):155-165.
[25] KHAMTHONG N, RUKACHAISIRIKUL V, TADPETCH K, et al ..
Tetrahydroanthra quinone and xanthone derivatives from the
marine-derived fungus Trichoderma aureoviride PSU-F95 [J].
Arch. Pharm. Res., 2012, 35(3): 461-468.
[26] ZHANG Q Q, CHEN L, HU X, et al .. Novel cytotoxic
metabolites from the marine-derived fungus Trichodermacitrinoviride
[J]. Heterocycles, 2014, 89(1): 189-196.
[27] YAMAZAKI H, SAITO R, TAKAHASHI O, et al ..
Trichoketides A and B,two new protein tyrosine phosphatase
1B inhibitors from the marine-derived fungus Trichoderma sp
[J]. J. Antibiot. (Tokyo),2015,68(10):628-632.
[28] QIN C, HU Z B, XIONG Y H, et al .. A new sesquiterpene
derivative from the mangrove endophytic fungus Trichoderma
harzianum (strain No.R1) [J].Chem.Nat.Compd.,2021,57(2):
312-314.
[29] MIAO F P,LIANG X R,YIN X L,et al ..Absolute configurations
of unique harziane diterpenes from Trichoderma species [J].
Org. Lett., 2012,14(15):3815-3817.
[30] ZHU L X, ZHAO X, WANG C H, et al .. Trichoderma affects
plant growth and soil ecological environment: a review [J].
Zemdirbyste, 2022, 109(4):341-348.
[31] HUANG X, ZHANG W, TANG S, et al .. Collaborative
biosynthesis of a class of bioactive azaphilones by two separate
gene clusters containing four PKS/NRPSs with transcriptional
crosstalk in fungi [J]. Angew. Chem. Int. Ed. Engl.,2020,59(11):
4349-4353.
[32] LIU K, YANG Y B, CHEN J L, et al .. Koninginins N-Q,
polyketides from the endophytic fungus Trichoderma
koningiopsis harbored in Panax notoginseng [J]. Nat. Prod.
Bioprospect., 2016,6(1):49-55.
[33] PARKER S R, CUTLER H G, SCHREINER P R. Koninginin E:
isolation of a biologically active natural product from Trichoderma
koningii [J]. Biosci. Biotechnol. Biochem., 1995,59(9):1747-1749.
[34] AHLUWALIA V, WALIA S, SATI O P, et al .. Isolation,
characterization of major secondary metabolites of the Himalayan
Trichoderma koningii and their antifungal activity [J]. Arch.
Phytopathol. Plant Prot. , 2013, 47(9): 1063-1071.
[35] LIU S Y, LO C T, SHIBU M A, et al .. Study on the
anthraquinones separated from the cultivation of Trichoderma
harzianum strain Th-R16 and their biological activity [J]. J.
Agric. Food Chem., 2009,57(16):7288-7292.
[36] VINALE F, MANGANIELLO G, NIGRO M, et al .. A novel
fungal metabolite with beneficial properties for agricultural
applications [J]. Molecules, 2014,19(7):9760-9772.
[37] ZHAO D L, ZHANG X F, HUANG R H, et al .. Antifungal
nafuredin and epithiodiketopiperazine derivatives from the
mangrove-derived fungus Trichoderma harzianum D13 [J/OL].
Front. Microbiol.,2020,11:1495 [2023-06-06]. https://doi.org/
10.3389/fmicb.2020.01495.
[38] SOOD M, KAPOOR D, KUMAR V, et al .. Trichoderma: the
“secrets” of a multitalented biocontrol agent [J/OL]. Plants
(Basel), 2020, 9(6): 762 [2023-06-06]. https://doi. org/10.3390/
plants9060762.
[39] GAJERA H, DOMADIYA R, PATEL S, et al .. Molecular
mechanism of Trichoderma as biocontrol agents against
phytopathogen system-a review [J]. Curr. Res. Microbiol.
Biotechnol., 2013, 1(4): 133-142.
[40] MIETHKE M. Molecular strategies of microbial iron
assimilation:from high-affinity complexes to cofactor assembly
systems [J]. Metallomics,2013,5(1):15-28.
[41] CHAKRABORTY B N, CHAKRABORTY U, SUNAR K. Induced
immunity developed by Trichoderma species in plants [C]//
Trichoderma: Host Pathogen Interactions and Applications [M].
Springer, 2020: 125-147.
[42] CHEN S C, REN J J, ZHAO H J, et al .. Trichoderma
harzianum improves defense against Fusarium oxysporum by
regulating ROS and RNS metabolism,redox balance,and energy
flow in cucumber roots [J]. Phytopathology, 2019, 109(6):
972-982.
[43] LAZAZZARA V, VICELLI B, BUESCHL C, et al .. Trichoderma
spp. volatile organic compounds protect grapevine plants by
activating defense-related processes against downy mildew [J].
Physiol. Plant, 2021,172(4):1950-1965.
[44] MARRA R, COPPOLA M, PIRONTI A, et al..The application of
Trichoderma strains or metabolites alters the olive leaf metabolome
and the expression of defense-related genes [J/OL]. J. Fungi (Basel),
2020, 6(4): 369 [2023-06-06]. https://doi.org/10.3390/jof6040369.
[45] PIMENTEL M F, ARN?O E, WARNER A J, et al ..
Trichoderma isolates inhibit Fusarium virguliforme growth,
reduce root rot,and induce defense-related genes on soybean
seedlings [J].Plant Dis.,2020,104(7):1949-1959.
[46] ZEHRA A, AAMIR M, DUBEY M K, et al.. Enhanced protection of
tomato against Fusarium wilt through biopriming with Trichoderma
harzianum [J/OL]. J. King Saud Univ. Sci., 2023, 35(2): 102466
[2023-06-06]. https://doi.org/10.1016/j.jksus.2022.102466.
[47] 馬志強,牛芳勝,畢秋艷,等.哈茨木霉菌與啶酰菌胺聯用對
番茄灰霉病菌的增效機制[J]. 植物保護學報,2013,40(4):
369-373.
MA Z Q, NIU F S, BI Q Y, et al .. The synergistic mechanism of
Trichoderma harzianum combined with boscalid to Botrytis
cinerea [J]. J. Plant Prot., 2013,40(4):369-373.
[48] 牛芳勝,馬志強,畢秋艷.哈茨木霉與啶酰菌胺互作對番茄灰
霉病的增效作用評價[J].中國農學通報,2013,29(12):201-205.
NIU F S, MA Z Q, BI Q Y. The synergism evaluation of
Trichoderma harzianum interaction with boscalid to Botrytis
cinerea [J]. Chin. Agric. Sci. Bull.,2013,29(12):201-205.
[49] TANG J, LIU L, HUANG X, et al .. Proteomic analysis of
Trichoderma atroviride mycelia stressed by organophosphate
pesticide dichlorvos [J]. J. Microbial.,2010,56(2):121-127.
[50] ZHANG C, WANG W, XUE M, et al .. The combination of a
biocontrol agent Trichoderma asperellum SC012 and hymexazol
reduces the effective fungicide dose to control Fusarium wilt in
cowpea [J/OL]. J. Fungi (Basel), 2021, 7(9): 685 [2023-06-06].
https://doi.org/10.3390/jof7090685.
[51] IZQUIERDO-GARCíA L F, GONZáLEZ-ALMARIO A,
COTES A M, et al .. Trichoderma virens Gl006 and Bacillus
velezensis Bs006:a compatible interaction controlling Fusarium
wilt of cape gooseberry [J/OL].Sci.Rep.,2020,10:6857 [2023-
06-06]. https://doi.org/10.1038/s41598-020-63689-y.
[52] MANJULA K, KISHORE G K, GIRISH A G, et al .. Combined
application of Pseudomonas fluorescens and Trichoderma viride
has an improved biocontrol activity against stem rot in
groundnut [J]. Plant Pathol.,2004,20(1):75-80.
[53] SAINI I, YADAV K, AGGARWAL A. Response of arbuscular
mycorrhizal fungi along with Trichoderma viride and
Pseudomonas fluorescens on the growth, biochemical attributes
and vase life of Chrysanthemum indicum [J]. J. Environ. Biol.,
2019, 40(2): 183-191.
[54] KARUPPIAH V, VALLIKKANNU M, LI T T, et al ..
Simultaneous andsequential based co-fermentations of
Trichoderma asperellum GDFS1009 and Bacillus
amyloliquefaciens 1841: a strategy to enhance the gene
expression and metabolites to improve the bio-control and plant
growth promoting activity [J/OL].Microb.Cell Fact., 2019,18(1):
185 [2023-06-06]. https://doi.org/10.1186/s12934-019-1233-7.
[55] WU Q, NI M, DOU K, et al.. Co-culture of Bacillus
amyloliquefaciens ACCC11060 and Trichoderma asperellum
GDFS1009 enhanced pathogen-inhibition and amino acid yield
[J/OL]. Microb Cell. Fact.,2018,17(1):155 [2023-06-06]. https://
doi.org/10.1186/s12934-018-1004-x.
[56] HAO D Z, LANG B, WANG Y K, et al.. Designing synthetic
consortia of Trichoderma strains that improve antagonistic activities
against pathogens and cucumber seedling growth [J/OL]. Microb.
Cell Fact., 2022, 21(1): 234 [2023-06-06]. https://doi.org/
10.1186/s12934-022-01959-2.
[57] 陳凱,隋麗娜,趙忠娟,等.木霉共培養發酵對黃瓜枯萎病的
防治效果[J].中國生物防治學報,2022,38(1):108-114.
CHEN K, SUI L N, ZHAO Z J, et al .. Control effect of cocultured
fermentation of two Trichoderma strains on cucumber
Fusarium wilt [J]. Chin. J. Biol. Contr., 2022,38(1):108-114.
[58] 陳凱,隋麗娜,楊凱,等.兩株木霉共培養發酵提高對小麥苗期
莖基腐病的防治效果[J].植物病理學報,2022,52(3):425-433.
CHEN K, SUI L N, YANG K, et al .. Co-culturation of two
Trichoderma strains enhanced control efficiency against wheat
crown rot at seedling stage [J]. Acta Phytopathol. Sin., 2022,52(3):
425-433.
[59] KUMAR S, CHANDRA R, BEHERA L, et al.. Dual Trichoderma
consortium mediated elevation of systemic defense response against
early blight in potato [J]. Eur. J. Plant Pathol., 2022,162(3):681-696.
[60] YANG R, QIN Z, WANG J,et al .. The interactions between
arbuscular mycorrhizal fungi and Trichoderma longibrachiatum
enhance maize growth and modulate root metabolome under
increasing soil salinity [J/OL].Microorganisms,2022,10(5):1042
[2023-06-06]. https://doi.org/10.3390/microorganisms10051042.
[61] EGBERONGBE H O, AKINTOKUN A K, BABALOLA O O,
et al .. The effect of Glomus mosseae and Trichoderma
harzianum on proximate analysis of soybean (Glycine max (L.)
Merrill.) seed grown in sterilized and unsterilised soil [J]. J.
Agric. Ext. Rural Dev., 2010, 2(4): 54-58.
[62] TRIVEDI P, PANDEY A, PALNI L M S. Bacterial inoculants
for field applications under mountain ecosystem: present
initiatives and future prospects [C]// Bacteria in Agrobiology:
Plant Probiotics [M]. Springer, 2012:15-44.
[63] D’ERRICO G,GRECO N,VINALE F,et al .. Synergistic effects
of Trichoderma harzianum, 1, 3 dichloropropene and organic
matter in controlling the root-knot nematode Meloidogyne
incognita on tomato [J/OL]. Plants (Basel), 2022, 11(21): 2890
[2023-06-06]. https://doi.org/10.3390/plants11212890.
[64] APRILE A M, COPPOLA M, TURRà D, et al .. Combination
of the systemin peptide with the beneficial fungus;Trichoderma
afroharzianum; T22 improves plant defense responses against
pests and diseases [J]. J. Plant Interact,2022,17(1):569-579.
[65] EL-MOHAMEDY R S, ABDEL-KAREEM F, DAAMI-REMADI
M. Chitosan and Trichoderma harzianum as fungicide alternatives
for controlling Fusarium crown and root rot of tomato [J].
Tunisian J. Plant Prot., 2014,9(1):5-6.
[66] AL-SURHANEE A A. Protective role of antifusarial ecofriendly
agents (Trichoderma and salicylic acid) to improve
resistance performance of tomato plants [J].Saudi J.Biol.Sci.,
2022,29(4):2933-2941.
[67] CAO X,ZHANG N, ZENG X Y, et al .. Effects of biochar and
Trichoderma on bacterial community diversity in continuous
cropping soil [J]. Hortic. Environ. Biotechnol., 2022,63(1):1-12.
[68] WEI Z, YANG T J, FRIMAN V P, et al .. Trophic network
architecture of root-associated bacterial communities determines
pathogen invasion and plant health [J/OL].Nat.Commun.,2015,6:
8413 [2023-06-06]. https://doi.org/10.1038/ncomms9413.
[69] SARMA B K, YADAV S K, SINGH S, et al .. Microbial
consortium-mediated plant defense against phytopathogens:
readdressing for enhancing efficacy [J]. Soil Biol. Biochem.,
2015,87:25-33.

