柿葉提取物對H2O2誘導IEC-6細胞鐵死亡的影響及機制研究
關鍵詞柿葉提取物;潰瘍性結腸炎;鐵死亡;Nrf2/HO-1信號通路
潰瘍性結腸炎(ulcerativecolitis,UC)是炎癥性腸病的主要類型之一,其發病率在全球范圍內不斷上升[1]。長期以來,氧化應激被學界認為是UC的重要致病因素[2]。在UC的發病過程中,腸道炎癥反應的發生可促進細胞過度產生活性氧(reactiveoxygenspecies,ROS),當ROS的生成超過機體的抗氧化緩沖能力時,會導致脂質過氧化的發生,并進一步誘發鐵死亡[2]。可見,鐵死亡主要由脂質過氧化累積所致,減輕機體氧化應激反應可有效抑制鐵死亡。研究指出,無論是UC還是用于UC治療的藥物都會增加患者并發癥(如結腸癌、皮膚癌、宮頸癌、骨骼疾病、焦慮抑郁等)的發生風險,若不及時治療,這些并發癥將導致不良的用藥依從性、更高的醫療費用、更快的疾病進展,從而嚴重影響患者的生活質量[3―4]。
柿葉(persimmonleaf,PL)提取物多年來被廣泛用作炎癥性疾病的治療劑。研究顯示,PL提取物具有抗炎、抗氧化的作用[5],其主要活性成分槲皮素可通過降低丙二醛(malondialdehyde,MDA)和ROS水平、抑制鐵死亡來減輕缺血再灌注或葉酸誘導的急性腎損傷[6]。本課題組前期研究發現,PL提取物對UC具有保護作用[7],但這種作用是否與氧化應激和鐵死亡相關并不清楚。實驗表明,過氧化氫(H2O2)可誘導細胞發生鐵死亡[8]。基于此,本研究擬以H2O2致鐵死亡的IEC-6細胞(具隱窩樣上皮細胞特征,是UC相關體外研究的常用細胞)作為體外模型,初步探討PL提取物對該細胞模型的影響,以期為UC治療新藥的研發提供參考。
1 材料
1.1 主要儀器
本研究所用主要儀器包括IncubatorCO2-PU-90A型CO2培養箱(上海搏旅儀器有限公司)、Ti20型倒置熒光顯微鏡(日本Nikon公司)、EXL800型酶標儀(美國BioTek公司)、Navios型流式細胞儀(美國BeckmanCoulter公司)、K5500Plus型實時聚合酶鏈反應(realtimePCR,RT-PCR)儀(北京凱奧科技發展有限公司)等。
1.2 主要藥品與試劑
PL(產地安徽亳州,批號20210314)購自安徽亳州藥材市場,由河南省中西醫結合醫院中藥研究所劉長河副研究員鑒定為柿樹科植物柿DiospyroskakiThunb.的干燥葉。
鐵死亡抑制劑ferrostatin-1(Fer-1)的對照品(批號HY100579,純度99.96%)購自美國MedChemExpress公司;胎牛血清(fetalbovineserum,FBS;批號2181654CP)購自美國Gibco公司;MTT試劑、DMEM高糖培養基、胰蛋白酶、超氧化物歧化酶(superoxidedismutase,SOD)試劑盒、MDA試劑盒、線粒體膜電位JC-1試劑盒(批號分別為20210508、20210903、20210804、20210323、20210303、20210412)均購自北京索萊寶科技有限公司;PCR試劑盒購自凱杰生物工程(深圳)有限公司;Trizol試劑(批號20210316)購自北京康為世紀生物科技有限公司;Revert-AidTMFirstStrandcDNA合成試劑盒(批號00780630)購自美國ThermoFisherScientific公司;ROS試劑盒(熒光探針法,批號D3861)購自美國Invitrogen公司;兔源胱氨酸/谷氨酸反向轉運體(cystine/glutamateanti-porter,xCT)、谷胱甘肽過氧化物酶4(glutathioneperoxidase4,GPX4)抗體(批號分別為ab307601、ab125066)均購自英國Abcam公司;兔源核轉錄因子紅系2相關因子2(nuclearfactor-erythroid2-relatedfactor2,Nrf2)、鐵蛋白重鏈(ferritinheavychain,FTH)抗體(批號分別為#AF0639、#DF6278)均購自美國Affinity公司;兔源還原型煙酰胺腺嘌呤二核苷酸磷酸/醌氧化還原酶1(NADPH/quinoneoxidoreductase-1,NQO-1)、血紅素氧合酶1(hemeoxygenase-1,HO-1)抗體(批號分別為GB11282、GB11549)均購自武漢賽維爾生物科技有限公司;兔源甘油醛-3-磷酸脫氫酶(GAPDH)抗體(批號10494-1)購自武漢三鷹生物科技有限公司;辣根過氧化物酶(HRP)標記的山羊抗兔免疫球蛋白G二抗(批號162607)購自北京鼎國昌盛生物技術有限責任公司。
1.3 細胞
大鼠IEC-6細胞由北京協和醫學院基礎學院細胞庫提供。
2 方法
2.1 藥液的制備
PL提取物藥液的制備參考本課題組前期已發表的文獻[8]。
2.2 細胞培養與處理
將IEC-6細胞接種于含5%FBS的DMEM高糖培養基(以下簡稱“完全培養基”)中,在37℃、5%CO2、飽和濕度條件(培養條件后同)下培養,每2~3d換液1次,待細胞生長至對數期進行后續實驗。
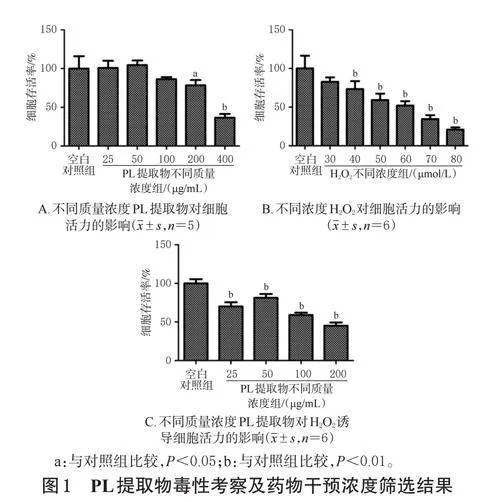
2.3 PL提取物毒性考察及藥物干預濃度篩選
2.3.1 PL提取物毒性考察
取對數生長期的IEC-6細胞,按1×105個/mL接種于96孔板中,每孔100μL,培養。待細胞融合至80%左右時,將其分為空白對照組和PL提取物不同質量濃度組,每組設置5個復孔。對照組加入完全培養基200μL,各藥物組加入含不同質量濃度PL提取物(根據預實驗結果設置,質量濃度分別為25、50、100、200、400μg/mL,以PL提取物質量計)的完全培養基200μL。培養24h,每孔加入0.5%MTT溶液20μL,避光反應2h;棄去培養基,每孔加入二甲基亞砜150μL,振搖5min,使用酶標儀于490nm波長處檢測各孔的吸光度值,并計算細胞存活率(細胞存活率=實驗組細胞的平均吸光度值/對照組細胞的平均吸光度值×100%),以考察PL提取物對細胞活力的影響。
2.3.2 H2O2作用濃度篩選
取對數生長期的IEC-6細胞,按1×105個/mL接種于96孔板中,每孔100μL,培養。待細胞融合至80%左右時,吸棄培養液,以磷酸鹽緩沖液(PBS)清洗1次后,將其分為空白對照組和H2O2不同濃度組,每組設置6個復孔。對照組加入完全培養基200μL,其余各組分別加入含不同濃度H2O2(參考相關文獻[9]設置,濃度分別為30、40、50、60、70、80μmol/L)的完全培養基200μL。培養24h,按“2.3.1”項下方法檢測各組細胞存活率,以篩選H2O2的作用濃度。
2.3.3 PL提取物干預濃度篩選
取對數生長期的IEC-6細胞,按1×105個/mL接種于96孔板中,每孔100μL,培養。待細胞融合至80%左右時,吸棄培養液,以PBS清洗1次后,將其分為空白對照組和PL提取物不同質量濃度組,每組設置6個復孔。對照組加入不含H2O2的完全培養基200μL,其余各組分別加入含H2O260μmol/L和PL提取物25、50、100、200μg/mL的完全培養基200μL(H2O2和PL提取物干預濃度參考“2.3.2”“2.3.1”項下結果設置)。培養24h,按“2.3.1”項下MTT法檢測細胞存活率,以進一步篩選后續實驗PL提取物的干預濃度。
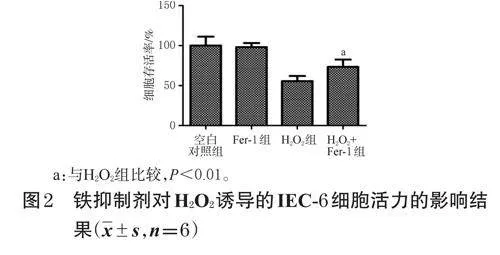
2.4 鐵死亡抑制劑對H2O2誘導的IEC-6細胞活力的影響檢測
取對數生長期的IEC-6細胞,按1×105個/mL接種于96孔板中,每孔100μL,培養。待細胞融合至80%左右時,吸棄培養液,以PBS清洗1次,將其分為空白對照組、Fer-1組、H2O2組、H2O2+Fer-1組,每組設置6個復孔。對照組加入完全培養基200μL,Fer-1組加入含Fer-11μg/μL的完全培養基200μL,H2O2組加入含H2O260μmol/L的完全培養基200μL,H2O2+Fer-1組加入含Fer-11μg/μL、H2O260μmol/L的完全培養基200μL(Fer-1干預濃度參考相關文獻[10]設置,H2O2干預濃度參考“2.3.2”項下結果設置)。培養24h,按“2.3.1”項下MTT法檢測細胞存活率,以考察H2O2導致的IEC-6細胞損傷是否與鐵死亡相關。
2.5 PL提取物對H2O2誘導的IEC-6細胞氧化應激的影響檢測
取對數生長期的IEC-6細胞,按1×105個/mL接種于96孔板中,每孔100μL。待細胞貼壁后,將其分為對照組(Control組)、H2O2組、H2O2+PL25μg/mL組、H2O2+PL50μg/mL組,每組設置6個復孔。Control組加入完全培養基200μL,H2O2組加入含H2O260μmol/L的完全培養基200μL,H2O2+PL25、50μg/mL組分別加入含H2O260μmol/L和PL提取物25、50μg/mL的完全培養基200μL(H2O2、PL提取物干預濃度分別參考“2.3.2”“2.3.3”項下結果設置)。培養24h,收集細胞上清液,按照相應試劑盒說明書方法操作,使用酶標儀檢測其MDA含量和SOD活性。
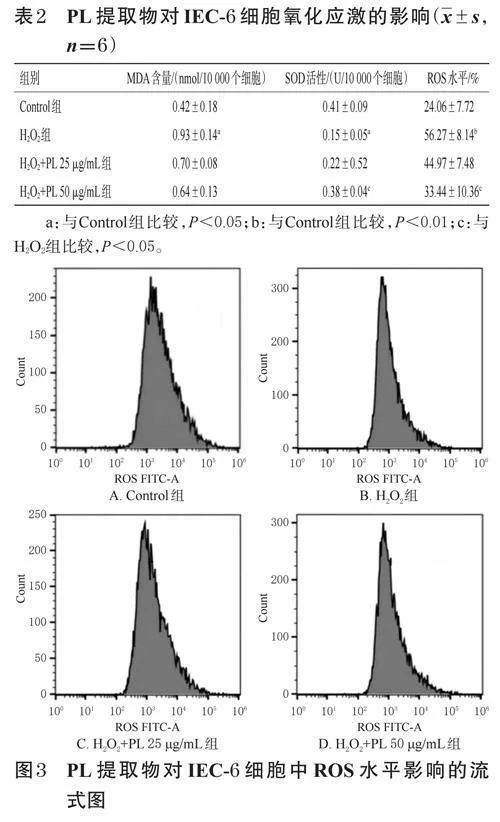
按上述方法進行細胞分組、造模、處理。培養24h后,收集各組細胞,加入ROS試劑盒中BODIPYTM581/591C11試液(以無血清培養基稀釋,終濃度為2μmol/L)1mL,于37℃下孵育30min;棄去上清液,細胞用PBS1mL清洗2次,加入胰蛋白酶1mL,消化3min后,加入培養基1mL終止消化。收集細胞懸液,于4℃下以10000r/min離心3min,吸棄培養基,細胞用預冷的PBS1mL清洗2次后,再以預冷的PBS400μL稀釋,使用流式細胞儀檢測細胞內ROS水平。
2.6 PL提取物對H2O2誘導的IEC-6細胞線粒體膜電位的影響
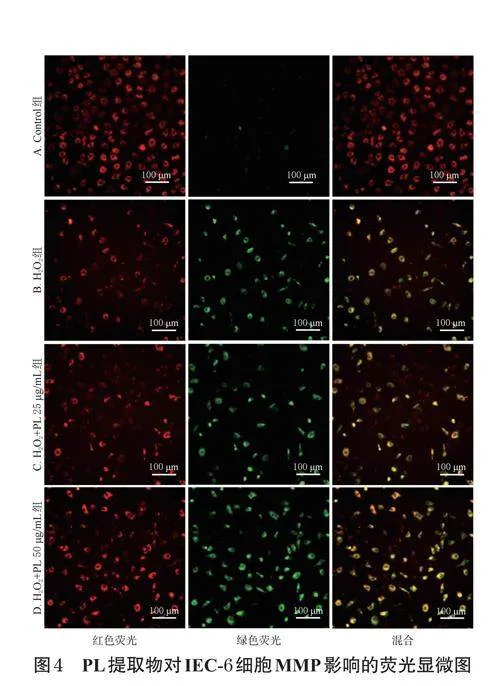
按“2.5”項下方法進行細胞分組、造模、處理。培養24h后,收集各組細胞,加入JC-1熒光探針試液(以二甲基亞砜為溶劑,終濃度為10μg/mL),于37℃下孵育20min;細胞用PBS輕柔洗滌2次后,再以PBS5mL稀釋,使用倒置熒光顯微鏡觀察細胞狀態(JC-1聚合物呈紅色熒光,JC-1單體呈綠色熒光),分析每張顯微圖的平均熒光強度并計算細胞線粒體膜電位(mitochondrialmembranepotential,MMP;MMP=紅色平均熒光強度/綠色平均熒光強度),以反映各組細胞線粒體膜的去極化程度(MMP與去極化程度成反比)。
2.7 PL提取物對H2O2誘導的IEC-6細胞中鐵死亡相關mRNA表達的影響檢測
采用定量RT-PCR法檢測。按“2.5”項下方法進行細胞分組、造模、處理。培養24h后,收集各組細胞,使用Trizol試劑提取其總RNA,檢測其濃度和純度后,使用反轉錄試劑盒將其反轉錄為cDNA,然后以此為模板進行PCR擴增。PCR反應體系包括SYBR?PremixExTaqTM酶(2×)10μL、PCR正/反向引物各0.8μL、cDNA模板2μL和無菌水6.4μL。PCR反應條件為:95℃預變性2min;95℃變性2s,60℃退火10s,共40個循環。以GAPDH為內參,采用2-ΔΔCt法分析Nrf2、HO-1、NQO-1、xCT、GPX4、FTHmRNA的表達水平,結果以Control組為參照進行歸一化處理。PCR引物由蘇州金唯智生物科技有限公司設計、合成,具體序列及產物長度見表1。
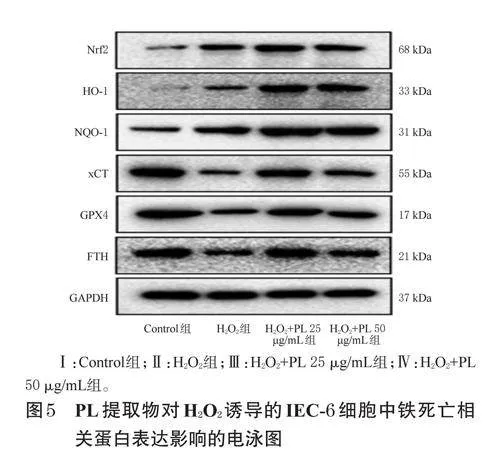
2.8 PL提取物對H2O2誘導的IEC-6細胞中鐵死亡相關蛋白表達的影響檢測
采用Westernblot法檢測。按“2.5”項下方法進行細胞分組、造模、處理。培養24h后,收集各組細胞,用RIPA裂解液提取總蛋白,以BCA法測定蛋白濃度后加熱變性。取變性蛋白適量,經12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離并轉移到聚偏二氟乙烯膜上,用5%脫脂牛奶封閉1h;洗膜后,加入Nrf2、HO-1、NQO-1、xCT、GPX4、FTH、GAPDH一抗(稀釋比例均為1∶1000),于4℃下孵育過夜;洗膜后,加入相應二抗(稀釋比例1∶2000),于室溫下孵育2h;使用化學發光試劑顯色后置于凝膠成像儀下成像。以GAPDH為內參,使用ImageJ軟件量化Nrf2、HO-1、NQO-1、xCT、GPX4、FTH蛋白的表達水平,結果以Control組為參照進行歸一化處理。
2.9 統計學方法
采用GraphPadPrism9軟件對數據進行統計分析并繪圖。實驗數據以x±s表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
3 結果
3.1 PL提取物毒性考察及藥物干預濃度篩選結果
當PL提取物質量濃度為200、400μg/mL時,細胞存活率(平均值分別為77.85%、36.60%)均較空白對照組顯著降低(P<0.05或P<0.01);當PL提取物質量濃度為25、50、100μg/mL時,細胞存活率(平均值分別為100.77%、104.42%、86.25%)與空白對照組比較差異均無統計學意義(P>0.05)。結果見圖1A。
當H2O2濃度分別為30、40、50、60、70、80μmol/L時,細胞的平均存活率分別為82.68%、73.32%、59.16%、52.04%、34.55%、20.98%。為保證細胞有足夠的活力進行后續實驗,本研究選用60μmol/L作為H2O2誘導濃度。結果見圖1B。
當PL提取物質量濃度為100、200μg/mL時,隨著藥物質量濃度的增加,細胞存活率呈下降趨勢;當PL提取物濃度為25、50μg/mL時,隨著藥物濃度的增加,細胞存活率有所升高,提示上述質量濃度的PL提取物可抑制H2O2所導致的細胞存活率降低。因此,本研究選用25、50μg/mL作為后續實驗PL提取物的干預質量濃度。結果見圖1C。
3.2 鐵死亡抑制劑對H2O2誘導的IEC-6細胞活力的影響
當只加Fer-1時,細胞的平均存活率為98.19%,接近于空白對照組,提示此質量濃度的Fer-1對細胞幾乎沒有毒性;當在H2O2誘導的細胞中加入Fer-1后,細胞的存活率較H2O2組顯著升高(P<0.01)。由此可見,H2O2誘導的IEC-6細胞死亡可能與鐵死亡相關。結果見圖2。
3.3 PL提取物對H2O2誘導的IEC-6細胞氧化應激的影響
與Control組比較,H2O2組細胞上清液中SOD活性顯著降低,MDA含量、ROS水平均顯著升高(P<0.05或P<0.01)。與H2O2組比較,H2O2+PL50μg/mL組細胞上清液中SOD活性顯著升高,ROS水平顯著降低(P<0.05)。結果見表2、圖3。
3.4 PL提取物對H2O2誘導的IEC-6細胞MMP的影響
與Control組(MMP為2.01±0.21)比較,H2O2組細胞的紅色熒光明顯減弱,綠色熒光明顯增強,MMP(0.63±0.15)顯著降低(P<0.01);與H2O2組比較,H2O2+PL25、50μg/mL組細胞的紅色熒光有所增強,綠色熒光有所減弱,MMP[1.17±0.15、1.63±0.15]均顯著升高(P<0.05或P<0.01)。結果見圖4。
3.5 PL提取物對H2O2誘導的IEC-6細胞中鐵死亡相關mRNA及蛋白表達的影響
與Control組比較,H2O2組細胞中Nrf2、NQO-1mRNA及Nrf2、HO-1蛋白的表達均顯著上調,xCT、GPX4、FTHmRNA及GPX4、FTH蛋白的表達均顯著下調(P<0.05或P<0.01);與H2O2組比較,各藥物組細胞中Nrf2、HO-1、NQO-1、xCT、GPX4、FTHmRNA及蛋白的表達均有不同程度上調,部分指標組間比較差異有統計學意義(P<0.01或P<0.05)。結果見表3、表4、圖5。
4 討論
中藥因作用靶點多、價格低的優勢,在慢性疾病治療領域得到了越來越多的關注和應用。研究指出,PL提取物可通過調節Jun激酶途徑來抑制T細胞的活化,從而改善小鼠的特應性皮炎[11];其可提高大鼠口腔潰瘍組織中SOD活性并降低MDA含量,減輕口腔黏膜下層的炎癥細胞浸潤,對醋酸誘導的口腔潰瘍有一定的改善作用,上述作用可能是通過抗炎和抗氧化而實現的[4];此外,PL提取物可通過活化Nrf2/HO-1信號通路來發揮抗氧化作用,從而減緩阿爾茨海默病的進程[12]。研究表明,PL提取物中的黃酮類成分金絲桃苷不僅可直接清除細胞內的ROS、螯合金屬離子,而且可增加GPX4、SOD、HO-1等抗氧化酶的生物活性[13]。可見,PL提取物具有一定的抗炎、抗氧化作用。
鐵死亡與人體生理、病理進程密切相關,特別是在炎癥性、神經性、代謝異常等疾病的發生及發展過程中發揮了重要作用[14]。早有研究表明,使用鐵螯合劑可以緩解UC患者的臨床癥狀,而使用鐵劑則可能加重相關癥狀[15]。隨后,有學者指出,過量的鐵會加重腸道炎癥,且人群的高膳食鐵攝入量可促進UC的發展[16―17]。此外有學者發現,UC患者結腸黏膜中ROS的增加與疾病活動度成正比,而鐵螯合劑可減少ROS的生成,并改善UC的結腸癥狀[18]。由此可見,鐵死亡與UC的發生發展密切相關,抑制鐵死亡的發生可能對治療UC有益。
氧化應激長期被認為是UC的重要致病因素。ROS由細胞線粒體產生,正常情況下具有殺菌作用;但在UC的發病過程中,腸道炎癥反應的發生可促進細胞過度生成ROS,超過機體抗氧化緩沖能力,從而引發脂質過氧化、腸道黏膜屏障損傷和炎癥反應[19]。SOD、MDA是氧化應激的重要指標。其中,MDA是ROS誘導脂質過氧化反應的產物之一,也是機體組織氧化損傷的重要指標,MDA水平越高,表明機體組織損傷越嚴重;SOD是一種抗氧化酶,能夠清除氧自由基,若機體對氧自由基的抑制作用減弱,可導致氧自由基在體內過量積累,從而增加細胞膜的通透性,使體內炎癥因子水平升高[20]。本研究結果表明,在50μg/mLPL提取物的作用下,IEC-6細胞氧化應激模型的ROS水平顯著降低,SOD活性顯著升高,提示PL提取物可抑制H2O2誘導的IEC-6細胞的氧化應激損傷。
腸道內抗氧化防御系統的過度損傷與UC的發病機制密切相關,Nrf2/HO-1信號通路是體內對抗氧化應激的主要防御機制之一,可影響疾病的轉歸[12]。近年研究表明,UC患者體內Nrf2蛋白的表達水平顯著低于對照組,但UC相關結腸癌患者體內Nrf2蛋白的表達水平顯著高于對照組[21];此外,有研究顯示,與健康對照組比較,磷酸化的Nrf2蛋白在中/重度UC患者體內呈高表達,但非磷酸化的Nrf2蛋白在中/重度UC患者體內的表達則明顯下調[22]。上述研究表明,Nrf2蛋白的表達水平及表達形式與疾病進程有關。現有研究表明,中醫藥治療UC的作用可能與調節線粒體的生物發生、動力學平衡等有關[23]。ROS主要在線粒體中產生,適量的ROS可維持體內各通路的信號轉導,而過量的ROS則可能造成MMP降低,從而導致線粒體功能障礙[24]。本研究結果表明,PL提取物可顯著提高H2O2誘導的IEC-6細胞的MMP,抑制線粒體去極化的發生;同時,PL提取物可激活Nrf2蛋白,上調下游HO-1、NQO-1、xCT、GPX4、FTH蛋白及mRNA的表達,從而發揮抗氧化應激和抑制鐵死亡的作用。
綜上所述,PL提取物能減輕H2O2所導致的細胞線粒體膜損傷、ROS異常堆積,上述作用可能與激活Nrf2/HO-1信號通路從而抑制鐵死亡有關。

