加味芍藥甘草湯對慢傳輸型便秘大鼠腸道傳輸功能、腸道菌群及代謝產物含量的影響
中圖分類號 R965 文獻標志碼 A 文章編號 1001-0408(2025)02-0154-06
DOI 10.6039/j.issn.1001-0408.2025.02.04
摘要 目的 觀察加味芍藥甘草湯對慢傳輸型便秘(STC)大鼠腸道傳輸功能、腸道菌群及共代謝產物γ氨基丁酸(GABA)和5-羥色胺(5-HT)含量的影響。方法 將SD大鼠隨機分為空白組(10只)和造模組(30只),雌雄各半。造模組大鼠以復方地芬諾酯灌胃法構建STC模型。將造模成功的大鼠隨機分為模型組、加味芍藥甘草湯組[56 g/(kg·d),以生藥量計]、陽性對照藥組[乳果糖2.09g/(kg·d)],每組10 只。各藥物組大鼠灌胃相應藥液,空白組和模型組大鼠灌胃等體積生理鹽水,每天1 次,連續14 d。實驗期間,觀察各組大鼠的一般情況;末次給藥后,稱定其體重并對糞便性狀進行Bristol 評分,檢測糞便含水率、腸道推進率和腸內容物中GABA、5-HT含量,考察腸內容物中腸道菌群的多樣性,并分析GABA、5-HT含量與菌群相對豐度的關聯性。結果 與模型組比較,加味芍藥甘草湯組大鼠體形瘦小、皮毛稀疏粗糙、行動遲緩等一般情況均有所改善,體重、Bristol 評分、糞便含水率、腸道推進率、5-HT含量、Chao1 和Shannon 指數均顯著升高,GABA含量、Simpson 指數均顯著降低(P<0.05)。該組大鼠的腸道菌群可與空白組歸為一類,但與模型組相距較遠;該組脫硫桿菌門、厚壁菌門、擬桿菌門的相對豐度雖有回調,但與模型組比較差異均無統計學意義(P>0.05);脫硫桿菌門是組間差異因素(P<0.05)。GABA含量與擬桿菌門、藍菌門、髕骨菌門、放線菌門的相對豐度呈負相關(P<0.01 或P<0.05),5-HT含量與彎曲桿菌門的相對豐度呈正相關(P<0.05)。結論 加味芍藥甘草湯可改善STC模型大鼠糞便性狀和腸道動力,上述作用可能與改善腸道菌群,進而影響腸內容物中GABA、5-HT含量有關;此外,GABA、5-HT含量可能與擬桿菌門、彎曲桿菌門等特定菌門的相對豐度顯著相關。
關鍵詞 加味芍藥甘草湯;慢傳輸型便秘;腸道菌群;γ氨基丁酸;5-羥色胺
功能性便秘是臨床多發病之一,根據病理生理改變分為正常傳輸型、慢傳輸型、排便障礙型和混合型。其中,慢傳輸型便秘(slow transit constipation,STC)是一類以結腸傳輸減慢為特點的頑固性便秘,約占功能性便秘的45.5%,是功能性便秘的常見類型[1―2]。目前,STC 發病機制尚不明確,學界普遍認為與腸動力障礙、腸道菌群失調、腸神經系統和中樞神經系統異常、神經遞質改變等密切相關[3]。研究表明,STC 的發生與腸道菌群及其與宿主的共代謝產物[如γ氨基丁酸(γ aminobutyricacid,GABA)、5-羥色胺(5-hydroxytryptamine,5-HT)等]有關[4]。同時,有研究顯示,STC患者存在明顯的腸道菌群失調,其體內有害菌種(如大腸埃希菌等)明顯增多,腸道益生菌(如雙歧桿菌等)大幅減少[5―6]。多項研究報道指出,雙歧桿菌屬和乳酸桿菌屬成員均能通過生成GABA來影響腸道5-HT 的含量,進而改善STC 患者的腸道動力[7―9]。
加味芍藥甘草湯由白芍、麥冬、玄參、火麻仁、枳實、厚樸、太子參、生白術、甘草組成,是成都中醫藥大學趙瓊教授根據酸甘化陰名方“芍藥甘草湯”并結合長期臨床實踐化裁而來,具酸甘化陰、養陰增液、益氣通便之功效。本課題組前期研究證實了加味芍藥甘草湯改善小兒便秘的療效,并對其理法方藥及主要成分的通便活性進行了初步探索[10]。近期藥理學研究報道,加味芍藥甘草湯活性成分可提高便秘模型動物的結腸推進率、糞便含水率及排便量,并可改善其便秘癥狀,上述作用可能是通過正向調節腸道菌群的方式來實現的[11―12]。基于此,本研究擬采用復方地芬諾酯灌胃構建STC大鼠模型,從腸道菌群及產物(GABA、5-HT)含量角度出發,進一步探討加味芍藥甘草湯改善STC的潛在機制,以期為STC的臨床治療提供參考。
1 材料
1.1 主要儀器
本研究所用主要儀器包括QuantiFluorTM ST 型藍色熒光定量系統(美國Promega 公司),A200 型聚合酶鏈式反應(PCR)儀(杭州朗基科學儀器有限公司),REPS300型電泳儀(上海天能科技有限公司),1290 Infinity Ⅱ型超高效液相色譜儀、6495 LC/TQ 型三重四極桿質譜儀(美國Agilent公司)等。
1.2 藥品與試劑
白芍、麥冬、玄參、火麻仁、枳實、厚樸、太子參、生白術、甘草飲片(批號分別為D2209079、2210048、2206147、2206142、2207091、2210036、2111091、D2207058、2206076)均購自四川新荷花中藥飲片股份有限公司,經成都中醫藥大學中藥學教研室黃勤挽副教授鑒定均為真品。
乳果糖口服溶液(批號366197,規格15 mL∶10 g)由Fresenius Kabi Austria GmbH生產;復方地芬諾酯片(批號220501,每片含鹽酸地諾酚酯2.5 mg、硫酸阿托品25μg)由廣西河豐藥業有限責任公司生產;活性炭、阿拉伯樹膠(批號分別為C14358027、C14362403)均購自上海麥克林生化科技股份有限公司;AxyPrep DNA凝膠回收試劑盒購自美國Axygen Biosciences 公司;SMRTbellTMTemplate 制備試劑盒購自美國Pacific Biosciences 公司;GABA、5-HT對照品(批號分別為1ST7512、1ST157682,純度分別為99.6%、99.9%)均購自天津阿爾塔科技有限公司;甲醇、乙腈、甲酸為色譜純,其余試劑為分析純或實驗室常用規格,水為超純水。
1.3 實驗動物
SPF級健康SD大鼠40 只,雌雄各半,4 周齡,購自斯貝福(北京)生物技術有限公司,實驗動物許可證號為SCXK(京)2019-0010。所有實驗動物均飼養于成都中醫藥大學溫江校區藥理學實驗室動物飼養中心[相對濕度(55±10)%,溫度(25±2)℃,每12 h 明暗交替,定時通風換氣],以普通飼料喂養并自由飲水。所有實驗程序均經過四川省實驗動物學會福利倫理委員會批準(批準文號P202303201)。
2 方法
2.1 藥液和墨汁的制備
2.1.1 加味芍藥甘草湯
稱取飲片白芍15 g、麥冬10 g、玄參10 g、火麻仁10g、枳實8 g、厚樸8 g、太子參8 g、生白術8 g、甘草5 g(共82 g),混合,以10 倍量水浸泡30 min 后,武火煮沸,轉文火煎煮30 min,過濾;取藥渣,同法再煎煮1 次。合并2次水煎液,過濾,濃縮,得質量濃度為5.6 g/mL(以生藥量計)的加味芍藥甘草湯煎液。
2.1.2 陽性對照藥
取乳果糖口服溶液適量,用生理鹽水制成質量濃度為208.44 mg/mL的溶液,即配即用。
2.1.3 復方地芬諾酯
將復方地芬諾酯片研磨為細粉,用生理鹽水配制成質量濃度為1.5 mg/mL的混懸液,即配即用。
2.1.4 墨汁
取阿拉伯膠50 g,加水400 mL,混合,煮沸至澄清透明,再加活性炭25 g,混勻并煮沸3 次,冷卻,用水定容至500 mL,于4 ℃下保存,使用前攪拌均勻。
2.2 分組、造模與給藥
大鼠適應性飼養3 d 后,按隨機數字表法分為空白組(10 只)和造模組(30 只),雌雄各半。造模組大鼠參考相關文獻[2,13―14],采用復方地芬諾酯[15 mg/(kg·d),每天1 次,連續14 d]灌胃的方式構建STC 模型;空白組大鼠灌胃等體積生理鹽水。造模后,若大鼠出現體形干癟瘦小、毛發豎立、拱背、活動減少、糞便質量減輕及顆粒變細等癥狀,大便Bristol 評分較空白組顯著降低,且首粒黑便排出時間(造模結束后立即禁食24 h,經口灌入墨汁10 mL/kg。從灌胃完畢開始計時,記錄首粒黑便排出時間)較空白組顯著延長,則視為STC模型復制成功。
造模期間大鼠無死亡,全部存活。將造模成功的大鼠隨機分為模型組(10 只),加味芍藥甘草湯組(10 只),陽性對照藥組(10 只),雌雄各半。本課題組前期臨床研究表明,加味芍藥甘草湯常規劑量治療STC 的療效顯著,故參考此劑量,予加味芍藥甘草湯組大鼠相應藥液56 g/(kg·d)(以生藥量計);同法予陽性對照藥組大鼠相應藥液2.09 g/(kg·d),空白組和模型組大鼠灌胃等體積生理鹽水;每天1 次,連續14 d。
2.3 大鼠一般情況觀察及體重、Bristol 評分、糞便含水率檢測
2.3.1 一般情況觀察
實驗期間,觀察各組大鼠的精神、活動、毛發、攝食、飲水等一般情況。
2.3.2 體重、Bristol評分、糞便含水率檢測
(1)體重:觀察各組大鼠實驗期間的體重變化情況,并記錄末次給藥后各組大鼠的體重。
(2)糞便Bristol 評分:末次給藥后,將大鼠單籠飼養,收集其24 h 糞便,并按Bristol 評分標準評估其糞便性狀,具體標準如下:糞便存在分散的硬塊,似堅果,記1分;糞便呈臘腸狀,且成塊,記2 分;糞便呈臘腸狀,但表面有裂縫,記3 分;糞便似臘腸或蛇狀,光滑柔軟,記4分;糞便為軟團,邊緣清楚,記5 分;糞便似糊狀、絨狀物,邊緣不清,記6 分;糞便為水樣,無固狀物,記7 分[13]。
(3)糞便含水率:取各組大鼠上述24 h 糞便,稱定糞便濕重;于60 ℃下恒溫烘干12 h 后,稱定其干重,按下式計算糞便含水率:糞便含水率=(糞便濕重-糞便干重)/糞便濕重×100%[13]。
2.4 大鼠腸道推進功能檢測
采用墨汁灌胃法檢測。結束上述指標檢測后,隨機選取每組4 只大鼠,禁食、不禁水24 h,以墨汁10 mL/kg灌胃,30 min 后以戊巴比妥鈉30 mg/kg 腹腔注射麻醉,再以頸椎脫臼法處死,隨后立即剖開腹部,快速取出其腸道,在無張力的狀態下測量大鼠的腸道全長及墨汁在腸道內的推進長度,按下式計算腸道推進率:腸道推進率=墨染腸管長度/腸道全長×100%[13]。
2.5 大鼠腸內容物中GABA、5-HT含量的檢測
取每組剩余6 只大鼠,按“2.4”項下方法麻醉、處死、解剖,快速取出其腸內容物,采用液相色譜-串聯質譜法檢測其中GABA、5-HT含量。
(1)色譜與質譜條件:色譜柱為Agilent Eclipse PlusC18(3.0 mm×150 mm,1.8 μm),以0.6% 甲酸溶液(A)-乙腈(B)為流動相進行梯度洗脫(0~0.3 min,98%A;0.3~5 min,98%A→90%A;5~10 min,90%A→10%A;10~14.5 min,10%A→98%A),柱溫為35 ℃,進樣量為5 μL。采用電噴霧離子源以多反應監測模式進行正離子掃描,用于定量分析的離子對分別為m/z 104.1→87.1(GABA)、m/z 177.4→160.0(5-HT)。
(2)樣品檢測:精密稱取各組大鼠的腸內容物50mg,置于2 mL EP 管中,加入-20 ℃預冷的80% 乙腈400 μL 沉淀蛋白,渦旋提取20 min,于4 ℃下以12 000r/min 離心10 min;取上清液,以氮氣流吹干,殘渣以初始流動相100 μL 復溶,于4 ℃下以12 000 r/min 離心10min;取上清液,按上述色譜與質譜條件進樣測定,記錄峰面積,以外標法計算腸內容物中GABA、5-HT 含量。方法學考察結果顯示,GABA、5-HT檢測質量濃度的線性范圍分別為1.00~50.0、2.00~100 ng/mL(r>0.999);精密度、重復性等結果均符合2020 年版《中國藥典》(四部)的相關要求。
2.6 大鼠腸道菌群檢測
采用第三代16S rRNA 高通量測序技術檢測。取“2.5”項下各組大鼠的腸內容物樣本適量,使用相應試劑盒對樣本進行基因提取和定量后,使用特定引物(515 正向引物為5′-AGRGTTYGATYMTGGCTCAG-3′,806 反向引物為5′-RGYTACCTTGTTACGACTT-3′,由杭州聯川生物技術股份有限公司設計、合成)擴增16S rRNA的V1~V9 區域。所得產物經回收、純化后,使用藍色熒光定量系統定量;以SMRTbellTM Template 制備試劑盒構建測序文庫,并進行測序分析。采用DADA 2 軟件對測序數據進行去噪處理,得到擴增子序列變體(amplicon sequencevariants,ASV)特征序列和豐度表格,使用SILVA數據庫(https://www.arb-silva.de)進行分類學注釋,通過Chao1、Goods_coverage、Shannon、Simpson 指數( 以Chao1 指數表征群落豐度,Shannon、Simpson 指數表征群落多樣性,Goods_coverage 指數反映測序深度)進行腸道菌群的α 多樣性分析,通過計算4 種距離(weighted_unifrac、unweighted_unifrac、jaccard、bray_curtis)以主成分分析(principal component analysis,PCA)法進行腸道菌群的β多樣性評價;同時,從門水平分析腸道菌群的物種組成,并通過方差分析進行組間比較。
2.7 GABA、5-HT含量與腸道菌群相對豐度的相關性分析
對各組大鼠腸內容物中GABA、5-HT含量與腸道菌群相對豐度進行Pearson 相關性分析,并繪制熱圖。
2.8 統計學方法
采用SPSS 22.0 軟件對數據進行統計分析。符合正態分布的計量資料以x±s 表示,兩組間比較采用t 檢驗(方差齊)或校正t 檢驗(方差不齊);多組間比較采用單因素方差分析,事后多重比較采用LSD-t 檢驗(方差齊)或Tamhane’s T 2檢驗(方差不齊)。不符合正態分布的計量資料以M(P25,P75)表示,組間比較采用Mann-Whitney U檢驗。檢驗水準α=0.05。
3 結果
3.1 加味芍藥甘草湯對大鼠一般情況、體重、Bristol 評分、糞便含水率的影響
與空白組比較,模型組大鼠形體瘦小,皮毛稀疏粗糙,行動變遲緩,其體重、Bristol 評分、糞便含水率均顯著降低(P<0.05);與模型組比較,各藥物組大鼠上述一般情況均有所改善,其體重、Bristol 評分、糞便含水率均顯著升高(P<0.05)。結果見表1。
3.2 加味芍藥甘草湯對大鼠腸道推進率的影響
與空白組[(81.34±11.19)%]比較,模型組大鼠的腸道墨汁推進長度明顯縮短,腸道推進率[(33.51±9.52)%]顯著降低(P<0.01);與模型組比較,加味芍藥甘草湯組和陽性對照藥組大鼠的腸道墨汁推進長度均有所延長,其推進率[(75.57%±12.44)% 、(52.64±15.38)%]均顯著升高(P<0.05)。結果見圖1。
3.3 加味芍藥甘草湯對大鼠腸內容物中GABA、5-HT含量的影響
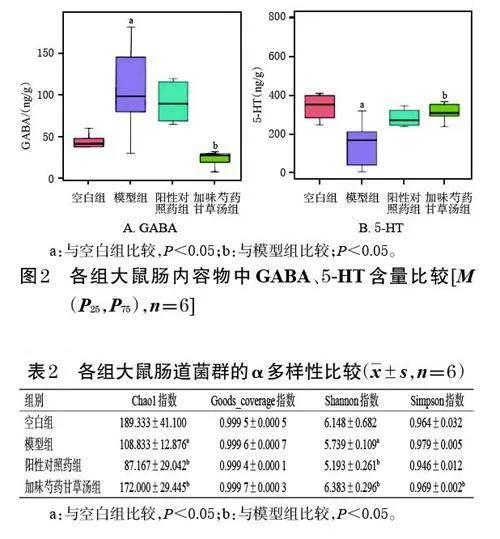
與空白組比較,模型組大鼠腸內容物中GABA含量顯著升高,5-HT 含量顯著降低(P<0.05);與模型組比較,加味芍藥甘草湯組大鼠腸內容物中GABA含量顯著降低,5-HT含量顯著升高(P<0.05),而陽性對照藥組大鼠腸內容物中上述指標含量的差異均無統計學意義(P>0.05)。結果見圖2。
3.4 加味芍藥甘草湯對大鼠腸道菌群的影響
3.4.1 α多樣性
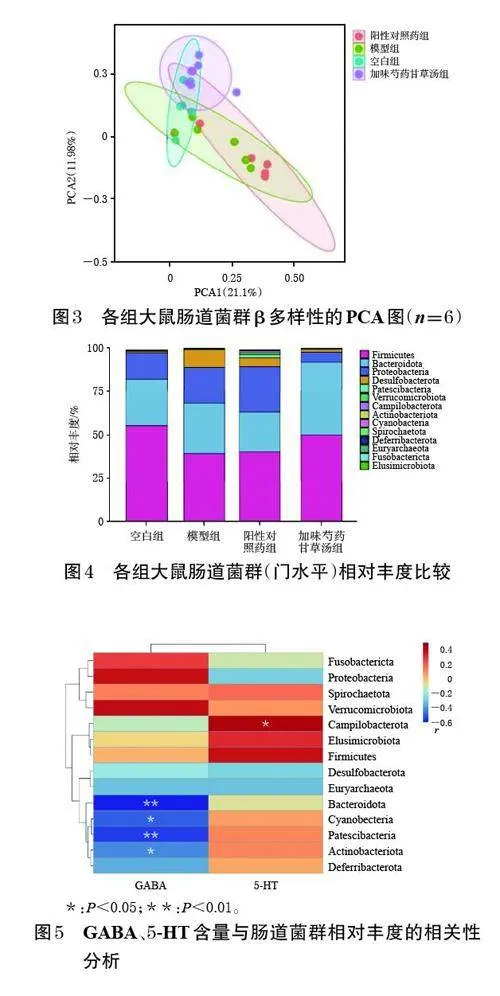
與空白組比較,模型組大鼠的Chao1、Shannon 指數均顯著降低(P<0.05);與模型組比較,加味芍藥甘草湯組大鼠的Chao1、Shannon 指數均顯著升高(P<0.05),而陽性對照藥組大鼠的Chao1、Shannon 指數和加味芍藥甘草湯大鼠的Simpson 指數均顯著降低(P<0.05);各組大鼠的Goods_coverage 指數比較,差異均無統計學意義(P>0.05)。結果見表2。
3.4.2 β多樣性
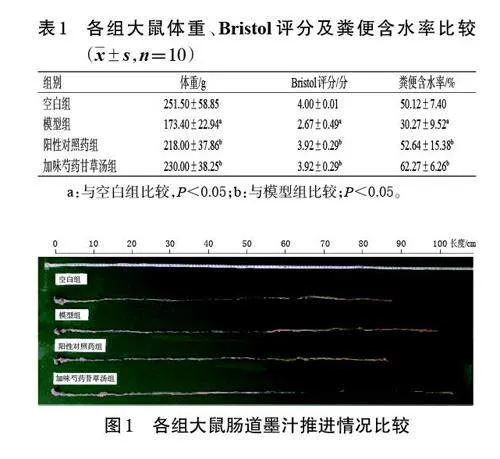
PCA結果提示,空白組與加味芍藥甘草湯組腸道菌群可歸為一類,與模型組距離較遠;而陽性對照藥組大鼠腸道菌群與模型組距離較近。結果見圖3。
3.4.3 物種組成
門水平上,與空白組比較,模型組大鼠腸內容物中脫硫桿菌門Desulfobacterota 的相對豐度顯著升高(P<0.05);厚壁菌門Firmicutes 的相對豐度雖有所降低,但差異無統計學意義(P>0.05)。與模型組比較,加味芍藥甘草湯組大鼠腸內容物中脫硫桿菌門、厚壁菌門、擬桿菌門Bacteroidota 的相對豐度雖有回調,但差異均無統計學意義(P>0.05)。方差分析結果顯示,脫硫桿菌門是組間差異因素(P<0.05)。結果見圖4。
3.5 GABA、5-HT含量與腸道菌群相對豐度的相關性
Pearson 分析結果提示,GABA的含量與擬桿菌門、藍菌門Cyanobacteria、髕骨菌門Patescibacteria、放線菌門Actinobacteriota 的相對豐度呈負相關(r<0,P<0.01或P<0.05);5-HT 的含量與彎曲桿菌門Campilobacterota的相對豐度呈正相關(r>0,P<0.05)。結果見圖5。
4 討論
STC是一類以結腸傳輸減慢為特點的頑固性便秘,病情易反復且病程持久,嚴重影響患者的生活質量[1―2]。現代醫學治療STC一般以基礎治療為主,手段有限且遠期效果不佳[15―16]。我國中醫學認為,STC的病位在大腸,病機為大腸傳輸功能失常。研究證實,中醫藥治療STC具有療效確切、安全可靠、作用持久等優勢[5,17]。加味芍藥甘草湯由經典名方“芍藥甘草湯”化裁而得,用于小兒STC的療效確切[10]。本方重用白芍化陰降下為君,與甘草配伍酸甘化陰、養陰增液,且《本經疏證》記載“芍藥合甘草以破腸胃之結”,因此白芍、甘草合用既能滋陰潤燥,也能破腸胃之結以通下;輔以玄參、麥冬,可滋陰潤燥、清熱生津;枳實清脾熱且理脾氣,使氣機得以通暢;厚樸一則增強枳實理氣下行之功,二則制約玄參、枳實寒性太過,使脾氣既不為熱約、又不為寒凝;火麻仁潤腸通便;生白術、太子參益脾氣,降陰濁,升清陽,消水谷;全方共奏酸甘化陰、養陰增液、益氣通便之功[10]。
GABA、5-HT 是反映腸道功能的重要介質,在STC發生發展中具有特殊的作用。近期研究表明,GABA能系統在腸神經系統中廣泛表達,可與其他神經遞質協同作用以維持腸道穩態,并可參與調節腸神經系統功能及腸激素分泌[11―12]。研究表明,GABA能激活腸道組織中的GABA A型受體(type A γ aminobutyric acid receptor,GABAAR),引起上皮細胞氯離子(Cl-)外流,從而使腸道基底側水、電解質向腸腔內流動,從而調節腸道的水液代謝;同時,GABAAR激活后,可刺激腸嗜鉻細胞分泌5-HT,5-HT分泌的增加可有助于改善機體的腸道傳導功能[15―16]。此外,有研究指出,GABA具有一定的腸道動力促進作用,但高濃度GABA的作用可能與之相反;同時,GABA也是腸道菌群的營養來源之一,其在腸道菌群中的穩態是維持腸道動力正常的關鍵[5]。本研究結果顯示,經加味芍藥甘草湯干預后,大鼠腸內容物中GABA含量較模型組顯著降低,5-HT含量較模型組顯著升高,提示加味芍藥甘草湯可能通過調節腸內容物中GABA 和5-HT 含量,進而改善模型大鼠的糞便Bristol評分、糞便含水率、腸道推進率等STC相關指標。
研究指出,腸道菌群失調是STC 等疾病的重要病因,而GABA和5-HT 作為腸道菌群與宿主的共代謝產物,在胃腸道疾病的發生發展中具有關鍵作用[18―20]。本研究結果表明,加味芍藥甘草湯能夠改善模型大鼠腸道菌群的多樣性,使其接近空白組水平,且效果優于陽性對照藥;同時,加味芍藥甘草湯組擬桿菌門、厚壁菌門相對豐度均有增加趨勢,且兩者比例相較模型組更接近空白組;Pearson 分析結果顯示,GABA的含量與擬桿菌門、藍菌門、髕骨菌門、放線菌門的相對豐度呈負相關,5-HT的含量與彎曲桿菌門的相對豐度呈正相關,提示腸道菌群與宿主共代謝產物GABA、5-HT的含量與特定菌門顯著相關。以上結果表明,各組大鼠腸道菌群組成具有高度的特異性,STC大鼠腸道菌群中有害菌(厚壁菌門、脫硫桿菌門等)的相對豐度增加,而加味芍藥甘草湯可改善大鼠的腸道菌群結構,并可一定程度地下調有害菌的相對豐度,進而影響大鼠腸道菌群中GABA、5-HT的含量[21]。但本研究并未具體到菌屬、菌種,這可能是藥物組與模型組菌群豐度差異無統計學意義的原因,尚需后續實驗予以完善。
綜上所述,加味芍藥甘草湯可改善STC模型大鼠糞便性狀和腸道動力,上述作用可能與改善腸道菌群,進而影響腸內容物中GABA、5-HT含量有關;GABA、5-HT含量可能與擬桿菌門、彎曲桿菌門等特定菌門的相對豐度顯著相關。
參考文獻
[ 1 ] ROBIN S G,KELLER C,ZWIENER R,et al. Prevalence
of pediatric functional gastrointestinal disorders utilizing
the Rome Ⅳ criteria[J]. J Pediatr,2018,195:134-139.
[ 2 ] 許明敏. 基于腸道菌群探討針刺改善FC小鼠胃腸傳輸
功能的效應機制研究[D]. 成都:成都中醫藥大學,2020.
XU M M. Study on the mechanism of acupuncture improving
gastrointestinal transmission function in FC mice
based on intestinal flora[D]. Chengdu:Chengdu University
of Traditional Chinese Medicine,2020.
[ 3 ] 中華醫學會消化病學分會胃腸動力學組,功能性胃腸病
協作組. 中國慢性便秘專家共識意見:2019,廣州[J]. 中
華消化雜志,2019,39(9):577-598.
Neurogastroenterology and Motility Committee,Chinese
Society of Gastroenterology,Functional Gastrointestinal
Disorder Group. Chinese expert consensus on chronic
constipation:2019,Guangzhou[J]. Chin J Dig,39(9):
577-598.
[ 4 ] CERESOLA E R,FERRARESE R,PRETI A,et al. Targeting
patients’ microbiota with probiotics and natural fibers
in adults and children with constipation[J]. Eur Rev
Med Pharmacol Sci,2018,22(20):7045-7057.
[ 5 ] ZHAO Y,YU Y B. Intestinal microbiota and chronic
constipation[J]. Springerplus,2016,5(1):1130.
[ 6 ] KOPPEN I J N,BENNINGA M A,TABBERS M M. Is
there a role for pre-,pro- and synbiotics in the treatment
of functional constipation in children? A systematic review
[J]. J Pediatr Gastroenterol Nutr,2016,63(Suppl. 1):S27-
S35.
[ 7 ] STRANDWITZ P. Neurotransmitter modulation by the
gut microbiota[J]. Brain Res,2018,1693:128-133.
[ 8 ] CHEN M J,RUAN G C,CHEN L,et al. Neurotransmitter
and intestinal interactions:focus on the microbiota-gutbrain
axis in irritable bowel syndrome[J]. Front Endocrinol
(Lausanne),2022,13:817100.
[ 9 ] SCHW?RER H,RACKé K,KILBINGER H. GABA receptors
are involved in the modulation of the release of 5-
hydroxytryptamine from the vascularly perfused small intestine
of the guinea-pig[J]. Eur J Pharmacol,1989,165
(1):29-37.
[10] 萬什方. 芍藥甘草湯加味治療兒童功能性便秘腸燥津虧
證的臨床觀察[D]. 成都:成都中醫藥大學,2023.
WAN S F. Clinical observation on the treatment of functional
constipation in children with intestinal dryness and
fluid deficiency by Modified shaoyao gancao decoction
[D]. Chengdu:Chengdu University of Traditional Chinese
Medicine,2023.
[11] DENG Y,ZHAO Q,ZHOU H Y,et al. Activation of
ASIC3/ERK pathway by paeoniflorin improves intestinal
fluid metabolism and visceral sensitivity in slow transit
constipated rats[J]. Kaohsiung J Med Sci,2024,40(6):
561-574.
[12] NGO D H,VO T S. An updated review on pharmaceutical
properties of gamma-aminobutyric acid[J]. Molecules,
2019,24(15):2678.
[13] ZHAN Y,WEN Y,ZHANG L L,et al. Paeoniflorin
improved constipation in the loperamide-induced rat
model via TGR5/TRPA1 signaling-mediated 5-hydroxytryptamine
secretion[J]. Evid Based Complement Alternat
Med. 2021:6076293.
[14] 宋攀. 中藥高位保留灌腸對STC 大鼠結腸ICC 與血清
VIP的影響研究[D]. 南充:川北醫學院,2017.
SONG P. Effect of high retention enema with traditional
Chinese medicine on colon ICC and serum VIP in STC
rats[D]. Nanchong:North Sichuan Medical College,2017.
[15] KOH W,KWAK H,CHEONG E,et al. GABA tone regulation
and its cognitive functions in the brain[J]. Nat Rev
Neurosci,2023,24(9):523-539.
[16] LUND M L,EGEROD K L,ENGELSTOFT M S,et al.
Enterochromaffin 5-HT cells:a major target for GLP-1
and gut microbial metabolites[J]. Mol Metab,2018,11:
70-83.
[17] BARBARA G,FEINLE-BISSET C,GHOSHAL U C,et
al. The intestinal microenvironment and functional gastrointestinal
disorders[J]. Gastroenterology,2016,150(6):
1305-1318.e8.
[18] DROSSMAN D A,HASLER W L. Rome Ⅳ:functional
GI disorders:disorders of gut-brain interaction[J]. Gastroenterology,
2016,150(6):1257-1261.
[19] HUNGIN A P S,MITCHELL C R,WHORWELL P,et al.
Systematic review:probiotics in the management of lower
gastrointestinal symptoms:an updated evidence-based international
consensus[J]. Aliment Pharmacol Ther,2018,
47(8):1054-1070.
[20] 陳振海,馮江毅,胡淞,等. 枯草芽孢桿菌通過TGR5/
TRPA1 信號通路調節慢性傳輸型便秘小鼠的腸蠕動[J].
中國現代應用藥學,2022,39(7):878-884.
CHEN Z H,FENG J Y,HU S,et al. Bacillus subtilis regulates
intestinal peristalsis in mice with slow transit constipation
through the TGR5/TRPA1 signaling pathway[J].
Chin J Mod Appl Pharm,2022,39(7):878-884.
[21] 洪燕秋. 基于腸道微生態探討運脾法治療慢傳輸型便秘
的臨床和實驗研究[D]. 北京:北京中醫藥大學,2022.
HONG Y Q. Clinical and experimental study on the treatment
of slow transit constipation by spleen-activating
method based on intestinal microecology[D]. Beijing:
Beijing University of Chinese Medicine,2022.
(收稿日期:2024-05-29 修回日期:2024-12-01)
(編輯:張元媛)

