胃癌藥物治療專家共識

關鍵詞胃癌;抗腫瘤藥物;化療;免疫治療;靶向治療;手術;專家共識
胃癌(gastriccancer,GC)是全世界發病率較高的腫瘤之一,患者的5年生存率僅約20%[1]。我國胃癌的發病人數和病死人數均居世界首位,分別約占43.9%和48.6%[2]。據2019-2021年中國腫瘤生存數據統計,我國胃癌5年標化相對生存率為35.2%[3]。靶向、免疫治療等新型治療模式的出現,一定程度上改善了患者的預后。但由于胃癌異質性強、生物學行為差、整體預后不良,因此,規范化藥物治療具有十分重要的作用。為提高醫務人員對胃癌的規范化用藥,為臨床醫師提供指導性用藥參考,進而延長患者生存時間,改善患者生存質量,經臨床專家編寫和審定,最終形成《胃癌藥物治療專家共識》(以下簡稱共識)。
1 共識制定方法
本共識由重慶市醫學會腫瘤學分會化療學組和重慶市醫藥生物技術協會腫瘤罕見病疑難病專委會共同發起,由重慶大學附屬腫瘤醫院腫瘤內科作為牽頭單位,組織重慶市內49家醫院的73名臨床專家編寫和審定。所有參編專家均具有10年以上腫瘤專科工作經歷,其中高級職稱占比86.3%,博士占比67.8%。
本共識采用名義群體法,由重慶大學附屬腫瘤醫院腫瘤內科專家組成員共同討論確定編寫大綱。編寫組專家針對大綱涉及內容進行系統檢索,參考文獻通過PubMed、WebofScience、Embase、CochraneLibrary、中國知網、萬方數據庫等數據庫及國際會議途徑獲取,檢索時間為建庫至2024年5月14日。通過對文獻進行分析、歸納及總結,并根據我國現狀、臨床需求和研究證據初步擬定推薦建議。編寫及審定專家采用線上和線下相結合的會議形式經過多輪討論,對推薦建議進行修訂,以投票形式確定最終共識內容和推薦等級。本共識推薦等級分級標準見表1。
2 共識內容
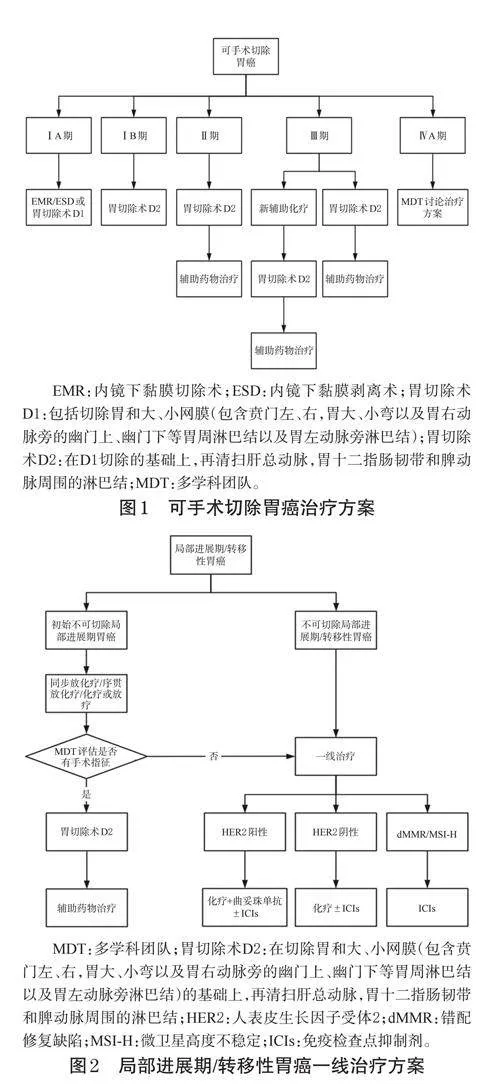
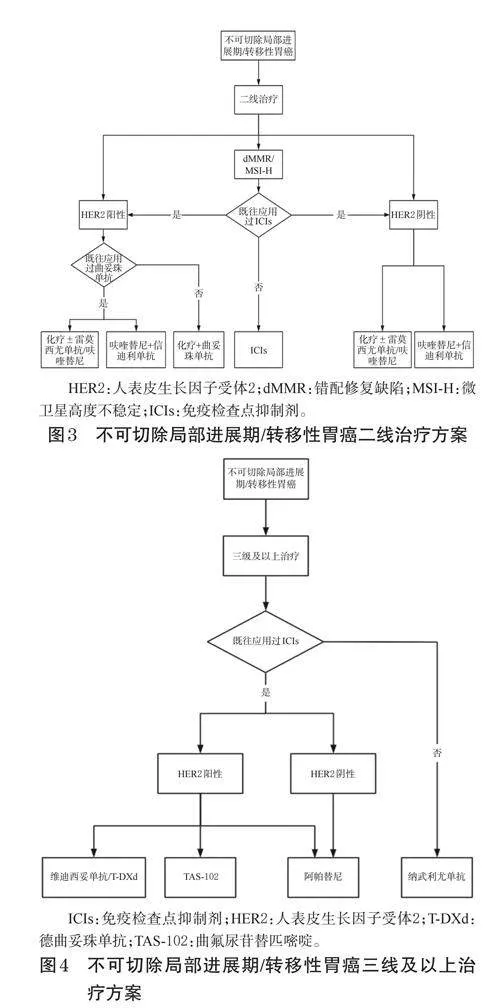
本共識內容包括胃癌的圍手術期藥物治療、晚期轉移性胃癌一線藥物治療、晚期轉移性胃癌二線藥物治療、晚期胃癌三線及三線以上藥物治療、胃癌腹膜轉移的藥物治療等部分組成。本共識中的腫瘤分期參考國際胃癌研究協會第8版TNM分期,共識內容所涉及的胃癌部位不包括胃食管結合部(gastroesophagealjunction,GEJ)。胃癌治療流程圖見圖1~圖4。
2.1 圍手術期藥物治療
2.1.1 圍手術期新輔助藥物治療
胃癌圍手術期新輔助藥物治療是為了使腫瘤縮小、降低腫瘤分期、提高胃癌根治率、延長患者生存時間、提高患者的生存質量。韓國的PRODIGY研究是一項Ⅲ期臨床研究,納入了Ⅱ~ⅢC期的胃癌患者,使用多西他賽+奧沙利鉑+替吉奧(DOS)作為新輔助化療對比單藥替吉奧(S-1)輔助化療,結果顯示DOS新輔助化療提升了患者的3年無進展生存(progression-freesurvival,PFS)率,但其中亞組分析發現Ⅱ期患者獲益不顯著[4]。我國Ⅲ期臨床研究RESOLVE納入cT4aN+M0或cT4bNxM0胃癌患者,結果顯示與卡培他濱+奧沙利鉑(XELOX)相比,使用新輔助S-1+奧沙利鉑(SOX)化療的患者有更高的3年無疾病生存(disease-freesurvival,DFS)率(62.2%vs.54.7%,P=0.045)和5年總生存(overallsurvival,OS)率(60.0%vs.52.1%,P=0.049)[5]。MATCH研究對比了DOS和SOX用于新輔助治療,結果表明DOS方案化療提高了胃癌患者的主要病理緩解(majorpathologicresponse,MPR)率(25.4%vs.11.8%,P=0.035)、R0切除率(78.9%vs.61.8%,P=0.024),但3年PFS率(52.3%vs.35.0%,P=0.065)和3年OS率(57.5%vs.49.2%,P=0.114)差異無統計學意義[6]。FLOT4-AIO研究報道了多西他賽+奧沙利鉑+氟尿嘧啶+亞葉酸鈣(FLOT)對比表柔比星+順鉑+氟尿嘧啶(ECF)/希羅達(ECX)用于新輔助治療,結果表明前者提高了9%的5年OS率,中位生存期(mOS)延長了15個月[7]。對于僅有腹腔游離癌細胞學陽性(CY1P0)的患者,一項系統性綜述結果顯示經新輔助治療后細胞學轉陰的患者OS得到改善(HR=0.64,P<0.0001)。一項Meta分析結果顯示腹腔化療聯合手術對比單純手術,可提高CY1P0患者的5年生存率[8]。而對于肉眼可見的腹膜轉移患者(P1),化療很難消滅所有的微轉移灶[9]。因此,若無明顯化療禁忌,除P1的Ⅲ期患者均應考慮行新輔助化療。
ICIs聯合治療在新輔助治療中顯現出一定的應用前景。KEYNOTE-585研究對比了帕博利珠單抗聯合化療與安慰劑聯合化療,結果顯示ICIs聯合化療顯著地提高了患者的病理完全緩解(pathologicalcompleteremission,pCR)率(P<0.05),也可改善患者的無事件生存期(event-freesurvival,EFS),但差異無統計學意義[10]。MATTERHORN研究證實與安慰劑相比,度伐利尤單抗聯合FLOT方案新輔助治療可顯著改善患者的pCR率(19%vs.7%,P<0.00001),且提高了達到pT0期和pN0期的患者比例,但目前EFS數據尚未公布[11]。DRAGONIV/AHEAD-G208研究顯示,阿帕替尼、卡瑞利珠單抗聯合SOX化療較單純化療組pCR率顯著得到了提升(18.3%vs.5.0%,P<0.0001),且在所有亞組中均有獲益[12]。
此外,對于dMMR/MSI-H的局部進展期可切除胃癌患者,GERCORNEONIPIGA研究使用納武利尤單抗聯合伊匹木單抗作為新輔助治療方案,pCR率達到58.6%[13]。INFINITY研究中,MSI-H的可切除胃癌患者使用曲美木單抗聯合度伐利尤單抗作為新輔助治療方案,pCR率為60%、MPR率為80%[14]。DANTE研究納入了可手術的胃癌患者,使用阿替利珠單抗聯合FLOT化療作為新輔助治療方案,MSI-H亞組患者的pCR率為63%[15]。因此,對于dMMR/MSI-H的可切除胃癌患者,目前多個Ⅰ~Ⅱ期研究結果初步顯示了免疫治療作為新輔助治療的有效性。
共識意見1(專家推薦率:93.2%;推薦等級:2級):無手術禁忌的Ⅱ期胃癌患者建議直接手術,不推薦進行新輔助治療;Ⅲ期患者(P1除外)應考慮行新輔助化療,方案可選擇DOS、SOX、FLOT、XELOX、氟尿嘧啶+亞葉酸鈣+奧沙利鉑(FOLFOX),也可考慮參加免疫聯合新輔助治療的臨床研究;對于CY1P0的腹膜轉移患者可考慮聯合腹腔灌注化療;對于dMMR/MSI-H可切除的局部進展期胃癌患者,新輔助治療推薦免疫聯合治療。
2.1.2 圍手術期術后輔助藥物治療
胃癌圍手術期術后輔助治療的目的是通過消滅殘留癌細胞來降低術后復發率、延長患者的生存時間。2006年,ACTS-GC試驗證實胃癌D2根治術后Ⅱ期或Ⅲ期患者S-1單藥輔助化療3年OS率為80.1%,而未行術后輔助化療的3年OS率僅為70.1%,使S-1單藥在日本成為胃癌輔助化療的標準方案[16]。2012年,韓國CLASSIC試驗結果顯示,XELOX方案術后輔助化療6個月可延長Ⅱ/Ⅲ期胃癌患者的無復發生存期(recurrence-freesurvival,RFS)[17]。我國的Ⅲ期RESOLVE研究顯示,對于cT4aN+M0或者cT4bNanyM0胃癌患者,D2根治術后接受8個周期XELOX或SOX輔助化療患者的3年DFS率分別為51.1%和56.5%,但兩組患者差異無統計學意義,其5年OS率及DFS率差異也無統計學意義[5]。
JACCROGC-07研究是一項對比Ⅲ期胃癌患者R0切除術后給予S-1單藥治療1年和S-1+多西他賽治療的Ⅲ期臨床試驗。其結果表明,術后給予S-1口服1年+多西他賽治療7個周期可改善患者的3年RFS率(65.9%vs.49.5%,P<0.001)[18]。因此,推薦S-1+多西他賽雙藥方案作為Ⅲ期胃癌患者術后輔助化療方案之一,S-1單藥方案可作為某些患者希望避免發生多西他賽相關不良事件(例如脫發)的推薦方案。Ⅲ期試驗ARTIST2的結果顯示,對于D2根治術后pⅡ/Ⅲ期胃癌患者,與S-1單藥持續1年比較,術后輔助化療使用SOX方案6個月可顯著延長患者的DFS(HR=0.692,P=0.042)[19]。因此,對于pⅡ/Ⅲ期胃癌患者根治術后推薦使用包含S-1單藥或聯合方案進行輔助化療,對pⅢ期患者優先推薦S-1聯合方案治療。
ATTRACTION-5研究證實胃癌D2根治術或更廣泛的淋巴結清掃后的Ⅲ期胃癌患者行輔助納武利尤單抗+化療與安慰劑+化療的3年RFS率分別為68.4%和65.3%,無復發生存的風險比為0.90(P=0.44);但在亞組分析中細胞程序性死亡-配體1(programmedcelldeathligand1,PD-L1)腫瘤細胞陽性比例分數(tumorproportionscore,TPS)≥1%的患者能夠在納武利尤單抗+化療中顯著獲益(HR=0.33)[20]。因此,對于PD-L1表達陽性的患者,PD-1單抗聯合治療對降低復發風險具有重要臨床意義。
專家共識2(專家推薦率:94.5%;推薦等級:2級):輔助化療適用于胃癌D2根治術后病理分期為Ⅱ期及Ⅲ~ⅣA期的患者;Ⅱ期患者推薦S-1單藥輔助化療,或兩藥聯合方案輔助化療;Ⅲ~ⅣA期胃癌患者推薦SOX、S-1+多西他賽、氟尿嘧啶類藥物+鉑類等兩藥聯合方案;兩藥聯合治療推薦時限為6個月,單藥化療推薦時限為1年;對于PD-L1表達陽性的Ⅲ期患者,術后可考慮免疫聯合化療。
2.1.3 新輔助+輔助藥物治療
新近研究表明,與單純新輔助或者輔助治療相比,新輔助治療+輔助治療胃癌能提高手術R0切除率,改善術后生存時間,且不增加安全方面的風險。RESOLVE研究旨在比較D2根治術后使用XELOX或SOX方案與圍手術期使用SOX方案的療效和安全性[5]。該研究2023年公布的5年隨訪結果顯示,對于cT4aN+M0或T4bN0M0局部進展期胃癌患者,與XELOX方案輔助治療相比,圍手術期的新輔助+輔助治療方案(3個周期SOX新輔助化療+5個周期SOX方案輔助化療+3個周期S-1單藥維持治療)可改善患者5年OS率(60.0%vs.52.1%,P=0.049),顯著降低21%的死亡風險。基于此,圍手術期SOX方案序貫S-1單藥維持治療可作為局部進展期胃癌患者的新選擇。另外,同期報道的PRODIGY研究顯示,對于cT2~3N+M0或T4NanyM0的局部進展期胃癌,與S-1單藥輔助化療相比,術前3個周期DOS新輔助化療加上術后8個周期S-1單藥可將PFS提高29%,5年PFS率分別為60.6%和56%,8年PFS率分別為55.8%和43.2%[4]。
專家共識3(專家推薦率:86.3%;推薦等級:2級):對于cT4aN+M0或T4bN0M0局部進展期胃癌患者,可推薦圍手術期SOX方案序貫S-1單藥維持治療;對于cT2~3N+M0或T4NanyM0的局部進展期胃癌患者,可推薦術前3個周期DOS方案新輔助化療加術后8個周期S-1單藥化療。
2.2 晚期轉移性胃癌一線藥物治療
晚期轉移性胃癌的一線治療,需根據患者的HER2、MMR/MSI狀態、PD-L1、緊密連接蛋白18.2(Claudin18.2,CLDN18.2)等表達情況選擇相應的全身藥物治療;根據病情可選擇聯合姑息性手術、放療、介入等局部或者營養治療等來獲得更好的生存期和生存質量。
2.2.1 HER2陽性患者
HER2陽性指免疫組織化學(immunohistochemistry,IHC)3+或者IHC2+且免疫熒光原位雜交檢測HER2擴增陽性。KEYNOTE-811研究結果提示,對于PD-L1聯合陽性分數(combinedpositivescore,CPS)≥1(以下簡稱為PD-L1CPS)的HER2陽性胃癌患者,帕博利珠單抗+曲妥珠單抗+化療[奧沙利鉑/順鉑+5-氟尿嘧啶(5-fluorouracil,5-FU)/卡培他濱]的療效優于曲妥珠單抗+化療,能延長mPFS(10.9個月vs.7.3個月,HR=0.71)和mOS(20.0個月vs.15.7個月,HR=0.81);而對于PD-L1CPS<1的患者,該方案則無獲益[21]。ToGA研究結果顯示,對初治HER2陽性的晚期轉移性胃腺癌患者,曲妥珠單抗+5-FU/卡培他濱+順鉑較單純化療顯著增加了生存獲益(mOS:13.8個月vs.11.1個月,P=0.00046)[22]。EVIDENCE研究提示,對于HER2陽性轉移性胃癌患者,曲妥珠單抗聯合化療方案[XELOX、順鉑+氟尿嘧啶(PF)、順鉑+卡培他濱、多西他賽/紫杉醇+鉑類+氟尿嘧啶類]中,曲妥珠單抗與XELOX方案的聯合應用療效最佳,mOS達34.6個月[23]。
專家共識4(專家推薦率:91.8%;推薦等級:2級):HER2陽性的晚期胃癌的一線治療,PD-L1CPS≥1時,推薦帕博利珠單抗+曲妥珠單抗+奧沙利鉑/順鉑+5-FU/卡培他濱方案;PD-L1CPS<1時,推薦曲妥珠單抗+奧沙利鉑/順鉑+5-FU/卡培他濱方案。
2.2.2 HER2陰性患者
(1)對于PD-L1CPS≥5或腫瘤區域陽性(tumorareapositivity,TAP)評分≥5%的患者,GEMSTONE-303、CheckMate-649、ORIENT-16等多項臨床研究結果證實給予化療聯合免疫治療,可以提高患者的mPFS和mOS。2023年歐洲腫瘤內科學會(EuropeanSocietyforMedicalOncology,ESMO)公布的GEMSTONE-303研究結果提示,舒格利單抗+XELOX可顯著改善患者的mPFS(7.62個月vs.6.08個月,P<0.0001)和mOS(15.64個月vs.12.65個月,P=0.0060),且PD-L1CPS評分越高的患者獲益越明顯。CheckMate-649研究結果顯示,在PD-L1CPS≥5的亞組分析中,FOLFOX/XELOX方案聯合納武利尤單抗較單純化療延長了患者的mPFS(7.7個月vs.6.05個月,P<0.0001)和mOS(14.4個月vs.11.1個月,P<0.0001)[24]。ORIENT-16研究表明,對于PD-L1CPS≥5的患者,XELOX+信迪利單抗對比單純化療顯著延長了其mPFS(7.7個月vs.5.8個月,P=0.0002)和mOS(18.4個月vs.12.9個月,P=0.0023),將客觀緩解率(objectiveresponserate,ORR)從48.4%提高至58.2%;對于PD-L1CPS≥10的患者,也可選擇XELOX/PF聯合帕博利珠單抗治療[25]。KEYNOTE-859研究結果顯示,XELOX/PF聯合帕博利珠單抗組的mOS比化療聯合安慰劑組更長(12.9個月vs.11.5個月,P<0.0001),其中PD-L1CPS≥10的患者OS獲益更為顯著(15.7個月vs.11.8個月,P<0.0001)[26]。RATIONALE-305研究結果顯示,替雷利珠單抗+XELOX/PF對比單純化療顯著延長了PD-L1TAP評分≥5%的患者的mPFS(7.2個月vs.5.9個月,P<0.001)和mOS(17.2個月vs.12.6個月,P=0.006),且在各亞組中使用替雷利珠單抗聯合化療均能獲益[27]。
(2)PD-L1CPS<5或不能檢出的患者,免疫聯合化療未顯示出治療優勢。CheckMate-649研究結果顯示,PD-L1CPS<5的亞組中,納武利尤單抗聯合化療對比單純化療沒有為患者帶來生存獲益(mOS:HR=0.950,mPFS:HR=0.95)[24]。ORIENT-16研究結果顯示,在PDL1CPS<5的亞組中,信迪利單抗聯合化療組的mOS為11.7個月,而單純化療組為12.0個月[25]。因此,針對PDL1CPS<5或不能檢出的患者,建議選擇以化療為主的治療方案。一線化療方案通常選擇奧沙利鉑/順鉑+5-FU或者紫杉醇+5-FU;多西他賽+順鉑+5-FU(DCF/mDCF)三藥聯合方案只適合于體能狀況好且腫瘤負荷較大的患者;體能狀況較差的患者可選擇氟尿嘧啶或紫杉醇類單藥方案[28]。GO2研究結果顯示,減量的XELOX方案療效不劣于標準劑量組,且不良反應發生率較低,為70歲以上老年體弱的胃癌患者提供了減量化療的依據[29]。
(3)對于CLDN18.2陽性且HER2陰性的患者,SPOTLIGHT研究顯示,佐妥昔單抗聯合氟尿嘧啶+亞葉酸鈣+奧沙利鉑(mFOLFOX6)與單純化療相比能為患者帶來生存獲益(mPFS:10.61個月vs.8.67個月,P=0.0066;mOS:18.23個月vs.15.54個月,P=0.0053)[30]。GLOW研究[31]結果顯示,佐妥昔單抗聯合XELOX組的mPFS及mOS顯著高于單純化療組(mPFS:8.21個月vs.6.80個月,P=0.0007;mOS:14.39個月vs.12.16個月,P=0.0118)[31]。但佐妥昔單抗在我國暫未獲批上市,且CLDN18.2表達通過免疫組化檢測,目前尚無統一的陽性判讀標準,故推薦CLDN18.2陽性且HER2陰性的患者可參加相關臨床研究治療。
專家共識5(專家推薦率:100%;推薦等級:1級):HER2陰性晚期胃癌的一線治療,PD-L1CPS≥5或TAP評分≥5%時,推薦XELOX或PF方案化療聯合ICIs;PD-L1CPS<5、TAP評分<5%或不能檢出的患者,推薦以化療為主的治療方案。
2.2.3 dMMR/MSI-H患者
dMMR/MSI-H胃癌約占晚期胃癌的6%[32]。KEYNOTE-062Ⅲ期研究結果顯示,在MSI-H/PD-L1CPS≥1胃癌亞組的50例患者中,接受帕博利珠單抗組mOS未達到,而化療組mOS為8.5個月,提示免疫單藥療效優于單純化療,長期生存獲益明顯[33]。CheckMate-649Ⅲ期研究結果提示,在MSI-H亞組中,納武利尤單抗聯合化療對比單純化療可改善患者的mOS(38.7個月vs.12.3個月,HR=0.34)[24]。NOLIMIT研究為一項Ⅱ期研究,評價了納武利尤單抗聯合低劑量伊匹木單抗作為MSI-H晚期胃腺癌或GEJ腺癌一線治療的療效,納入了29例患者,ORR為62.1%,疾病控制率(diseasecontrolrate,DCR)達到79.3%,mPFS為13.8個月,mOS未達到[34]。
專家共識6(專家推薦率:84.9%;推薦等級:2級):對于dMMR/MSI-H晚期胃癌患者,推薦帕博利珠單抗單藥或納武利尤單抗聯合化療/伊匹木單抗治療。
2.3 晚期轉移性胃癌二線藥物治療
德國腫瘤內科學會開展的一項Ⅲ期臨床試驗評估了伊立替康作為晚期胃癌患者二線治療方案的療效[35]。該研究結果表明,與最佳對癥支持治療相比,伊立替康延長了患者mOS(4.0個月vs.2.4個月,P=0.012)。此外,COUGAR-02研究證實了多西他賽在延長晚期胃癌患者二線治療后的mOS方面的優越性(5.2個月vs.3.6個月,P=0.01)[36]。在WJOG4007G的Ⅲ期研究中,紫杉類藥物與伊立替康在晚期胃癌二線治療的療效對比中顯示出相當的療效(mPFS:3.6個月vs.2.3個月,P=0.33;mOS:9.5個月vs.8.4個月,P=0.38)[37]。BIRIP研究是一項Ⅲ期臨床試驗,旨在評估伊立替康聯合順鉑與伊立替康單藥治療在一線治療失敗后的晚期胃癌患者中的療效[38]。該研究結果顯示,聯合治療方案在提高患者的mPFS方面優于單藥治療(3.8個月vs.2.8個月,P=0.0398),然而,mOS在兩組間的差異無統計學意義(10.7個月vs.10.1個月,P=0.9823)。
在REGARDⅢ期臨床試驗中,研究者對雷莫西尤單抗作為晚期胃腺癌或GEJ腺癌患者的二線治療方案進行了評估。結果顯示,與安慰劑相比,雷莫西尤單抗能顯著延長患者的mOS(5.2個月vs.3.8個月,P=0.0473)[39]。RAINBOW研究是一項全球多中心的Ⅲ期研究,探討了雷莫西尤單抗與紫杉醇聯合治療方案在治療對鉑類和氟尿嘧啶類藥物一線治療無效的轉移性或局部晚期胃腺癌及GEJ腺癌患者中的療效[40]。該研究結果顯示,與單獨使用紫杉醇相比,雷莫西尤單抗的加入顯著提升了患者的mPFS(4.4個月vs.2.9個月,P<0.0001)和mOS(9.63個月vs.7.36個月,P=0.0169)。同時,RAINBOW-AsiaⅢ期研究中90%的患者來自我國,結果顯示雷莫西尤單抗聯合紫杉醇較紫杉醇單藥顯著延長患者的mPFS[41]。該項研究的結果與RAINBOW研究相一致,顯示出顯著的生存獲益和良好的耐受性。
FRUTIGAⅢ期研究旨在評價呋喹替尼聯合紫杉醇對比安慰劑聯合紫杉醇在接受含氟尿嘧啶或鉑類一線化療后失敗的晚期胃腺癌或GEJ腺癌患者中的療效以及患者的安全性[42]。結果顯示呋喹替尼聯合紫杉醇顯著提高了患者的mPFS(5.55個月vs.2.73個月,P<0.0001)和mOS(9.56個月vs.7.85個月,P=0.0233)。
NCT03903705是一項旨在評估呋喹替尼與信迪利單抗聯合療法在初治或經治的晚期胃腺癌及GEJ腺癌患者中療效的臨床研究[43]。該研究結果顯示,該聯合療法的ORR達到了72.2%、DCR達到了100%,中位緩解持續時間(mediandurationofresponse,mDoR)為10.3個月、mPFS為11.0個月。
對于HER2陽性的晚期胃癌患者的二線治療,JFMC45-1102Ⅱ期臨床試驗結果顯示,在既往治療失敗且未曾接受過曲妥珠單抗治療的患者群體中,曲妥珠單抗與紫杉醇聯合療法的mOS達到了17.1個月,而mPFS為5.1個月,ORR為37%[44]。DESTINY-Gastric02Ⅱ期研究評價了德曲妥珠單抗(trastuzumabderuxtecan)治療HER2陽性且經一線含曲妥珠單抗方案治療失敗的胃癌患者的療效,結果顯示該治療方案的ORR為41.8%,mPFS為5.6個月[45]。
一項Ⅱ期前瞻性、多中心臨床試驗對恩沃利單抗在標準治療方案無效的dMMR/MSI-H晚期實體瘤患者中的療效進行了評估,共納入18例二線及以上胃癌患者,結果顯示ORR為55.6%,12個月的OS率為83.3%[46]。RATIONALE209研究納入了74例標準治療失敗的MSI-H/dMMR晚期惡性腫瘤患者,結果顯示接受替雷利珠單抗治療的患者群體ORR達到34.9%,其中8例胃癌患者有1例達到完全緩解(completeremission,CR)和4例達到部分緩解(partialremission,PR)[47]。另一項前瞻性臨床研究則納入了68例對標準治療無效的MSI-H/dMMR晚期惡性腫瘤患者予以斯魯利單抗治療,結果顯示ORR為39.7%,12個月的DoR率達到了92.1%、OS率達到了74.5%[48];其中3例接受過二線治療的胃癌受試者中位隨訪時間為7.16個月,1例達到PR。
專家共識7(專家推薦率:87.7%;推薦等級:2級):晚期胃癌患者二線治療,推薦紫杉醇聯合雷莫西尤單抗/呋喹替尼,亦可選擇呋喹替尼聯合信迪利單抗或紫杉類/伊立替康單藥治療;對于HER2陽性的晚期胃癌患者,如之前未接受過曲妥珠單抗治療,可考慮曲妥珠單抗與紫杉醇的聯合療法;經一線含曲妥珠單抗方案治療失敗的胃癌患者可考慮德曲妥珠單抗治療。對于dMMR/MSIH的晚期胃癌患者,如既往未接受過PD-1或PD-L1抑制劑治療,可推薦使用恩沃利單抗、替雷利珠單抗或斯魯利單抗。
2.4 晚期胃癌三線及三線以上藥物治療
晚期胃癌進展迅速、預后差,三線治療選擇有限,后線治療以靶向治療、免疫治療、單藥化療或者最佳支持治療為主。
一項Ⅱ期研究C008納入125例二線及以上標準治療失敗的HER2IHC2+/3+晚期胃癌患者,研究結果提示維迪西妥單抗組的ORR為24.8%,中位OS達到7.9個月[49]。另一項Ⅲ期臨床研究顯示甲磺酸阿帕替尼較安慰劑組在三線治療中顯著延長了晚期胃癌患者的mPFS(2.6個月vs.1.8個月,P<0.001)及mOS(6.5個月vs.4.7個月,P=0.015)[50]。DESTINY-Gastric01是一項研究德曲妥珠單抗用于經二線及以上治療失敗的HER2陽性晚期胃癌或GEJ腺癌患者的Ⅱ期試驗,共納入187例患者,主要為韓國和日本人群,結果顯示德曲妥珠單抗組較化療組的ORR(51.3%vs.14.3%,P<0.0001)和mPFS(5.6個月vs.3.5個月,P=0.0003)顯著提升[51]。該項研究結果初次驗證了德曲妥珠單抗在晚期胃癌后線治療中獲益。另一項在我國開展的單臂Ⅱ期臨床試驗DESTINYGastric06評價了德曲妥珠單抗在既往二線治療進展的HER2陽性局部晚期或轉移性胃癌或GEJ腺癌的安全性和療效,結果顯示HER2陽性胃癌或GEJ腺癌患者的mDoR、mPFS和mOS分別為7.9個月、5.7個月和10.2個月,提示德曲妥珠單抗在我國人群中同樣可以延長晚期胃癌患者的生存時間,且安全性良好[52]。最新的一項Ⅰ期研究共納入113例經二線及以上治療失敗的CLDN18.2陽性晚期胃或GEJ癌患者,結果顯示抗體藥物偶聯物(antibody-drugconjugate,ADC)藥物CMG901治療后總體ORR為33%,DCR為70%,同時安全性可耐受[53]。
在胃癌三線治療中,免疫檢查點抑制劑的應用也有前瞻性研究結果支持,其中,ATTRACTION-2研究結果顯示,相較于安慰劑,納武利尤單抗能延長胃癌患者的mOS(5.26個月vs.4.14個月,P<0.0001)[54]。
TAGSⅢ期研究評價了曲氟尿苷替匹嘧啶(trifluridineandtipiracilhydrochloride,TAS-102)用于經治二線及以上治療失敗的復發或轉移性胃癌和GEJ腺癌的療效,研究結果顯示,TAS-102相較安慰劑延長了患者的mOS(5.7個月vs.3.6個月,P=0.0003)和mPFS(2.0個月vs.1.7個月,P<0.0001)[55]。
專家共識8(專家推薦率:83.6%;推薦等級:2級):晚期胃癌三線治療根據患者體能狀況評分和既往用藥來綜合確定,靶向治療可選擇阿帕替尼,HER2陽性患者也可選擇維迪西妥單抗、德曲妥珠單抗;既往未經免疫治療的患者推薦納武利尤單抗單藥治療;化療可選擇TAS-102。
2.5 胃癌腹膜轉移的藥物治療
胃癌腹膜轉移目前的標準治療方案是全身化療[56]。研究已證實采用全身化療效果明顯優于最佳支持療法,且氟尿嘧啶類聯合鉑類的兩藥化療方案比單藥化療效果更為顯著,副作用也小于三藥治療方案[57]。Ⅲ期隨機對照SPIRITS研究亞組分析顯示,一線使用替吉奧聯合順鉑方案(SP)與替吉奧單藥相比,顯著延長了晚期胃癌患者mOS(13.0個月vs.11.0個月,P=0.04);亞組結果顯示,SP方案對腹膜轉移的患者療效更好(HR=0.52,P=0.02)[58]。一項Ⅲ期G-SOX臨床試驗對SOX方案和SP方案的療效及安全性進行了對比探究,分組研究結果表明對于有腹膜轉移的患者,SOX治療方案表現出更佳的療效(P=0.032),同時也顯示出較高的安全性[59]。RATIONALE-305研究顯示,替雷利珠單抗聯合化療顯著延長了PD-L1陽性(TAP評分≥5%)局部晚期不可切除或轉移性胃癌患者的mOS(17.2個月vs.12.6個月,HR=0.74,P=0.006);亞組分析顯示對于腹膜轉移的患者,替雷利珠單抗聯合化療組的總生存期均優于單純化療組(HR=0.80)[27]。這為晚期胃癌腹膜轉移患者的全身治療提供了新的選擇。
腹腔化療是治療胃癌腹膜轉移的關鍵策略,包括術前腹腔化療(intraperitonealchemotherapy,IPC)以及術中廣泛腹腔灌洗(extensiveintraoperativeperitoneallavage,EIPL)。一項Meta分析表明,手術聯合IPC治療較單純手術可有效提高5年生存率(RR=3.10)、降低復發風險(OR=0.45),而在IPC聯合EIPL治療方案中,獲益進一步增加(RR=6.19,OR=0.13)[60]。日本PHOENIX-GC研究比較了胃癌腹膜轉移患者的一線治療,該研究分為SP全身化療組和替吉奧+紫杉醇全身化療聯合紫杉醇腹腔灌注(IP)組,結果IP組未能顯示總體人群的生存獲益(mOS:17.7個月vs.15.2個月,P=0.08);但是將腹水因素進行校正后發現,IP組生存獲益顯著(mOS:17.7個月vs.14.3個月,P=0.022),且IP組的腹腔游離癌細胞(freecancercell,FCC)轉陰的比例明顯高于SP組(76%vs.33%)[61]。紫杉醇分子量大,屬于脂溶性藥品,通過淋巴系統吸收較為緩慢,治療后腹腔不易出現粘連,因此該藥可實現多次腹腔內給藥,是較理想的腹腔內化療藥物。目前國內外眾多的研究結果也證實,5-FU、順鉑、紫杉醇、多西他賽以及奧沙利鉑對于胃癌惡性腹腔積液有一定療效[62―66]。腹腔灌注化療可以聯合應用貝伐珠單抗[67]和溶瘤病毒[68―69]、銅綠假單胞菌、紅色諾卡氏菌細胞壁骨架[70]等生物制劑增加療效。綜上,推薦腹腔灌注治療作為全身系統化療的補充治療方案,對合并有癥狀的腹水,可考慮腹水引流和腹腔灌注化療。
專家共識9(專家推薦率:76.7%;推薦等級:2級):對于體能狀況良好的胃癌腹膜轉移患者,可選擇聯合化療方案;對體能狀況評分較差的患者予以單藥化療。腹腔灌注化療可作為全身系統化療的補充治療方案,腹腔化療常用的藥物包括紫杉醇、多西他賽、順鉑和奧沙利鉑等。
3 結語
在腫瘤精準診療時代,胃癌的藥物治療即化療、免疫治療、靶向治療等具有重要的地位及作用。然而,臨床上常用藥物的療效有限,遠未滿足治療需求。因此,未來需要探索創新藥物,優化藥物使用模式,同時結合其他治療方式如放療、介入、灌注、中醫中藥等,以提高患者的療效。
胃癌作為全身性疾病,病因及機制復雜、異質性強,不同病理類型、不同分期的胃癌治療原則也不一樣,因此全程管理至關重要,在每一個治療節點都需要多學科團隊(multidisciplinaryteam,MDT)共同參與指導臨床用藥。隨著基礎與臨床轉化研究的發展,胃癌新型藥物治療領域,特別是針對新型靶點的藥物的臨床研究正在進行,如針對HER2靶點的ADC藥物率先帶來突破,其次,CLDN18.2ADC藥物的初步探索帶來有希望的臨床獲益,而靶向人滋養層細胞表面抗原2(trophoblastcellsurfaceantigen2,TROP2)、表皮生長因子受體(epidermalgrowthfactorreceptor,EGFR)、人表皮生長因子受體3(humanepidermalgrowthfactorreceptor3,HER3)等分子的ADC藥物也在胃癌領域積極探索中,未來可期。參與上述相關臨床研究有可能使患者獲得新型的治療方法,為患者帶來新的希望。

